Перейти к:
ОСТРОЕ ПОВРЕЖДЕНИЕ ПОЧЕК НЕЗАВИСИМО СВЯЗАНО С ОБЩЕЙ СМЕРТНОСТЬЮ БОЛЬНЫХ ПОСЛЕ ТРАНСПЛАНТАЦИИ ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК
https://doi.org/10.24884/1561-6274-2018-22-6-30-37
Аннотация
ЦЕЛЬ: определить ассоциировано ли развитие острого повреждения почек в раннем периоде после аллогенной трансплантации гемопоэтических стволовых клеток (ТГСК) со смертностью больных.
ПАЦИЕНТЫ И МЕТОДЫ. В открытое обсервационное проспективное исследование включены 90 больных (46 мужчин и 44 женщины), которым была выполнена аллогенная ТГСК. За 7 дней до ТГСК (неделя 0), на 1–5-й неделях посттрансплантационного периода выполняли мониторинг и оценку клинико-лабораторных показателей. Диагностику и стратификацию тяжести острого повреждения почек (ОПП) проводили согласно рекомендациям KDIGO (Kidney Disease Improving Global Outcomes). Регистрировали смерти от всех причин в течение одного года посттрансплантационного наблюдения. Связь ОПП с риском смерти оценивали в анализах кумулятивной выживаемости и мультивариантных регрессионных моделях Кокса с коррекцией по другим существенным клиническим факторам.
РЕЗУЛЬТАТЫ. Острое повреждение почек было выявлено у 67 из 90 больных (74 %). У подавляющего числа пациентов (84 %) имело место ОПП 1 стадии (KDIGO). Острую дисфункцию почек 2 и 3 стадии (KDIGO) перенесли 16 % больных. Заместительная почечная терапия применена у 4 (6 %) больных с ОПП. Кумулятивная выживаемость после ТГСК составила 75 %. В период наблюдения (1 год после ТГСК) зарегистрировано 28 смертельных исходов (31 %). Развитие острой дисфункции почек после ТГСК связано со значительным снижением кумулятивной выживаемости пациентов. При множественном регрессионном анализе ОПП имело прямую, достоверную связь с относительным риском смерти в течение 1 года после ТГСК, независимую от других клинических параметров.
ЗАКЛЮЧЕНИЕ. Острое повреждение почек может расцениваться как клинический предиктор неблагоприятного исхода аллогенной ТГСК, учитывая независимую связь этого осложнения с увеличением общей смертности больных в посттрансплантационном периоде.
Ключевые слова
Для цитирования:
Смирнов К.А., Добронравов В.А., Афанасьев Б.В., Смирнов А.В. ОСТРОЕ ПОВРЕЖДЕНИЕ ПОЧЕК НЕЗАВИСИМО СВЯЗАНО С ОБЩЕЙ СМЕРТНОСТЬЮ БОЛЬНЫХ ПОСЛЕ ТРАНСПЛАНТАЦИИ ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК. Нефрология. 2018;22(6):30-37. https://doi.org/10.24884/1561-6274-2018-22-6-30-37
For citation:
Smirnov K.A., Dobronravov V.A., Afanasiev B.V., Smirnov A.V. ACUTE KIDNEY INJURY IS INDEPENDENTLY ASSOCIATED WITH ALL-CAUSE MORTALITY FOLLOWING HEMATOPOIETIC STEM CELL TRANSPLANTATION. Nephrology (Saint-Petersburg). 2018;22(6):30-37. (In Russ.) https://doi.org/10.24884/1561-6274-2018-22-6-30-37
ВВЕДЕНИЕ
Острое повреждение почек (ОПП) является значимой междисциплинарной проблемой современной медицины, учитывая его высокую распространённость и ассоциацию с неблагоприятными исходами течения различных заболеваний [1]. Хорошо известна роль острой дисфункции почек в удлинении сроков госпитализации больных, существенном увеличении смертности, развитии и прогрессировании хронической болезни почек (ХБП) и ее осложнений, а также в закономерном увеличении затрат на лечение [2-4].
Заболеваемость ОПП у пациентов, перенёсших ТГСК существенна [5-7] и достигает 70 %, а его развитие также имеет немаловажное значение в отношении увеличения посттрансплантационной летальности [8], затрат на лечение, последующего формирования ХБП [9]. Таким образом, ОПП может быть одним из факторов, связанных с увеличением рисков смерти больных при ТГСК и снижающим эффективность данной лечебной технологии. Представляемое исследование проведено с целью проверки этой нулевой гипотезы, тем более, что подобного рода данные немногочисленны, а в отечественной литературе до настоящего времени отсутствовали.
ПАЦИЕНТЫ И МЕТОДЫ
Клинико-демографическая характеристика больных.
Данное открытое одноцентровое проспективное обсервационное исследование выполнено на базе Института детской онкологии, гематологии и трансплантологии им. Р.М. Горбачёвой и Научноисследовательского института Нефрологии Научно-клинического исследовательского центра ФГБОУ ВО ПСПбГМУ им. акад. И. П. Павлова, одобрено этическим комитетом учреждения. В исследование включены 90 пациентов, которым была выполнена аллогенная ТГСК в период с 2013 по 2015 г.
Критерием включения была планируемая ТГСК.
Критериями невключения были: ОПП на момент ТГСК (до проведения процедуры кондиционирования), хроническая болезнь почек, недостаточность другого органа (органов) на момент трансплантации, возраст моложе 18 лет, наличие коморбидности, которая могла бы влиять на функцию почек (сахарный диабет тип 1 и 2, артериальная гипертензия, ИБС, гепатиты В и С до ТГСК) либо ТГСК, выполняемая как терапия отчаяния в связи с тяжестью основного заболевания.
Основные клинические и демографические показатели обследуемой группы представлены в табл. 1.
Регистрировали нижеследующие клинические параметры на момент включения в исследование:
- параметры реципиента: пол, возраст на момент ТГСК, наличие ТГСК в анамнезе, количество курсов химиотерапии до ТГСК, цитомега- ловирусная (ЦМВ) инфекция (наличие любого из условий: IgM+, IgG+, ПЦР+), базальная функция почек;
- параметры донора: пол, ЦМВ инфекция, наличие родственной связи с реципиентом;
- совместимость реципиента и донора по системе HLA (полная: 10/10; неполная: 8-9/10 совпадений генов локусов HLA-A, HLA-B, HLA-C и HLA-DRB1);
- диагноз основного заболевания;
- результаты лечения основного заболевания на этапе до ТГСК: наличие и характер ремиссии - полная/неполная (полная клиникогематологическая ремиссия - нормализация клинической симптоматики, показателей периферической крови (отсутствие бластов) и миелограммы (содержание бластных клеток менее
- %)/неполная клинико-гематологическая ремиссия - достигнутое на фоне терапии состояние, при котором нормализуется клинический статус и гемограмма, однако в миелограмме отмечается до 20 % бластов); наличие минимальной остаточной болезни [11]);
- тип кондиционирования (миелоаблативный/ немиелоаблативный).
Период проспективного наблюдения составил 6 нед и включал: неделю 0 (до выполнения процедуры кондиционирования и ТГСК), недели 1-5 после трансплантации.
Таблица 1 / Table 1
Клинические и демографические данные больных с ТГСК (n=90)
Patient’s OharacteNstics at baseline (n=90)
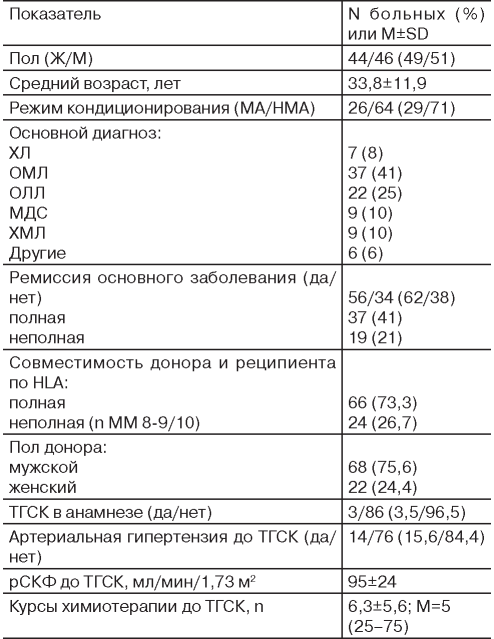
Примечание. МА - миелоаблативный режим кондиционирования; НМА - немиелоаблативный режим кондиционирования (РК с редуцированной токсичностью); ХЛ - лимфома Ходжкина; ОМЛ - острый миелоидный лейкоз; ОЛЛ - острый лимфобластный лейкоз; МДС - миелодиспластический синдром; ХМЛ - хронический миелоидный лейкоз; НХЛ - неходжкинская лимфома; ТГСК - трансплантация гемопоэтических стволовых клеток; рСКФ - расчётная скорость клубочковой фильтрации; SD - стандартное отклонение; nMM - число несовпадений по аллелям генов HLA (human leucocyte antigens - группа человеческих лейкоцитарных антигенов гистосовместимости).
На неделе 0 и на неделях 1-5 после трансплантации производили отбор образцов сыворотки крови, образцы аликвотировали согласно стандартной методике, принятой при выполнении лабораторных тестов, центрифугировали при 1500 об/мин в течение 10 мин, после чего проводили криоконсервацию при температуре -80 оС до момента проведения анализов. Концентрацию креатинина в сыворотке крови определяли с помощью модифицированного метода Яффе (реактивы фирмы «Beckman Coulter», США) на анализаторе Synchron того же производителя. Расчёт базальной СКФ (в мл/мин/1,73 м2) - неделя 0 производили по формуле MDRD (Modification of Diet in Renal Disease): 175 x (креатинин сыворотки)-1,154 χ (возраст пациента)-0,203 χ (0,742 у женщин) χ 1,212 (у темнокожих лиц) [10]. Диагностику и стратификацию тяжести ОПП осуществляли в соответствии с рекомендациями KDIGO (Kidney Disease Improving Global Outcomes, 2012) [10].
Динамические клинические данные.
На каждой неделе раннего периода наблюдения (0-5) у всех больных регистрировали следующие клинические показатели: диурез; развитие типичных осложнений ТГСК (мукозита, острой реакции трансплантат против хозяина, оРТПХ), веноокклюзионной болезни (ВОБ); инфекционные осложнения (локальные и системные, сепсис); суммарное число применяемых потенциально нефротоксичных препаратов; наличие приживления; выполнение повторной ТГСК.
Для оценки выраженности цитопении, вовлеченности печени, воспалительной реакции и белково-энергетической недостаточности использовали следующие динамические лабораторные показатели: гемоглобин (Hb), число тромбоцитов и лейкоцитов (L), аланинаминотрансфера- зу (АлТ), С-реактивный белок (СРБ), альбумин ^воротки крови.
Отдаленное наблюдение.
В течение 1 года после ТГСК осуществляли наблюдение пациентов с регистрацией случаев смерти от всех причин, оценкой смертности в случае наличия или отсутствия ОПП, а также в случаях наличия/отсутствия других прогностически неблагоприятных факторов, ассоциированных с ТГСК.
Статистический анализ полученных результатов был выполнен с использованием стандартных пакетов прикладных статистических программ SPSS 14.0 for Windows и Statistica 6.1 for Windows. В зависимости от задач анализа как отдельные случаи использовали клинический случай, как таковой (пациент), или отдельную временную точку проспективного наблюдения. Так, при оценке заболеваемости ОПП каждую временную точку периода проспективного наблюдения включали в анализ как отдельный случай (всего n=474, c вычетом неполных наблюдений). В анализах выживаемости, ряде межгрупповых анализов использовали случаи пациентов (n=90). При исследовании выживаемости применяли метод Каплана-Мейера, используя log-rank тест для оценки достоверности межгрупповых различий. Дату смертельного исхода учитывали как конец наблюдения, а такой случай как цензурированный. Для анализа связей исследуемых показателей с риском дожития применяли одно- и мульти- вариантные модели пропорциональных интенсивностей Кокса. Другие независимые переменные (клинические показатели) для последующего использования в множественных регрессиях были предварительно селекционированы путем одновариантного анализа (использовали только со значением р для коэффициента регрессии <0,1).
Корректировка мультивариантных регрессионных моделей по потенциальным клиническим факторам риска изучаемого исхода была проведена путем их принудительного включения с последующим пошаговым исключением или без него.
Для сравнительного межгруппового анализа применяли однофакторный дисперсионный анализ (ANOVA). Данные представлены как среднее и стандартное отклонение (M±SD), медиана с интерквартильным размахом [m (25-75 %)], среднее и 95 % доверительный интервал (95 % ДИ) для среднего М, среднее и стандартная ошибка среднего или стандартное отклонение (M±SEM/SD). Межгрупповые различия и регрессионные (корреляционные) коэффициенты считали статистически достоверными при значении р<0,05.
Таблица 2 / Table 2
Одновариантный анализ факторов, ассоциированных с посттрансплантационной смертностью от всех причин
Univariate analysis of factors associated with posttransplant all-cause mortality
Переменные, ед. изменения | Exp(β) | 95 % ДИ для Exp(β) | Значение р |
|---|---|---|---|
ОПП (vs нет ОПП) | 3,980 | 1,201-13,191 | 0,024 |
оРТПХ (vs без оРТПХ) | 1,879 | 0,966-4,079 | 0,070 |
ПР основного заболевания до ТГСК (vs нет ПР) | 0, 342 | 0,139-0,845 | 0, 020 |
Повторная ТГСК (vs первая) | 3,757 | 1,642-8,593 | 0,002 |
Неполная совместимость по системе HLA (vs полная) | 2,419 | 1,144-5,117 | 0,021 |
Приживление (vs неприживление) | 0,037 | 0,015-,094 | <0,001 |
Средний уровень СРБ (1 мг/л) | 1,017 | 1,011-1,023 | <0,001 |
Уровень тромбоцитов до ТГСК(1 x 109/л) | 3,160 | 1,503-6,646 | 0,002 |
Уровень гемоглобина до ТГСК (1 г/л) | 0,978 | 0,962-0,995 | 0,010 |
Уровень альбумина до ТГСК (1 г/л) | 2,747 | 1,284-5,875 | 0,009 |
Примечание. ПР - полная ремиссия; ТГСК - трансплантация гемопоэтических стволовых клеток; оРТПХ - острая реакция трансплантат против хозяина; ОПП - острое повреждение почек; HLA - human leucocyte antigens (лейкоцитарные антигены человека); СРБ - С-реактивный белок.
РЕЗУЛЬТАТЫ
Всего у 67 из 90 больных (74 %) было зарегистрировано 99 эпизодов, удовлетворявших клиническим критериям ОПП. У подавляющего числа пациентов (84 %) имело место ОПП 1 стадии (KDIGO). Острую дисфункцию почек 2 или 3 стадии (KDIGO) перенесли 16 % пациентов. Случаев со снижением диуреза, удовлетворяющим рутинным диагностическим критериям ОПП (KDIGO), в проанализированной нами общей группе пациентов выявлено не было. Заместительную почечную терапию (продленную гемодиафильтрацию) применили у 4 (6 %) больных с ОПП.
Кумулятивная выживаемость в исследуемой группе за период проспективного наблюдения представлена на рис. 1.
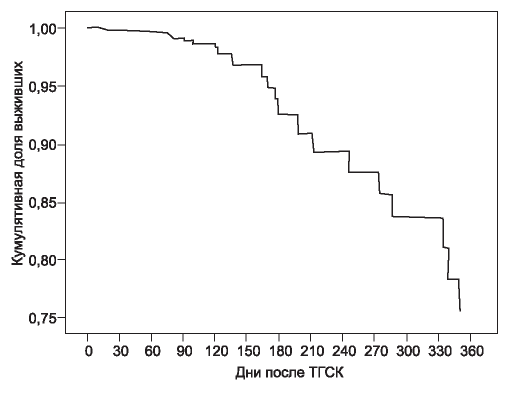
Рис. 1. Кумулятивная выживаемость пациентов после ТГСК. ТГСК - трансплантация гемопоэтических стволовых клеток.
Figure 1. Cumulative survival following HSCT
В период наблюдения (1 год после ТГСК) зарегистрировано 28 смертельных исходов (31 %). Наиболее частыми причинами летального исхода в группе умерших пациентов являлись: сепсис (66 %), ОПП (70 %), сердечная недостаточность (59 %), прогрессия основного заболевания (48 %).
Выявлено значительное увеличение кумулятивной смертности пациентов с развитием острой дисфункции почек в раннем посттрансплантаци- онном периоде в сравнении с группой больных без признаков ОПП (рис. 2, А). Смертность в группах с одним и несколькими эпизодами ОПП (KDIGO 1-3) достоверно не отличалась (см. рис. 2, Б).
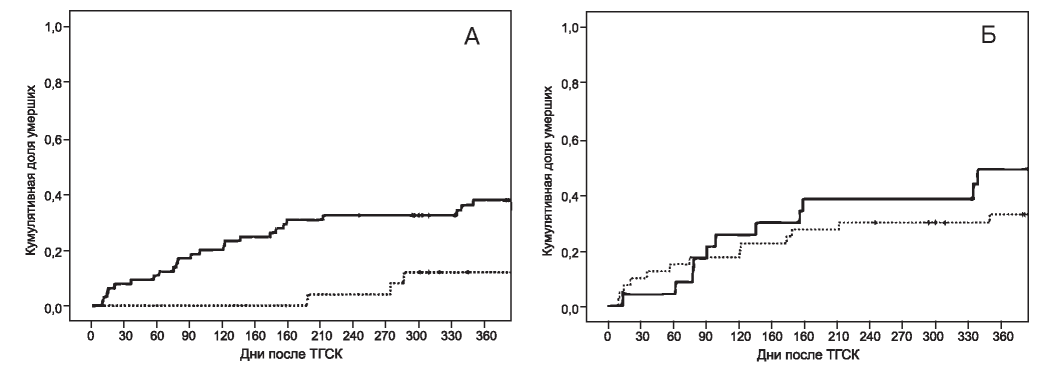
Рис. 2. Общая кумулятивная смертность больных после трансплантации гемопоэтических стволовых клеток в зависимости от развития ОПП (А, Б).
ТГСК - трансплантация гемопоэтических стволовых клеток. А - сплошная кривая - ОПП есть; кривая-пунктир - ОПП нет. Б - сплошная кривая - более 1 эпизода ОПП; кривая-пунктир - 1 эпизод ОПП.
Figure 2 (А and B). Cumulative mortality following HSCT in patients with and without AKI.
Кумулятивная смертность была достоверно выше в группе больных с ОПП 2-3 стадии по KDIGO в сравнении с пациентами, перенесшими ОПП 1 стадии и без такового (рис. 3).
Среди анализируемых клинических показателей при проведении одновариантного регрессионного анализа были определены целый ряд пе- ритрансплантационных факторов, ассоциированных с увеличением летальности, помимо ОПП: (табл. 2). Эти показатели были использованы как независимые переменные в мультивариантных анализах риска фатального исхода.
Другие исследуемые клинические показатели перитрансплантационного периода не имели достоверных связей с рисками дожития, включая режим кондиционирования, этиологический фактор (острые лейкозы), поражение печени (веноокклюзионная болезнь (ВОБ), средний уровень АЛТ) (данные не представлены).
В ходе мультивариантного анализа с принудительным включением переменных ОПП сохраняло независимую связь с относительным риском смерти в посттрансплантационном периоде наряду с другими существенными клиническими факторами и событиями ТГСК (табл. 3).
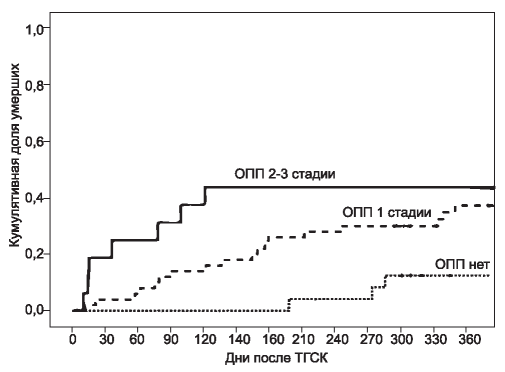
Рис. 3. Кумулятивная смертность в зависимости от наличия и стадии ОПП.
p(log-rank)=0,012 для тренда; ОПП - острое повреждение почек; ТГСК - трансплантация гемопоэтических стволовых клеток.
Figure 3. Cumulative mortality according to presence and stage of AKI.
ОБСУЖДЕНИЕ
ОПП является частым внутригоспитальным осложнением различных состояний, связанным с последующим формированием и прогрессированием ХБП, необходимостью применения заместительной почечной терапии, развитием сердечнососудистых и инфекционных осложнений и, в целом, существенным увеличением смертности таких пациентов [1-4, 10]. Заболеваемость ОПП при аллогенной ТГСК является высокой [5-7, 13, 14], однако вопрос о том, насколько развитие ОПП может повлиять на исходы трансплантации, остается открытым из-за ограниченного числа исследований в этой области [15, 16].
Таблица 3 / Table 3
Мультивариантный анализ факторов, ассоциированных со смертностью больных после ТГСК
Multivariable analysis of factors, associated with mortality following HSCT
Модели | Переменныеb | Εxp(β) | 95 % ДИ для Εxp(β) | Значение р |
|---|---|---|---|---|
Модель 1 | ОППа | 2,263 | 1,249-4,099 | 0,007 |
Неполная совместимость по системе HLA | 2,886 | 1,323-6,295 | 0,008 | |
Полная ремиссия до ТГСК | 0,350 | 0,138-0,889 | 0,027 | |
оРТПХ | 2,367 | 1,073-5,322 | 0,033 | |
Модель 2 | ОПП а | 2,123 | 1,049-4,298 | 0,036 |
Неполная совместимость по системе HLA | 2,195 | 1,003-4,804 | 0,049 | |
Полная ремиссия до ТГСК | 0,244 | 0,093-0,637 | 0,004 | |
оРТПХ | 6,296 | 2,399-16,524 | <0,001 | |
Приживление | 0,019 | 0,06-0,061 | <0,001 | |
Модель 3 | ОПП а | 2,137 | 1,197-3,817 | 0,010 |
Полная ремиссия до ТГСК | 0,448 | 0,178-1,126 | 0,088 | |
Неполная совместимость по системе HLA | 3,179 | 1,442-7,011 | 0,004 | |
Повторная ТГСК | 2,649 | 1,143-6,142 | 0,023 | |
Модель 4 | ОПП а | 2,044 | 1,082-3,861 | 0,028 |
Неполная совместимость по системе HLA | 3,429 | 1,553-7,572 | 0,002 | |
Полная ремиссия до ТГСК | 0,517 | 0,198-1,349 | 0,178 | |
Среднее значение СРБ | 1,016 | 1,09-1,022 | <0,001 | |
оРТПХ | 2,128 | 0,952-4,756 | 0,066 | |
Модель 5 | ОПП а | 2,118 | 1,101-4,074 | 0,025 |
Неполная совместимость по системе HLA | 3,998 | 1,746-9,154 | 0,001 | |
Полная ремиссия до ТГСК | 0,589 | 0,221-1,568 | 0,290 | |
Среднее значение СРБ | 1,015 | 1,008-1,021 | <0,001 | |
оРТПХ | 2,188 | 0,972-4,927 | 0,059 | |
Повторная ТГСК | 2,303 | 0,930-5,699 | 0,071 |
Примечание. а - на стадию ОПП KDIGO (0-1-2/3); b - для единиц изменения параметра см. табл. 2; ТГСК - трансплантация гемопоэтических стволовых клеток; ОПП - острое повреждение почек; оРТПХ - острая реакция трансплантат против хозяина; HLA - human leucocyte antigens (человеческие лейкоцитарные антигены); ДИ - достоверный интервал.
По данным N. Shingai и соавт. смертность больных после ТГСК в случае развития острой дисфункции почек в период до приживления трансплантата составила 39,1 % [16]. Нами было показано существенное увеличение смертности больных с ОПП в течение одного года после ТГСК по сравнению со смертностью пациентов без острой дисфункции почек. Риск фатального исхода после ТГСК был связан со степенью выраженности дисфункции почек, но не с числом перенесённых эпизодов ОПП в раннем пострансплантационном периоде.
В представляемом исследовании впервые установлено, что ОПП после аллогенной ТГСК может оказывать влияние на смертность больных независимо от ряда других существенных клинических факторов до- и послетрансплантационно- го периодов и известных предикторов исходов ТГСК - полноты ремиссии онкогематологическо- го заболевания до проведения процедуры, HLA- совместимости, повторной ТГСК, приживления аллографта, развития острой реакции «трансплантант против хозяина» (РТПХ), выраженности воспалительной реакции, поражения печени.
Негативное прогностическое значение дисфункции почек в отношении рисков смерти, независимое от действия других существенных клинических факторов посттрансплантационного периода, не кажется удивительным и имеет свои объяснения. Вкратце, почка при её повреждении является триггером формирования и/или ухудшения течения экстраренальной патологии (сердечно-сосудистые заболевания, системное воспаление, инфекционные осложнения как в ближайшей, так и в отдалённой перспективе и др. [17-19]), и развития мультиорганной недостаточности за счёт целого ряда механизмов межорганного взаимодействия [19, 20].
Следует отметить ряд ограничений данного исследования. Так, относительно небольшой размер исследуемой группы пациентов и низкая летальность в первые недели после ТГСК не позволили оценить связь ОПП с выживаемостью на ранних сроках посттрансплантационного периода. Не исключено, что одноцентровой дизайн исследования оказал влияние на структуру экстраренальных факторов, ассоциированных с выживаемостью. В частности, в большинстве случаев был применён режим кондиционирования с редуцированной токсичностью, последнее может отражаться на частоте формирования целого ряда специфических осложнений ТГСК, связанных с увеличением риска смерти. Кроме того, пациенты, включённые в исследование, не имели клинически значимой сопутствующей патологии внутренних органов, которая может иметь негативную связь с прогнозом [21], что ограничивает распространение данных исследования на другие популяции больных при ТГСК и требует их валидизации.
К сильным сторонам исследования можно отнести его проспективный характер, многофакторный анализ широкого спектра перитранспланта- ционных факторов, способных оказывать влияние на прогноз ТГСК.
ЗАКЛЮЧЕНИЕ
Острое повреждение почек может расцениваться как клинический предиктор неблагоприятного исхода аллогенной ТГСК.
Полученные данные, существенные для клинической практики, указывают на необходимость разработки подходов предиктивной диагностики и профилактики ОПП при ТГСК, что может быть перспективным подходом, направленным на улучшение результатов данного метода лечения.
Исследование выполнено при финансовой поддержке Комитета по науке и высшей школе Правительства Санкт-Петербурга и ПСПбГМУ им. акад. И.П. Павлова (конкурс инновационных научных проектов ПСПбГМУ, 2015 год).
Благодарности.
Авторы благодарят Марину Олеговну Попову за ценные пояснения в ходе подготовки публикации.
Список литературы
1. Zeng X, McMahon GM, Brunelli SM et al. Incidence, outcomes, and comparisons across definitions of AKI in hospitalized individuals. Clin J Am Soc Nephrol 2014;9(1):12–20. DOI: 10.2215/CJN.02730313
2. Hsu RK, Hsu C. The Role of Acute kidney Injury in Chronic Kidney Disease. Semin Nephrol 2016;36(4):283–292. DOI: 10.1016/j.semnephrol.2016.05.005
3. Chertow GM, Burdick E. Acute kidney injury, mortality, length of stay, and costs in hospitalized patients. J Am Soc Nephrol 2005;16(11):3365–3370. DOI: 10.1681/ASN.2004090740
4. Sawhney S, Marks A, Fluck N et al. Intermediate and Long-term Outcomes of Survivals of Acute Kidney Injury Episodes: A Large Population-Based Cohort Study. Am J Kidney Dis 2017;69(1):18–28. DOI: 10.1053/j.ajkd.2016.05.018
5. Смирнов КА, Добронравов ВА, Афанасьев БВ и соавт. Динамика биомаркеров повреждения почек после трансплантации гемопоэтических стволовых клеток (пилотное исследование). Нефрология 2015;19(6):28–33
6. Добронравов ВА, Смирнов КА, Афанасьев БВ и соавт. Острое повреждение почек и тубулярные биомаркеры. Терапевтический архив 2016;88(6):14–20
7. Krishnappa V, Gupta M, Manu G et al. Acute Kidney Injury in Hematopoietic Stem Cell Transplantation: A Review. Int J Nephrol 2016: 5163789. DOI: 10.1155/2016/5163789
8. Ando M. An Overview of Kidney Disease Following Hematopoietic Stem Cell Transplantation. Intern Med 2018;57(11):1503–1508. DOI: 10.2169/internalmedicine.9838-17
9. Добронравов ВА. Обзор патофизиологии острого повреждения почек. В: Смирнов АВ, Добронравов ВА, Румянцев АШ, Каюков ИГ Острое повреждение почек. МИА, М., 2015; 30–79
10. Паровичникова ЕН, Маврина ЕС, Сурин ВЛ и соавт. Методы мониторинга минимальной резидуальной болезни у больных острым лимфобластным лейкозом. Гематол. и трансфузиол. 2013;58(3):46–48
11. Hahn T, Rondeau C, Shaukat A et al. Acute renal failure requiring dialysis after allogeneic blood and marrow transplantation identifies very poor prognosis patients. Bone Marrow Transplant 2003; 32(4):405–410. DOI: 10.1038/sj.bmt.1704144
12. Sawinski D. The Kidney Effects of Hematopoietic stem Cell Transplantation. Advances in Chronic Kidney Disease 2014;21(1):96–105. DOI: 10.1053/j.ackd.2013.08.007
13. Lopes JA, Jorge S. Acute kidney injury following HCT: incidence, risk factors and outcome. Bone Marrow transplantation 2011;46(11):1399–1408. DOI: 10.1038/bmt.2011.46
14. Kizilbash SJ, Kashtan CE, Chavers BM. Acute kidney injury and the risk of mortality in children undergoing hematopoietic stem cell transplantation. Biol Blood Marrow Transplant 2016;22(7):1264–1270. DOI: 10.1016/j.bbmt.2016.03.014
15. Shingai N, Morito T, Najima Y et al. Early-onset acute kidney injury is a poor prognostic sign for allogeneic SCT recipients. Bone Marrow Transplantation 2015;50:1557–1562. DOI: 10.1038/bmt.2015.188
16. Keller SP, Kovacevic A, Howard J. Evidence of cardiac injury and arrhythmias in dogs with acute kidney injury. J Small Anim Pract 2016;57(8):402–408. DOI: 10.1111/jsap.12495
17. Wen X, Murugan R, Peng Z. Pathophysiology of acute kidney injury: a new perspective. Contrib Nephrol 2010;165:39–45. DOI: 10.1159/000313743
18. Grams ME, Rabb H. The distant organ effects of acute kidney injury. Kidney Int 2012;81(10):942–948. DOI: 10.1038/ki.2011.241
19. Yap SC, Lee HT. Acute kidney injury and extrarenal organ dysfunction: new concepts and experimental evidence. Anesthesiology 2012; 116:1139–1148. DOI: 10.1097/ALN.0b013e31824f951b
20. Fein JA, Shimoni A, Labopin M et.al. The impact of individual comorbidities on non-relapse mortality following allogeneic hematopoietic stem cell transplantation. Leukemia. 2018;32(8):1787–1794. DOI: 10.1038/s41375-018-0185-y
Об авторах
К. А. СмирновРоссия
197101, Санкт-Петербург, ул. Л. Толстого, д. 17.
Смирнов Кирилл Алексеевич, врач-нефролог отделения реанимации и интенсивной терапии для экстренной детоксикации клиники научно-клинического центра анестезиологии и реаниматологии.
Тел.: 8(921) 908-69-85.
В. А. Добронравов
Россия
197101, Санкт-Петербург, ул. Л. Толстого, д. 17.
Проф. Добронравов Владимир Александрович, д-р мед. наук, зам. директора НИИ нефрологии НКИЦ.
Тел.: 8(812) 234-66-56.
Б. В. Афанасьев
Россия
197101, Санкт-Петербург, ул. Л. Толстого, д. 6–8.
Проф. Афанасьев Борис Владимирович, д-р мед. наук, директор.
Тел.: 8(812) 338-62-62.
А. В. Смирнов
Россия
197101, Санкт-Петербург, ул. Л. Толстого, д. 17.
Проф. Смирнов Алексей Владимирович, д-р мед. наук, директор НИИ нефрологии НКИЦ, заведующий кафедрой пропедевтики внутренних болезней.
Тел.: (812) 338-69-01.
Рецензия
Для цитирования:
Смирнов К.А., Добронравов В.А., Афанасьев Б.В., Смирнов А.В. ОСТРОЕ ПОВРЕЖДЕНИЕ ПОЧЕК НЕЗАВИСИМО СВЯЗАНО С ОБЩЕЙ СМЕРТНОСТЬЮ БОЛЬНЫХ ПОСЛЕ ТРАНСПЛАНТАЦИИ ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК. Нефрология. 2018;22(6):30-37. https://doi.org/10.24884/1561-6274-2018-22-6-30-37
For citation:
Smirnov K.A., Dobronravov V.A., Afanasiev B.V., Smirnov A.V. ACUTE KIDNEY INJURY IS INDEPENDENTLY ASSOCIATED WITH ALL-CAUSE MORTALITY FOLLOWING HEMATOPOIETIC STEM CELL TRANSPLANTATION. Nephrology (Saint-Petersburg). 2018;22(6):30-37. (In Russ.) https://doi.org/10.24884/1561-6274-2018-22-6-30-37








































