Перейти к:
ЗАБОЛЕВАНИЯ ПОЧЕК И ОЖИРЕНИЕ: МОЛЕКУЛЯРНЫЕ ВЗАИМОСВЯЗИ И НОВЫЕ ПОДХОДЫ К ДИАГНОСТИКЕ (обзор литературы)
https://doi.org/10.24884/1561-6274-2017-3-25-38
Аннотация
Ключевые слова
Для цитирования:
Вялкова А.А., Лебедева Е.Н., Афонина С.Н., Чеснокова С.А., Куценко Л.В., Лукерина Е.В. ЗАБОЛЕВАНИЯ ПОЧЕК И ОЖИРЕНИЕ: МОЛЕКУЛЯРНЫЕ ВЗАИМОСВЯЗИ И НОВЫЕ ПОДХОДЫ К ДИАГНОСТИКЕ (обзор литературы). Нефрология. 2017;21(3):25-38. https://doi.org/10.24884/1561-6274-2017-3-25-38
For citation:
Vyalkova A.A., Lebedeva E.N., Afonina S.N., Chesnokova S.A., Kutsencko L.V., Lukerina E.V. KIDNEY DISEASES AND OBESITY: MOLECULAR RELATIONSHIP AND NEW APPROACHES TO DIAGNOSIS (literature review). Nephrology (Saint-Petersburg). 2017;21(3):25-38. (In Russ.) https://doi.org/10.24884/1561-6274-2017-3-25-38
Актуальность проблемы поражения почек у детей с ожирением обусловлена ростом частоты нефропатий, связанных с метаболическими нарушениями, склонностью к прогрессирующему течению и необходимостью оптимизации их ранней диагностики [1-8].
Ранняя диагностика патологии почек основана на выявлении и оценке патогенетических факторов риска их формирования [8-11].
Механизмы развития и прогрессирования патологического процесса в почках под влиянием избытка массы тела изучены недостаточно. Известны единичные, в основном экспериментальные работы по клиническим [12-14] и эпидемиологическим [15] исследованиям в этой области.
В исследованиях последних лет установлено прямое повреждающее действие на структуру почечной ткани, эндотелий сосудов почек и клиническое значение гиперхолестеринемии, атерогенных фракций липидов, липидных медиаторов (простогландинов), цитокинов, среди которых наиболее значимыми являются медиаторы, непосредственно продуцируемые адипоцитами: леп- тин, альфа-фактор некроза опухоли, интерлейкины-1,6,8 [16-21].
В последнее десятилетие распространённость ожирения повышается до эпидемии и является медико-социальной проблемой здравоохранения во всем мире [12, 13, 18, 21]. По глобальным оцен- кам ВОЗ (2014 г.) частота встречаемости ожирения среди детей и подростков составляет 17%. Более 1,9 миллиарда взрослых людей имеют избыточный вес, из них свыше 600 миллионов людей страдают ожирением [22]. Высокая распространенность ожирения способствует развитию хронических заболеваний, в том числе и хронической почечной недостаточности [23-24].
По результатам комплексных исследований установлены клинико-параклинические особенности нефропатий у детей на фоне висцерального ожирения, характеризующиеся многофакторной природой развития заболевания на фоне нарушений липидного, углеводного обмена, высокого уровня сывороточного лептина, под влиянием комплекса патогенетических наследственных и медико-биологических (воздействие хронической гипоксии) факторов [7, 17, 19, 25, 26]. Доказано, что у пациентов с нефропатиями на фоне висцерального ожирения липидный спектр сыворотки крови характеризуется повышением атерогенности липидов при снижении холестерина липопротеинов высокой плотности [10], увеличением сывороточных триацилглицеринов, общего холестерола, холестерол липопротеидов очень низкой плотности в сочетании гиперлептинемией и нарушением толерантности к глюкозе. Доказано, что у всех пациентов с ХГН, даже при самых благоприятных клиникометаболических вариантах его течения, отмечается дефект в системе периферической утилизации низкоплотных липопротеидов. При анализе профилей флотации липопротеидов высокой плотности выявлено увеличение третьей и уменьшение второй субфракции липопротеидов высокой плотности у всех пациентов с ХГН , что косвенно указывает на снижение активности фермента лецитинхолестеринацетилтрансферазы при данной патологии [10].
При нефротическом синдроме с минимальными изменениями в дебюте и при рецидивах заболевания у детей диагностированы 11а, 11б типы ги- перлипопротеинемий. В период ремиссии нефротического синдрома в течение 5-10 лет у детей не выявлено нарушений липидного обмена, что подтверждает отсутствие атерогенного характера нефротической гиперлипопротеинемии при данной патологии [16].
Установлено, что повышение сывороточного лептина и нарушение показателей липидного обмена у детей с нефропатиями на фоне висцерального ожирения ассоциирует с изменениями эхографических показателей структурного состояния почек, внутрипочечной гемодинамики и парциальным снижением почечных функций [17, 19].
Исследования Framingham Heart Study и 18-летнее наблюдение пациентов показали более высокий риск развития третьей стадии хронической болезни почек (ХБП) у пациентов с ожирением (индекс массы тела (ИМТ)> 30 кг/м2) по сравнению с пациентами с избыточным весом (ИМТ 25-30 кг/м2) [23].
Доказано, что заболевания почек прогрессируют у пациентов с АГ с формированием не- фросклероза и развитием первично-сморщенной почки. При СД 2 формируется тубулоинтерстици- альный фиброз, гломерулосклероз и развивается диабетическая нефропатия [12-14].
Заболевания почек, связанные с ожирением, с СД, развиваются при взаимодействии нескольких метаболических и гемодинамических факторов, активирующих общие внутриклеточные сигналы, которые, в свою очередь, вызывают выработку цитокинов и факторов роста, формирующих почечную недостаточность. Механизмы, лежащие в основе клубочковой гиперфильтрации на фоне ожирения широко обсуждаются в литературе [1]. Признанным механизмом являются данные об увеличении реабсорбции натрия в непосредственной близости от трубочек или петли Генле, ведущей к развитию тубулогломерулярной обратной связи - опосредованному уменьшению сопротивления афферентных артериол, увеличению внутрикапсулярного давления и скорости клубочковой фильтрации [27].
Среди основных факторов прогрессирования повреждения почек при ожирении выделяют: инсулинорезистентность (ИР), гиперинсулинемию, дислипидемию, нарушение системной и почечной гемодинамики, ишемию тканей почек, ауто- и па- ракринное воздействие гормонов жировой ткани [1, 28-29].
В настоящее время при оценке патофизиологических механизмов поражения почек особое внимание уделяется изучению роли метаболического синдрома (МС). Многие авторы считают, что ключевым патогенетическим звеном поражения почек является выработка жировой тканью биологически активных веществ - адипоцитокинов, что позволяет рассматривать жировую ткань как активный эндокринный орган. Среди адипокинов особое внимание уделяют лептину и адипонектину [30].
Установлено, что первоначальное увеличение скорости клубочковой фильтрации, связанное с ожирением, является ранним компенсаторным ответом, способствующим восстановлению солевого баланса, несмотря на продолжающуюся активизацию реабсорбции. Длительно сохраняющаяся клубочковая гиперфильтрация является причиной развития повреждения ткани почек, особенно у пациентов, имеющих сочетание с АГ. Имеются исследования, в которых показано снижение клубочковой гиперфильтрации и повреждения ткани почек при потери веса [31]. Определение маркеров эндотелиальной дисфункции в настоящее время является актуальным при многих заболеваниях, в том числе и при заболеваниях почек [32].
Эндотелиальная дисфункция у больных ХБП рассматривается как дисбаланс между вазоконстрикторами и релаксирующими факторами, между анти- и прокоагулянтными медиаторами, факторами роста и их ингибиторами [33].
Связь эндотелиальной дисфункции (ЭД) с поражением почек представляется закономерной, но недостаточно изученной. Патологическая роль эндотелиальной дисфункции описана при хроническом пиелонефрите, хроническом гломеруло- нефрите [34].
В настоящее время под дисфункцией эндотелия понимают нарушение равновесия между продукцией вазодилатирующих, атромбогенных, антипролиферативных факторов с одной стороны и вазоконстрикторных, протромботических и пролиферативных веществ, которые продуцирует эндотелий - с другой [34]. Маркёрами эндотелиальной дисфункции считают снижение эндотелиального синтеза оксида азота (NO), повышение уровней эндотелина-1, циркулирующего фактора фон Виллебранда, ингибитора активатора плазминогена, гомоцистеина, тромбомодулина, растворимой молекулы сосудистой межклеточной адгезии BI, С-реактивного белка, микроальбуминурию и другие [35].
Микроальбуминурия является доказанным высокочувствительным маркером прогностически неблагоприятного поражения почек, а также отражает наличие эндотелиальной дисфункции. Выявление неселективной протеинурии свидетельствует о грубом повреждении почечных структур и, кроме того, становится непосредственным повреждающим фактором, способствующим прогрессированию нефросклероза. Повреждающее действие системной артериальной гипертонии на почки реализуется через нарушение почечной гемодинамики под влиянием каскада изменений в ренин-ангиотензин-альдостероновой системе (РААС). Появление указанных клинических симптомов свидетельствует о выраженном, часто необратимом повреждении почечной ткани. В связи с этим продолжается активное исследование ранних биологических показателей почечного повреждения, среди которых активно изучаются маркеры эндотелиальной дисфункции [34].
Варианты поражения почек при ожирении
Строго специфичный клинико-морфологический вариант поражения почек при ожирении не идентифицирован. Вместе с тем, оценка выявляемых у большинства пациентов с ожирением изменений мочи, системного АД и внутрипочечной гемодинамики позволило выделить несколько типичных клинических признаков:
- микроальбуминурия (МАУ), являющаяся локально-почечным маркером генерализованной эндотелиальной дисфункции и стойкой гиперфильтрации [3, 36];
- нефротическая или субнефротическая протеинурия, рассматриваемая как следствие прямого повреждения гломерулярной базальной мембраны (как результат стойкой гиперфильтрации); при этом гипопротеинемия и отеки, как правило, не формируются [26, 37-38].
Фокально-сегментарный гломерулосклероз (ФСГС) - поражение почек, обнаруживаемое при биопсии у пациентов с ожирением, имеющих в клинике протеинурию более 1 г/сут. При сравнении течения ФСГС-нефропатии, ассоциированной с ожирением и ФСГС с идиопатической формой этого заболевания, установлено, что у большинства пациентов протеинурия достигала нефротического уровня, при этом у пациентов с ФСГС и ожирением выявлена положительная корреляция между индексом массы тела (ИМТ) и уровнем суточной протеинурии [39,40].
Ренальные эффекты ожирения
Влияние ожирения на почки реализуется через морфологические и функциональные изменения органа [26, 38-40].
Морфологические изменения: Эксперименты на животных показали расширение Боуменовой капсулы, быструю гиперплазию гломерул, утолщение клубочковой и трубчатой базальной мембраны, увеличение мезангиальной основы во многих гломерулах и изменения размера почек. Исследования структуры почек у тучных пациентов выявили обусловленную ожирением гломерулопатию (ООГ), которая включает ФСГС, гломеруломегалию, мезангиальную гиперплазию и лизис ножек (подий) подоцитов, а также центральный мезангиальный склероз или утолщение базальной мембраны центральных гломерул и трубок [38].
По сравнению с идиопатическим ФСГС у ООГ реже встречаются склерозированные гломерулы, что отражает более медленно развивающуюся болезнь. Кроме того, при ООГ развивается более умеренный лизис подий в подоцитах и почти 100%-ый уровень гломеруломегалии. Гломеруломегалия может быть единственным проявлением ООГ без ФСГС. При гистологических исследованиях наблюдали гиперплазию юкстагломеруляр- ного аппарата у тучных пациентов с заболеваниями почек, даже без гипертонии [26, 36-41].
Функциональные изменения: Эксперименты на животных показали существенную клубочковую гиперфильтрацию и повышение почечного кровотока, АД, увеличение уровня ренина и инсулина в плазме [42]. Функциональные изменения, которые происходят в почках тучных пациентов, включают увеличение ФРГ, повышение почечного кровотока, протеинурию субнефротического и нефротического диапазона. В отличие от идиопатического ФСГС у тучных пациентов более высокий альбумин сыворотки, более низкий холестерин сыворотки и ниже выраженность отёков, что связано с сохранением функции трубок в реабсорбции белков и меньшим повреждением подоцитов, наблюдаемой при ООГ [43]. На процесс формирования патологии почек при ожирении оказывают влияние гормональные факторы [44].
Гиперинсулинемия
Наибольший практический интерес вызывает раннее нарушение углеводного обмена - инсулинорезистентность (ИР), рассматриваемая не просто как метаболический феномен, но как один из ключевых компонентов метаболического синдрома (МС), частота и выраженность которого в популяции людей уже приобрели характер «мировой эпидемии XXI века» [45].
Развитие ИР приводит к целому ряду негативных патофизиологических системных реакций, которые способны инициировать механизмы дестабилизации клеток и тканей внутренних органов, включая почки, вызывая в них анатомофункциональные нарушения [45].
Инсулинорезистентность приводит к нарушению структуры и функции нервной ткани, индуцирует нейропатию, в основе которой лежит внутренняя симпатическая гиперактивность как результат гиперактивации центральных α-адренорецепторов паравентрикулярных гипоталамических ядер, а затем и органного (тканевого) адренергического ней- рорецепторного аппарата [46].
Индуцируемая инсулинорезистентностью нейропатия приводит к развитию системных и местных (органных и тканевых вазоконстрикторных) реакций, эндотелиальной дисфункции, приводящей к дефициту основного вазодилататора - оксида азота NO (т.к. 90% синтеза оксида азота происходит не в эндотелии, а в терминалях нервных окончаний сосудов). Для почек это означает спазмы артериол клубочков, нарушения трофики почки, почечного кровотока, микроциркуляции и клубочковой фильтрации, гипоксию и ишемию почечной паренхимы [47].
Ишемия и гипоксия ткани почек вследствие ИР запускает компенсаторный каскад активации системы «ренин-ангиотензин - альдостерон», которая вносит свой дальнейший вклад в прогрессирование функциональных и микроциркуляторных нарушений в почках [48].
Установлено, что инсулин индуцирует дила- тацию афферентной артериолы клубочка, тем самым способствуя повышению внутриклубоч- кового давления. Кроме того, участие инсулина в развитии гипертрофии клубочков и гломеруло- склероза при ожирении реализуется и через активацию синтеза некоторых факторов роста (ИФР-1 и ИФР-2) и фиброгенеза [42, 44].
По мнению H. Pham et al. (2011) ИР при заболеваниях почек развивается вследствие МС, сопутствующему ожирению. Установлено, что уровень инсулина крови может неадекватно отражать степень ИР, так как нарушения функции печени и почек способны влиять на метаболизм инсулина. Проведенные исследования показывают, что коррекция ИР может быть важной новой терапевтической целью нефропротективной стратегии [49]. M. Ensling et al. (2011) на основании проведенного анализа баз данных PubMed (1961-2010) утверждают, что почки могут быть непосред ственной мишенью для повреждающего воздействия всех компонентов МС, включая ИР[50].
Сами клетки жировой ткани (адипоциты) продуцируют различные гормоны и медиаторы - адипокины (лептин, фактор некроза опухолей альфа (ФНО α), резистин и др.), большинство из которых обладает тканедеструктивным действием, способностью индуцировать тканевое воспаление и, как следствие, фиброз [51-52]. Установлено, что развитие и прогрессирование поражения почек при ожирении реализуются при участии некоторых гормонов, факторов роста и цитокинов, продуцируемых как непосредственно адипоцитами, так и макрофагами [50].
В настоящее время при изучении роли лепти- на, ФНО - α, ингибитора активатора плазмино- гена 1 (PAI1) и ангиотензина-2, установлено, что лептин - продукт Ob-гена, гормон пептидной природы - синтезируется адипоцитами пропорционально массе жировой ткани и играет ключевую роль в гомеостазе энергии, сигнализируя головному мозгу о запасах жировой ткани и, таким образом, являясь представителем группы гормонов насыщения. Основная функция лептина в норме - стимуляция соответствующих зон гипоталамуса, угнетающих пищевое поведение [44, 53-55]. Известно, что лептин регулирует гомеостаз жирных кислот, предохраняя ткани от эктопического накопления липидов (липотоксикоза). У пациентов с ожирением выявлена гиперлептинемия [8] и резистентность к данному гормону (подобно инсули- норезистентности), в связи с чем и формируется его стойкая гиперпродукция [56].
При лептинорезистентности активируется перекисное окисление липидов, что стимулирует развитие липотоксических нарушений: инсули- норезистентности, эндотелиальной дисфункции, оксидативного стресса. При висцеральном ожирении и лептинорезистентности этот гормон влияет на кальцификацию сосудов, аккумуляцию холестерина клетками сосудистой стенки, повышение тонуса симпатической нервной системы.
Рецепторы к лептину обнаруживаются в клетках канальцевого эпителия. Следствием их стимуляции являются увеличение диуреза и натрийу- реза, при этом уровень АД и экскреции калия с мочой не изменяются. В работах последних лет показано, что при ожирении лептин индуцирует продукцию коллагена I типа мезангиальными клетками и стимулирует пролиферацию эндотелиоцитов и гладкомышечных клеток сосудов, опосредованно вызывая гипертрофию клубочков. Избыток лептина способен непосредственно активировать пролиферацию мезангиоцитов и продукцию ими медиаторов фиброгенеза (трансформирующего фактора роста-бета (ТФР-β), обладает антинатрийуретическим действием и значительно усиливает инсулинорезистентность [57].
В 1985 г. открыт гормон жировой ткани - адипонектин. У пациентов с ожирением наблюдается снижение активности и концентрации адипонек- тина в плазме крови. Установлено, что адипонек- тин способен препятствовать дифференцировке преадипоцитов, участвовать в регуляции жирового обмена [51, 52]. Существует обратная взаимосвязь между уровнем адипонектина и массой жировой ткани, показателем отношения «объем талии/ объем бедер». При развитии ожирения происходит не только значительное уменьшение уровня адипонектина в крови, но снижение экспрессии рецепторов к адипонектину, в результате чего защитные механизмы адипонектина в отношении развития атеросклероза утрачиваются. По данным многочисленных исследований при снижении веса у пациентов с
ИМТ выше 30 кг/м2 более, чем на 12% (около 14 кг) от исходного значения на протяжении 8 недель, отмечается увеличение уровня адипонектина на 22% от исходного, а снижение веса на 5-7 кг не сопровождается значительным повышением уровня адипонектина. Известно, что этот гормон оказывает тормозящее действие на процессы дифференцировки преадипоцитов, препятствует адгезии тромбоцитов к эндотелию, трансформации макрофагов в пенистые клетки, пролиферациии миграции миоцитов, захвату ЛПНП при формировании атеросклеротической бляшки, что указывает на его антиатерогенное и противовоспалительное действие.
Адипонектин снижает активность миеломо- ноцитов, фагоцитов, уменьшает синтез фактора некроза опухоли-α (ФНО-α) макрофагами, тормозит обусловленную ростовыми факторами пролиферацию гладкомышечных клеток в аорте. Адипонектин обладает противовоспалительными свойствами благодаря способностям увеличивать уровни интерлейкина-10 (ИЛ-10), интерлейкина-1 (ИЛ-1) и снижать концентрацию в крови ИЛ- 6. Несомненным признается тот факт, что адипонектин оказывает положительный эффект на метаболизм глюкозы, чувствительность к инсулину миоцитов и гепатоцитов [58].
Один из главных механизмов поражения почек, индуцируемого лептином и другими адипо- кинами, - общая дисфункция эндотелиоцитов почечных клубочков. Под действием лептина эндотелий начинает продуцировать медиаторы вазоконстрикции, тканевой гипоксии и антинатрийуреза (ангиотензин II, эндотелин-1), а также факторы роста и фиброгенеза (ТФР-β, основной фактор роста фибробластов, тромбоцитарный фактор роста), компоненты эндотелий-зависимого звена гемостаза (ингибитор активатора плазминогена типа1) [54]. Все эти факторы, а также наблюдающееся при стойкой гиперлептинемии расстройство эндотелий-зависимой вазодилатации, связанное с угнетением эндотелиальной NO-синтазы и резким уменьшением сродства эндотелиоцитов к образовавшемуся NO, приводят к выраженным нарушениям внутрипочечной гемодинамики, наблюдающимся уже тогда, когда показатели, характеризующие фильтрационную функцию почек, остаются в пределах нормальных значений [47].
При ожирении развивается воспалительный процесс, связанный с инфильтрацией макрофагов в почках. Инфильтрация макрофагов, в свою очередь, становится источником повышения числа целого ряда медиаторов воспаления, таких как фактор некроза опухоли альфа, интерлейкин-6,
С-реактивный белок, хемоаттрактантный протеин 1 моноцитов и фактор, ингибирующий миграцию макрофагов [59]. Кроме того, висцеральные адипоциты вырабатывают адипокины, такие как адипонектин и лептин, которые играют роль в патофизиологии поражения почек. Кроме адипокинов и медиаторов воспаления, такие вазоактивные пептиды, как ангиотензин II, также способствуют развитию гломерулопатии, ассоциированной с ожирением и СД [10].
Доказано, что у пациентов с ожирением выявлены стабильно низкие уровни адипонектина в циркулирующей крови [60].
Нами установлено, что первой клинической стадией поражения почек при ожирении является нарушение внутрипочечной гемодинамики [2]. По мере прогрессирования тубулярной и (или) гломерулярной эндотелиальной дисфункции выявляются постепенное снижение почечного функционального резерва [44].
В норме лептин циркулирует в крови, главным образом, в связанной форме, достигает гипоталамуса, проходя через гематоэнцефалический барьер и проявляет действие, уменьшая аппетит и увеличивая метаболизм. Трансдукция сигнала после связывания лептина с гипоталамическими рецепторами, включает уменьшение секреции нейропептида Y (NPY) и изменения в образовании меланокорти- на, которые изменяют пищевое поведение и вызывают насыщение. Уровни лептина изменяются в течение дня, повышаясь ночью, с чем и связано отсутствие аппетита в ночное время.
Установлено, что у тучных пациентов выражена экспрессия лептиновой м-РНК в подкожной жировой ткани. Но у них развивается лептиноре- зистентность из-за дефектного транспорта лептина через гематоэнцефалический барьер, что и приводит к гиперлептинемии. Гиперлептинемия обусловливает повышение аппетита и, как следствие, увеличение массы тела. Кроме того, высокие уровни инсулина у тучных пациентов непосредственно стимулируют производство лептиновой м-РНК. Другие факторы (пубертатный возраст, женский пол, повышение уровня IL-1, ФНО-α, кортикостероиды) увеличивают секрецию лептина, в то время как менопауза, старение, голодание - уменьшают. С другой стороны, лептин снижает секрецию инсулина и увеличивает гематопоэз, ангиогенез, термогенез [56, 57].
Лептин экскретируется почками. В терминальной стадии хронической почечной недостаточности уровень лептина повышается. Этому способствуют такие факторы, как тучность и воспаление [10, 29]. В экспериментах на животных показано, что лептин вызывает быстрое увеличение клубочковых эндотелиальных клеток, увеличивает экспрессию ТФР-β 1 с увеличением образования м-РНК коллаген IV типа. Эти факторы приводят к ФСГС и протеинурии. Кроме того, лептин связан с адренергической активацией, повышением АД, тахикардией, что объединяет повреждение почек и гипертонию при ожирении.
В ткани почек активно экспрессируется м-РНК рецептора лептина. Предполагают, что это связано с транспортом лептина через ткань почки - это основной этап тканевого захвата и катаболизма лептина. Лептиновый рецептор - член семейства цитокиновых рецепторов gp 130. Выделяют 6 изоформ лептиновых рецепторов [Ов-R (a-f)]. Среди них вариант Ов-Ra транспортирует лептин через гематоэнцефалический барьер, и вариант Ов-Rb представляет рецептор, необходимый для внутриклеточной трансдукции сигнала. Длинная изоформа рецептора Ов-Rb экспрессируется в мозге, особенно в гипоталамических ядрах. В периферических тканях длинная изоформа Ов- Rb была обнаружена только в надпочечниках и пирамидальной области почек [37, 44]. Роль почек в выделении лептина у человека оценивают при измерении концентрации лептина в плазме артериальной и венозной крови. Показано, что при однократном прохождении через почки концентрация лептина в плазме крови снижается на 17% [40, 56]. K. Sharma et al. (2008) сообщили об уменьшении концентрации лептина на 12% при прохождении через почки у здоровых лиц [61]. У пациентов с умеренно выраженным снижением функции почек выделение лептина было значительно снижено. В ходе экспериментальных исследований показано, что у крыс, подвергшихся двухсторонней нефрэктомии, снижается уровень выделения лептина [62, 63]. Вероятно, почки являются основным органом выведения лептина из организма.
При обследовании 70 пациентов с абдоминальным ожирением выявлена артериальная гипертензия у 68%. Доказано, что по мере возрастания ИМТ нарастает частоты поражения почек. С увеличением массы тела происходит прогрессирующее увеличение концентрации лептина в сыворотке крови, достигающей максимальных значений у пациентов с морбидным ожирением [5]. Аналогичные результаты продемонстрированы и другими исследователями [8, 9].
Механизм повреждающего действия лептина на ткань почек при ожирении и метаболическом синдроме до конца не ясен. Установлено, что реализация эффектов лептина осуществляется через рецепторы, расположенные преимущественно во внутренней зоне мозгового вещества, пирамидах, канальцах и собирательных трубочках. В этой связи предполагают, что лептин оказывает прямое повреждающее действие на структуру и функции почек [64]. В эксперименте было показано, что введение рекомбинантного лептина стимулирует пролиферацию эндотелиальных клеток клубочка и увеличивает продукцию коллагена I и IV типа, приводя к формированию гломерулосклероза и развитию протеинурии даже при нормальном уровне АД. Описано опосредованное влияние лептина на почку [30].
ФНО α, как один из основных индукторов инсулинорезистентности, наиболее активно образуется в адипоцитах висцеральной жировой ткани. Являясь одним из ключевых провоспалительных факторов, он стимулирует активацию ядерного фактора транскрипции с последующим увеличением синтеза ЭТ1 в мезангиальных клетках почек и активацией процессов пролиферации и склероза в почечной ткани [65].
Кроме того, ФНО α принадлежит ключевая роль в активации продукции PAI1. При нормальной массе тела его синтез происходит преимущественно в гепатоцитах и эндотелиальных клетках, в меньшей степени - в клетках гладкой мускулатуры и тромбоцитах. Доказано, что при ожирении повышается экспрессия гена PAI1 в жировой ткани сальника, являющегося одним из ведущих источников избытка этого маркера эндотелийзависимого звена гемостаза в плазме наряду с ЛПНП и ЛПОНП, способствующего тромбообразованию и нарушениям микроциркуляции [66].
Висцеральная жировая ткань синтезирует и секретирует ангиотензиноген, превращающийся под влиянием локально продуцируемого ренина и ангиотензинпревращающего фермента (АПФ) в АТП. Последний регулирует дифференциров- ку клеток жировой ткани, а также способствует увеличению плазменной концентрации лептина. Предполагают, что, вызывая стойкую вазокон- стрикцию, АТП способствует снижению перфузии жировой ткани, что, в свою очередь, ведет к нарушению обмена глюкозы и свободных жирных кислот в адипоцитах и впоследствии - к усугублению инсулинорезистентности [67].
АТП, в том числе его локально-почечный пул, стимулирует пролиферацию мезангиальных клеток и продукцию ими коллагенов, факторов хемотаксиса и трансформирующего фактора роста β1, которые способствуют нарастанию макрофагальной инфильтрации, тубулоинтерстициального воспаления и фиброза и в итоге - прогрессированию гломерулосклероза. Кроме того, АТП непосредственно увеличивает проницаемость базальной мембраны клубочков, таким образом способствуя нарастанию протеинурии. Вызывая спазм преимущественно выносящей артериолы, АТП обусловливает повышение внутриклубочкового давления и увеличение градиента почечного транскапиллярного давления. Спазм клубочковых артерий может приводить к перераспределению крови в почке: увеличивается шунтирование ее в сосуды почечных пирамид, что ведет к частичной ишемии структур почечной коры [68].
Ангиотензин II играет важную роль в развитии и прогрессировании нефроттии. Это главным образом связано с клубочковой капиллярной гипертонией и гипертрофией мезангиальных клеток. Особенно это выражено при ожирении, когда увеличенные уровни ангиотензина II сопровождаются гиперинсулинемией [66]. Эстрогены вызывают изменение соотношения аполипопротеинов A-IV и B и увеличение клубочковой секреции белка десмина и коллагена IC типа, с последующим почечным повреждением [36].
Таким образом, ожирение приводит к прогрессивному повреждению почек через множество механизмов. ООГ включает широкий диапазон морфологических и функциональных изменений в почках: гломерулосклероз, тубулоинтерстициальный фиброз, гломеруломегалию, клубочковую гипертрофию, утолщение клубочковой базальной мембраны и протеинурию [36].
Почечный кровоток и скорость клубочковой фильтрации увеличены при ожирении и связаны с появлением альбумина в моче (альбуминурия) [68]. Эпидемиологические исследования показали, что наличие микроальбуминурии 30-300 μg/ mg, ассоциирует с увеличением частоты сердечнососудистых заболеваний [36]. Отношение альбумина/креатинина (в норме 10-30 μg/mg) связано с более высоким сердечно-сосудистым риском [36, 69].
Появление МАУ зависит от начального ведущего механизма её развития. Основными пусковыми механизмами являются эндотелиальная дисфункция и клубочковая гиперфильтрация. Повышение внутриклубочкового давления происходит по причине сужения выносящей артериолы в результате непосредственного влияния на эндотелий сосудов или гиперактивации симпатической нервной системы. В результате данных изменений наблюдается усиление процессов фильтрации - гиперфильтрация, и увеличение поступления альбуминов в первичную мочу [69, 70].
Вторым ведущим механизмом поступления альбуминов в мочу является непосредственное поражение эндотелия сосудов. Известно, что наличие МАУ коррелирует с признаками эндотелиальной дисфункции по результатам пробы с реактивной гиперемией, позволяющей оценить степень эндотелийзависимой дилатации плечевой артерии. Эндотелиоцит - главная мишень для факторов риска, ведущих к возрастанию мочевой экскреции альбумина. Несомненным является тот факт, что стойкое повышение АД сопровождается существенной интенсификацией воздействия на эндотелий гемодинамического удара - так называемого shear stress, при котором эндотелиоци- ты растягиваются, взаимодействия между ними нарушаются. Гемодинамический удар способен сам приводить к повышению экспрессии эндотелиальными клетками некоторых вазоактивных молекул с преимущественно вазоконстрикторным действием - ангиотензина II , эндотелина I, молекул адгезии (VCAM-1), компонентов эндотелий- зависимого звена гемостаза (ингибитора активатора плазминогена типа 1). Таким образом, эндотелиальная дисфункция является интегральным маркером поражения органов - мишеней при АГ, и в первую очередь почек [71].
Инсулинорезистентность, окислительный стресс и воспаление приводят к альбуминурии и снижению почечной функции, но основные механизмы развития этих нарушений неясны.
K.Sharma et al. (2008) описывают роль адипо- нектина в развитии альбуминурии [61]. Адипо- нектин секретируется исключительно адипоци- тами. Адипонектин циркулирует в плазме в виде различных комплексов: высокая молекулярная масса (HMW; 12-к 36-mer), низкая молекулярная масса (hexamer) и в форме тримера. Общее количество и высокомолекулярная форма адипонектина характерны для женщин и снижении степени ожирения [42-43]. Низкие уровни адипонектина наблюдаются при СД 2, воспалении и атеросклерозе [12]. Эффекты тиазолидинедионов, повышающие чувствительность к инсулину связаны с увеличением уровня высокомолекулярной формы адипонектина [43, 51].
В последние годы активно изучается действие факторов риска, составляющих метаболический синдром (МС): артериальная гипертензия, гипертриглицеридемия, абдоминальное ожирение, инсулинорезистентность [72-77]. Доказано, что влияние этих факторов на почечную ткань во многом стереотипно: первым этапом поражения почек всегда является дисфункция гломерулярных эндотелиоцитов. В дальнейшем, в зависимости от преобладающего фактора, картина почечного поражения может стать более специфичной (гипертоническая, диабетическая нефропатия) и на определенной стадии изменения ткани почек при МС развивается фокально-сегментарный гломеру- лосклероз или тубулоинтерстициальный фиброз. При фокально-сегментарном гломерулосклерозе, ассоциированном с ожирением, возможна «большая» (>3г/сут) протеинурия, не приводящая, к снижению сывороточной концентрации альбумина и другим признакам нефротического синдрома. Ассоциированный с ожирением фокальносегментарный гломеруло склероз развивается медленно и встречается сравнительно редко (часть случаев его, очевидно, остается нераспознанной в связи с тем, что биопсию почки этим пациентам, как правило, не выполняют); о его формировании с наибольшей достоверностью свидетельствует нарастание экскреции альбумина с мочой [61, 63, 72].
Анализ морфологической картины почечной ткани у пациентов, у которых была выполнена нефрэктомия по поводу почечно-клеточного рака, показал, что у пациентов с МС достоверно более выраженными оказались атрофия канальцев, интерстициальный фиброз, артериолярный склероз, а также гломерулосклероз. Спустя 1 год наблюдения за этими пациентами установлено, что скорость клубочковой фильтрации была достоверно ниже по сравнению с пациентами без МС [66].
По результатам эпидемиологических исследований, доказано, что МС и его составляющие представляют собой одну из основных детерминант хронической болезни почек, при которой имеется основной ее признак - стойкое снижение скорости клубочковой фильтрации [28]. Установлено, что по мере увеличения индекса массы тела риск терминальной почечной недостаточности возрастает более чем в 7 раз.
В исследовании Strong Heart Study показано, что наличие МС сопряжено с увеличением на 40% вероятности стойкой микроальбуминурии и снижением на 30% (менее 60 мл/мин/1,73 м2) расчетной скорости клубочковой фильтрации, что соответствует III стадии хронической болезни почек. Обследование 994 жителей Финляндии, страдавших артериальной гипертензией, выявило, что при МС вероятность развития хронической почечной недостаточности возрастает в 2,79 раза. Показано, что риск хронической болезни почек возрастает по мере увеличения числа компонентов МС: присутствие одной составляющей его увеличивает относительный риск почечного поражения в 1,49 раза, двух - в 1,86, трех - в 2,65 раза. У пациентов, имеющих МС, вероятность возникновения признаков хронической болезни почек (альбуминурия, снижение расчетной скорости клубочковой фильтрации) увеличивается более чем на 80% [29].
При обследовании молодых мужчин, имеющих абдоминальное ожирение, выделены группы со сниженным и истощенным почечным функциональным резервом, при котором исходный почечный плазмоток был ниже должного, рассчитанного по номограмме. Установлено, что у этих пациентов с абдоминальным ожирением даже при приеме каптоприла под контролем результатов радиоизотопной нефросцинтиграфии, выявлено дальнейшее снижение почечного плазмотока. В группе пациентов с истощенным почечным функциональным резервом наблюдались максимально выраженные расстройства эндотелий-зависимой вазодилатации и наиболее высокий уровень; плазменной концентрации маркеров эндотелиальной дисфункции (эндотелина-1, микроальбуминурии) [11, 36, 66, 73-75].
При диагностике поражения почек у пациентов с ожирением изменения мочи мало информативны: лейкоцитурия, эритроцитурия не характерны, протеинурия не превышает уровень «следовой».
Значительно более точным методом диагностики ранней стадии поражения почек является количественное определение альбумина в моче, позволяющее своевременно выявить микроальбуминурию [75]. Нами было выявлено, что на этапе скринингового обследования возможно использование тест-полосок (микраль-тест). Обязательно также определение сывороточной концентрации креатинина и расчет скорости клубочковой фильтрации по формулам Cockroft-Gault или MDRD (у детей по Шварцу). Результаты нашего исследования доказали, что необходима оценка показателей, характеризующих обмен липопротеидов (сывороточная концентрация общего холестерина, липопротеидов низкой, очень низкой и высокой плотности, триацилглицеридов), тощаковой гликемии и урикемии, а также проведение диагностических тестов, использующихся для диагностики инсулинорезистентности [2].
Нами доказано, что клинико-параклинические особенности нефропатий у детей на фоне висцерального ожирения характеризуются многофакторной природой заболевания с нарушениями липидного, углеводного обмена, высоким уровнем сывороточного лептина, влиянием комплекса наследственных и медико-биологических (воздействие гипоксии) факторов. Установлено, что у больных с нефропатиями на фоне висцерального ожирения липидный спектр сыворотки крови характеризуется повышением атерогенности при снижении холестерина липопротеидов высокой плотности, увеличением сывороточных триацилглицеридов, общего холестерола, холестерина ли- попротеидов очень низкой плотности в сочетании с гиперлептинемией и нарушением толерантности к глюкозе. Выявлено, что повышение уровня сывороточного лептина и нарушение показателей липидного обмена у детей с нефропатиями на фоне висцерального ожирения ассоциирует с изменениями эхографических показателей структурного состояния почек, внутрипочечной гемодинамики и парциальным снижением почечных функций. Для диагностики патологии почек у детей с висцеральным ожирением информативными являются комплекс показателей: микроальбуминурия, уровень лептинемии, показатели углеводного и липидного спектра крови в сочетании с эхографическими параметрами структурного состояния почек, внутрипочечной гемодинамики и состоянием функции почек. Гиперлептинемия, повышение атерогенности сыворотки крови за счет снижения ХС ЛПВП и увеличения ХС ЛПНП являются предикторами развития патологии почек у детей с висцеральным ожирением [8].
Для ранней диагностики нефропатий у детей с висцеральным ожирением в программу диагностического обследования помимо общепринятых показателей рекомендовано включить определение уровня сывороточного лептина, микроальбуминурии, липидного спектра крови, показателей внутрипочечной гемодинамики, результатов суточного мониторирования артериального давления и функционального состояния почек с оценкой функционального почечного резерва.
Применение диагностической таблицы с определением комплекса показателей: микроальбуминурии, структурно-функционального состояния почек по данным цифрового допплеровского картирования, допплерографии почечных сосудов и функционального почечного резерва позволяет совершенствовать диагностику нефропатий у детей с висцеральным ожирением [8].
Разработанный алгоритм ранней диагностики поражения почек у детей с висцеральным ожирением рекомендовано использовать в практике врачей-педиатров, детских нефрологов и детских эндокринологов [8].
За последние 15 лет значительные успехи достигнуты в определении роли липидов в биологии подоцитов [77-80]. Сложное структурное устройство подоцита обеспечивает широкий набор его функций и приспособительных реакций в физиологических условиях, но в то же время делает эту клетку очень чувствительной к повреждению. После воздействия различных патогенных факторов (метаболических, токсических, гемодина- мических) подоциты подвергаются структурнофункциональным изменениям (рис. 1) [81]. Нарушения функционирования этих важнейших клеточных структур канальцевого аппарата получили обозначение подоцитопатий.
Признаками подоцитопатии являются сглаживание ножек подоцитов с нарушением проницаемости щелевидной диафрагмы, гипертрофия, апоптоз, отслоение подоцитов от БМК со слущи- ванием их в мочевое пространство и появлением в моче как целых клеток (подоцитурия), так и его структурных белков (нефрина, подоцина и др.), уменьшение количества подоцитов в клубочке (подоцитопения) [78-81].
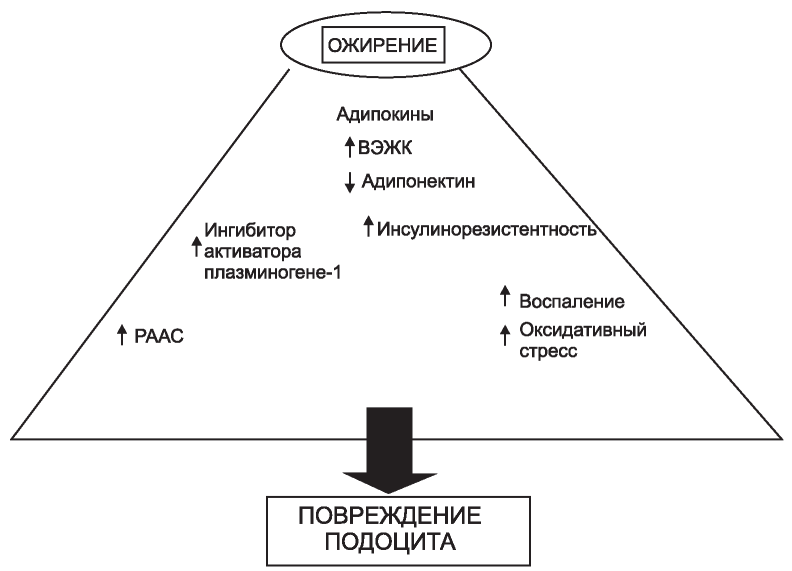
Рис.1. Ожирение и подоцитопатии [81].
В настоящее время установлено, что феномен сглаживания ножковых отростков представляет собой неспецифическую реакцию эпителиальной клетки на действие патогенного фактора . Он обусловлен нарушениями актинового цитоскелета подоцита с реорганизацией его в плотную сеть, что ведет к дислокации щелевидной диафрагмы к апикальной поверхности подоцита, слиянию фильтрационных щелей и увеличению проницаемости гломерулярного фильтра. С открытием большого количества подоцитарных белков расшифрована сложная молекулярная организация ножковых отростков подоцитов. Идентифицированы особые адгезивные соединения, образующие фильтрационные щели, основным компонентом которых является трансмембранный белок нефрин, который участвует в связывании с акти- новым цитоскелетом подоцитов, с другой стороны, через взаимодействие экстрацеллюлярных доменов между собой - в формировании межподоцитарной щелевой диафрагмы [79-]. Нефринпорообразующий белок, который необходим для формирования структуры основного компонента почечного фильтра - фенестрированной мембраны. Нефрин формирует комплексы с другими протеинами: подоцином и молекулой CD2AP. При целостности щелевой диафрагмы через барьер не могут пройти белковые молекулы, например, сывороточный альбумин [79-81].
При дефиците нефрина наблюдаются про- теинурия, гипоальбуминемия, гиперлипидемия и др. Гипергликемия приводит к активации ренинангиотензиновой системы (РАС) и повышению уровня ангиотензина II [78-80] и способствуют количественным и функциональным нарушениям подоцитов и снижению экспрессии вырабатываемого ими нефрина. Усиливающаяся в результате этих повреждений фильтрация белка, в свою очередь, может приводить к избыточной секреции эпителием проксимальных канальцев специфического почечного фактора фиброза MCP-1, экспрессия которого индуцируется гипергликемией. МСР-1 вызывает усугубление процессов воспаления и фиброза в почечных канальцах и интерсти- ции. Усиленная экскреция нефрина с мочой свидетельствует о подоцитопатии [79].
ЗАКЛЮЧЕНИЕ
Научные исследования последних лет по проблеме поражения почек у детей с ожирением проводятся в направлении изучения биомаркеров формирования патологии почек с оценкой уровня показателей липидного, углеводного обмена, инсулинорезистентности, сывороточного лептина и адипонектина [1-4].
Установлено, что непосредственное влияние адипоцитокинов, вырабатываемых жировой тканью, может быть причиной формирования структурных и функциональных почечных нарушений [5, 6]. Перспективным является выявление молекулярных механизмов, лежащих в основе взаимосвязей патологии почек при ожирении для разработки новых диагностических подходов к использованию биомаркеров уже на ранних стадиях избыточного накопления жировой ткани в организме и изменений в органах-мишенях, в том числе и почках.
Доказано, что основными звеньями патогенеза нефропатии при ожирении являются не только гемодинамические нарушения и эндотелиальная дисфункция, но и повышенная секреция провоспалительных адипокинов, снижение образования адипонектина, липотоксичность, латентное воспаление, гиперурикемия и другие механизмы. До открытия лептина общее представление о жировой ткани рассматривалось как пассивное депо хранения триглицеридов. В настоящее время доказано, что адипоциты секретируют белки, которые активно управляют энергетическим гомеостазом, участвуют в регуляции углеводного и липидного обмена, а также нейроэндокринной и сердечно-сосудистой и другими системами. Выявление ведущих патогенетических факторов, действующих на почку, которые тесно взаимосвязаны, дополняют и активируют друг друга, позволяет сформировать группу риска по нефропатиям у детей с избыточной массой тела.
А.А. Крячковой и соавт. доказано, что увеличение степени ожирения при метаболическом синдроме сопровождается нарастанием концентрации лептина в сыворотке крови. Гиперлептинемия тесно связана с антропометрическими показателями и функциональными параметрами почек и является фактором риска развития артериальной гипертензии при ожирении [5].
Адипонектин - адипокин, наиболее вероятный критерий для исследований связи между жировой тканью и почечной функцией. Использование адипонектина как биомаркера альбуминурии при ожирении - важный шаг к профилактике и лечению почечных заболеваний [76,77].
Результаты многочисленных клиникоэкспериментальных и эпидемиологических исследований свидетельствуют о всё более возрастающей роли системных гормонально-метаболических факторов в патогенезе патологии почек. Перспективным направлением патогенетической профилактики и лечения заболеваний почек является междисциплинарный подход, в рамках которого особый интерес представляет один из ключевых компонентов метаболического синдрома - инсулинорезистентность, оказывающая разносторонние патофизиологические эффекты, способные приводить к развитию и прогрессированию заболеваний почек. Раннее выявление и коррекция инсулинорезистентности у пациентов с метаболическими нарушениями и заболеваниями почек будут способствовать как патогенетической профилактике этих заболеваний, так и оптимизации их современного лечения, стандартные схемы диагностики и терапии которых пока не учитывают индивидуальные особенности гормональнометаболического статуса пациента, а потому нередко болезнь носит длительный, рецидивирующий или прогрессирующий характер [10, 16, 29].
Ожирение наряду с другими элементами метаболического синдрома тесно взаимосвязаны. Каждый из них вносит свой вклад в развитие и прогрессирование заболеваний почек. Воздействие множественных факторов приводит к вазодилата- ции почечных сосудов, клубочковой гиперфильтрации и альбуминурии с дальнейшим развитием нефропатии. Присоединение АГ способствует прогрессированию заболевания с формированием хронической болезни почек. Дальнейшие исследования молекулярной взаимосвязи при нефропатиях у детей с ожирением позволят индивидуализировать подход к каждому ребенку с избыточной массой тела, диагностировать и корректировать ведущее звено нарушенного метаболизма.
Раннее выявление болезни, контроль веса, уровня гипергликемии и АД, ведение правильного образа жизни и новые подходы к диагностике и лечению заболевания могут привести к уменьшению риска высокой частоты заболеваемости и смертности от почечной патологии, связанной с ожирением, СД и другими обменными заболеваниями [1, 11, 58].
Использование ранних биомаркеров патологии почек при ожирении с оценкой уровня показателей липидного, углеводного обмена, сывороточного лептина и инсулинорезистентности является перспективным для диагностики ренального поражения при ожирении у детей [1, 8].
Список литературы
1. Вялкова АА, Лебедева ЕН, Красиков СИ и др. Клинико-патогенетические аспекты повреждения почек при ожирении (обзор литературы). Нефрология 2014; (3): 24- 33 [Vyalkova AA, Lebedeva EN, Krasikov SI i dr. Kliniko-patogeneticheskie aspekty povrezhdeniya pochek pri ozhirenii (obzor literatury). Nefrrologiya 2014; (3): 24- 33]
2. Вялкова АА, Зорин ИВ, Седашкина ОА и др. Биомаркеры ренального поражения при патологии органов мочевой системы у детей. Нефрология 2012; (3): 68-75 [Vyalkova AA, Zorin IV, Sedashkina OA i dr. Biomarkery renal’nogo porazheniya pri patologii organov mochevoj sistemy u detej. Nefrologiya 2012; (3): 68-75]
3. Вялкова АА, Савельева ЕВ, Барсукова СВ, Дребнева СА. Факторы риска и биомаркеры диагностики вторичных заболеваний почек у детей. Материалы VIII Российского форума с международным участием «Педиатрия Санкт-Петербурга: опыт, инновации, достижения» (Санкт-Петербург,12-13 сентября 2016). СПб., 2016; 30-31 [Vyalkova AA, Savel'eva EV, Barsukova SV, Drebneva SA. Faktory riska i biomarkery diagnostiki vtorichnyh zabolevanij pochek u detej. Materialy VIII Rossijskogo foruma s mezhdunarodnym uchastiem “Pediatriya Sankt-Peterburga: opyat, innovacii, dostizheniya” (Sankt-Peterburg,12-13 sentyabrya 2016). SPb., 2016; 30-31]
4. Смирнова НН, Куприенко НБ. Нефропатия ожирения в педиатрии. Нефрология 2013 (6): 37-45 [Smirnova NN, Kuprienko NB. Nephropathy in pediatric obesity. Nefrologiya 2013 (6) 37-45]
5. Крячкова АА, Савельева СА, Галлямова МГ и др. Роль ожирения в поражении почек при метаболическом синдроме. Нефрология и диализ 2010; 12 (1): 34-38 [Kryachkova AA, Savel'eva SA, Gallyamova MG i dr. Rol’ ozhireniya v porazhenii pochek pri metabolicheskom sindrome. Nefrologiya i dializ 2010; 12 (1): 34-38]
6. Лебедева ЕН, Вялкова АА, Николаева СН, Саломатина ИИ. Определение структуры тела у детей с ожирением. Сборник научных работ «Актуальные проблемы здоровья детей и подростков» (Уфа, 2006); 160-163 [Lebedeva EN, Vyalkova AA, Nikolaeva SN, Salomatina II. Opredelenie struktury tela u detej s ozhireniem. Sbornik nauchnyh rabot «Aktual’nye problemy zdorov’ya detej i podrostkov» (Ufa, 2006); 160-163]
7. Вялкова АА, Гордиенко ЛМ, Кулагина ЕП. Тубулоинтерстициальная болезнь почек у детей, ассоциированная с висцеральным ожирением. Российский вестник перинатологии и педиатрии 2015; (4): 201 [Vyalkova AA, Gordienko LM, Kulagina EP. Tubulointersticial’naya bolezn’ pochek u detej, associirovannaya s viscerpal’nym ozhireniem. Rossijskij vestnik perinatologii i pediatrii 2015; (4): 201]
8. Николаева СН. Особенности поражения почек у детей с ожирением. Автореферат на соискание ученой степени кандидата медицинских наук 2010: 23-24 16 [Nikolaeva SN. Osobennosti porazheniya pochek u detej s ozhireniem. Avtoreferat na soiskanie uchenoj stepeni kandidata medicinskih nauk 2010: 23-24 16]
9. Вялкова АА, Ушакова ЮВ, Кулагина ЕП и др. К вопросу ранней диагностики диабетической нефропатии у детей. Нефрология и диализ 2010; (2):358-365 [Vyalkova AA, Ushakova YUV, Kulagina EP i dr. K voprosu rannej diagnostiki diabeticheskoj nefropatii u detej. Nefrologiya i dializ 2010; (2):358-365].
10. Смирнов АВ. Характеристика дислипопротеинемий у больных гломерулонефритом. Нефрология 1998; (2):76-83 [Smirnov AB Dislipoproteinemia features in patients with glomerulonephritis. Nephrology 1998; (2): 76-83]
11. Вялкова АА, Савельева ЕВ, Кулагина ЕП, Белова МА. Ранняя диагностика поражения почек у детей с сахарным диабетом 1 типа. Педиатр 2016; (2): 181-182 [Vyalkova AA, Savel’eva EV, Kulagina EP, Belova MA. Rannyaya diagnostika porazheniya pochek u detej s saharnym diabetom 1 tipa Pediatr 2016; (2): 181-182]
12. Кутырина ИМ, Краснова ЕА, Федорова ЕВ, Фомин ВВ. Поражение почек при ожирении: клинические, патогенетические и терапевтические аспекты. Врач 2005; (6):6-9 [Kutyrina IМ, Krasnova EА, Fedorova EV, Fomin VV. Porazhenie pochek pri ozhirenii: klinicheskie, patogeneticheskie i terapevticheskie aspekty. Vrach 2005; (6): 6-9]
13. Мухин НА, Балкаров ИМ, Моисеев СВ и др. Хронические прогрессирующие нефропатии и образ жизни современного человека. Тер арх 2004; (9): 5-11 [Muhin NA, Balkarov IM, Moiseev SV i dr. Hronicheskie progressirujushhie nefropatii i obraz zhizni sovremennogo cheloveka. Ter arh 2004; (9): 5-11]
14. Мухин НА, Шоничев ДГ, Балкаров ИМ и др. Формирование артериальной гипертонии при уратном тубулоинтерстициальном поражении почек. Тер арх 1999; (6): 12-24 [Muhin NA, Shonichev DG, Balkarov IM i dr. Formirovanie arterial’noj gipertonii pri uratnom tubulointersticial’nom porazhenii pochek Ter. arh 1999; (6): 12-24]
15. Ogden CL, Yanovski SZ, Carroll MD, Flegal KM. The epidemiology of obesity. Gastroenterology 2007; 132: 2087-2102
16. Савенкова НД, Папаян АВ. Нефротический синдром в практике педиатра. Эскулап. СПб., 1999; 128-143 [Savenkov ND Papayan AB. Nephrotic syndrome in pediatric practice. St. Petersburg: Aesculapius. 1999; 128-143]
17. Вялкова АА, Савельева ЕВ, Кулагина ЕП, Белова МА. Особенности патологии почек при сахарном диабете и ожирении у детей. Материалы конференции педиатровнефрологов, урологов «Памяти А.В. Папаяна посвещается» (Санкт-Петербург, 5 февраля 2016). СПб., 2016 [Vyalkova AA, Savel'eva EV, Kulagina EP, Belova MA. Osobennosti patologii pochek pri saharnom diabete i ozhirenii u detej. Materialy konferencii pediatrov-nefrologov, urologov «Pamyati A.V. Papayana posveshchaetsya (Sankt-Peterburg, 5 fevralya 2016). SPb., 2016]
18. Бутрова СА, Дзгоева ФХ. Висцеральное ожирение – ключевое звено метаболического синдрома. Ожирение и метаболизм 2004; (1): 10–16 [Butrova SA, Dzgoeva FH. Visceral'noe ozhirenie – kljuchevoe zveno metabolicheskogo sindroma. Ozhirenie i metabolizm 2004; (1): 10–16]
19. Вялкова АА, Николаева СН, Лебедева ЕН и др. Характеристика липидного обмена при ожирении у детей с нефропатиями. Материалы III научно-практическая конференция «Педиатрия и детская хирургия в Приволжском федеральном округе» (Казань, 2006) ;107-108 [Vjalkova AA, Nikolaeva SN, Lebedeva EN i dr. Harakteristika lipidnogo obmena pri ozhirenii u detej s nefropatijami. Materialy III nauchno-prakticheskaja konferencija «Pediatrija i detskaja hirurgija v Privolzhskom federal’nom okruge». Kazan’, 2006; 107-108]
20. Гинзбург ММ, Козупица ГС. Значение распределения жира при ожирении. Пробл Эндокр 1996; (3): 42–46 [Ginzburg MM, Kozupica GS. Znachenie raspredelenija zhira pri ozhirenii Probl jendokr 1996; (3): 42–46]
21. Дедов ИИ, Мельниченко ГА, Романцова ТИ. Патогенетические аспекты ожирения. Ожирение и метаболизм 2004; (1): 3–9 [Dedov II, Mel’nichenko GA, Romancova TI. Patogeneticheskie aspekty ozhirenija. Ozhirenie i metabolizm 2004; (1): 3–9]
22. Global status report on noncommunicable diseases 2014. Geneva: WHO, 2012.: doi: 10.1016/j.amepre.2015.10.007
23. Foster MC, Hwang SJ, Larson MG et al. Overweight, obesity, and the development of stage 3 CKD: the Framingham Heart Study. Am J Kidney Dis 2008; 52(1): 39-48. doi: 10.1053/j.ajkd.2008.03.003
24. Wang Y, Chen X, Song Y et al. Association between obesity and kidney disease: a systematic review and meta-analysis. Kidney Int 2008; 73(1):19-33. doi: 10.1038/sj.ki.5002586
25. Савельева ЕВ, Вялкова АА, Кулагина ЕП, Куценко ЛВ. Эндокринопатии и патология почек у детей. Российский вестник перинатологии и педиатрии 2016; (4): 217 [Savel'eva EV, Vyalkova AA, Kulagina EP, Kutsencko LV. Endokrinopatii i patologiya pochek u detej. Rossijskij vestnik perinatologii i pediatrii 2016; (4): 217].
26. Федорова ЕЮ, Кутырина ИМ. Механизмы прогрессирования поражения почек при ожирении. Нефрология и диализ 2006;(2): 3-12 [Fedorova EJu, Kutyrina IM. Mehanizmy progressirovanija porazhenija pochek pri ozhirenii. Nefrologiya i dializ 2006;(2): 3-12]
27. Miyazaki Y, Cersosimo E, Triplitt C, DeFronzo RA. Rosiglitazone decreases albuminuria in type 2 diabetic patients. Kidney Int 2007; 72 (2):1367-1373. doi: 10.1038/sj.ki.5002516
28. Наточин ЮВ. Нефрология и фундаментальная наука. Нефрология 2012; (16): 9-21 [NatochinYuV. Nephrologija i fundamental’naja nauka. Nefrologiya 2012; (16): 9-21]
29. Смирнов АВ, Шилов ЕМ, Добронравов ВА. Национальные Рекомендации. Хроническая болезнь почек: основные принципы скрининга, диагностики, профилактики и подходы к лечению. Нефрология 2012; (16): 89-115 [Smirnov AV, Shilov EM, Dobronravov VA. National’nye Recommendacii. Chronicheskaja bolezn’ pochek: osnovnye principy screninga, diagnostiki, profilaktiki i podhody k lecheniju. Nefrologiya 2012; (16): 89-115]
30. Chdek J, Adamczak М, Nieszporek T. еt al. Adipose Tisseu as an Endocrine Organ-A Nephrologistists Perspective. Obesity and kidney. Gunter Wolf 2006; 15 (1): 70-90. doi: 10.1159/000095320
31. Chagnac A, Herman M, Zingerman B et al. Obesityinduced glomerular hyperfiltration: its involvement in the pathogenesis of tubular sodium reabsorption. Nephrol Dial Transplant 2008; 23(12): 3946-3952. doi: 10.1093/ndt/gfn379
32. Мартынов АИ, Аветяк АИ, Акатова ЕВ и др. Эндотелиальная дисфункция и методы ее диагностики. Российский кардиологический журнал 2005; (4): 94-98 [Martynov AI, Avetyak NA, Akatova EV et al. Endothelial dysfunction and method of its diagnosis. Russia Cardiologic Journal 2005; (4): 94-98]
33. Malyszko J, Bachorzewska-Gajewska H, Malyszko JS et al. Prevalence of Chronic Kidney Disease in Elderly Patients with Normal Serum Creatinine Levels Undergoing Percutaneous Coronary Interventions. Gerontol 2010; (56): 51-54. doi: 10.1159/000265560
34. Боровкова НЮ, Боровков НН, Теплова НО. Состояние вазодилатирующей функции эндотелия при артериальной гипертензии у больных хроническим гломерулонефритом с сохранной функцией почек. Клиническая медицина 2009; (4): 57-61 [Воrovkova NYU, Borovkov NN, Teplova NO. Sostoyanie vazodilatiruyushchej funkcii ehndoteliya pri arterial'noj gipertenzii u bol'nyh hronicheskim glomerulonefritom s sohrannoj funkciej pochek. Klinicheskaya medicina 2009; (4): 57-61]
35. Конюх ЕА, Парамонова НС. Клинические особенности течения острого и хронического гломерулонефритов у детей с дисфункцией эндотелия. Журнал ГрГМУ 2010; (2): 149-151 [Konyuh EA, Paramonova NS. Klinicheskie osobennosti techeniya ostrogo i hronicheskogo glomerulonefritov u detej s disfunkciej ehndoteliya. ZHurnal GrGMU 2010;(2): 149-151]
36. Мухин НА, Арутюнов ГП, Фомин ВВ. Альбуминурия – маркер поражения почек и риска сердечно-сосудистых осложнений. Клин Нефр 2009; (1): 5-10 [Muhin NA, Arutjunov GP, Fomin VV. Al’buminurija – marker porazhenija pochek i riska serdechno-sosudistyh oslozhnenij. Klin Nefr 2009; (1): 5-10]
37. Papafragkaki DK, Tolis G. Obesity and renal disease: A possible role of leptin. Hormones 2005; 4 (2): 90-95.
38. Wickman C, Kramer H. Obesity and kidney disease: potential mechanisms. Semin Nephrol. 2013; 33(1):14-22. doi:10.1016/j.semnephrol.2012.12.006
39. Praga M, Hernаndez E, Morales E. Clinical features and long-term outcome of obesity-associated focal segmental glomerulosclerosis. Nephrol Dial Transplant 2001; (15): 1790-1798
40. Meier-Krieshce HU, Vaghela M, Thambuganipalle R. The effect of body index on long-trem renal allograft survival.Transplantation1999; (68): 1294-1297
41. Ahima RS. Linking adiponektin to proteinuria. JCI 2008; 118 (2); 1619-1622. doi: 10.1172/JCI35655
42. Villarreal D, Reams G, Freeman RH, Taraben A. Renal effects of leptin in normotensive, hypertensive and obese rats. Am J Physiol. 1998; 27 (5): 2056-2060
43. Kohan DE. Endothelins in the normal and diseased kidney. Am J Kidney Dis 1996; (1): 2-26
44. Adamczak M, Wiecek A. The adipose tissue as an endocrine organ. Semin Nephrol 2013; 33(1):2-13. doi:10.1016/i.semnephrol.2012.12.008
45. Rustenbeck I. Desensitization of insulin secretion. Biochem Pharmacol 2002; 54(63): 1921–1935
46. Leibson CL, O’Brien PC, Atkinson E. Relative contributions of incidence and survival to increasing prevalence of adult-onset diabetes mellitus: a population-based study. Am J Epidemiol 1997; 43 (146): 12–22.doi: 10.1093/oxfordjournals.aje.a009187
47. Mravec B. Role of catecholamine-induced activation of vagal afferent pathways in regulation of sympathoadrenal system activity: negative feedback loop of stress response. Endocr Regul 2011;53 (45): 37-41
48. Garrido AM, Griendling КК. NADPH oxidases and angiotensin II receptor signaling. Molecul Cell Endocrinol 2009; 30 (2): 148–158. doi: 10.1016/j.mce.2008.11.003.
49. Pham H, Utzschneider KM, de Boer IH. Measurement of insulin resistance in chronic kidney disease. Curr Opin Nephrol Hypertens 2011; 20(6): 640-646. doi: 10.1097/MNH.0b013e32834b23c1.
50. Ensling M, Steinmann W, Whaley-Connell A. Hypoglycemia: A Possible Link between Insulin Resistance, Metabolic Dyslipidemia, and Heart and Kidney Disease (the Cardiorenal Syndrome). Cardiorenal Med 2011; 1(1): 67-74. doi: 10.1159/000322886
51. van Stijn CM, Kim J, Barish GD. Adiponectin expression protects against angiotensin II-mediated inflammation and accelerated atherosclerosis. PLoS One 2014 ; 9 (1): 86-94
52. Wolf G. Obesity and Renal Disease: Introduction. Semin Nephrol 2013; 33(1):1. doi: 10.1016/j.semnephrol.2012.12.001
53. Han DC, Isono M, Chen S. Leptin stimulates type I collagen production in db/db mesangial cells: glucose uptake and TGFbeta type II receptor expression. Kidney Int 2001; (59):1315-1323
54. Hong SW, Isono M, Chen S et al. Increased glomerular and tubular expression of transforming growth factor-beta1, its type II receptor, and activation of the Smad signaling pathway in the db/db mouse. Am J Pathol 2001;(158): 1653-1663
55. Rüster C, Wolf G. The role of the renin-angiotensinaldosterone system in obesity-related renal diseases. Semin Nephrol 2013; 33(1):44-53
56. Nasrallah MP, Ziyadeh FN. Overview of the physiology and pathophysiology of leptin with special emphasis on its role in the kidney. Semin Nephrol 2013 Jan; 33(1): 54-65. doi:10.1016/j.semnephrol.2012.12.005
57. Locatelli F, Pozzoni P, Del Vecchio L. Renal manifestations in the metabolic syndrome. J Am Soc Nephrol 2006;17(4 ):81-85. doi: 10.1681/ASN.2005121332
58. Ваулин НА. Ингибитор ангиотензинпревращающего фермента или блокаторы рецепторов ангиотензина: с чего начать лечить гипертензию. Consilium Medicum 2012; 14 (5): 21-27 [Vaulin NA. Ingibitor angiotenzinprevrashchayushchego fermenta ili blokatory receptorov angiotenzina: s chego nachat’ lechit’ gipertenziyu. Consilium Medicum 2012; 14 (5): 21-27]
59. King GL. The role of inflammatory cytokines in diabetes and its complications. J Periodontol 2008; 79(8): 1527-1534. doi: 10.1902/jop.2008.080246
60. Saraheimo M, Forsblom C, Thorn L et al. Serum adiponectin and progression of diabetic nephropathy in patients with type 1 diabetes. Diabetes Care 2008; 31(6): 1165-1169. doi: 10.2337/dc07-2306
61. Sharma K. Adiponectin regulates albuminuria and podocyte function in mice. J Clin Invest 2008; (118):1645-1656. doi: 10.1172/JCI32691
62. Bonnet F, Deprele C, Sassolas A et al. Excessive body weight as a new independent risk factor for clinical and pathological progression in primary IgA-nephritis. Am J Kidney Dis 2001; (37): 720-727
63. Siddiqi FS, Advani A. Endothelial-Podocyte Crosstalk: The Missing Link Between endothelial Dysfunction and Albuminuria in Diabetes. Diabetes 2013;62 (11): 3647-3655
64. Pabafragkaki DK , George T. Obesity and renal disease: A possible role of leptin. Hormonse 2005; 4 (2): 90-95
65. Sharma K, McCue P, Dunn S. Diabetic kidney disease in the db/db mouse. Am J Renal Physiol 2003; (284): 1138-1144. doi:10.1152/ajprenal.00315.2002
66. Henegar J, Bigler S, Henegar L et al. Functional and structural changes in the kidney in the early stages of obesity. Am J Soc Nephrol 2001;(12): 1211-1217
67. Kadowaki T. Adiponectin and adiponectin receptors in insulin resistance, diabetes, and the metabolic syndrome. J Clin Invest 2006;(116):1784-1792. doi: 10.1172/JCI29126
68. Ohashi K. Exacerbation of albuminuria and renal fibrosis in subtotal renal ablation model of adiponectin-knockout mice. Arterioscler Thromb Vasc Biol 2007; (27):1910-1917. doi:10.116 1/ATVBAHA.107.147645
69. Jauregui A, Mintz DH, Mundel P, Fornoni A. Role of altered insulin signaling pathways in the pathogenesis of podocyte malfunction and microalbuminuria. Curr Opin Nephrol Hypertens 2009; 18(6): 539-545. doi:10.1097/MNH.0b013e32832f7002
70. McCullough PA, Li S, Jurkovitz CT et al. Chronic kidney disease, prevalence of premature cardiovascular disease, and relationship to shortterm mortality. Am Heart J 2008; (156): 277—283. doi: 10.1016/j.ahj.2008.02.024
71. Кочуева МН, Гаврилюк ВА. Нейроэндокринные механизмы развития нефропатии у больных эссенциальной артериальной гипертензией с ожирением. Схiдноєвропейський журнал внутрiшньої та сiмейної медицини 2014; (1): 43-50 [Kochueva MN, Gavrilyuk VA. Nejroehndokrinnye mekhanizmy razvitiya nefropatii u bol'nyh ehssencial'noj arterial'noj gipertenziej s ozhireniem. Skhidnoєvropejs'kij zhurnal vnutrishn'oї ta simejnoї medicini 2014; (1): 43-50]
72. Lee MJ. A role for AMP-activated protein kinase in diabetes-induced renal hypertrophy. Am J Physiol Renal Physiol 2007; (292):F617-F627. doi: 10.1152/ajprenal.00278.2006
73. Yamauchi T, Nio Y, Maki T et al. Targeted disruption of AdipoR1 and AdipoR2 causes abrogation of adiponectin binding and metabolic actions. Nat Med 2007;(13):332-339. doi:10.1038 /nm1557
74. Yano Y. Differential impacts of adiponectin on low-grade albuminuria between obese and nonobese persons without diabetes. J Clin Hypertens (Greenwich) 2007;( 9):775-782
75. Looker HC. Adiponectin concentrations are influenced by renal function and diabetes duration in Pima Indians with type 2 diabetes. J Clin Endocrinol Metab 2004; (89):4010-4017. doi:10. 1 210/jc.2003-03191
76. Risheng Y, Scherer PE. Adiponectin, driver or passenger on the road to insulin sensitivity? Mol Metab 2013; 2(3): 133–141. doi:10.1016/j.molmet.2013.04.001
77. Jeon WS, Park JW, Lee N et al. Urinary adiponectin concentration is positively associated with micro- and macrovascular complications. Cardiovasc Diabet 2013; (12):137. doi:10.1186/1475-2840-12-137
78. Othman M, Kawar B, El Nahas AM. Influence of obesity on progression of non-diabetic chronic kidney disease: a retrospective cohort study. Nephron Clin Pract 2009, 113 (1): 16-23
79. Fornoni A, Merscher S, Kopp JB. Lipid biology of the podocyte—new perspectives offer new opportunities. Nat. Rev. Nephrol. 2014;10(7):379-88. doi: 10.1038/nrneph.2014.87
80. Kandasamy et al. Nephrin – a biomarker of early glomerular injury. Biomarker Research 2014; (2): 21
81. Camici M, Galetta F, Abraham N, Carpi A. Obesity-related glomerulopathy and podocyte injury: A mini review Front Biosci (Elite Ed). PLoS One 2012; 1(4):1058-1069
Об авторах
А. А. ВялковаРоссия
профессор, заведующая кафедрой факультетской педиатрии, эндокринологии, д.м.н.,
460000, Оренбург, ул. Советская, д. 6
Е. Н. Лебедева
Россия
доцент, кафедра биологической химии, к.м.н.,
460000, Оренбург, ул. Советская, д. 6
С. Н. Афонина
Россия
доцент, кафедра биологической химии, к.м.н.
460000, Оренбург, ул. Советская, д. 6
С. А. Чеснокова
Россия
клинический ординатор, кафедра факультетской педиатрии, эндокринологии,
460000, Оренбург, ул. Советская, д. 6
Л. В. Куценко
Россия
ассистент, кафедра факультетской педиатрии, эндокринологии
460000, Оренбург, ул. Советская, д. 6
Е. В. Лукерина
Россия
аспирант, кафедра факультетской педиатрии, эндокринологии
460000, Оренбург, ул. Советская, д. 6
Рецензия
Для цитирования:
Вялкова А.А., Лебедева Е.Н., Афонина С.Н., Чеснокова С.А., Куценко Л.В., Лукерина Е.В. ЗАБОЛЕВАНИЯ ПОЧЕК И ОЖИРЕНИЕ: МОЛЕКУЛЯРНЫЕ ВЗАИМОСВЯЗИ И НОВЫЕ ПОДХОДЫ К ДИАГНОСТИКЕ (обзор литературы). Нефрология. 2017;21(3):25-38. https://doi.org/10.24884/1561-6274-2017-3-25-38
For citation:
Vyalkova A.A., Lebedeva E.N., Afonina S.N., Chesnokova S.A., Kutsencko L.V., Lukerina E.V. KIDNEY DISEASES AND OBESITY: MOLECULAR RELATIONSHIP AND NEW APPROACHES TO DIAGNOSIS (literature review). Nephrology (Saint-Petersburg). 2017;21(3):25-38. (In Russ.) https://doi.org/10.24884/1561-6274-2017-3-25-38
JATS XML








































