Перейти к:
ПОРАЖЕНИЯ ПОЧЕК, АССОЦИИРОВАННЫЕ С МОНОКЛОНАЛЬНЫМИ ГАММАПАТИЯМИ: ОДНОЦЕНТРОВОЕ ИССЛЕДОВАНИЕ
https://doi.org/10.24884/1561-6274-2018-22-6-38-46
Аннотация
ВВЕДЕНИЕ. Поражение почек, ассоциированное с моноклональными гаммапатиями (МГ), является областью интересов практической онконефрологии. Распространенность, структура, почечный прогноз и подходы к терапии этой группы заболеваний, в том числе в российской популяции, остаются не до конца определенными и нуждаются в уточнении. ЦЕЛЬ. Анализ распространенности, структуры, лечения и исходов поражений почек при МГ.
ПАЦИЕНТЫ И МЕТОДЫ. В одноцентровое проспективное исследование за период с 01.01.2011 г. – 01.05.2018 г. включены пациенты с МГ и морфологически верифицированным поражением почек (n=119). Случаи МГ неопределенного значения при неамилоидном поражении почек расценивали как МГ ренального значения (МГРЗ). Проанализированы виды терапии, гематологический и почечный ответы. Прогрессированием дисфункции почек считали снижение рСКФ >25 % от исходной/ начало заместительной почечной терапии (ЗПТ), улучшением – нарастание рСКФ >25 %/ прекращение ЗПТ на момент конца наблюдения, остальные случаи считали стабильной функцией. Регистрировали исходы: начало ЗПТ или рСКФ<15 мл/мин/1,73 м2 и смерть от всех причин. Почечную выживаемость оценивали методом Каплана–Мейера. Медиана периода наблюдения составила 12 (2; 27) мес.
РЕЗУЛЬТАТЫ. Распространенность поражения почек, ассоциированного с МГ, составила 7,5 %, МГРЗ – 0,94 % от всех нефробиопсий (n=1580). Множественная миелома (ММ), AL-амилоидоз и лимфопролиферативное заболевание (ЛПЗ) диагностировали у 39, 55 и 10 больных, соответственно. Частота отдельных вариантов поражения почек была следующей: AL-амилоидоз (53 %), цилиндровая нефропатия (12 %), болезнь отложения легких цепей (12 %), С3-гломерулопатия (3 %), пролиферативный гломерулонефрит (ГН) с отложением моноклональных иммуноглобулинов (3 %), криоглобулинемический ГН (2 %), тромботическая микроангиопатия (2 %), подоцитопатия (2 %), острый тубулярный некроз (2 %), иммунотактоидный, фибриллярный ГН, проксимальная тубулопатия (по 1 %), сочетание форм (6 %). Пациенты в основном получили лечение бортезомибом и дексаметазоном, в 13 случаях была выполнена аутологичная трансплантация костного мозга. Гематологический ответ получен у 48,8, 45,4 и 46,7 % больных с ММ, AL-амилоидозом и МГРЗ соответственно. Ухудшение функции почек наблюдали при ММ (11,1 %) и AL-амилоидозе (37,2 %), улучшение/стабилизация – в 88,9 и 62,7 % соответственно. При МГРЗ наблюдали улучшение (20 %) и стабилизацию почечной функции (80 %). Четырехлетняя кумулятивная почечная выживаемость в группах ММ, AL-амилоидоза, МГРЗ и ЛПЗ составила 63, 54, 80 и 39 % соответственно, и достоверно не отличалась.
ЗАКЛЮЧЕНИЕ. Поражение почек при МГ – нередкая патология с неблагоприятным почечным прогнозом, представленная разнообразными клинико-морфологическими паттернами, требует практической реализации высокоспециализированного мультидисциплинарного подхода к диагностике и лечению.
Ключевые слова
Для цитирования:
Храброва М.С., Добронравов В.А., Смирнов А.В. ПОРАЖЕНИЯ ПОЧЕК, АССОЦИИРОВАННЫЕ С МОНОКЛОНАЛЬНЫМИ ГАММАПАТИЯМИ: ОДНОЦЕНТРОВОЕ ИССЛЕДОВАНИЕ. Нефрология. 2018;22(6):38-46. https://doi.org/10.24884/1561-6274-2018-22-6-38-46
For citation:
Khrabrova M.S., Dobronravov V.A., Smirnov A.V. KIDNEY DISEASE ASSOCIATED WITH MONOCLONAL GAMMOPATHIES: SINGLE-CENTER STUDY. Nephrology (Saint-Petersburg). 2018;22(6):38-46. (In Russ.) https://doi.org/10.24884/1561-6274-2018-22-6-38-46
ВВЕДЕНИЕ
Поражение различных структур почек при моноклональных гаммапатиях (МГ) обусловлено воздействием патологического моноклонального белка, продуцируемого аберрантным клоном В-лимфоцитов или плазматических клеток (ПК). Масса опухолевого клона может существенно различаться и не достигать выраженности [1], соответствующей известным критериям множественной миеломы (ММ) [2], лимфоплазмоцитомы [3] или лимфомы [4]. Повреждения почек, ассоциированные с «небольшим» клоном В-лимфоцитов/ ПК, с недавнего времени обозначаются как «моноклональная гаммапатия ренального значения» (МГРЗ), что подчеркивает генез почечного поражения и необходимость этиологического лечения [5]. Поражение почек при МГ - гетерогенная группа заболеваний, которые отличаются по патогенезу, клиническим проявлениям, прогнозу и требуют дифференцированной диагностики и терапии [610]. Дисфункция почек при МГ - междисциплинарная проблема, которая относится и к сфере компетенций развивающейся области онконефрологии. С учетом необходимости накопления данных о распространенности, клинико-морфологических проявлениях и почечном прогнозе поражений почек при МГ, включая МГРЗ [6, 7, 10-14], было инициировано настоящее исследование.
ПАЦИЕНТЫ И МЕТОДЫ
В открытое одноцентровое проспективное исследование, начатое в клинике НИИ нефрологии 01.01.2011 г., были включены впервые выявленные случаи, удовлетворяющие следующим критериям: 1) наличие плазмоклеточной дискразии [моноклональной гаммапатии неопределенного значения (МГНЗ)/МММИ-амилоидоза [2]] или лимфопролиферативного заболевания (ЛПЗ) [3, 4] и 2) морфологически верифицированное поражение почек. Случаи МГНЗ при неамилоидном поражении почек расценивали как МГРЗ.
Клинико-морфологические исследования
У всех пациентов регистрировали следующие клинико-демографические параметры: пол, на момент биопсии почки и конца наблюдения - возраст, креатинин и расчетную скорость клубочковой фильтрацииCKD-EPI (рСКФ) [15], суточную протеинурию (СП), альбумин сыворотки. На момент диагностики МГ и при рестадировании определяли следующие показатели: парапротеин крови и мочи методом иммунофиксации с типированием парапротеина, легкие цепи иммуноглобулина (ЛЦ) методом Freelite® и/или иммуноферментным анализом в сыворотке и моче, соотношение ЛЦ kappa/lambda, разницу между вовлеченной ЛЦ и невовлеченной ЛЦ, уровень плазматизации костного мозга по данным миелограммы. Оценивали стадию ММ по ISS на момент диагноза [16, 17]. Экстраренальное поражение при AL- амилоидозе устанавливали при наличии клинических симптомов, ассоциированных с депозицией и токсическим действием амилоида на ткань вовлеченного органа, и гистологической верификации амилоида [18].
Для диагностики поражения почек использовали данные световой микроскопии, иммуноморфологического исследования (иммунофлюоресцентного на замороженных срезах и/или иммуногистохимического из парафиновых блоков) и ультраструктурного анализа в морфологической лаборатории НИИ нефрологии (зав. канд. мед. наук В.Г. Сиповский) [19].
Лечение и исходы
Анализировали характер и число курсов полихимиотерапии (ПХТ), выполнение высокодозной химиотерапии в сочетании с аутологичной трансплантацией гемопоэтических стволовых клеток (аутоТГСК). Гематологический ответ при ММ оценивали согласно рекомендациям Международной рабочей группы по множественной миеломе [20], при AL-амилоидозе - по критериям, предложенным Palladini и соавт. [21]. При МГРЗ гематологический ответ определяли в зависимости от типа моноклонального белка [22]: при ЛЦ-МГРЗ (k или λ) подход к оценке ответа основывался на таковом при AL-амилоидозе, при Ig-МГРЗ (IgG k/λ; IgA k/λ; IgM k/λ) - в соответствии с критериями оценки ответа при ММ. При ЛПЗ гематологический ответ оценивали в соответствии с принятыми критериями [3, 4, 23].
Оценка ренального ответа была основана на динамике почечной функции и протеинурии. Прогрессирование почечной дисфункции регистрировали при снижении рСКФ на момент конца наблюдения >25 % от исходного значения или начале заместительной почечной терапии (ЗПТ); улучшение - при нарастании рСКФ на момент конца наблюдения >25 % или прекращении ЗПТ; остальные случаи расценивали как стабильную функцию почек. Ответом по протеинурии считали снижение СП >30 % от исходного значения при стабильной функции почек [24]. В остальных случаях констатировали отсутствие ответа по протеинурии.
В качестве твердых конечных точек прогноза использовали почечный исход (начало ЗПТ или рСКФ<15 мл/мин/1,73 м2 на момент конца наблюдения) и смерть от всех причин. Медиана периода наблюдения (до 01.05.2018 г.) составила 12 (2; 27) мес.
Статистический анализ
Данные представлены в виде частот (%), средних величин и стандартных отклонений (m±SD), медиан и интерквартильного размаха (M; 2575 %), если не указано иное. Для оценки меж- групповых различий применяли однофакторный дисперсионный анализ (ANOVA), критерий χ2.
Почечную выживаемость оценивали с помощью метода Каплана-Мейера. При этом дату летального исхода, наступившего при функционирующих почках, принимали за конец наблюдения, а случай такого летального исхода учитывали как цензурированный. Достоверными считали различия при значении p<0,05.
РЕЗУЛЬТАТЫ
В анализ включили 119 пациентов с поражением почек на фоне различных вариантов МГ. У 39 больных диагностировали ММ (в 12 случаях в сочетании с AL-амилоидозом), в 55 случаях - AL-амилоидоз (один случай сочетания AL-амилоидоза с транстиретиновым). На момент постановки диагноза у пациентов с ММ I, II или III стадии заболевания по ISS были выявлены в 8,1, 35,1 и 56,8 % случаев соответственно. ЛПЗ было выявлено у 10 больных: лимфоплазмоцитарная лимфома/макроглобулинемия Вальденстрема (ЛПЛ/МВ; n=5), В-клеточный хронический лимфолейкоз (n=2), лимфома маргинальной зоны (n=2) и мантийноклеточная лимфома (n=1). Критериям МГРЗ соответствовали 15 случаев. Клинико-морфологические параметры пациентов представлены в табл. 1.
Распространенность МГ-ассоциированного поражения составила 7,5 % от всего числа нефробиопсий, выполненных в центре за указанный период времени (n=1580)). Структура изучаемой ре- нальной патологии представлена на рис. 1. В табл. 2 описано распределение форм поражения почек при различных вариантах МГ.
При AL-амилоидозе (в том числе при сочетании с ММ) моноорганное поражение почек выявили у 14,8 %, вовлечение двух органов - у 25 %, трех - у 33,8 %, четырех - у 19,1 %, пяти и больше - у 7,3 %. Поражение почек регистрировали у всех пациентов, сердца - в 73,5 %, печени - в 39,7 %, нервной системы - в 38,2 %, желудочнокишечного тракта - в 13,2 %, легких - 8,8 %, других тканей - в 14,7 % случаев. Один случай был представлен сочетанием преимущественной депозиции амилоида в стенке артерий почки и иммуноглобулин- и С3-позитивного мембранопролиферативного гломерулонефрита III типа (Strife/ Anders).
Лечение и гематологический ответ
Для лечения МГ с поражением почек, ассоциированных с плазмоклеточной пролиферацией, применяли следующие варианты ПХТ: бортезомиб + дексаметазон (VD), циклофосфамид + бортезомиб + дексаметазон (CVD), леналидомид + дексаметазон (RD), бортезомиб + леналидомид + дексаметазон (VRD), мелфалан + преднизолон (MP), бортезомиб + мелфалан + преднизолон (VMP), мелфалан + дексаметазон (MD), дексаметазон или преднизолон, а также аутоТГСК (табл. 3). В ходе лечения пациенты могли получить последовательно разные схемы ПХТ.
Таблица 1 / Table 1
Клинико-демографические показатели у пациентов с моноклональными гаммапатиями на момент биопсии почки
Clinical and demographic data in patients with monoclonal gammopathies at the time of kidney biopsy
Показатель | ММ | AL-амилоидоз | ЛПЗ | МГРЗ | PANOVA |
|---|---|---|---|---|---|
Пол, ж/м | 25/14 | 32/23 | 7/3 | 3/12 | 0,019 |
Возраст, г (m±SD) | 60±9 | 62±8 | 61±8 | 52±10 | 0,003 |
рСКФ, мл/мин/1,73 м2 (M, 25-75 %) | 25 (16; 45) | 65 (31; 83) | 23 (10; 61) | 46(21;61) | 0,005 |
% рСКФ >90 | 7,7 | 14,5 | 10 | 0 | - |
% рСКФ=60-89 | 17,9 | 40,0 | 20 | 33,3 | - |
% рСКФ=30-59 | 20,5 | 25,5 | 10 | 20,0 | - |
% рСКФ=15-29 | 30,8 | 9,1 | 20 | 40,0 | - |
%рСКФ<15 | 23,1 | 10,9 | 40 | 6,7 | - |
СПБ, г/сут (M, 25-75 %) | 6,8 (2,8; 11,0) | 9,6 (5,9; 13,8) | 3,6 (1,5; 10,0) | 10,0 (4,5; 22,0) | 0,018 |
Альбумин сыворотки, г/л, (M, 25-75 %) | 33 (25; 40) | 20 (16; 28) | 31 (28; 32) | 27 (20; 35) | <0,001 |
% плазматических клеток по данным миелограммы (M, 25-75 %) | 20 (8; 35) | 5,3 (2,6; 8) | 5,6 (1,2; 9,2) | 2,2 (1; 4,8) | <0,001 |
Парапротеин сыворотки, г/л (M, 25-75 %) | 9,3 (4,2; 16,4) | 7,7 (4,5; 11,7) | 5,9 (5,4; 6,4) | 1,1 (0,08; 7,9) | 0,38 |
Парапротеин мочи, г/л (M, 25-75 %) | 0,93 (0,33; 1,96) | 0,2 (0; 0,91) | 3,9 (3,1; 4,7) | 0,3 (0; 1,5) | 0,8 |
Тип парапротеина, % |
|
|
|
| - |
- IgG/λ | 7,7 | 21,8 | 10 | 0 |
|
- IgG/k | 23,1 | 8,3 | 0 | 25 |
|
- IgA/k | 10,2 | 2,8 | 0 | 0 |
|
- IgA/ λ | 2,6 | 11,5 | 0 | 0 |
|
- IgM/k | 0 | 1,8 | 90 | 0 |
|
- k | 20,5 | 13,7 | 0 | 60 |
|
- λ | 35,9 | 40,1 | 0 | 15 |
|
Примечание. ЛПЗ - лимфопролиферативное заболевание; МГРЗ - моноклональная гаммапатия ренального значения; ММ - множественная миелома; СПБ - суточная потеря белка; рСКФ - расчетная скорость клубочковой фильтрации.
Таблица 2 / Table 2
Типы повреждения почек у пациентов с различными формами моноклональной гаммапатии
Types of kidney injury in patients with different monoclonal gammopathies
Множественная миелома | Моноклональная гаммапатия ренального значения | Лимфопролиферативные заболевания |
|---|---|---|
ЦН (n=13) AL-амилоидоз (n=12), 2 случая в сочетании с ЦН БОЛЦ (n=7), 1 случай в сочетании с ЦН С3-гломерулопатия (n=2) (С3-ГН) ПГНОМИГ (n=1) Проксимальная тубулопатия (n=1) Подоцитопатия (n=1) Острый тубулярный некроз (n=2) | БОЛЦ (n=7) ТМА (n=3), из них 2 случая с вторичным ФСГС ПГНОМИГ (n=1) С3-гломерулопатия (n=2) (болезнь отложения плотных депозитов) Криоглобулинемический ГН (n=1) Фибриллярный гломерулонефрит (n=1) | ЦН (n=1) ПГНОМИГ (n=3), 1 случай в сочетании с AL-амилоидозом Криоглобулинемический ГН (n=3), 1 случай в сочетании с ТМА БОЛЦ (n=1) в сочетании с ТМА Иммунотактоидный ГН (n=1) Подоцитопатия(n=1) |
Примечание. БОЛЦ - болезнь отложения легких цепей иммуноглобулинов; ГН - гломерулонефрит; ПГНОМИГ - пролиферативный гломерулонефрит с отложением моноклональных иммуноглобулинов; ТМА - тромботическая микроангиопатия; ФСГС - фокально-сегментарный гломерулосклероз; ЦН - цилиндровая нефропатия.
В группе ММ одному пациенту аутоТГСК выполнена дважды, после чего достигнута стабилизация опухоли. Также у одного пациента с ММ применили 4 курса VRD с достижением полного гематологического ответа. Один пациент с сочетанием ММ и AL-амилоидоза получил 1 курс VMP и 1 курс MP с последующим переходом на терапию RD в течение 8 курсов с достижением ремиссии заболевания. Об эффективности лечения неизвестно в одном случае ММ в связи с выходом пациента из-под наблюдения и в трех случаях МГРЗ. Два случая МГРЗ оставлены под наблюдение в отношении прогрессии как гематологической, так и нефрологической патологии по соображениям соотношения риск/польза лечения. В группе AL-амилоидоза 10 пациентов не получили лечения: вышли из-под наблюдения (n=6), умерли (n=4). Гематологический ответ и летальные исходы у пациентов с плазмоклеточными дискразиями представлены в табл. 4.
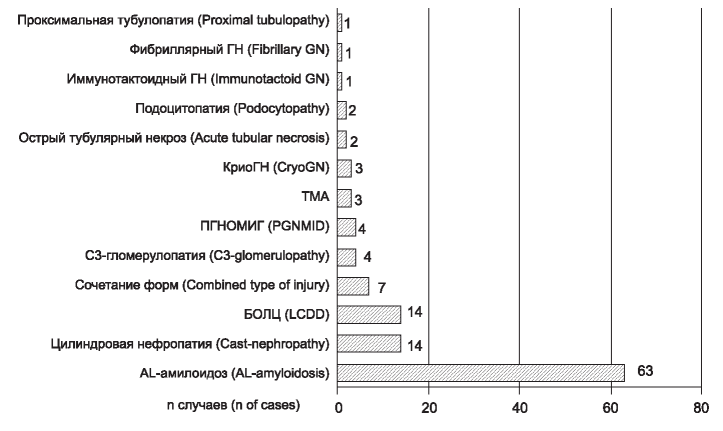
Рис. 1. Структура поражения почек, ассоциированного с МГ. БОЛЦ - болезнь отложения легких цепей иммуноглобулинов; ГН - гломеру- лонефрит; КриоГН - криоглобу- линемический гломерулонефрит; ПГНОМИГ - пролиферативный гло- мерулонефрит с отложением моноклональных иммуноглобулинов; ТМА - тромботическая микроангио- патия.
Figure 1. Spectrum of kidney disease associated with monoclonal gam- mopathy. CryoGN - cryoglobulinemic glomerulonephritis; GN - glomerulonephritis; LCDD - light chain deposition disease; PGNMID - proliferative glomerulonephritis with monoclonal immunoglobulin deposits; TMA - thrombotic microangiopathy.
Таблица 3 / Table 3
Виды лечения пациентов с поражением почек, ассоциированным с плазмоклеточной пролиферацией [указано % пациентов; число циклов, M (25-75 %)]
Treatment approaches in patients with plasma cell dyscrasia [% of patients; number of cycles, M (25-75%)]
Вид терапии | ММ | AL-амилоидоз | МГРЗ |
|---|---|---|---|
VD | 88,4; 4 (2; 6) | 80; 4 (3,5; 6) | 40; 4 (1; 4) |
CVD | 7,7; 3 (2; 4) | 5,4; 4 (2; 4) | 0 |
RD | 7,7; 1,5 (1; 2) | 3,6; 5,5 (5; 6) | 0 |
MD | 0 | 14,5; 4 (3,5; 6) | 0 |
Дексаметазон/ преднизолон | 0 | 0 | 20; 1 (1; 11) |
АутоТГСК | 15,4 | 12,7 | 6,7 |
Без ПХТ, количество пациентов n | 1 | 10 | 5 |
Примечание. АутоТГСК - аутологичная трансплантация гемопоэтических стволовых клеток в сочетании с высокодозной химиотерапией; МГРЗ - моноклональная гаммапатия ренального значения; ММ - множественная миелома; ПХТ - полихимиотерапия; CVD - циклофосфамид + бортезомиб + дексаметазон; MD - мелфалан + дексаметазон; RD - леналидомид + дексаметазон; VD - бортезомиб + дексаметазон.
В группе пациентов с поражением почек вследствие ЛПЗ применяли: ритуксимаб (n=3) с достижением частичного ответа в двух случаях и одним летальным исходом; ритуксимаб + пред- низолон (n=3) с достижением полного ответа в одном случае и стабилизации у двух пациентов, а также RVD (n=1; полный ответ), VD (n=1; полный ответ), ритуксимаб с последующим переходом на бортезомиб (n=1; прогрессирование), только дексаметазон (n=1; летальный исход).
Почечный ответ по функции и протеинурии на момент конца наблюдения регистрировали у всех пациентов за исключением вышедших из- под наблюдения (n=29) (табл. 5).
Почечный прогноз у пациентов с МГ, не получивших лечения, был достоверно хуже, чем таковой у больных, подвергшихся лечению (рис. 2, А). При оценке почечной выживаемости различий, в том числе при попарном сравнении между изучаемыми группами МГ, выявлено не было (рис. 2, В). Почечный исход, случившийся до начала лечения МГ, регистрировали у 4 пациентов с ММ, у 6 - при AL-амилоидозе, у 4 - при МГРЗ и у 2 пациентов с ЛПЗ. При исключении этих случаев 4-летняя кумулятивная выживаемость при ММ составила 51 %, при AL-амилоидозе - 56 %, при ЛПЗ - 42 %, при МГРЗ - 100 %.
ОБСУЖДЕНИЕ
Полученные нами и другими авторами данные [10, 14, 25] указывают на то, что поражения почек при МГ являются далеко не редкими в общей структуре ренальной патологии и обнаруживаются в каждом 12-13-м случае проведения клиникоморфологической диагностики в связи с протеинурией и дисфункцией почек. Дисфункция почек является существенным фактором, усугубляющим риски неблагоприятных исходов при ММ [26-29], и главным фактором прогноза при МГРЗ, что делает очевидным необходимость междисциплинарного подхода к диагностике и лечению таких больных. Многообразие почечных проявлений при плазмоклеточных или В-клеточных дискразиях требует существенных диагностических ресурсов и междисциплинарного подхода к проблеме с участием нефролога, зачастую сталкивающегося с обсуждаемой проблемой при первичной диагностике дисфункции почек. При соблюдении этих условий поражение почек, ассоциированное с МГ, перестает быть «трудным» диагнозом в многопрофильном центре, специализирующимся на данной проблеме и имеющим необходимые диагностические возможности в рамках новой субспециальности - онконефрологии.
Таблица 4 / Table 4
Гематологический ответ и летальные исходы у пациентов с плазмоклеточной дискразией*
Haematological response and death in patients with plasma cell dyscrasia
Гематологический ответ / исходы, % | ММ | AL-амилоидоз | МГРЗ | PANOVA для всех групп |
|---|---|---|---|---|
Полный ответ | 25,6 | 30,9 | 20 | 0,67 |
Очень хороший частичный ответ | 2,7 | 1,8 | 0 | 0,82 |
Частичный ответ | 20,5 | 12,7 | 26,7 | 0,37 |
Стабилизация | 7,7 | 9,1 | 20 | 0,39 |
Прогрессия | 7,7 | 12,8 | 0 | 0,29 |
Умерли | 5,1 | 10,9 | 0 | 0,29 |
Выход из-под наблюдения | 30,7 | 21,8 | 33,3 | 0,52 |
Примечание.* Гематологический ответ не был оценен у 12 больных в группе ММ, у 12 - в группе AL-амилоидоза и у 5 больных - в группе МГРЗ. Основная причина - выход пациента из-под наблюдения. ЛПЗ - лимфопролиферативное заболевание; МГРЗ - моноклональная гаммапатия ренального значения; ММ - множественная миелома.
Таблица 5 / Table 5
Почечный ответ по функции и протеинурии у пациентов с моноклональными гаммапатиями
Renal response estimated by kidney function and proteinuria in patients with monoclonal gammopathies
Почечный ответ, % | ММ (n=27) | AL-амилоидоз (n=43) | МГРЗ (n=10) | ЛПЗ (n=10) | PANOVA |
|---|---|---|---|---|---|
Прогрессирование дисфункции | 11,1 | 37,2 | 0 | 55,6 | 0,003 |
Улучшение функции | 22,2 | 6,9 | 20 | 11,1 | 0,29 |
Стабильная функция почек | 66,7 | 55,8 | 80 | 33,3 | 0,17 |
Наличие ответа по протеинурии | 72,3 | 48,8 | 50 | 25 | 0,45 |
Примечание. ЗПТ - заместительная почечная терапия; ЛПЗ - лимфопролиферативное заболевание; МГРЗ - моноклональная гаммапатия ренального значения; ММ - множественная миелома; рСКФ - расчетная скорость клубочковой фильтрации; СП - суточная протеинурия.
Одним из решающих моментов диагностики является тщательное морфологическое исследование почек, позволяющее дифференцировать многочисленные варианты ренальных проявлений гаммапатий, помимо ЦН [6, 26, 30]. Полученные на основе такого подхода данные подтверждают наблюдения о весьма разнообразной структуре поражении почек, ассоциированного с МГ [6, 7, 14], в отечественной популяции (см. рис. 1). Отдельные случаи выходили за рамки принятой в настоящее время классификации ренальной патологии, связанной с пролиферацией клона клетки костного мозга [8, 31]. Это касается случаев подоцитопатий на фоне МГ, выявленных в анализируемой группе, и отмеченных другими авторами [32-35]. Предполагаемый механизм повреждения подоци- тов может заключаться в прямом/ непрямом (им- муноопо средованном) действии на эпителиальные клетки клубочка аберрантного моноклонального белка [34] и требует дальнейшего изучения. Другим малоизвестным вариантом поражения почек при МГ является тромботическая микро- ангиопатия. Механизм развития этого типа эндотелиального повреждения у пациентов изучаемой группы может быть связан с повреждением эндотелия и активацией альтернативного пути комплемента моноклональным белком [36], а включение этой формы в классификацию представляется вопросом времени [37]. Описанные ранее случаи сочетания AL-амилоидоза с БОЛЦ и ЦН [13, 26] были отмечены в анализируемой когорте (см. табл. 2). Кроме того, в двух случаях обнаружено сочетание парапротеин-опосредованного пролиферативного гломерулонефрита и амилоида, локализованного преимущественно в артериальной стенке. Возможность сочетания различных вариантов повреждения почек при МГ у одного пациента неудивительна с учетом разнонаправленных эффектов парапротеинов во всех компартментах органа, что следует учитывать при проведении первичной диагностики.

Рис. 2. Кумулятивная почечная выживаемость при поражении почек, ассоциированном с моноклональной гаммапатией. А - почечная выживаемость в группах пациентов с моноклональной гаммапатией с лечением и без; В - почечная выживаемость в группах разной МГ. ЛПЗ - лимфопролиферативное заболевание; МГ - моноклональная гаммапатия; МГРЗ - моноклональная гаммапатия ренального значения; ММ - множественная миелома.
Figure 2. Death-censored kidney survival in monoclonal gammopathy associated kidney injury. A) renal survival in patients with MG with and without treatment; B) renal survival in different forms of MG. LPD - lymphoproliferative disorder; MG - monoclonal gammopathy; MGRS - monoclonal gammopathy of renal significance; ММ - multiple myeloma.
Представленные данные о тенденциях в подходах к терапии изучаемого контингента больных (см. табл. 3) носят описательный характер и не преследовали цели сравнительного анализа. Методы лечения злокачественных форм МГ и AL-амилоидоза соответствовали общепринятым, включая аутоТГСК [3, 4, 38]. Подходы к оптимальной терапии МГРЗ остаются неопределенными, в том числе в связи с отсутствием достаточной доказательной базы [22]. Тем не менее, очевидно, что в случае обсуждаемой патологии этиотропное лечение должно быть направлено на элиминацию клона, продуцирующего патогенный белок [5, 22, 27, 37]. Так, в представляемом исследовании большинство пациентов с МГРЗ получили химиотерапевтическое лечение, а в одном случае была выполнена высокодозная химиотерапия с последующей аутоТГСК с достижением полного гематологического и почечного ответов.
По гематологическому ответу пациенты изучаемых подгрупп существенно не отличались (см. табл. 4). Частота гематологического ответа у пациентов с МГРЗ в представляемой работе составила 46,7 %, что согласуется с результатами других наблюдений [27]. Своевременное лечение, направленное на элиминацию патологического клона, ассоциировано с более благоприятным почечным прогнозом не только при ММ, но и при менее злокачественных формах МГ. Этот вывод, сделанный ранее другими исследователями [26, 28, 39], подтверждают и наши результаты, демонстрируемые в отношении почечного ответа и прогноза (см. табл. 5, рис. 2). В отношении использованных нами индексов прогрессирования дисфункции почек большая часть пациентов имели либо улучшение, либо стабилизацию. По крайней мере, у половины больных с МГ регистрировали наличие ответа по протеинурии. Напротив, в отсутствие терапии прогрессирование дисфункции почек и развитие терминальной почечной недостаточности (ТПН) в короткие сроки было ультимативным (см. рис. 2, А).
Хорошо известно, что вовлечение почек при AL-амилоидозе и ММ ассоциировано с неблагоприятным прогнозом [13, 28, 29, 40]. Подтверждает эти наблюдения и анализ почечной выживаемости в анализируемых подгруппах пациентов (см. рис. 2). Почечная выживаемость в группе МГРЗ также была низкой и достоверно не отличалась от таковой при других вариантах МГ. При этом у пациентов с МГРЗ, которые успели получить лечение до развития ТПН, почечная выживаемость составила 100 %. С учетом приведенных данных очевидно, что в отличие от МГНЗ без явных клинических проявлений больные с МГРЗ требуют этиотропной терапии, направленной на эрадикацию патологического клеточного клона и минимизации эффектов аберрантных иммуноглобулинов. Такой подход может быть эффективной стратегией ренопротекции и предупреждения тПН. Вместе с тем, в системе отечественного здравоохранения диагноз МГРЗ остается в рамках моноклональных гаммапатий неизвестного значения, а следовательно, не является формальным показанием для назначения необходимой терапии и ее финансирования. В результате сроки начала лечение таких пациентов часто бывают лимитированными и запоздалыми, что может приводить к утрате функции почек и снижению продолжительности жизни пациентов. Очевидно, что эта организационная проблема требует решения на уровне профессиональных ассоциаций и службы здравоохранения.
ЗАКЛЮЧЕНИЕ
Поражение почек при моноклональных гаммапатиях, представленное разнообразными клинико-морфологическими паттернами и связанное с неблагоприятным прогнозом, является стандартной клинической проблемой онкогематологии и нефрологии, которая требует развития высокоспециализированных междисциплинарных подходов к диагностике и лечению.
Список литературы
1. Merlini G, Stone MJ. Dangerous small B-cell clones. Blood 2006; 108 (8): 2520–2530. doi: 10.1182/blood-2006-03-001164
2. International Myeloma Working Group (IMWG) criteria for the diagnosis of multiple myeloma. 2015. Режим доступа (available at): https://imwg.myeloma.org/international-myeloma-working-group-imwg-criteria-for-the-diagnosis-of-multiple-myeloma
3. Gertz MA. Waldenström macroglobulinemia: 2018 update on diagnosis, risk stratification, and management. Am J Hematol 2018; 1–11. doi: 10.1002/ajh.25292
4. NCCN Clinical Practice Guidelines in Oncology version 4.2014. Non-Hodgkin’s lymphomas. Режим доступа (available at): https://www.nccn.org/about/nhl.pdf
5. Leung N, Bridoux F, Hutchison CA et al. Monoclonal gammopathy of renal significance: when MGUS is no longer undetermined or insignificant. Blood 2012; 120 (22): 4292–4295. doi: 10.1182/blood-2012-07-445304
6. Nasr SH, Valeri AM, Sethi S et al. Clinicopathologic correlations in multiple myeloma: a case series of 190 patients with kidney biopsies. Am J Kidney Dis 2012; 59 (6):786–794. doi: 10.1053/j.ajkd.2011.12.028
7. Decourt A, Gondouin B, Delaroziere JC et al. Trends in survival and renal recovery in patients with multiple myeloma or light-chain amyloidosis on chronic dialysis. Clin J Am Soc Nephrol 2016; 11(3): 431–441. doi: 10.2215/CJN.06290615
8. Bridoux F, Leung N, Hutchison CA et al. Diagnosis of monoclonal gammopathy of renal significance. Kidney Int 2015;87(4): 698–711. doi: 10.1038/ki.2014.408
9. Al-Hussain T, Hussein MH, Al Mana H, Akhtar M. Renal involvement in monoclonal gammopathy. Adv Anat Pathol 2015; 22 (2):121–134. doi: 10.1097/PAP.0000000000000056
10. Steiner N, Göbel G, Suchecki P et al. Monoclonal gammopathy of renal significance (MGRS) increases the risk for progression to multiple myeloma: an observational study of 2935 MGUS patients. Oncotarget 2017; 9 (2): 2344–2356. doi: 10.18632/oncotarget.23412
11. Rosner MH, Edeani A, Yanagita M et al. Paraprotein–related kidney disease: diagnosing and treating monoclonal gammopathy of renal significance. Clin J Am Soc Nephrol 2016;11 (12): 2280–2287. doi: 10.2215/CJN.02920316
12. Paueksakon P, Revelo MP, Horn RG et al. Monoclonal gammopathy: significance and possible causality in renal disease. Am J Kidney Dis 2003; 42 (1): 87–95. doi: -
13. Zand L, Nasr SH, Gertz MA et al. Clinical and prognostic differences among patients with light chain deposition disease, myeloma cast nephropathy and both. Leuk Lymphoma 2015; 56 (12): 3357–3364. doi: 10.3109/10428194.2015
14. Fish R, Pinney J, Jain P et al. The Incidence of major hemorrhagic complications after renal biopsies in patients with monoclonal gammopathies. Clin J Am Soc Nephrol 2010; 5 (11): 1977–1980. doi: 10.2215/CJN.00650110
15. Levey AS, Stevens LA, Schmid CH et al. A new equation to estimate glomerular filtration rate. Ann Intern Med 2009; 150 (9): 604–612. doi: -
16. Greipp PR, San Miguel J, Durie BG et al. International staging system for multiple myeloma. J Clin Oncol 2005; 23 (15): 3412–3420. doi: 10.1200/JCO.2005.04.242
17. Palumbo A, Avet-Loiseau H, Oliva S et al. Revised international staging system for multiple myeloma: a report from international myeloma working group. J Clin Oncol 2015; 33 (26): 2863–2869. doi: 10.1200/JCO.2015.61.2267
18. Gertz MA, Comenzo R, Falk RH et al. Definition of organ involvement and treatment response in immunoglobulin light chain amyloidosis (AL): a consensus opinion from the 10th international symposium on amyloid and amyloidosis. Am J Hematol 2005; 79 (4): 319–328. doi: 10.1002/ajh.20381
19. Сиповский ВГ, Добронравов ВА, Карунная АВ, Смирнов АВ. Клинико-морфологический анализ изменений перитубулярных микрососудов интерстиция почек у больных IgA-нефропатией (IgAN) с оценкой активности лектинового пути системы комплемента. Нефрология 2013; 17(4): 89–94. doi: 10.24884/1561-6274-2013-17-4-89-94
20. Kumar S, Paiva B, Anderson KC et al. International Myeloma Working Group consensus criteria for response and minimal residual disease assessment in multiple myeloma. Lancet Oncol 2016;17 (8): e328–e346. doi: 10.1016/S1470-2045(16)30206-6
21. Palladini G, Dispenzieri A, Gertz MA et al. New criteria for response to treatment in immunoglobulin light chain amyloidosis based on freelight chain measurement and cardiac biomarkers: impact on survival outcomes. J Clin Oncol 2012; 30 (36): 4541–4549. doi: 10.1200/JCO.2011.37.7614
22. Fermand JP, Bridoux F, Kyle RA et al. How I treat monoclonal gammopathy of renal significance (MGRS). Blood 2013; 122 (22): 3583–3590. doi: 10.1182/blood-2013-05-495929
23. Owen RG, Kyle RA, Stone MJ et al. Response assessment in Waldenström macroglobulinaemia: update from the VIth International Workshop. Br J Haematol 2013;160 (2): 171–176. doi: 10.1111/bjh.12102
24. Milani P, Merlini G, Palladini G. Light chain amyloido sis. Mediterr J Hematol Infect Dis 2018; 10(1): e2018022. doi: 10.4084/MJHID.2018.022
25. Dispenzieri A, Katzmann JA, Kyle RA et al. Prevalence and risk of progression of light-chain monoclonal gammopathy of undetermined significance: a retrospective population-based cohort study. Lancet 2010; 375 (9727): 1721–1728. doi: 10.1016/S0140-6736(10)60482-5
26. Ecotière L, Thierry A, Debiais-Delpech C et al. Prognostic value of kidney biopsy in myeloma cast nephropathy: a retrospective study of 70 patients. Nephrol Dial Transplant 2016; 31(1): 64–72. doi: 10.1093/ndt/gfv283
27. Kourelis TV, Nasr SH, Dispenzieri A et al. Outcomes of patients with renal monoclonal immunoglobulin deposition disease. Am J Hematol 2016; 91(11): 1123–1128. doi: 10.1002/ajh.24528
28. Uttervall K, Duru AD, Lund J et al. The use of novel drugs can effectively improve response, delay relapse and enhance overall survival in multiple myeloma patients with renal impairment. PLoS One 2014; 9(7): e101819. doi: 10.1371/journal.pone.0101819
29. Gonsalves WI, Leung N, Rajkumar SV et al. Improvement in renal function and its impact on survival in patients with newly diagnosed multiple myeloma. Blood Cancer J 2015; 5: e296. doi: 10.1038/bcj.2015.20
30. Leung N. To biopsy or not to biopsy, that is the question in myeloma cast nephropathy. Nephrol Dial Transplant 2016; 31(1): 1–3. doi: 10.1093/ndt/gfv294
31. Dimopoulos MA, Sonneveld P, Leung N et al. International Myeloma Working Group recommendations for the diagnosis and management of myeloma-related renal impairment. J Clin Oncol 2016; 34 (13): 1544–1557. doi: 10.1200/JCO.2015.65.0044
32. Oweis AO, Al Shelleh SA, Aldaoud N et al. Multiple myeloma in a patient with focal segmental glomerulosclerosis: A Case Report. Am J Case Rep 2018;19: 946–950. doi: 10.12659/AJCR.909696
33. Jeon YL, Lee WI, Choi Y et al. Crystalloid podocytopathy with focal segmental glomerulosclerosis in PCM: a case report. Diagn Pathol 2015; 10: 213. doi: 10.1186/s13000-015-0448-0
34. Dingli D, Larson DR, Plevak MF et al. Focal and segmental glomerulosclerosis and plasma cell proliferative disorders. Am J Kidney Dis 2005; 46(2): 278–282. doi: 10.1053/j.ajkd.2005.05.004
35. Salviani C, Guido G, Serriello I et al. Renal involvement in Waldenström's macroglobulinemia: case report and review of literature. Ren Fail 2014; 36(1): 114–118. doi: 10.3109/0886022X.2013.832859
36. Sethi S, Rajkumar SV. Monoclonal gammopathy-associated proliferative glomerulonephritis. Mayo Clin Proc 2013; 88(11): 1284–1293. doi: 10.1016/j.mayocp.2013.08.002
37. Goodship TH, Cook HT, Fakhouri F et al. Atypical hemolytic uremic syndrome and C3 glomerulopathy: conclusions from a «Kidney Disease: Improving Global Outcomes» (KDIGO) Controversies Conference. Kidney Int 2017; 91(3): 539–551. doi: 10.1016/j.kint.2016.10.005
38. Kumar SK, Callander NS, Alsina M et al. Multiple Myeloma, Version 3.2017, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw 2017; 15 (2): 230–269. doi: 10.6004/jnccn.2017.0023
39. Cohen C, Royer B, Javaugue V et al. Bortezomib produces high hematological response rates with prolonged renal survival in monoclonal immunoglobulin deposition disease. Kidney Int 2015; 88 (5): 1135–1143. doi: 10.1038/ki.2015.201
40. Kastritis E, Terpos E, Roussou M et al. Evaluation of the Revised International Staging System in an independent cohort of unselected patients with multiple myeloma. Haematologica 2017 Mar;102(3):593–599. doi: 10.3324/haematol.2016.145078
Об авторах
М. С. ХраброваРоссия
197022, Россия, Санкт-Петербург, ул. Л. Толстого, д. 17, корп. 54.
Доц. Храброва Мария Сергеевна, канд. мед. наук, кафедра пропедевтики внутренних болезней.
Тел.: (812) 338-69-01.
В. А. Добронравов
Россия
197022, Россия, Санкт-Петербург, ул. Л. Толстого, д. 17, корп. 54.
Проф. Добронравов Владимир Александрович, д-р мед. наук, заместитель директора НИИ нефрологии по научной работе.
Тел.: +7(812)338-69-16.
А. В. Смирнов
Россия
197022, Россия, Санкт-Петербург, ул. Л. Толстого, д. 17, корп. 54.
Проф. Смирнов Алексей Владимирович, д-р мед. наук, директор НИИ нефрологии.
Тел.: +7(812) 338-69-01.
Рецензия
Для цитирования:
Храброва М.С., Добронравов В.А., Смирнов А.В. ПОРАЖЕНИЯ ПОЧЕК, АССОЦИИРОВАННЫЕ С МОНОКЛОНАЛЬНЫМИ ГАММАПАТИЯМИ: ОДНОЦЕНТРОВОЕ ИССЛЕДОВАНИЕ. Нефрология. 2018;22(6):38-46. https://doi.org/10.24884/1561-6274-2018-22-6-38-46
For citation:
Khrabrova M.S., Dobronravov V.A., Smirnov A.V. KIDNEY DISEASE ASSOCIATED WITH MONOCLONAL GAMMOPATHIES: SINGLE-CENTER STUDY. Nephrology (Saint-Petersburg). 2018;22(6):38-46. (In Russ.) https://doi.org/10.24884/1561-6274-2018-22-6-38-46
JATS XML








































