Перейти к:
ПРОГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ CD3+, CD68+, CD20+ КЛЕТОК В ИНТЕРСТИЦИИ У БОЛЬНЫХ С ГЛОМЕРУЛИТОМ АЛЛОГРАФТА ПОЧКИ
https://doi.org/10.24884/1561-6274-2018-22-6-47-55
Аннотация
ЦЕЛЬ ИССЛЕДОВАНИЯ. Оценить связь выраженности инфильтрации интерстиция CD3+, CD68+ и CD20+ клетками при гломерулите с отдаленным прогнозом аллотрансплантации почки (АТП).
ПАЦИЕНТЫ И МЕТОДЫ. В ретроспективное исследование были включены 86 реципиентов аллографта почки (АП) с морфологически верифицированным в соответствии с критериями Banff гломерулитом. Случаи далее были разделены на подгруппы: 1) изолированный гломерулит без донор-специфических антител (ДСА) (n=53); 2) гломерулит с положительными ДСА (n=22); 3) гломерулит с неуточненными ДСА (n=11). Производили количественный анализ позитивных клеток в интерстиции после идентификации CD68+, CD3+, CD20+ лейкоцитов с помощью стандартного иммуногистохимического (ИГХ) окрашивания. Использовали метод Каплана–Мейера и мультивариантный регрессионный анализ Кокса для оценки связи выраженности инфильтрации интерстиция CD3+, CD68+, CD20+ клетками с риском потери АП.
РЕЗУЛЬТАТЫ. CD68+ и CD3+ клетки в интерстиции преобладали при гломерулите АП. CD20+ инфильтраты были выявлены в 60 % случаев. CD20+ клетки имели склонность к образованию инфильтратов, которые в 9 случаях достигали значительных размеров (≥ 50 CD20+ лимфоцитов) с формированием нодулярных структур. Подгруппы с/без ДСА не отличались по выраженности инфильтрации интерстиция CD3+, CD68+ клетками и наличию CD20+ инфильтратов. Уровни CD68+ клеток в интерстиции ≥ 5 клеток на поле зрения (х400), а CD3+ ≥ 8 были ассоциированы со снижением выживаемости АП, как и наличие значительных CD20+ инфильтратов (plog-rank < 0,05). В мультивариантных регрессионных моделях Кокса показатели уровней CD68+ (≥ 5 клеток/поле зрения), CD3+ (≥ 8 клеток/поле зрения) клеток и наличие значительных CD20+ инфильтратов в интерстиции являлись независимыми предикторами потери АП при коррекции моделей по наличию ДСА, времени холодовой и тепловой ишемии (p < 0,05). ВЫВОДЫ. Выраженность инфильтрации интерстиция CD3+, CD68+ и CD20+ клетками при гломерулите может быть предиктором выживаемости АП.
Ключевые слова
Для цитирования:
Добронравов В.А., Мухаметдинова А.О., Храброва М.С., Набоков А.В., Грене Х.-., Клим Ф. ПРОГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ CD3+, CD68+, CD20+ КЛЕТОК В ИНТЕРСТИЦИИ У БОЛЬНЫХ С ГЛОМЕРУЛИТОМ АЛЛОГРАФТА ПОЧКИ. Нефрология. 2018;22(6):47-55. https://doi.org/10.24884/1561-6274-2018-22-6-47-55
For citation:
Dobronravov V.A., Mukhametdinova A.O., Khrabrova M.S., Nabokow A., Gröne H.-., Kliem V. THE PROGNOSTIC SIGNIFICANCE OF CD3+, CD68+, CD20+ INTERSTITIAL CELLS IN PATIENTS WITH KIDNEY ALLOGRAFT GLOMERULITIS. Nephrology (Saint-Petersburg). 2018;22(6):47-55. (In Russ.) https://doi.org/10.24884/1561-6274-2018-22-6-47-55
ВВЕДЕНИЕ
Выживаемость аллографта почки (АП) зависит от выраженности иммунологического конфликта между организмом реципиента и донорским органом [1-3]. Основными проявлениями аллоиммунных реакций в трансплантате являются Т-клеточное и В-клеточное отторжение [4, 5], однако существуют и другие фенотипы иммунного конфликта [6]. К одним из них относится эндотелиально-лейкоцитарная реакция в клубочках - гломерулит, развитие которого ассоциировано со снижением выживаемости АП вне зависимости от наличия других признаков отторжения [7]. Интракапиллярное воспаление клубочков зачастую сочетается с инфильтрацией в интерстиции, которая, в свою очередь, может быть негативным предиктором выживаемости аллографта почки [8]. Опубликованных данных о прогностическом значении и составе инфильтратов в интерстиции у реципиентов с гломерулитом мы не нашли. Целью представляемого исследования была проверка предположения о связи выраженности интерстициальной инфильтрации отдельными субпопуляциями иммунных клеток и отдаленного прогноза аллотрансплантации почки (АТП).
ПАЦИЕНТЫ И МЕТОДЫ
Исследуемая группа пациентов
В ретроспективное обсервационное исследование были включены 86 реципиентов АП, получивших трансплантат в 2000-2013 гг. в соответствии с критериями: наличие в индикационной или протокольной биопсии гломерулита по определению Banff [5], совместимость с донором по группе крови, отрицательный цитотоксический кросс-матч тест. Критериями исключения были: морфологические признаки возврата первичной патологии почек, полиомавирусная инфекция (подтвержденная иммуногистохимически), частые рецидивирующие инфекции мочевого тракта после АТП. СКФ на момент биопсии с гломерулитом была определена по формуле MDRD. Основные клинико-демографические параметры пациентов, включенных в исследование, представлены в табл. 1.
Морфологический и иммунологический анализ
ДСА в сыворотке пациентов на момент биопсии АП с гломерулитом и морфологические параметры были определены с использованием методологии, описанной ранее [9]. На основании наличия/отсутствия ДСА пациенты были разделены на подгруппы: ДСА+ (n=22), ДСА- (n=53). В 11 случаях на момент биопсии ДСА не были определены (ДСА?) в связи с техническими ограничениями. Медиана от АТП до биопсии с гломерулитом составила 29 (9; 93) дней. Морфологические параметры оценивали в соответствии с критериями Banff (табл. 2). Между подгруппами ДСА+ и ДСА- достоверных различий по представленным показателям (см. табл. 2) выявлено не было.
Иммуногистохимическое исследование био- птатов (ИГХ) проводили по стандартным методикам, также описанным ранее [9]. Использовали первичные моноклональные мышиные антитела, специфичные к CD68 (маркер моноцитарно- макрофагальных клеток), CD3 (маркер Т-лимфоцитов) и CD20 (маркер В-лимфоцитов) антигенам.
Для количественной оценки интерстициальной инфильтрации производили подсчет суммарного количества клеток в интерстиции и перитубуляр- ных капиллярах коркового вещества в 20 последовательных полях зрения средней зоны биоптата, исключая субкапсулярные и периваскулярные зоны, при увеличении 400. Рассчитывали среднее число CD68+ и CD3+ клеток на поле зрения. При наличии CD20+ клеток в интерстиции для оценки выраженности инфильтрации определяли среднее количество CD20+ лимфоцитов в инфильтрате.
Иммуносупрессивная терапия, период наблюдения и исходы
В случаях наличия ДСА на момент биопсии с гломерулитом проводили соответствующую им- муносупрессивную терапию (ИСТ), описанную ранее [7]. Тактика ИСТ, примененная в случаях гломерулита с отсутствием данных о наличии ДСА, также изложена в предыдущих работах [7].
Медиана периода наблюдения от биопсии составила 54 (12; 77) мес. Комбинированная конечная точка включала два исхода: потерю АП с возвратом на диализ или СКФ по формуле MDRD < 15 мл/мин/1,73 м2.
Статистический анализ
Данные представлены как среднее и стандартное отклонение (M±SD), медиана с интерквартильным размахом [m (25-75 %)]. Для анализа различий между оцениваемыми параметрами в группах применяли непараметрический критерий Манна- Уитни, точный тест Фишера и критерий χ2 Пирсона при анализе таблиц сопряженности, коэффициент корреляции Спирмена для оценки связи между показателями. Анализ выживаемости АП производили с помощью метода Каплана-Майера. Дату смертельного исхода, наступившего при наличии функционирующего АП, учитывали как конец наблюдения, а такой случай как цензурированный. Для выявления различий между кривыми выживаемости использовали Log-rank тест. Регрессионный анализ Кокса применяли для оценки прогностической значимости изучаемых факторов с коррекцией по другим потенциальным факторам риска потери АП путем их принудительного включения в анализ. В мультивариантном регрессионном анализе использовали показатели, которые имели связь с риском потери АП в одновариантном анализе при p < 0,05.
Критический уровень значимости для всех статистических тестов и коэффициентов регрессии принимали равным 0,05. Для статистической обработки данных использовали пакеты прикладной статистической программы SPSS for Windows 23.0 (IBM Chicago, IL, USA).
РЕЗУЛЬТАТЫ
Клеточный состав интерстициальных инфильтратов
Медиана уровня CD3+ лимфоцитов составила 18 (10; 30), а CD68+ - 13 (6; 24) клеток на поле зрения. Степени инфильтрации интерстиция CD3+ и CD68+ клетками значимо не различались. Инфильтраты CD20+ клеток в интерстиции были выявлены в 60 % (n=49) случаев, в 9 из них инфильтраты достигали значительных размеров (более 50 CD20+ клеток на инфильтрат) с формированием нодулярных структур (рис. 1, Б).
При сравнении степени инфильтрации CD68+ и CD3+ клетками интерстиция между подгруппами ДСА+ и ДСА- различия выявлены не были (рис. 2). В подгруппе с ДСА+ инфильтраты CD20+ лимфоцитов были обнаружены в 64 % биопсий, с ДСА— в 45 % (Fisher exact test p > 0,05).
Таблица 1 / Table 1
Клинико-демографические показатели исследуемой группы (n=86)
Demographics and clinical characteristics of the group (n=86)
Показатель | Значение |
|---|---|
Мужской пол, % | 49 |
Возраст пациента на момент биопсии, годы, M±SD | 50±13 |
Продолжительность ЗПТ, мес, m (25-75%) | 76 (42; 147) |
PRA>0, % | 49 |
Длительность холодовой ишемии, мин, M±SD | 718±386 |
Длительность тепловой ишемии, мин, M±SD | 38±11 |
АТП от живого донора, % | 17 |
Последнее значение креатинина донора, ммоль/л, M±SD | 0,083±0,040 |
Возраст донора, годы, M±SD | 51±15 |
Отсроченная функция АП, % | 63 |
Повторные АТП, % | 34 |
HLA MM, m (25-75 %) | 3 (2; 3) |
Примечание. АТП - аллотрансплантация почки; АП - аллографт почки; ЗПТ - заместительная почечная терапия; HLA MM - количество несовпадений по локусам системы генов HLA; PRA (panel reactive antibody) - предсуществующие антитела; M±SD - среднее и стандартное отклонение; m (25-75 %) - медиана и интерквартильный размах.
Таблица 2 / Table 2
Результаты морфологического исследования(n=86)
Morphological data (n=86)
Показатель | Значение |
|---|---|
g, баллы по Banff, M±SD | 1,87±0,91 |
ptc, баллы по Banff, M±SD | 0,81±0,82 |
i, баллы по Banff, M±SD | 1,42±1,20 |
t, баллы по Banff, M±SD | 0,56±0,79 |
v, баллы по Banff, M±SD | 0,35±0,59 |
ИФТА, баллы по Banff, M±SD | 0,71±0,90 |
C4d-ptc +, % | 20 |
C4d-ptc, баллы по Banff, M±SD | 0,81±0,82 |
Примечание. g - гломерулит; ptc - перитубулярный капиллярит; ptc+, % - процент случаев с наличием сопутствующего перитубулярного капиллярита; i - интерстициальное воспаление; t - тубулит; v - васкулит; ИФТА - интерстициальный фиброз и тубулярная атрофия (среднее значение баллов по Banff); C4d-ptc - окрашивание перитубулярных капилляров на C4d; C4d-ptc+, % - процент случаев c положительным окрашиванием на C4d; M±SD - среднее и стандартное отклонение.
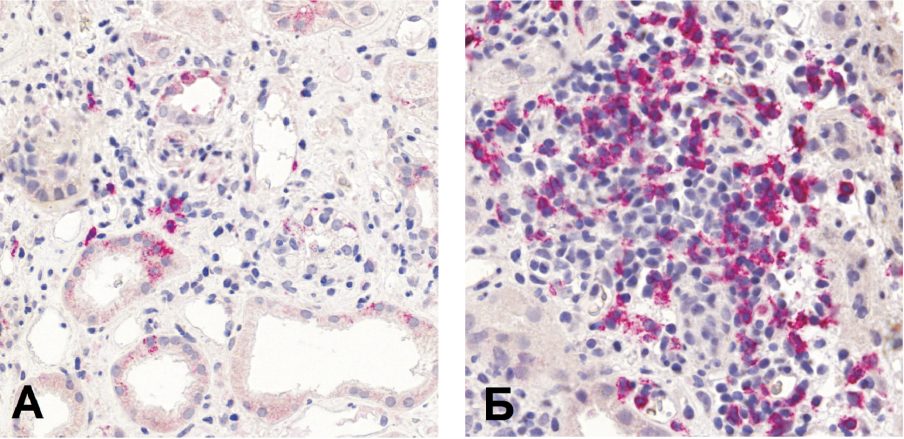
Рис. 1. Репрезентативные микрофотографии инфильтрации интерстиция CD20+ лимфоцитами: А - незначительная CD20+ инфильтрация; Б - выраженная CD20+ инфильтрация.
Figure 1. Representative photomicrographs of interstitial CD20+ infiltration: А - mild interstitial CD20+ infiltration; B - severe interstitial CD20+ infiltration.
Таблица 3 / Table 3
Анализ корреляционных связей между уровнями CD20+, CD3+ и CD68+ клеток в клубочках и интерстиции аллографта почки (указаны коэффициенты корреляции Спирмена и значения p)
Correlation between interstitial and glomerular CD3+, CD68+, CD20+ cell count. Spearman correlation coefficients and P-values are shown
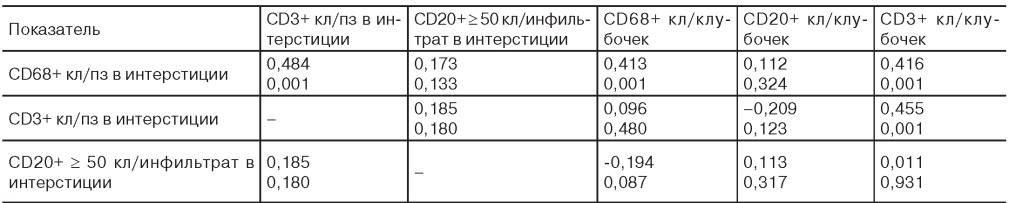
Примечание. кл - клетка; пз - поле зрения.
Интерстициальная инфильтрация и интрагломерулярное воспаление
Между выраженностью инфильтрации интерстиция CD68+ и СD3+ лейкоцитами были выявлены достоверные прямые взаимосвязи (табл. 3). Кроме того, уровень CD68+ клеток в интерстиции имел прямые связи с количеством CD3+ и CD68+ клеток в клубочках, уровень CD3+ клеток в интерстиции - с количеством CD3+ клеток в клубочках, тогда как наличие значительных СD20+ инфильтратов не было связано с уровнями CD3+ и CD68+ клеток (см. табл. 3).
Анализ выживаемости
Достоверные отличия в выживаемости АП были выявлены при сравнении групп с различной степенью инфильтрации CD68+ и CD3+ клетками интерстиция. Уровень CD68+ клеток в интерстиции ≥ 5 на поле зрения был ассоциирован со снижением выживаемости АП, как и наличие ≥ 8 СD3+ лимфоцитов на поле зрения (рис. 3, А, Б). Наличие инфильтратов CD20+ клеток не влияло на прогноз (см. рис. 3, В), однако выживаемость АП при наличии CD20+инфильтратов значительных размеров была достоверно ниже (см. рис. 3, Г).
Унивариантный регрессионный анализ Кокса показал, что относительный риск потери АП достоверно возрастает при уровне CD68+ клеток в интерстиции ≥ 5 на поле зрения, CD3+ ≥ 8 на поле зрения, наличии значительных CD20+ инфильтратов, увеличении времени холодовой и тепловой ишемии АП, наличии ДСА (табл. 4).
Таблица 4 / Table 4
Результаты унивариантного регрессионного анализа связи основных клинико-морфологических факторов с риском потери АП
Univariable analysis of risk factors for allograft loss
Показатель | p | Exp(β) | ДИ 95,0 % для Exp(β) |
|---|---|---|---|
CD68+, 1 клетка/пз | 0,131 | 1,015 | 0,995-1,036 |
CD3+, 1 клетка/пз | 0,366 | 1,008 | 0,991-1,026 |
CD68+ ≥ 5 клеток/пз (vs < 5 клеток/пз) | 0,024 | 3,921 | 1,199-12,827 |
CD3+ ≥ 8 клеток/пз (vs < 8 клеток/пз) | 0,049 | 7,427 | 1,005-54,865 |
CD20+ инфильтрат > 50 клеток (vs инфильтрат < 50 клеток) | 0,012 | 2,893 | 1,260-6,644 |
ДСА+ (vs ДСА-/ДСА?) | 0,016 | 2,174 | 1,156-4,088 |
ДСА+/ДСА? (vs ДСА-) | 0,060 | 1,780 | 0,976-3,245 |
Пол (м vs ж) | 0,233 | 0,691 | 0,377-1,268 |
Количество АТП (>1 vs первая) | 0,550 | 1,208 | 0,650-2,243 |
АТП от живого донора vs трупная | 0,790 | 0,432 | 0,170-1,101 |
ЗПТ, 1 мес | 0,636 | 1,001 | 0,998-1,004 |
Возраст донора, 1 год | 0,087 | 1,020 | 0,997-1,044 |
ВХИ, 1 мин | 0,012 | 1,001 | 1,000-1,002 |
ВТИ, 1 мин | 0,019 | 1,033 | 1,004-1,062 |
Отсроченная функция АП (vs своевременная) | 0,072 | 1,849 | 0,947-3,608 |
СКФMDRD на момент биопсии, 1 мл/мин/1,73 м2 | 0,178 | 0,989 | 0,956-1,003 |
Возраст реципиента, 1 год | 0,091 | 0,979 | 0,956-1,003 |
PRA (vs отсутствие) | 0,121 | 1,622 | 0,880-2,993 |
Период от АТП до биопсии, 1 день | 0,759 | 1,000 | 1,000-1,000 |
ИФТА (2-3 vs 0-1 по Banff) | 0,118 | 1,692 | 0,874-3,276 |
HLA MM (2-6 vs 0-1) | 0,710 | 1,166 | 0,519-2,624 |
Примечание. АП - аллографт почки; АТП - аллотрансплантация почки; ВТИ - время тепловой ишемии; ВХИ - время Холодовой ишемии; ДИ - доверительный интервал; ДСА+ - наличие донор-специфических антител; ДСА— отрицательные донорспецифические антитела; ДСА? - донор-специфические антитела не определены; пз - поле зрения; ИФТА - интерстициальный фиброз и тубулярная атрофия (среднее значение баллов по Banff); ЗПТ - заместительная почечная терапия; СКФ - скорость клубочковой фильтрации; PRA - предсуществующие антитела; HLA MM - количество несовпадений по локусам системы генов HLA.
Таблица 5 / Table 5
Результаты мультивариантного регрессионного анализа связи потенциальных предикторов с риском потери АП
Multivariable analyses of risk factors for allograft loss
Показатели, включенные в модели | Exp(β) (ДИ 95 %) для CD68+ (≥ 5 кл/пз) | Exp(β) (ДИ 95 %) для CD3+ (≥ 8 кл/пз) | Exp(β) (ДИ 95 %) для CD20+ (инфильтрат ≥ 50 кл) |
|---|---|---|---|
ВХИ, ДСА+ (vs ДСА-/ДСА?), ВТИ | 3,361 (1,031-11,147) | 7,958 (1,077-58,814) | 3,637 (1,355-9,762) |
АП - аллографт почки; ВТИ - время тепловой ишемии (1 мин); ВХИ - время Холодовой ишемии (1 мин); ДИ - доверительный интервал Exp(β); ДСА+ - наличие донор-специфических антител; ДСА— отрицательные донор-специфические антитела; ДСА? - донор-специфические антитела не определены; кл - клетка; пз - поле зрения.
В мультивариантных моделях показатели уровней CD3+, CD68+ клеток в интерстиции и наличие значительных CD20+ инфильтратов имели достоверную и независимую связь с риском потери АП (табл. 5).
ОБСУЖДЕНИЕ
Интерстициальная инфильтрация является частой находкой при морфологическом исследовании АП [10], в том числе при наличии признаков отторжения - Т-клеточного или антительно-опосредованного [10, 11]. Не будучи специфичным показателем отторжения [12], интерстициальная инфильтрация способна оказывать влияние на отдаленный прогноз выживаемости АП [13]. Можно полагать, что субпопуляционный состав интерстициальной инфильтрации в сочетании с другими патоморфологическими изменениями отражает различные механизмы клеточных взаимодействий в трансплантате и, соответственно, в различной степени связан с прогнозом АП.
В данное исследование были включены случаи, селекционированные по наличию гломерулита - неблагоприятного в прогностическом плане морфологического фенотипа, отражающего активную эндотелиально-лейкоцитарную реакцию в капиллярах клубочка. Интерстициальная инфильтрация была выявлена в 70 % случаев.
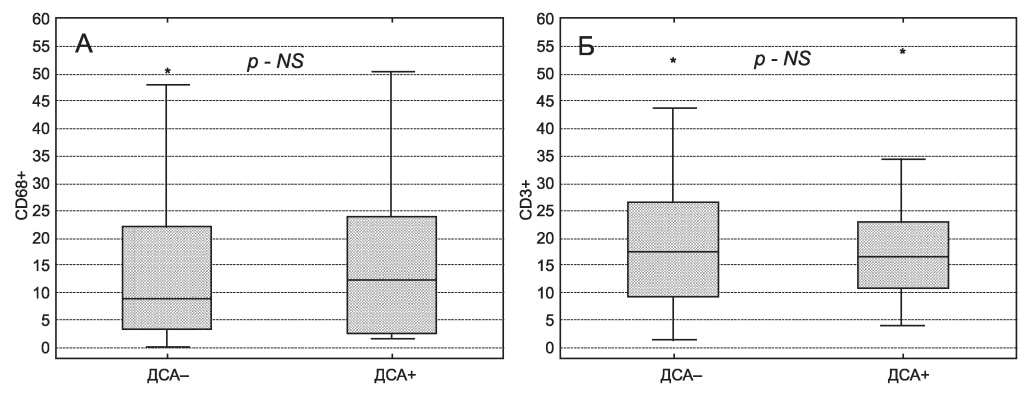
Рис. 2. Количество CD68+ (А) и CD3+ (Б) клеток на поле зрения (х400) в зависимости от наличия донор-специфических антител (ДСА). NS - не достоверно.
Figure 2. Interstitial CD68+ (A) and CD3+ (B) cells per field of view (х400) according to the presence/absence of donor-specific antibodies (DSA). NS - not significant.
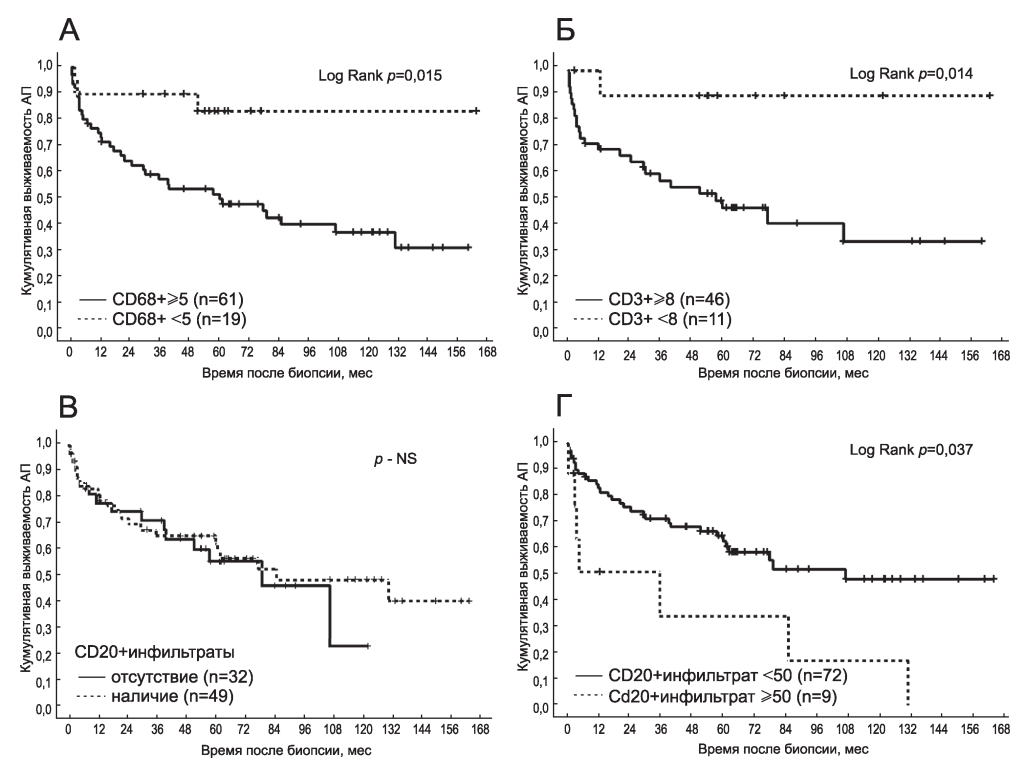
Рис. 3. Выживаемость аллографта почки (АП) в зависимости от выраженности инфильтрации CD68+ (А), CD3+ (Б) и CD20+ (В, Г) клетками интерстиция. NS - не достоверно.
Figure 3. Renal allograft survival according to the count of interstitial CD68+ (А), CD3+ (B) and CD20+ (C, D) cells. NS - not significant.
Основными клетками, участвующими в образовании инфильтрации, были Т-лимфоциты (CD3+) и клетки моноцитарно-макрофагального ряда (CD68+). CD3+ и CD68+ клетки могли располагаться по отдельности, а также находиться в составе инфильтратов. CD20+ лимфоциты имели отчетливую склонность к образованию инфильтратов, даже при незначительном количестве клеток (см. рис. 2).
В двух недавно произведенных исследованиях было выявлено независимое влияние на выживаемость АП повышенного уровня CD68+ клеток в интерстиции АП [11, 14]. Sicard et al показали самостоятельное отрицательное прогностическое значение CD68+ инфильтрации интерстиция в группе неселекционированной по наличию и виду отторжения, а подсчет уровня клеток был произведен во всех компартментах органа, включая клубочки [11]. Роль моноцитарно- макрофагальных клеток в развитии гуморального аллоиммунитета известна [15-19]. Уровень CD68+ в интерстиции был независимым прогностическим фактором выживаемости АП в группе с антительно-опосредованным отторжением [14]. Мы установили, что уровень CD68+ и CD3+ клеток в интерстиции при гломерулите может быть негативным предиктором долгосрочной выживаемости АП независимо от наличия других существенных факторов, в том числе ДСА.
Популяция CD68+ клеток может участвовать в инициации аллоиммунного ответа, распознавая антигены АП и представляя их Т-лимфоцитам [20, 21]. Активированные CD68+ клетки могут экспрессировать интерлейкины 1, 6, 12, интерферон-γ и фактор некроза опухоли α, участвующие в активации и рекрутировании других субпопуляций иммунных клеток, а также в активации и повреждении эндотелиоцитов [15, 19, 22]. Последние через различные механизмы сами могут инициировать и поддерживать аллоиммунное повреждение трансплантата [23, 24], а также способствовать развитию аутоиммунных реакций [25-27]. Подобные эндотелиально-лейкоцитарные взаимодействия могут протекать как в клубочках, так и в тубулоинтерстициальном компартменте почки, на что косвенно указывают выявленные корреляции количества иммунных клеток в клубочках и интерстиции.
Вместе с тем, известна роль определенных субпопуляций моноцитарно-макрофагальных клеток (CD68+CD206+) в развитии фибропластических изменений, как исхода хронического повреждения любого генеза [28, 29], а значительная инфильтрация, в том числе в зоне фиброза, указывает на текущее активное повреждение [29, 30].
В значительной части случаев (60 %) были также выявлены В-лимфоцитарные инфильтраты различного размера от единичных CD20+ клеток до значительных агрегатов с формированием образований, напоминающих третичные лимфоидные структуры (см. рис. 2). В данном исследовании было установлено, что такие инфильтраты в интерстиции при гломерулите являются независимым предиктором потери АП. В ранее произведенных исследованиях в отношении связи В-клеток в интерстиции с прогнозом получены различные данные: отсутствие влияния на выживаемость АП [31, 32], ассоциация с ее снижением [33, 34] или даже улучшение прогноза при увеличении выраженности инфильтрации интерстиция CD20+ клетками [35]. Такие противоречия могут быть отчасти объяснены гетерогенностью исследуемых групп и методик определения степени инфильтрации. Кроме того, субпопуляционный состав В-лимфоцитарных CD20+ инфильтратов может быть представлен эффекторными и регуляторными клетками [3638]. Известно, что В-клетки способны принимать участие в Т-клеточном отторжении через непосредственную активацию Т-лимфоцитов [39] и в антительно-опосредованном отторжении через дифференцировку в плазматические клетки [40].
Нодулярные лимфоидные структуры, подобные обнаруженным в данном исследовании, могут быть выявлены при различных заболеваниях и представляют собой, как полагают, реакцию иммунной системы на хроническую антигенную стимуляцию [41, 42]. Можно предположить, что в таких случаях происходит локальный В-клеточный иммунный ответ с синтезом антител к антигенам АП и адсорбцией их в трансплантате при минимальных попаданиях в системную циркуляцию [41-45]. Существование в третичных лимфоидных структурах локального гуморального иммунитета, отличающегося от системного по специфичности и репертуару антител, показано при хроническом отторжении аллографта и заболеваниях аутоиммунного генеза [41, 42, 46].
К ограничениям данного исследования можно отнести определение только анти-HLA-ДСА, отсутствие последующих ИГХ исследований биоптатов для оценки динамики, отсутствие дифференцированного подсчета уровней инфильтрации микрососудов интерстиция и собственно интерстиция, а также ретроспективный характер исследования и отсутствие контрольной группы. Вместе с тем, к преимуществам исследования можно отнести количество случаев и их селекцию по наличию гло- мерулита, а также длительный период наблюдения с оценкой твердых конечных точек прогноза.
ЗАКЛЮЧЕНИЕ
Выраженность инфильтрации интерстиция CD3+, CD68+ и CD20+ клетками при гломерулите может быть предиктором прогноза выживаемости АП.
Список литературы
1. Sellares J, de Freitas DG, Mengel M et al. Understanding the causes of kidney transplant failure: the dominant role of antibody-mediated rejection and nonadherence. Am J Transplant 2012;12(2):388–399. doi: 10.1111/j.1600-6143.2011.03840.x
2. Lamb KE, Lodhi S, Meier-Kriesche HU. Long-term renal allograft survival in the United States: A critical reappraisal. Am J Transplant 2011;11(3):450–462. doi: 10.1111/j.1600-6143.2010.03283.x
3. Gaston RS, Cecka JM, Kasiske BL et al. Evidence for antibody-mediated injury as a major determinant of late kidney allograft failure. Transplantation 2010;90(1):68–74. doi: 10.1097/TP.0b013e3181e065de
4. Loupy A, Haas M, Solez K et al. The Banff 2015 kidney meeting report: current challenges in rejection classification and prospects for adopting molecular pathology. Am J Transplant 2017;17(1):28–41. doi: 10.1111/ajt.14107
5. Haas M, Sis B, Racusen LC, Solez K et al. Banff 2013 Meeting Report: Inclusion of C4d-negative antibody-mediated rejection and antibody-associated arterial lesions. Am J Transplant 2014;14: 272–283. doi: 10.1111/ajt.12590
6. Добронравов ВА, Храброва МС. Иммуноморфологические фенотипы повреждения аллографта почки. Нефрология 2017; 21(6): 9–19. https://doi.org/10.24884/1561-6274-2017-21-6-9-19
7. Nabokow A, Dobronravov VA, Khrabrova M et al. Longterm kidney allograft survival in patients with transplant glomerulitis. Transplantation 2015; 99(2): 331–339. doi: 10.1097/TP.0000000000000606
8. Mengel M, Reeve J, Bunnag S, et al. Scoring total inflammation is superior to the current Banff inflammation score in predicting outcome and the degree of molecular disturbance in renal allografts. Am J Transplant 2009;9(8):1859–1867. doi: 10.1111/j.1600-6143.2009.02727.x
9. Храброва МС, Мухаметдинова АО, Набоков АВ, Грене Х, Клим Ф, Добронравов ВА. Cубпопуляции иммунных клеток при гломерулите аллографта почки: состав и прогностическое значение. Нефрология 2017; 21(6): 29–38. https://doi.org/10.24884/1561-6274-2017-21-6-29-38
10. Moreso F, Seron D, O'Valle F et al. Immunephenotype of glomerular and interstitial infiltrating cells in protocol renal allograft biopsies and histological diagnosis. Am J Transplant 2007;7:2739–2747. doi:10.1111/j.1600-6143.2007.02013.x
11. Sicard A, Meas-Yedid V, Rabeyrin M et al. Computerassisted topological analysis of renal allograft inflammation adds to risk evaluation at diagnosis of humoral rejection. Kidney Int 2017;92(1):214–226. doi: 10.1016/j.kint.2017.01.011
12. Sellarés J, de Freitas DG, Mengel M et al. Inflammation lesions in kidney transplant biopsies: association with survival is due to the underlying diseases. Am J Transplant 2011;11(3):489–499. doi: 10.1111/j.1600-6143.2010.03415.x
13. Mengel M, Reeve J, Bunnag S et al. Scoring total inflammation is superior to the current Banff inflammation score in predicting outcome and the degree of molecular disturbance in renal allografts. Am J Transplant 2009;9(8):1859–1867
14. Bräsen JH, Khalifa A, Schmitz J et al. Macrophage density in early surveillance biopsies predicts future renal transplant function. Kidney Int 2017;92(2):479–489. doi: 10.1016/j.kint.2017.01.029.
15. Piotti G, Palmisano A, Maggiore U et al. Vascular endothelium as a target of immune response in renal transplant rejection. Front Immunol 2014;5:505. doi: 10.3389/fimmu.2014.00505
16. Kilgore KS, Schmid E, Shanley TP et al. Sublytic concentrations of the membrane attack complex of complement induce endothelial interleukin-8 and monocyte chemoattractant protein-1 through nuclear factor-kappa B activation. Am J Pathol 1997;150(6):2019–2031
17. Valenzuela NM, Trinh KR, Mulder A et al. Monocyte recruitment by HLA IgG-activated endothelium: the relationship between IgG subclass and FcγRIIa polymorphisms. Am J Transplant 2015;15(6):1502–1518. doi: 10.1111/ajt.13174.
18. Valenzuela NM, Mulder A, Reed EF. HLA class I antibodies trigger increased adherence of monocytes to endothelial cells by eliciting an increase in endothelial P-selectin and, depending on subclass, by engaging FcγRs. J Immunol 2013;190(12):6635–6650. doi: 10.4049/jimmunol.1201434
19. Wyburn KR, Jose MD, Wu H et al. The role of macrophages in allograft rejection. Transplantation 2005;80(12):1641–1647. doi: 10.1097/01.tp.0000173903.26886.20
20. Zecher D, van Rooijen N, Rothstein DM et al. An innate response to allogeneic nonself mediated by monocytes. J Immunol 2009;183(12):7810–7816. doi: 10.4049/jimmunol.0902194
21. Oberbarnscheidt MH, Zeng Q, Li Q et al. Non-self recognition by monocytes initiates allograft rejection. J Clin Invest 2014;124(8):3579–3589. doi: 10.1172/JCI74370
22. Hirohashi T, Chase CM, Della Pelle P et al. A novel pathway of chronic allograft rejection mediated by NK cells and alloantibody. Am J Transplant 2012;12(2):313–321. doi: 10.1111/j.1600-6143.2011.03836.x
23. Kreisel D, Krupnick AS, Gelman AE et al. Non-hematopoietic allograft cells directly activate CD8+ T cells and trigger acute rejection: an alternative mechanism of allorecognition. Nat Med 2002; 8(3):233–239. doi:10.1038/nm0302-233
24. Ishii D, Rosenblum JM, Nozaki T et al. Novel CD8 T cell alloreactivities in CCR5-deficient recipients of class II MHC disparate kidney grafts. J Immunol 2014;193(7):3816–3824. doi: 10.4049/jimmunol.1303256
25. Jackson AM, Sigdel TK, Delville M et al. Endothelial cell antibodies associated with novel targets and increased rejection. J Am Soc Nephrol 2015;26(5):1161–1171. doi: 10.1681/ASN.2013121277
26. Cardinal H, Dieudé M, Brassard N et al. Antiperlecan antibodies are novel accelerators of immune-mediated vascular injury. Am J Transplant 2013;13(4):861–874. doi: 10.1111/ajt.12168
27. Dieude M, Bell C, Turgeon J et al. The 20S proteasome core, active within apoptotic exosome-like vesicles, induces autoantibody production and accelerates rejection. Sci Transl Med 2015;16;7(318):318ra200. doi: 10.1126/scitranslmed.aac9816.
28. Braga TT, Agudelo JS, Camara NO. Macrophages during the fibrotic process: M2 as friend and foe. Front Immunol 2015;6:602. doi:10.3389/fimmu.2015.00602
29. Toki D, Zhang W, Hor KL et al. The role of macrophages in the development of human renal allograft fibrosis in the first year after transplantation. Am J Transplant 2014;14(9):2126–2136. doi: 10.1111/ajt.12803
30. Nankivell BJ, Shingde M, Keung KL et al. The causes, significance and consequences of inflammatory fibrosis in kidney transplantation: The Banff i-IFTA lesion. Am J Transplant 2018;18(2):364–376. doi: 10.1111/ajt.14609
31. Scheepstra C, Bemelman FJ, Van Der Loos C et al. B clinical outcome of renal allograft rejection. Transplantation 2008;86(6):772–778. doi: 10.1097/TP.0b013e3181860a74
32. Kayler LK, Lakkis FG, Morgan C et al. Acute cellular rejection with CD20-positive lymphoid clusters in kidney transplant patients following lymphocyte depletion. Am J Transplant 2007;7(4):949–954. doi: 10.1111/j.1600-6143.2007.01737.x
33. Hippen BE, DeMattos A, Cook WJ et al. Association of CD20+ infiltrates with poorer clinical outcomes in acute cellular rejection of renal allografts. Am J Transplant 2005;5(9):2248–2252. doi: 10.1111/j.1600-6143.2005.01009.x
34. Moreso F, Seron D, O'Valle F et al. Immunephenotype of glomerular and interstitial infiltrating cells in protocol renal allograft biopsies and histological diagnosis. Am J Transplant 2007;7(12):2739–2747. doi: 10.1111/j.1600-6143.2007.02013.x
35. Jiang Y, Wang R, Wang H et al. The Effect of Histological CD20-Positive B Cell Infiltration in Acute Cellular Rejection on Kidney Transplant Allograft Survival. J Immunol Res 2016;16:7473239. doi: 10.1155/2016/7473239
36. Lee KM, Stott RT, Zhao G et al. TGF-beta-producing regulatory B cells induce regulatory T cells and promote transplantation tolerance. Eur J Immunol 2014;44(6):1728–1736. doi: 10.1002/eji.201344062
37. Ding Q, Yeung M, Camirand G et al. Regulatory B cells are identified by expression of Tim-1 and can be induced through Tim-1 ligation to promote tolerance in mice. J Clin Invest 2011;121(9):3645–3656. doi: 10.1172/JCI46274.
38. Lal G, Nakayama Y, Sethi A et al. Interleukin-10 from marginal zone precursor B-cell subset is required for costimulatory blockade-induced transplantation tolerance. Transplantation 2015;99(9):1817–1828. doi: 10.1097/TP.0000000000000718
39. Zeng Q, Ng YH, Singh T et al. B cells mediate chronic allograft rejection independently of antibody production. J Clin Invest 2014;124(3):1052–1056. doi: 10.1172/JCI70084
40. Nutt SL, Hodgkin PD, Tarlinton DM et al. The generation of antibody-secreting plasma cells. Nat Rev Immunol 2015;15(3):160–171. doi: 10.1038/nri3795
41. Thaunat O, Graff-Dubois S, Brouard S et al. Immune responses elicited in tertiary lymphoid tissues display distinctive features. PLoS One 2010;5(6):e11398. doi: 10.1371/journal.pone.0011398
42. Thaunat O, Patey N, Caligiuri G et al. Chronic rejection triggers the development of an aggressive intragraft immune response through recapitulation of lymphoid organogenesis. J Immunol 2010;185(1):717–728. doi: 10.4049/jimmunol.0903589
43. Adeyi OA, Girnita AL, Howe J et al. Serum analysis after transplant nephrectomy reveals restricted antibody specificity patterns against structurally defined HLA class I mismatches. Transpl Immunol 2005;14(1): 53–62. doi: 10.1016/j.trim.2005.01.001
44. Del Bello A, Congy-Jovilet N, Sallusto F et al. Donorspecific antibodies after ceasing immunosuppressive therapy, with or without an allograft nephrectomy. Clin J Am Soc Nephrol 2012;7(8): 1310–1319. doi: 10.2215/CJN.00260112
45. Marrari M, Duquesnoy RJ. Detection of donor-specific HLA antibodies before and after removal of a rejected kidney transplant. Transpl Immunol 2010;22(3-4):105–109. doi: 10.1016/j.trim.2009.12.005
46. Pipi E, Nayar S, Gardner DH et al. Tertiary Lymphoid Structures: Autoimmunity Goes Local. Front Immunol 2018;9: 1952. doi: 10.3389/fimmu.2018.01952
Об авторах
В. А. ДобронравовРоссия
197022, Россия, Санкт-Петербург, ул. Л. Толстого, д. 17.
Проф. Добронравов Владимир Александрович, д-р мед. наук, заместитель директора.
А. О. Мухаметдинова
Россия
197022, Россия, Санкт-Петербург, ул. Л. Толстого, д. 6/8.
Мухаметдинова Анастасия Олеговна.
М. С. Храброва
Россия
197022, Россия, Санкт-Петербург, ул. Л. Толстого, д. 17, корп. 54.
Храброва Мария Сергеевна, канд. мед. наук.
Тел.: (812) 338-01-65.
А. В. Набоков
Германия
34346, Германия, г. Ганн. Мюнден, Фогельзанг, д. 105.
Набоков Александр, заместитель директора.
Х. -Й. Грене
Германия
69120, Германия, г. Гейдельберг, Им Нойенгеймер Фелд, д. 280.
Проф. Германн-Йозеф Грёне.
Ф. Клим
Германия
34346, Германия, г. Ганн. Мюнден, Фогельзанг, д. 105.
Проф. Клим Фолкер, директор.
Рецензия
Для цитирования:
Добронравов В.А., Мухаметдинова А.О., Храброва М.С., Набоков А.В., Грене Х.-., Клим Ф. ПРОГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ CD3+, CD68+, CD20+ КЛЕТОК В ИНТЕРСТИЦИИ У БОЛЬНЫХ С ГЛОМЕРУЛИТОМ АЛЛОГРАФТА ПОЧКИ. Нефрология. 2018;22(6):47-55. https://doi.org/10.24884/1561-6274-2018-22-6-47-55
For citation:
Dobronravov V.A., Mukhametdinova A.O., Khrabrova M.S., Nabokow A., Gröne H.-., Kliem V. THE PROGNOSTIC SIGNIFICANCE OF CD3+, CD68+, CD20+ INTERSTITIAL CELLS IN PATIENTS WITH KIDNEY ALLOGRAFT GLOMERULITIS. Nephrology (Saint-Petersburg). 2018;22(6):47-55. (In Russ.) https://doi.org/10.24884/1561-6274-2018-22-6-47-55
JATS XML








































