Перейти к:
ЗНАЧИМОСТЬ ВЫЯВЛЕНИЯ МОНОКЛОНАЛЬНОЙ ГАММАПАТИИ У БОЛЬНЫХ НЕФРОЛОГИЧЕСКОГО ПРОФИЛЯ
https://doi.org/10.24884/1561-6274-2019-23-2-82-90
Аннотация
ВВЕДЕНИЕ. Моноклональная гаммапатия (МГ) рассматривается в настоящее время не только как состояние, предшествующее развитию гематологических неоплазм, но также и некоторых неопухолевых заболеваний, в частности поражения почек, что представляет высокоактуальную проблему. ЦЕЛЬ. Определить распространенность и варианты моноклональной гаммапатии (МГ) среди терапевтических больных, в том числе с неопухолевыми поражениями почек, для оптимизации методов их диагностики и определения тактики лечения. ПАЦИЕНТЫ И МЕТОДЫ. Всего проанализировано 11392 больных в течение 4 лет (2013–2016 гг.). Проводилось стандартное общеклиническое обследование, принятое в отделениях многопрофильного стационара. Для выявления МГ были использованы метод электрофореза белков сыворотки крови и 24-часовой концентрированной мочи, метод иммунофиксации белков сыворотки крови и мочи и метод определения свободных легких цепей в сыворотке крови (Freelite). РЕЗУЛЬТАТЫ. МГ диагностирована у 174 из 11392 больных: 49 % мужчин и 51 % женщин в возрасте от 18 до 85 лет и выявлялась в 2,1 раза чаще у больных нефрологического профиля. Среди больных этой группы у 41 % диагностирован AL-амилоидоз с поражением почек, у 18 % – криоглобулинемический гломерулонефрит, у 35 % – хронический гломерулонефрит и у небольшого числа больных – болезнь отложения легких цепей с поражением почек и cast-нефропатия. У 86 % больных нефрологического профиля величина МГ была менее 5 г/л, что соответствует олигосекреторной МГ, причем у 46 % из них – менее 1 г/л, еще 10 % имели величину МГ 5–10 г/л, и только у 4,42 % больных определены значения более 10 г/л. ЗАКЛЮЧЕНИЕ. Определено важное значение МГ в патогенезе поражения почек, особенно ее олигосекреторной формы, что требует применения у больных нефрологического профиля более чувствительных методов исследования МГиммунофиксации и Freelite.
Ключевые слова
Для цитирования:
Лысенко Л.В., Чеботарева Н.В., Мрыхин Н.Н., Рамеев В.В., Андросова Т.В., Варшавский В.В., Когарко И.Н., Рощупкина С.В. ЗНАЧИМОСТЬ ВЫЯВЛЕНИЯ МОНОКЛОНАЛЬНОЙ ГАММАПАТИИ У БОЛЬНЫХ НЕФРОЛОГИЧЕСКОГО ПРОФИЛЯ. Нефрология. 2019;23(2):82-90. https://doi.org/10.24884/1561-6274-2019-23-2-82-90
For citation:
Lysenko L.B., Chebotareva N.V., Mrykhin N.N., Rameev V.V., Androsova T.V., Varshavsky V.V., Kogarko I.N., Roshchupkina S.V. DETERMINING OF MONOCLONAL GAMMOPATHY IN NEPHROLOGICAL PATIENTS. Nephrology (Saint-Petersburg). 2019;23(2):82-90. (In Russ.) https://doi.org/10.24884/1561-6274-2019-23-2-82-90
ВВЕДЕНИЕ
В 1978 г. R. Kyle и его группа впервые ввели понятие «моноклональная гаммапатия неопределенного значения» (MGUS) после того, как на основании динамического наблюдения за пациентами с так называемой доброкачественной «асимптоматической» М-протеинемией (термин предложен J. Waldenstrom в 1960 г.) отметили среди них более высокий, чем в общей популяции, риск развития множественной миеломы (ММ), макроглобулинемии Вальденстрема (Wm), AL- иммуноглобулинового амилоидоза. Согласно результатам последующих эпидемиологических исследований, установлено, что в общей популяции моноклональную гаммапатию (МГ) выявляют примерно у 2 % людей старше 50 лет и только у 0,3 % - моложе 50 лет. При этом риск прогрессирования в гематологическую В-клеточную опухоль составляет около 1 % новых случаев в год [1-3].
По современным представлениям, MGUS (результат гиперпродукции одного малого клона плазматических клеток или В-лимфоцитов) рассматривается не только как предопухолевое состояние, практически всегда предшествующее развитию ММ и других ассоциированных гематологических неоплазм, но как причина некоторых неопухолевых негематологических форм заболевания, в частности поражения почек, вследствие установленного токсического действия моноклонального белка на ткань почки [4-6]. При этом среди больных с неопухолевым поражением почек, ассоциированным с MGUS, также отмечается повышенный риск опухолевой прогрессии. Так, по последним данным N. Steiner и соавт. [7], риск трансформации в В-лимфоцитарные опухоли среди почти 3000 пациентов с MGUS в течение первого года после диагноза составил, в целом, 1 % (0,6-1,4), а в группе пациентов, у кого отмечалось, кроме того, поражение почек, - 10 % [4-24]. Таким образом, в настоящее время изучение роли олигосекреторной MGUS в патогенезе заболеваний неопухолевой природы, в частности, ассоциированного с MGUS поражения почек, представляет собой актуальную проблему.
Цель исследования: определить распространенность и варианты МГ среди терапевтических больных, в том числе с неопухолевыми поражениями почек, для оптимизации методов их диагностики и определения тактики лечения.
ПАЦИЕНТЫ И МЕТОДЫ
Всего проанализировано 11392 больных, госпитализированных в различные отделения клиники нефрологии, внутренних и профессиональных заболеваний им. Е.М. Тареева УКБ №3 Первого МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет) в период с 2013 по 2016 г. Исследование проводилось в два этапа. На первом этапе из общего числа больных были выделены имеющие МГ, выявленную с помощью одного или комбинации используемых в клинической практике методов диагностики. Была определена распространенность МГ среди общего числа терапевтических больных в среднем за год и за каждый из четырех проанализированных лет с их разделением по возрасту и демографическому признаку. На втором этапе исследования все больные с моноклональной МГ были оценены в зависимости от нозологической принадлежности с целью выявления профиля терапевтической патологии, наиболее часто сочетающейся с МГ.
Все пациенты, включенные в исследование, были обследованы согласно плану, принятому в отделениях клиники в соответствии с профилем. Для верификации диагноза множественной миеломы ММ, AL-амилоидоза и других В-лимфоклеточных дискразий проводили стернальную пункцию и трепанобиопсию костного мозга, у части больных с иммунофеноти- пированием. Для оценки деструкции (лизиса) костей - важного компонента CRAB-синдрома (гиперкальциемия, почечная недостаточность, анемия, поражение костей), обязательного для диагностики ММ, применяли рентгенографию, компьютерную томографию и при необходимости магнитно-резонансную томографию, позитронно- эмиссионную томографию.
Для уточнения морфологического варианта поражения почек проводили диагностическую нефробиопсию с выполнением световой микроскопии, имму- нофлюоресцентного и электрономикроскопического исследования ткани почки в рамках стандартного обследования. У больных с криогло- булинемическим гломерулонефри- том, ассоциированным с вирусным гепатитом С, вирусологические исследования включали определение маркеров вируса гепатита С (антитела, HCV-РНК, генотип и вирусную нагрузку) и уровня циркулирующих криоглобулинов.
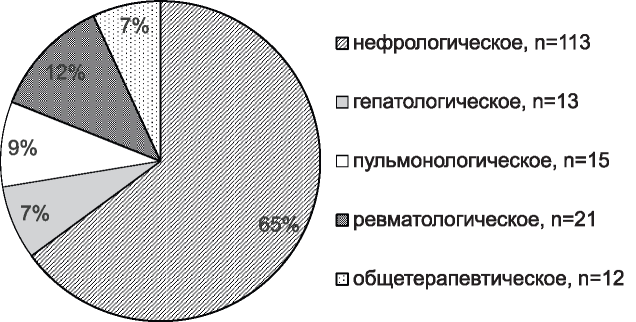
Рис. 1. Частота выявления МГ в разных отделениях многопрофильного терапевтического стационара (с 2013 по 2016 гг.) (n=174).
Figure 1. Percentage of MG in patients of different departments (from 2013 to 2016) (n=174).
Для выявления М-градиента были использованы 3 метода.
Метод электрофореза (ЭФ) белков сыворотки крови и 24-часовой концентрированной мочи выполняли на автоматическом приборе для проведения капиллярного электрофореза белков Capillarys (Sebia). Концентрацию свободных легких цепей κ-СЛЦ и λ-СЛЦ (мг/л) определяли в сыворотке крови иммунотурбидиметрическим методом Freelite на автоматическом биохимическом анализаторе «Hitachi». Методы иммунофиксации (ИФ) белков сыворотки крови и мочи и метод Freelite (метод определения свободных легких цепей в сыворотке крови) применили в лаборатории гуморального иммунитета Гематологического научного центра МЗ РФ.
Статистический анализ полученных данных проводили с использованием общепринятых параметрических и непараметрических методов. Применяли стандартные методы описательной статистики. Центральные тенденции оценивали по величине медианы и интерквартильного размаха. Статистическую значимость межгрупповых различий количественных переменных определяли с помощью дисперсионного анализа (ANOVA), критерия Манна - Уитни или Уилкоксона, бинарных переменных - с помощью х2-критерия. Нулевую гипотезу (ошибка первого рода) отвергали при p<0,05. Для расчетов использовали пакет прикладных статистических программ «Statistica Ver. 6.0» («StatSoft, Inc.», США).
РЕЗУЛЬТАТЫ
Среди общего числа больных (n=11392), госпитализированных в разные отделения многопрофильного терапевтического стационара (клиника нефрологии им. Е.М.Тареева Первого МГМУ им. И.М. Сеченова) в течение 4 лет (2013-2016 гг.), МГ диагностирована у 174 больных: 86(49 %) мужчин и 88(51 %) женщин в возрасте от 18 до 85 лет; средний возраст составил 57 (49;66) лет.
В течение периода исследования заболеваемость МГ была примерно одинаковой (табл.1) с тенденцией к увеличению к 2015-2016 году, однако разница не достигла статистической достоверности (р > 0,1).
Сравнение распространенности среди больных разных отделений показало, что МГ в 2,1 раза чаще выявлялась среди больных нефрологи- ческого профиля - у 113 (3,2 %) из 3494 по сравнению с терапевтическими больными в целом - у 174 (1,5 %) из 11392 больных. При этом доля МГ среди больных ненефрологического профиля была сопоставимой (рис.1) - в диапазоне 7-12 %, что, в целом, достоверно ниже (35 %), чем среди больных с МГ нефрологического профиля (65 %, р<0,05) (см. рис. 1). Статистически значимые различия позволили при дальнейшем анализе сравнивать две группы больных - ненефрологического (группа 1) и нефрологического профиля (группа 2).
Таблица 1 / Table 1
Частота моноклональной гаммапатии среди больных многопрофильной клиники за каждый год с 2013 по 2016 г.
Epidemiology of MG in Internal Medicine Clinic (from 2013 to 2016)
Год наблюдения | 2013 | 2014 | 2015 | 2016 | 2013-2016 |
|---|---|---|---|---|---|
Общее число больных (n) | 3475 | 3025 | 2424 | 2468 | 11392 |
Число больных с МГ, n (%) | 42 (1,2) | 41 (1,3) | 43 (1,7) | 48 (1,9) | 174 (1,5) |
Среди 4087 больных нефрологического отделения в анализ вошли 113 больных, у которых моноклональные белки были выявлены в сыворотке крови и у части в моче. Еще у 8 больных с ХГН они были выявлены иммуногистохимически только в ткани почки, тогда как в сыворотке крови и/или моче либо не исследовались (у 4), либо не были определены (у 4) при использовании лишь одного метода электрофореза белков сыворотки (недостаточно чувствительного для выявления MGUS малого объема). Поэтому для репрезентативности сравнения в группе 2 рассматривались лишь больные, у которых была выявлена и измерена МГ в сыворотке крови и моче.
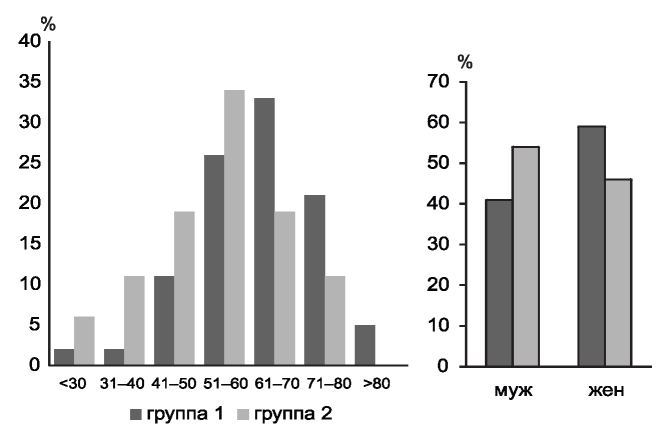
Рис. 2. Распределение больных отделений ненефрологического (группа 1) и нефрологического (группа 2) профиля с выявленной МГ по возрасту и полу.
Figure 2. Characteristic of patients with MG in Nephrology (group 1) and non-Nephrology (group 2) departments according to age and sex.
Анализ возрастного состава больных обследованных групп показал преобладание среди них лиц старше 50 лет - 52 среди 61 (85 %) в группе 1 и 12 среди 113 (64 %) в группе 2, средний возраст составил 63(53;73) года и 54 (47; 64) года (рис. 2).
Однако доля больных моложе 50 лет в группе 2 была выше, чем в группе 1, составила 41 (36 %) из 113, и 9 (15 %) из 61 соответственно. К группе 2 принадлежали и большее число больных до 40 лет - 19 (17 %) из 113 [в группе 1 - только 1 (2 %) из 61] за счет, главным образом, больных с ХГН и (HCV) крио-ГН (табл. 2).
Среди 61 больного группы 1 большинство составляли женщины (отношение м/ж = 0,69), среди 113 больных нефрологического отделения некоторое преимущество имели мужчины (отношение м/ж = 1,2), но различия недостоверны, p>0,1.
У 46 (41 %) больных группы 2 диагностирован первичный системный AL-амилоидоз с поражением почек, у 20 (18 %) - криоглобулинемиче- ский гломерулонефрит, связанный с хронической HCV-инфекцией (крио-ГН HCV+). Большая доля больных с AL-амилоидозом и (крио-ГН HCV) объясняется научными интересами клиники, у 40 (35 %) - диагностирован ХГН, в том числе у 2 - волчаночной этиологии, у 4 (3,5 %) - болезнь отложения легких цепей (БОЛЦ) с поражением почек. Еще у 3 (2,5 %) больных, поступивших в терапевтический стационар по признаку поражения почек, выявлена ММ с cast-нефропатией (рис. 3).
Сравнение средней величины МГ показало, что в группе 1 она была достоверно выше - 7,2 (4,56; 10,9) г/л, чем в группе 2 - 1,22 (0,1; 3,12) г/л (рис. 4). С одной стороны, это обьяснялось более высокими индивидуальными показателями у больных группы 1 с установленными впервые ММ и другими лимфоплазмацитарными опухолями, с другой стороны - применением в группе 1, главным образом, классического метода ЭФ белков сыворотки крови, а в группе 2 - также методов с более высокой разрешающей способностью выявления низких значений МГ, отвечающей по объему критериям MGUS.
Таблица 2 / Table 2
Возрастной диапазон больных с разными нозологическими формами поражения почек (группа 2)
Characteristic of patients with renal lesions according to age (group 2)
Нозологические формы поражения почек | n | До 30, n (%) | 31-40, n (%) | 41-50, n (%) | 51-60, n (%) | 61-70, n (%) | 71-80, n (%) |
|---|---|---|---|---|---|---|---|
AL-амилоидоз |
| - | 2 (4) | 10 (22) | 13 (28) | 12 (26) | 9 (20) |
| 46 | 12(26) | 34 (74) | ||||
крио-ГН HCV+ |
| - | 6 (30) | 5 (25) | 6 (30) | 2 (10) | 1 (5) |
| 20 | 11 (55) | 9 (45) | ||||
ХГН |
| 5 (12,5) | 6 (15) | 6 (15) | 17 (42,5) | 6 (15) | - |
| 40 | 17 (42,5) | 23 (57,5) | ||||
БОЛЦ | 4 |
|
| 2 (50) | 2 (50) |
|
|
|
| 2(50) | 2 (50) | ||||
cast-нефропатия | 3 |
|
| 1 (33) |
|
| 2 (67) |
|
| 1(33) | 2 (67) | ||||
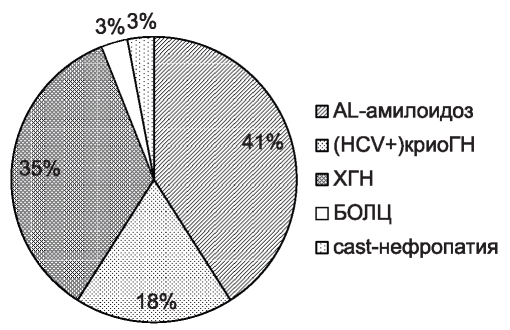
Рис. 3. Нозологические формы поражения почек среди больных нефрологического отделения с МГ
Figure 3. Monoclonal gammopathy of renal significance associated renal lesions.
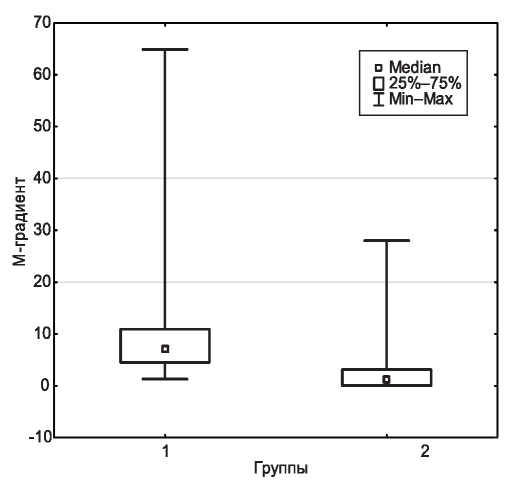
Рис. 4. Средняя величина М-градиента у больных ненефроло- гического (группа 1) и нефрологического (группа 2) профиля.
Figure 4. Median of MG in patients of Nephrology (group 1) and non-Nephrology (group 2).
Таблица 3 / Table 3
Распределение больных ненефрологического (группа 1) и нефрологического (группа 2) профиля по величине М-градиента
M-gradient levels in Nephrology (group 1) and non-Nephrology (group 2) patients
Величина М-градиента, г/л | Группа 1 (n=61) | Группа 2 (n=113) |
|---|---|---|
< 1 | - | 52 (46 %) |
1-5 | 17 (28 %) | 45 (40 %) |
5-10 | 24 (39 %) | 11 (10 %) |
10-15 | 9 (15 %) | 4 (3 %) |
>15 | 11 (18 %) | 1 (1 %) |
Таблица 4 / Table 4
Распределение больных нефрологического (группа 2) профиля с величиной М-градиента менее 1 г/л
The distribution nephrological patients (group 2) with an M-gradient value of less than 1 g/l
Величина М-градиента, мг/л | Группа 2 (М-градиент < 1 г/л) (n=52) |
|---|---|
< 50 | 3 (6 %) |
50-100 | 32 (62 %) |
100-500 | 10 (19 %) |
500-1000 | 7 (13 %) |
Высокие значения МГ (более 15 г/л) в группе 1 были констатированы у 11 (18 %) из 61 больного, в группе 2 - только у 1 (1 %) среди 113 больных (табл. 3, 4).
При анализе нозологической принадлежности больных группы 1 установлено, что высокое (>15 г/л) значение М-градиента имели половина из 16 больных с впервые диагностированными в условиях терапевтического стационара гематологическими В-лимфоцитарными опухолевыми заболеваниями (7 с ММ и 1 с В-клеточной неход- жкинской лимфомой - В-НХЛ), но также и 3 больных (1 с СКВ, 1 с ревматоидным артритом - РА и 1 с хроническим панкреатитом), у которых связь заболевания, послужившего причиной поступления в терапевтический стационар, с гематологической опухолью не была подтверждена.
У остальных 50 (82 %) больных (группа 1), включая 9 больных с впервые диагностированными В-лимфоцитарными опухолями (6 с ММ, 2 с MW, 1 с В-НХЛ), выявлялась МГ меньшей величины (< 15 г/л), по объему соответствующей MGUS.
Напротив, у основной части больных нефроло- гического профиля (группа 2) у 97 (86 %) из 113 величина МГ была < 5 г/л, причем у 52 (46 %) из них - < 1 г/л (такие значения не зафиксированы ни у одного ненефрологического больного - группа 1), еще 11 (10 %) имели величину МГ 5-10 г/л, и только у 5 больных определены значения >10 г/л (табл. 3, 4).
Среди этих 5 больных у одного диагностирована редкая патология - TEMPI-синдром (телеангиоэктазия, эритроцитоз, моноклональная гаммапатия, периренальный отек, внутрилегочное шунтирование в сочетании с IgA-нефропатией), у 3 больных - первичный AL-амилоидоз (связь с ММ не была доказана). У одной больной с наиболее высокой МГ (28 г/л) диагностирована СКВ с торпидным течением волчаночного нефрита 5-го класса.
У 3 больных группы 2 с cast-нефропатией, характерной формой поражения почек при ММ, которая впервые была диагностирована нами в не- фрологическом отделении терапевтического стационара, МГ по величине соответствовала также MGUS (5,52, 5,13, 5,0 г/л соответственно ).
У 4 больных с установленной БОЛЦ, как и у большинства больных группы 2, была выявлена МГ малой величины (<1 г/л - у 3 больных, 3,2 г/л - у 1).
ОБСУЖДЕНИЕ
В настоящее время появились все основания считать MGUS не только гематологической, но скорее общетерапевтической проблемой. Так, в крупном исследовании L.M. Doyle и соавт. (2009) среди 70 % пациентов без анамнеза гематологического заболевания, кому по разным показаниям был проведен электрофорез белков сыворотки, у 3 % была диагностирована MGUS и только у 1 % - лимфоплазмоцитарные злокачественные опухоли, при этом у большинства (81 %) тесты на М-градиент назначались не гематологами [8].
Полученные нами данные, основанные на сплошной выборке больных с МГ среди общего числа больных, госпитализированных в течение 4 лет в многопрофильный терапевтический стационар по признаку какого-либо терапевтического заболевания, в целом, отражают закономерность, отмеченную в популяционных исследованиях [9, 10]. В этих работах авторы выявили преимущественно среди лиц старше 50 лет «асимптоматическую» МГ (без клинических признаков гематологической патологии на момент исследования), которую они обозначили как моноклональную гаммапатию неопределенного значения (MGUS).
Проведенный нами анализ возрастного состава больных с МГ как в 1-й, так и во 2-й группе подтвердил общую тенденцию к увеличению риска выявления МГ среди лиц более старшего возраста [1, 9] и ее высокую распространенность среди населения, значительно превышающую частоту ассоциированных с МГ неоплазм, вместе взятых [1-3].
Анализ характера терапевтической патологии у наблюдаемого нами 61 больного группы 1 с МГ, исключая больных с вновь выявленными В-лимфоцитарными опухолевыми заболеваниями, не дал основания для предположения о патогенетической связи между ними. Однако обнаружение у больных многопрофильного терапевтического стационара сопутствующей MGUS заслуживает пристального внимания и требует динамического наблюдения, учитывая тот факт, что MGUS, как было доказано двумя независимыми эпидемиологическими исследованиями [10, 11], практически всегда предшествует за несколько лет развитию ММ и других опухолей и у части больных может вызывать неопухолевые поражения органов и тканей, в частности заболевания почек.
При этом риск прогрессирования гаммапатии в overt В-клеточные лимфоцитарные опухоли не исчезает даже спустя 25-30 лет после диагностики MGUS, поэтому пациенты с выявленной MGUS должны наблюдаться фактически пожизненно (интервал от диагноза до прогрессирования в ММ составляет от 1 до 32 лет , в среднем - 10,6 года) [3, 12]. Больным рекомендуют проводить клинико-лабораторное обследование через 6 месяцев после инициального диагноза (вероятность прогрессирования особенно высока в течение первого года), а затем с периодичностью в 3-5 лет или ежегодно в зависимости от стратификации риска прогрессирования, включая полный анализ крови, уровень в сыворотке крови кальция, креа- тинина, сывороточные (или при необходимости мочевые) тесты на М-градиент [13].
По данным нашего исследования, у 18 % больных ненефрологического профиля МГ была выше 15 г/л, у всех были диагностированы гематологические опухоли - ММ, MW и В-клеточная лимфома. У 82 % больных МГ не превышала 15 г/л, т.е. отвечала критериям олигосекреторной моноклональной гаммапатии неопределенного значения (MGUS). Из них у 6 были выявлены гематологические опухоли, что согласуется с современными требованиями к диагностике этих опухолей, допускающими любой уровень МГ и содержания моноклональных плазматических клеток в костном мозге, но при этом с обязательным учетом конечных органных повреждений (при ММ - CRAB- критериев). Группой исследователей из клиники Mayo были предложены критерии стратификации риска прогрессирования MGUS. Низкий риск (2 % в течение 20 лет) оценивается при величине М-протеина в сыворотке <15г/л, IgG-типе моноклональной интактной МГ, нормальном κ/λ- отношении моноклональных свободных легких цепей. Риск оценивают как высокий (27 % в течение 20 лет), когда имеется анормальное отношение κ/λ свободных легких цепей в комбинации с IgM- и IgA-типами интактной МГ, величиной МГ > 15г/л и обнаружением костных нарушений при МРТ, а также выявлением плазмоцитов в периферической крови [14, 15]. Нами отмечена статистически значимая прямая связь величины МГ у больных ненефрологического профиля с уровнем общего белка, гамма-глобулинов сыворотки крови и величиной СОЭ и обратная - с концентрацией гемоглобина. Полученные результаты, по нашему мнению, обосновывают целесообразность учета этих факторов при определении показаний к проведению скрининга на наличие MGUS.
Спектр нозологических форм поражения почек, протекающих с МГ, у нефрологических больных в нашем исследовании включал первичный системный AL-амилоидоз (большая доля больных с AL-амилоидозом в данном наблюдении может быть объяснена научным интересом кафедры и клиники к этой проблеме), криоглобулинеми- ческий ГН (как правило, HCV-положительный), ХГН, значительно реже (у 3 %) - БОЛЦ с поражением почек, и в порядке дифференциального диагноза может выявляться cast- нефропатия, как проявление ММ.
Патогенетическая связь AL-амилоидоза, крио- глобулинемического гломерулонефрита и БОЛЦ с моноклональными белками достаточно хорошо установлена, в то же время значение моноклональных белков в развитии ХГН стало изучаться лишь в последние годы, как одна из новых проблем МГ неопухолевой природы. Менее тесная связь с возрастом больных при МГ, ассоциированных с ХГН и (HCV+) криоглобулинемическим ГН, может быть объяснена с современных позиций тем, что в генезе этих форм неопухолевого поражения почек ведущую роль отводят иммуновоспалительному нефропатогенному потенциалу моноклональных белков, а не возрастному фактору [6, 16, 17].
При оценке распределения больных в двух группах по величине МГ оказалось, что по сравнению с группой больных ненефрологического профиля у больных нефрологического отделения зафиксированы более низкие (< 1 г/л) значения МГ, представляющей собой возможно особую «не- фрологическую» форму MGUS. Выявление этой олигосекреторной формы оказалось возможным вследствие применения во 2-й группе больных более чувствительных и специфичных методов ее оценки - иммунофиксации и Freelite. Их разрешающая способность достаточна для выявления всех вариантов МГ, в том числе, отвечающих критериям MGUS [18]. В своем исследовании N. Steiner et al. (2018) [7], сравнив среди 2935 пациентов с MGUS группы с поражением почек (MGRS) и без них, показали больший риск прогрессии в ММ пациентов с MGRS (18 % против 3 %, р<0,001), что было подтверждено в Cox-модели (HR 3,3 [1,57,4]. Риск прогрессии в первый год после установления диагноза составил 1 % [0,6-1,4] среди пациентов с MGUS и 10 % [4-29] среди MGRS пациентов. Приведенные данные литературы и наши собственные результаты еще раз подчеркивают важность мониторирования группы больных с выявленной MGUS в соответствии с критериями стратификации риска и обосновывают применение у больных с МГ и поражением почек таргетной терапии, направленной на подлежащий клон плазмоцитов или В-лимфоцитов.
ЗАКЛЮЧЕНИЕ
Моноклональная гаммапатия неопределенного значения (MGUS) изучалась, главным образом, как предопухолевое состояние, практически всегда предшествующее множественной миело- ме и другим секретирующим В-лимфоцитарным гематологическим опухолям. Полученные нами результаты подтверждают важное значение исследования на наличие MGUS у пациентов терапевтического и особенно нефрологического профиля. Широкое внедрение во врачебную практику высокочувствительных методов скрининга на выявление MGUS, включая Freelite, расширяет возможности диагностики этих состояний и установления этиологии ассоциированного с МГ поражения почек С другой стороны - установление связи почечного поражения с MGUS имеет значение для обоснования и выбора конкретной схемы таргетной терапии, направленной на эрадикацию В-клеточного лимфоцитарного клона, вырабатывающего моноклональные белки или их фрагменты с нефротоксическим действием.
Список литературы
1. Kyle R, Rajkumar S/ Monoclonal gammopathy of undetermined significance and smouldering multiple myeloma: emphasis on risk factors for progression. Br J Haematol 2007; 139(5):730– 743. Doi: 10.1111/j.1365-2141.2007.06873.x
2. Zingone A, Kuehl M. Pathogenesis of monoclonal gammopathy of undetermined significance (MGUS) and progression to multiple myeloma. Semin Hematol 2011; 48(1):4–12. Doi: 10.1053/j.seminhematol.2010.11.003
3. Landgren O, Iskander K. Modern multiple myeloma therapy: deep, sustained treatment response and good clinical outcomes. J Intern Med 2017; 281(4): 365–382. Doi: 10.1111/joim.12590
4. Nasr S, Satoskar A, Markowitz G et al. Proliferative glomeru-lonephritis with monoclonal IgG deposits. J Am Soc Nephrol 2009; 20: 2055–2064. Doi: 10.1681/ASN.2009010110
5. Merlini G, Palladini G. Differential diagnosis of monoclonal gam-mopathy of undetermined significance. Hematology. Am Soc Hematol Educ Program 2012; 2012: 595–603. Doi: 10.1182/ asheduca-tion-2012.1.595
6. Sethi S, Rajkumar SV. Monoclonal gammopathy-associated proliferative glomerulonephritis. Mayo Clin Proc 2013; 88(11): 1284–1293. Doi: 10.1016/j.mayocp.2013.08.002
7. Steiner N, Göbel G, Suchecki P et al. Monoclonal gammopathy of renal significance (MGRS) increases the risk for progression to multiple myeloma: an observational study of 2935 MGUS patients. Oncotarget 2017; 9(2): 2344–2356. Doi:10.18632/ oncotarget.23412
8. Doyle LM, Gundrum JD, Farnen JP et al. Determining why and which clinicians order serum protein electrophoresis (SPEP), subsequent diagnoses based on indications, and clinical significance of routine follow-up: a study of patients with monoclonal gammopathy of undetermined significance (MGUS). Blood 2009; 114. Abstract 4883
9. Kyle RA, Therneau TM, Rajkumar SV et al. Long-term follow-up of 241 patients with monoclonal gammopathy of undetermined significance: the original Mayo Clinic series 25 years later. Mayo Clin Proc 2004; 79(7):859–866. Doi: 10.1016/S0025-6196(11)62151-4
10. Landgren O, Kyle RA, Pfeiffer RM et al. Monoclonal gammopathy of undetermined significance (MGUS) consistently precedes multiple myeloma: A prospective study. Blood 2009; 113: 5412–5417. Doi: 10.1182/blood-2008-12-194241
11. Weiss BM, Abadie J, Verma P et al. A monoclonal gammopathy precedes multiple myeloma in most patients. Blood 2009; 113: 5418–5422. Doi: 10.1182/blood-2008-12-195008
12. Kyle RA. Monoclonal gammopathy of undetermined significance: natural history in 241 cases. Am J Med 1978;64:814–826
13. Go RS, Heien HC, Sangaralingham LR et al. Risk of progression of monoclonal gammopathy of undetermined significance into lymphoplasmacytic malignancies: determining demographic differences in the USA. Haematologica 2018; 103(3): e123–e125. Doi: 10.3324/haematol. 2017.179978
14. Rajkumar SV, Kyle RA, Therneau TM et al. Serum free light chain ratio is an independent risk factor for progression in monoclonal gammopathy of undetermined significance. Blood 2005; 106: 812–817. Doi: 10.1182/blood-2005-03-1038
15. Dispenzieri A, Katzmann JA, Kyle RA et al. Prevalence and risk of progression of light-chain monoclonal gammopathy of undetermined significance: A retrospective population-based cohort study. Lancet. 2010; 375: 1721–1728. Doi: 10.1016/S0140-6736(10)60482-5
16. Leung N, Bridoux F, Hutchison CA et al. Monoclonal gammopathy of renal significance: when MGUS is no longer undetermined or insignificant. Blood 2012; 120 (22): 4292–4295. Doi: 10.1182/ blood-2012-07-445304
17. Kapoulas S, Raptis V, Papaioannou M. New aspects on the pathogenesis of renal disorders related to monoclonal gammopathies. Nephrol Ther 2015; 11(3): 135–143. Doi: 10.1016/j. nephro.2014.12.005
18. Katzmann J, Kyle R, Benson J et al. Screening panels for detection of monoclonal gammopathies. Clin Chem 2009; 55 (8): 1517–1522. Doi:10.1373/clinchem.2009.126664
Об авторах
Л. В. ЛысенкоРоссия
кафедра внутренних, профессиональных болезней и ревматологии медико-профилактического факультета
Н. В. Чеботарева
Россия
Доц., кафедра внутренних, профессиональных болезней и ревматологии медико-профилактического факультета
Н. Н. Мрыхин
Россия
клиникодиагностическая лаборатория с экспресс-диагностикой УКБ №3, врач клинической лабораторной диагностики
В. В. Рамеев
Россия
Доц., кафедра внутренних, профессиональных болезней и ревматологии медико-профилактического факультета
Т. В. Андросова
Россия
кафедра внутренних, профессиональных болезней и ревматологии медикопрофилактического факультета, ассистент
В. В. Варшавский
Россия
кафедра патологической анатомии лечебного факультета
И. Н. Когарко
Россия
отдел динамики химических и биологических процессов, ведущий научный сотрудник
С. В. Рощупкина
Россия
клиника нефрологии, внутренних болезней и ревматологии Университетской клинической больницы №3, заведующая отделением нефрологии
Рецензия
Для цитирования:
Лысенко Л.В., Чеботарева Н.В., Мрыхин Н.Н., Рамеев В.В., Андросова Т.В., Варшавский В.В., Когарко И.Н., Рощупкина С.В. ЗНАЧИМОСТЬ ВЫЯВЛЕНИЯ МОНОКЛОНАЛЬНОЙ ГАММАПАТИИ У БОЛЬНЫХ НЕФРОЛОГИЧЕСКОГО ПРОФИЛЯ. Нефрология. 2019;23(2):82-90. https://doi.org/10.24884/1561-6274-2019-23-2-82-90
For citation:
Lysenko L.B., Chebotareva N.V., Mrykhin N.N., Rameev V.V., Androsova T.V., Varshavsky V.V., Kogarko I.N., Roshchupkina S.V. DETERMINING OF MONOCLONAL GAMMOPATHY IN NEPHROLOGICAL PATIENTS. Nephrology (Saint-Petersburg). 2019;23(2):82-90. (In Russ.) https://doi.org/10.24884/1561-6274-2019-23-2-82-90
JATS XML








































