Перейти к:
ЭКСПРЕССИЯ микроРНК-21 В ПОЧЕЧНОЙ ТКАНИ И МОЧЕ У КРЫС С ОДНОСТОРОННЕЙ ОБСТРУКЦИЕЙ МОЧЕТОЧНИКА
https://doi.org/10.24884/1561-6274-2017-21-1-46-51
Аннотация
ЦЕЛЬ: оценить уровень экспрессии микроРНК-21 в ткани почек и моче крыс с односторонней обструкцией мочеточника (ООМ). МАТЕРИАЛЫ И МЕТОДЫ. ООМ вызывали путем перевязки левого мочеточника у крыс-самцов линии Wistar (n=10). Срок наблюдения составил 14 сут после моделирования ООМ. Собирали мочу накануне оперативного вмешательства (UmiRNA21 C ) и за сутки до окончания эксперимента (UmiRNA21 ), в течение 24 ч. При выведении животного из эксперимента производили забор пробы мочи из лоханки левой почки (UmiRNA21 I ) и образцов ткани левой (KmiRNA21 O ) и правой (KmiRNA21 I ) почек. Экспрессию миРНК-21 в ткани почек и моче определяли при помощи реакции амплификации (RealTime PCR-протокол). Расчет проводился по методу 2-deltaCt. . Статистическую обработку проводили с применением критерия Вилкоксона и коэффициента корреляции Спирмена. Результаты представлены как медиана [нижний – верхний квартиль]. РЕЗУЛЬТАТЫ. UmiRNA21 I -deltaCt (3,78[2,0–5,28]) и UmiRNA21 O (3,78[3,25–3,82]) оказались значимо выше, чем UmiRNA21 C (1,15[0,71–1,74]; р=0,0125 и р=0,0069, respectively). Величины UmiRNA21 оказались практически одинаковыми. В почках с ООМ тканевой уровень экспрессии миРНК-21 был несколько выше, чем в контралатеральном органе (р=0,0926). Выявлена значимая прямая корреляция между KmiRNA (Rs=0,770, р=0,0092). ЗАКЛЮЧЕНИЕ. ООМ вызывает специфические изменения в экспрессии, распределении и выведении миРНК-21. Однако механизмы активации при почечной патологии данной миРНК и ее роль в развитии почечного тубулоинтерстициального фиброза требует дальнейших исследований
Для цитирования:
Каюков И.Г., Смирнов А.В., Кучер А.Г., Парастаева М.М., Береснева О.Н., Зарайский М.И., Иванова Г.Ю. ЭКСПРЕССИЯ микроРНК-21 В ПОЧЕЧНОЙ ТКАНИ И МОЧЕ У КРЫС С ОДНОСТОРОННЕЙ ОБСТРУКЦИЕЙ МОЧЕТОЧНИКА. Нефрология. 2017;21(1):46-51. https://doi.org/10.24884/1561-6274-2017-21-1-46-51
For citation:
Kayukov I.G., Smirnov A.V., Kucher A.G., Parastaeva M.M., Beresneva O.N., Zaraiskii M.I., Ivanova C.T. EXPRESSION miRNA-21 IN RENAL TISSUE AND URINE IN RATS WITH UNILATERAL URETERAL OBSTUCTION. Nephrology (Saint-Petersburg). 2017;21(1):46-51. (In Russ.) https://doi.org/10.24884/1561-6274-2017-21-1-46-51
ВВЕДЕНИЕ
МикроРНК - это некодирующие РНК, включающие, в среднем, около 22 пар нуклеотидов. Считается, что эти РНК вовлечены в прогрессирование целого ряда заболеваний [1-6]. Они являются регуляторами экспрессии генов на посттранскрипционном уровне. Более 90% генов у млекопитающих находятся под их контролем.
К настоящему времени в геноме человека описано более 2000 миРНК [7]. миРНК обладают специфичностью экспрессии в отношении тканей и типов клеток. Установлено, что для почек специфическими являются миРНК-146а, миРНК-886, миРНК-192, миРНК-194, миРНК-204, миРНК-215 и миРНК-216, а миРНК-196a/b, миРНК-10а/Ь, миРНК-130, миРНК-146, миРНК-200а, миРНК- 30а-е, миРНК-872 и миРНК-21- высокоспецифичными [8-10]. При этом миРНК-21 довольно обильно экспрессируется и во многих других тканях и клетках человека. Она является наиболее изученной многофункциональной миРНК. Ее ген локализуется в межгенной области хромосомы 17q23,1, размер - 72 пары нуклеотидов, фланкирован белоккодирующим геном TMEM49. Ген миРНК-21 имеет свой собственный промотор и транскрибируется вне зависимости от TMEM49. МиРНК-21- нокаутные мыши являются жизнеспособными, дают потомство и не имеют отличий в гистологии. Эти данные позволили сделать вывод о том, что миРНК-21 не является обязательным компонентом для нормального развития организма [11].
В настоящее время активно изучается возможное участие миРНК в механизмах развития повреждения почечной ткани при различных заболеваниях. При большинстве поражений почек развитие фиброза определяется комплексом механизмов (иммуновоспалительных, метаболических, гемодинамических), точную грань между ролью которых провести невозможно [12]. Однако на конечном этапе формирования фиброза основную роль играет экспрессия провоспалительных и профибротических цитокинов, которые, зачастую, начинают действовать вне зависимости от причин, вызвавших их активацию. Результаты некоторых исследований позволяют предположить, что миРНК-21 играет ведущую роль в развитии эпителиально-мезенхимальной трансформации и ренального фиброза [11, 13-15]. Однако сведений о деталях экспрессии миРНК-21 и ее последствиях в таких ситуациях недостаточно.
В связи с этим целью нашей работы было оценить уровень экспрессии миРНК-21 в ткани почек и моче у крыс Wistar с односторонней обструкцией мочеточника (ООМ) - классической моделью экспериментального тубулоинтерстициального фиброза.
МАТЕРИАЛ И МЕТОДЫ
Для создания экспериментальной модели тубулоинтерстициального фиброза на фоне ООМ были использованы самцы крыс Wistar (n=10) массой 230-250 г (питомник Колтуши РАН).
Методика выполнения оперативного вмешательства. Под общей анестезией - ксилазин (0,05 мл) в сочетании с тилетамин/золазепам (0,3 мл) внутрибрюшинно выполняли перевязку левого мочеточника. На мочеточник накладывали 2 лигатуры (использовали шелк 2/0 Silkam). Участок мочеточника между лигатурами перерезали. Правую почку (с неповрежденным мочеточником) использовали в качестве контроля [16]. Срок наблюдения составил 14 сут после моделирования ООМ.
Накануне оперативного вмешательства и за сутки до окончания эксперимента у крыс, находящихся в метаболической камере, в течение 24 ч собирали мочу для последующего определения экспрессии миРНК-21 (контрольная порция мочи - UmiRNA21C и моча из интактной почки - UmiRNA21I соответственно). При выведении животного из эксперимента у каждой крысы производили забор (с помощью шприца) пробы мочи из лоханки левой почки (моча из почки с обструкцией мочеточника - UmiRNA21O) и образцов ткани левой (KmiRNA21O) и правой (KmiRNA21I) почек для определения экспрессии миРНК-21.
Эксперименты выполняли в соответствии с международными стандартами по работе с лабораторными животными с разрешения этического комитета Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова.
Экспрессия миРНК-21 в ткани почек и моче экспериментальных животных определялась при помощи реакции амплификации (RealTime PCR- протокол). Расчет проводился по методу 2-deltaCt.
Статистическую обработку данных проводили с применением стандартных пакетов программ прикладного статистического анализа (Statistica 10.0 for Windows). Использовали критерий Вил- коксона и коэффициент корреляции Спирмена. Уровень статистической значимости соответствовал р<0,05. Результаты исследования представлены как медиана [нижний - верхний квартиль].
РЕЗУЛЬТАТЫ
Таблица
Матрица корреляций между уровнями относительной экспрессии миРНК-21в моче и почечной ткани у исследованных животных. Коэффициент ранговой корреляции Спирмена. Статистически значимые коэффициенты выделены жирным шрифтом
Коррелируемые показатели | UmiRNA21C | UmiRNA21I | UmiRNA210 | KmiRNA21I | KmiRNA210 |
|---|---|---|---|---|---|
UmiRNA21C | - | -0,067 | 0,043 | -0,213 | -0,249 |
UmiRNA21, | -0,067 | - | -0,448 | -0,236 | -0,212 |
UmiRNA210 | 0,043 | -0,448 | - | 0,067 | 0,117 |
KmiRNA21, | -0,213 | -0,236 | 0,067 | - | 0,770 |
KmiRNA210 | -0,249 | -0,212 | 0,117 | 0,770 | - |
Через 14 дней после оперативного вмешательства экспрессия микроРНК значительно повышалась как в моче из интактной почке (UmiRNA21I: 3,78 [2,0-5,28]), так и в моче из почки с перевязанным мочеточником (UmiRNA21O: 3,78 [3,253,82]) по сравнению с контрольными показателями (UmiRNA21O: 1,15 [0,71-1,74], р = 0,0125 и р= 0,0069 соответственно; рис. 1, 2). Уровни относительной экспрессии миРНК-21 в моче из неповрежденных почек и органов с обструкцией мочеточника на 14-е сутки эксперимента были практически одинаковыми (р = 0,953).
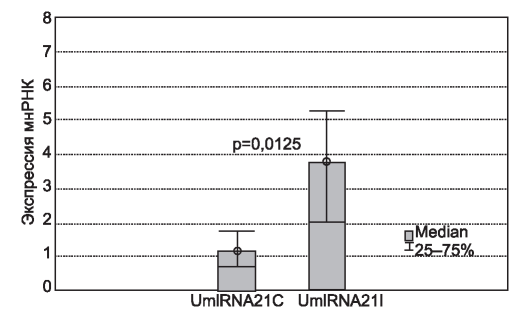
Рис. 1. Экспрессия миРНК-21 в контрольной порции мочи и моче из интактной почки.
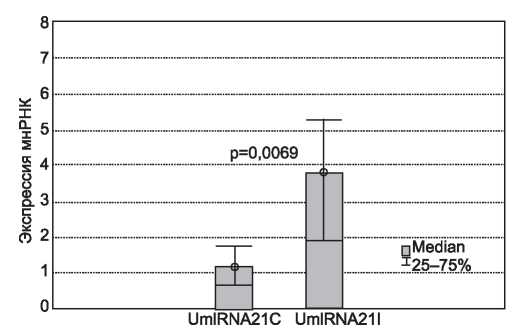
Рис. 2. Экспрессия миРНК-21 в контрольной порции мочи и моче из почки с обструкцией мочеточника.
В тканях почек с обструкцией мочеточника уровень экспрессии миРНК-21 (19,22 [4,9245,25]) был больше, чем в неповрежденном органе (9,38 [0,66-27,86]). Однако эти различия не достигали статистической значимости (р = 0,0926).
Была выявлена прямая корреляция между уровнями экспрессии миРНК-21 в тканях почек с обструкцией мочеточника и интактных почках (Rs = 0,770, р = 0,0092).
Все остальные изученные ассоциации оказались статистически не значимыми (таблица).
ОБСУЖДЕНИЕ
В настоящей работе в моче и почечной ткани крыс с ООМ, как и во многих экспериментальных исследованиях механизмов развития почечного фиброза, выявлялось повышение экспрессии миРНК [13,17]. Более того, в нашей предыдущей работе у пациентов с различными нефропатиями также была обнаружена более высокая мочевая экспрессия миРНК-21, чем у здоровых лиц. При этом у больных с большей выраженностью тубулярной атрофии величина экспрессии миРНК-21 в моче оказалась выше [18].
Установлено, что при повреждении тканей, особенно при инфаркте миокарда [19, 20] и остром повреждении почек [21], миРНК-21 является одной из наиболее активируемых. Длительная избыточная активация миРНК-21 ведет к разрастанию соединительной ткани. Этот факт подтвержден в целом ряде моделей сердечного [22], легочного [23] и почечного [15, 24] фиброза. В то же время, введение олинуклеотидов - ингибиторов миРНК-21 замедляет процессы фиброзирования тканей [15, 24].
Молекулярные механизмы, через которые миРНК-21 приводит к развитию фиброза, в последние годы активно изучаются. Одним из таких механизмов является TGFβ/Smad-система, которая стимулирует нуклеарный фактор транскрипции NFkB, который, в свою очередь, опосредует выработку провоспалительных цитокинов, прежде всего, фактора некроза опухолей α (TNF-α) и интерлейкина-1β (IL-Χβ) [4, 14, 15, 24].
Не вызывает сомнения, что TGFβ1 является ключевым медиатором прогрессирования почечного фиброза [25, 26].
В наших предыдущих работах на крысах с ООМ также было выявлено повышение активности как нуклеарного фактора транскрипции NFkB, так и TGFβ1 в почечной ткани [4, 27]. TGFβ1 и его изоформы (TGFβ2 и TGFβ3) синтезируются многими клетками, включая все типы клеток почек, и секретируются в виде латентных предшественников. Связывание активированного TGFβ со своим рецептором приводит к фосфорилированию ряда Smad (Sma and Mad related proteins)-белков, а именно активируемых рецептором Smads (R- Smads). R-Smads затем связываются с так называемым общим Smad-белком (Smad 4), образуя гетеродимерный комплекс. Этот комплекс проникает в ядро, где связываясь с SBE-элементами (Smad binding element) промотерных участков генов-мишеней, регулирует транскрипцию. Так, одно исследование показало, что R-Smads в фи- бробластах, гладкомышечных клетках сосудов, эпителиальных клетках канальцев связываются с SBE-элементом, расположенном в промоторе гена миРНК-21, запуская таким образом транскрипцию ее предшественников [24, 28]. миРНК-21 в свою очередь подавляет Smad 7, который является ингибитором TGFβ/Smad-пути. Возможны также и другие механизмы, при помощи которых миРНК-21 способствует прогрессированию фиброза, например, активация ERK/MAP-киназы [22].
Необходимо отметить, что уровень экспрессии миРНК-21 в моче значимо повышается при нарастании выраженности атрофии канальцев от незначительной до умеренной. При этом в экспериментальных работах показано, что наибольшая экспрессия миРНК-21 характерна для эпителиальных клеток канальцев [15]. Почечный фиброз характеризуется апоптозом и некрозом тубулярных клеток, лейкоцитарной инфильтрацией, пролиферацией тубулоинтерстициальных фибробластов и накоплением интерстициального матрикса [24] и является конечной стадией повреждения почек.
Полученные данные, по крайней мере, не противоречат предположению о том, что ООМ может активировать экспрессию миРНК-21 в почечной ткани, что далее модулирует деятельность миРНК-21-ассоциированных сигнальных путей формирования почечного фиброза. Однако особенностью результатов настоящего исследования является обнаружение того, что односторонняя перевязка мочеточника приводит к нарастанию экспрессии миРНК-21 в моче не только из поврежденной, но и из интактной контралатеральной почки. При этом уровни такой экспрессии оказываются практически идентичными. Отмечены также тенденция к более высоким значениям активации миРНК-21 в почке с ООМ по сравнению с интактной и статистически значимая прямая связь между этими показателями. Все это позволяет несколько расширить взгляды о механизмах индукции экспрессии миРНК в условиях патологии, но не дает ответа на существенный вопрос: какой механизм лежит в основе усиления экспрессии миРНК-21 в моче, полученной из контралатеральной почки? Возможно, в таких условиях эта миРНК из почки с обструкцией высвобождается в системный кровоток и далее попадает в контралатеральный орган и в мочу. Однако такая интерпретация встречает существенное препятствие. Как тогда объяснить отсутствие значимых связей между экспрессией миРНК-21 в почечной ткани и моче? Не исключено, например, что использованное экспериментальное воздействие вообще приводит к усилению экспрессии миРНК-21 на системном уровне за счет неустановленных механизмов. Очевидно, что данные проблемы требуют дополнительного изучения. Тем не менее, стоит иметь в виду, что полученные данные призывают проявить осторожность к использованию мочевой экспрессии миРНК-21, как маркера повреждения почек (почечного фиброза) в клинике. Такая настороженность должна сохраняться, по крайней мере, до тех пор, пока маркерная роль мочевой миРНК-21 не будет четко доказана не только в экспериментальных, но и клинических исследованиях.
ЗАКЛЮЧЕНИЕ
Таким образом, односторонняя обструкция мочеточника вызывает специфические изменения в экспрессии, распределении и выведении миРНК-21. Однако механизмы активации при почечной патологии данной миРНК и ее роль в развитии почечного тубулоинтерстициального фиброза требуют дальнейших исследований.
Список литературы
1. Kataoka M, Wang DZ. Non-Coding RNAs Including miRNAs and lncRNAs in Cardiovascular Biology and Disease. Cells 2014; 3(3): 883-898
2. Condorelli G, Latronico MV, Cavarretta E. microRNAs in cardiovascular diseases: current knowledge and the road ahead. J Am Coll Cardiol 2014; 63(21): 2177-2187
3. Gharipour M, Sadeghi M. Pivotal role of microRNA-33 in metabolic syndrome: A systematic review. ARYA Atheroscler 2013; 9(6): 372-376
4. Смирнов АВ, Кучер АГ, Добронравов ВА и др. Диетарный соевый протеин замедляет развитие интерстициального почечного фиброза у крыс с односторонней обструкцией мочеточника: введение в нутритивную эпигеномику. Нефрология 2012; 16(4):75-83 [Smirnov AV, Kucher AG, Dobronravov VA i dr. Dietarnyi soevyi protein zamedljаet razvitie intersticial’nogo pochechnogo fibroza u krys s odnostoronnei obstrukciei mochetochnika: vvedenie v nutritivnuyu yеpigenomiku. Nefrologijа 2012; 16(4):75-83]
5. Adams BD, Kasinski AL, Slack FJ. Aberrant Regulation and Function of MicroRNAs in Cancer. Curr Biol 2014; 24(16): R762-R776
6. Qingqing W, Qing-Sheng M, Zheng D. The regulation and function of microRNAs in kidney diseases. IUBMB Life 2013; 65(7): 602–614
7. Kozomara A, Griffiths-Jones S. miRBase: integrating microRNA annotation and deep-sequencing data. Nucleic Acids Res 2011; 39: D152-157
8. Landgraf P, Rusu M, Sheridan R et al. A mammalian microRNA expression atlas based on small RNA library sequencing. Cell 2007; 129(7): 1401-1414
9. Sun Y, Koo S, White N et al. Development of a micro-array to detect human and mouse microRNAs and characterization of expression in human organs. Nucleic Acids Res 2004; 32(22): e188
10. Chandrasekaran K, Karolina DS, Sepramaniam S et al. Role of microRNAs in kidney homeostasis and disease. Kidney Int 2012; 81(7): 617-627
11. Kumarswamy R, Volkmann I, Thum T. Regulation and function of miRNA-21 in health and disease. RNA Biol 2011; 8(5): 706–713
12. Lan HY. Diverse Roles of TGF-β/Smads in Renal Fibrosis and Inflammation. Int J Biol Sci 2011; 7(7): 1056–1067
13. Duffield JS, Grafals M, Portilla D. MicroRNAs are potential therapeutic targets in fibrosing kidney disease: lessons from animal models. Drug Discov Today Dis Models 2013; 10(3):e127-e135
14. Patel V, Noureddine L. MicroRNAs and fibrosis. Curr Opin Nephrol Hypertens 2012; 21(4): 410–416
15. Zarjou A, Yang S, Abraham E,Agarwal A et al. Identification of a microRNA signature in renal fibrosis: role of miR-21. Am J Physiol Renal Physiol 2011; 301(4): F793–F801
16. Береснева ОН, Парастаева ММ, Иванова ГТ и др. Влияние метформина на формирование тубулоинтерстициального фиброза у крыс. Нефрология 2014; 19(6): 45-48 [Beresneva ON, Parastaeva MM, Ivanova GT i dr. Vlijаnie metformina na formirovanie tubulointersticial’nogo fibroza u krys. Nefrologijа 2014; 19(6): 45-48]
17. Chung AC, Lan HY. MicroRNAs in renal fibrosis. Front Physiol 2015; 6:50. doi: 10.3389/fphys.2015.00050
18. Cмирнов АВ, Карунная АВ, Зарайский МИ и др. Экспрессия микроРНК-21 в моче у пациентов с нефропатиями. Нефрология 2014; 18(6): 59-63 [Smirnov AV, Karunnaya AV, Zarayskiy MI i dr. Ekspressiya mikroRNK-21 v moche u patsientov s nefropatiyami. Nefrologiya 2014; 18(6): 59-63]
19. D’Alessandra Y, Devanna P, Limana F et al. Circulating microRNAs are new and sensitive biomarkers of myocardial infarction. Eur Heart J 2010; 31(22): 2765–2773
20. Shi B, Guo Y, Wang J, Gao W. Altered expression of microRNAs in the myocardium of rats with acute myocardial infarction. BMC Cardiovasc Disord 2010; 10:11
21. Godwin JG, Ge X, Stephan K et al. Identification of a microRNA signature of renal ischemia–reperfusion injury. Proc Natl Acad Sci USA 2010; 107: 14339–14344
22. Thum T, Gross C, Fiedler J et al. MicroRNA-21 contributes to myocardial disease by stimulating MAP kinase signalling in fibroblasts. Nature 2008; 456: 980–984
23. Liu G, Friggeri A, Yang Y et al. miR-21 mediates fibrogenic activation of pulmonary fibroblasts and lung fibrosis. J Exp Med 2010; 207: 1589–1597
24. Zhong X, Chung AC, Chen HY et al. Smad3-mediated upregulation of miR-21 promotes renal fibrosis. J Am Soc Nephrol 2011; 22: 1668–1681
25. Bottinger EP. TGF-beta in renal injury and disease. Semin Nephrol 2007; 27: 309-320
26. Wang W, Koka V, Lan HY. Transforming growth factor-beta and Smad signalling in kidney diseases. Nephrology (Carlton) 2005;10(1):48-56
27. Смирнов АВ, Иванова ГТ, Береснева ОН и др. Экспериментальная модель интерстициального почечного фиброза. Нефрология 2009; 13(4): 70-74 [Smirnov AV, Ivanova GT, Beresneva ON i dr. Yeksperimental’najа model’ intersticial’nogo pochechnogo fibroza. Nefrologijа 2009; 13(4): 70-74]
28. Davis BN, Hilyard AC, Lagna G, Hata A. SMAD proteins control DROSHA-mediated microRNA maturation. Nature 2008;454:56–61
Об авторах
И. Г. КаюковРоссия
Профессор Каюков Иван Глебович
Научно-исследовательский институт нефрологии, лаборатория клинической физиологии почек, заведующий.
197022, Россия, Санкт-Петербург, ул. Л. Толстого, д. 17, корп. 54.
А. В. Смирнов
Россия
Профессор Смирнов Алексей Владимирович
Научно-исследовательский институт нефрологии, директор.
197022, Россия, Санкт-Петербург, ул. Л. Толстого, д. 17,
корп. 54.
А. Г. Кучер
Россия
Профессор Кучер Анатолий Григорьевич
Научно-исследовательский институт нефрологии, заместитель директора.
197022, Россия, Санкт-Петербург, ул. Л. Толстого, д. 17
М. М. Парастаева
Россия
Парастаева Марина Магрезовна, кандидат биологических наук, старший научый сотрудник.
Научно-исследовательский институт нефрологии, лаборатория клинической физиологии почек
197022, Россия, Санкт-Петербург, ул. Л. Толстого, д. 17, корп. 54.
О. Н. Береснева
Россия
Береснева Ольга Николаевна, кандидат биологических наук, старший научый сотрудник.
Научно-исследовательский институт нефрологии, лаборатория клинической физиологии почек
197022, Россия, Санкт-Петербург, ул. Л. Толстого, д. 17, корп. 54.
М. И. Зарайский
Россия
Профессор Зарайский Михаил Игоревич.
Научно-методический центр по молекулярной медицине МЗ РФ, лаборатория молекулярной диагностики, зав. лабораторией.
197022, Россия, Санкт-Петербург, ул. Л. Толстого, д. 6–8, корп. 28.
Г. Ю. Иванова
Россия
Иванова Галина Тажимовна, кандидат биологических наук, старший научный сотрудник.
Лаборатория экспериментальной и клинической кардиологии
199034, Россия, Санкт-Петербург, наб. Макарова, д. 6
Рецензия
Для цитирования:
Каюков И.Г., Смирнов А.В., Кучер А.Г., Парастаева М.М., Береснева О.Н., Зарайский М.И., Иванова Г.Ю. ЭКСПРЕССИЯ микроРНК-21 В ПОЧЕЧНОЙ ТКАНИ И МОЧЕ У КРЫС С ОДНОСТОРОННЕЙ ОБСТРУКЦИЕЙ МОЧЕТОЧНИКА. Нефрология. 2017;21(1):46-51. https://doi.org/10.24884/1561-6274-2017-21-1-46-51
For citation:
Kayukov I.G., Smirnov A.V., Kucher A.G., Parastaeva M.M., Beresneva O.N., Zaraiskii M.I., Ivanova C.T. EXPRESSION miRNA-21 IN RENAL TISSUE AND URINE IN RATS WITH UNILATERAL URETERAL OBSTUCTION. Nephrology (Saint-Petersburg). 2017;21(1):46-51. (In Russ.) https://doi.org/10.24884/1561-6274-2017-21-1-46-51
JATS XML








































