Перейти к:
РЕГЕНЕРАТИВНЫЕ СТРАТЕГИИ РЕКОНСТРУИРОВАНИЯ ПОЧКИ
Аннотация
Почка является важнейшим органом водного гомеостаза и экскреции токсических субстанций. Она выполняет несколько важных физиологических функций для обеспечения гомеостаза: удаляет циркулирующие продукты метаболизма, регулирует баланс жидкости в организме и действует как иммунный регулятор, а также модулятор нормального функционирования сердечно-сосудистой системы. В самое последнее время появились и активно развиваются модели почечных заболеваний in vitro с плюрипотентными стволовыми клетками (как стволовыми клетками человеческого эмбриона, так и индуцированными плюрипотентными стволовыми клетками), а также разрабатываются надежные протоколы по получению in vitro клеток, подобных специфичным ренальным, из индуцированных плюрипотентных стволовых клеток пациента. В данном обзоре мы приводим главные открытия в области регенерации почки с основным фокусом на развитие пошаговых протоколов по созданию почечных клеток из человеческих плюрипотентных стволовых клеток и самые последние достижения в области биоинжиниринга почки (т.е. децеллюляризированного почечного остова и биопринтинга). Возможность создания трехмерной структуры, подобной почке, с последующим наполнением ее индуцированными плюрипотентными стволовыми клетками почечного происхождения может открыть новые перспективы для создания функционирующего по требованию почечного трансплантата.
Статья переведена на русский язык и опубликована согласно условиям лицензии Creative Commons. Журнал FEBS J. 2016 Sep;283(18):3303–24. doi: 10.1111/febs.13704. Перевод М.С.Храбровой. Редакция перевода И.И.Трофименко
Ключевые слова
Для цитирования:
Монтсеррат Н., Гаррета Е., Бельмонте Х. РЕГЕНЕРАТИВНЫЕ СТРАТЕГИИ РЕКОНСТРУИРОВАНИЯ ПОЧКИ. Нефрология. 2016;20(6):10-25.
For citation:
Montserrat N., Garreta E., Belmonte J. REGENERATIVE STRATEGIES FOR KIDNEY ENGINEERING. Nephrology (Saint-Petersburg). 2016;20(6):10-25. (In Russ.)
ВВЕДЕНИЕ
Болезни почек представляют собой одну из основных проблем здравоохранения в современном обществе. Хроническая болезнь почек (ХБП) является ведущей причиной смертности и заболеваемости в западных странах, где её распространенность составляет до 11% взрослого населения. ХБП может прогрессировать до неизлечимой стадии терминальной почечной недостаточности (ТПН), требующей проведения диализа или трансплантации почки, что предпочтительно. К слову, затраты только на диализ составляют около 2% от национальных бюджетов здравоохранения, и в течение нескольких лет этот параметр удвоится. Если эта тенденция продолжится, национальные правительства будут вынуждены тратить от 3 до 5% своего годового бюджета здравоохранения на заместительную почечную терапию, без учета огромной стоимости дополнительных медицинских расходов.
В настоящее время в США 122 403 человека ожидают жизнесохраняющую органную трансплантацию, из которых 101 189 ожидают трансплантацию почки [1, 2]. Среднее время ожидания первого почечного трансплантата составляет 3,6 года и может варьировать в зависимости от различных параметров, таких как коморбидность, совместимость и доступность органа [2]. Заслуживает внимания то, что в 2014 году в США было выполнено 17 105 трансплантаций почки. Из них 11 570 были трупные и 5535 - от живого донора [1, 2]. Отдел здравоохранения и служба обеспечения органами и планирования трансплантаций США установил, что более 3000 новых пациентов ежемесячно добавляются в лист ожидания почечного трансплантата, и что в 2014 году 4270 пациентов умерли, ожидая пересадку. Таким образом, существует серьезная потребность развития новых терапевтических стратегий, которые позволили бы преодолеть данные проблемы.
Прогресс, достигнутый за последнее время в методологических подходах, основанных на стволовых клетках и достижениях тканевого инжиниринга, привел к появлению новой стратегии регенеративной медицины с целью лечения болезней почек.
Во-первых, возможность имитировать важные этапы развития почки в культивированной среде показывает, что при некоторых условиях человеческие плюрипотентные стволовые клетки (чПСК) могут дифференцироваться in vitro в основные типы почечных клеток, повреждающихся при патологии почек (например, подоциты и тубулярные клетки, и др.) [3, 4]. Во-вторых, появляющиеся технологии, включающие децеллюляризацию/рецеллюляризацию и биопринтинг, стали революционными в области тканевого инжиниринга, открывая возможность создания такого комплексного трехмерного (3D) органа, как почка [5, 6].
В данном обзоре мы освещаем текущие достижения в стратегии регенеративной медицины по воссозданию почечной функции с основным фокусом на (а) направленную дифференцировку чПСК в клетки, подобные почечным, которые можно использовать для инжиниринга почки и (б) применение децеллюляризации/рецеллюляризации и технологии биопринтинга. Видится, что все эти методики являются многообещающими стратегиями тканевого конструирования для биоинжиниринга почки, и здесь мы обсуждаем основные проблемы будущего осуществления этих многообещающих технологий в клинической практике (рисунок).
ЛЕЧЕНИЕ СТВОЛОВЫМИ КЛЕТКАМИ ДЛЯ РЕГЕНЕРАЦИИ ПОЧКИ: ПРОБЛЕМЫ И ТЕКУЩЕЕ ПОЛОЖЕНИЕ ДЕЛ
Болезни почек являются значимой проблемой здравоохранения во всем мире [7-9]. Распространенность и плохой прогноз болезней почек и ассоциированных патологий показывают срочную необходимость не только развития терапевтических подходов, но и расширения нашего понимания потенциала почки к развитию и восстановлению, о со- бенно, генерации нефрона, его дифференцировки и способности к самовосстановлению. Интересно, что почка взрослого млекопитающего имеет способность после повреждения восстанавливать некоторые типы клеток, включая клеточные элементы тубулярных и эпителиальных клеток, но не структуры клубочка [10-12]. Вероятно, это происходит путем пролиферации резидентных клеток при отсутствии популяции предшественников или вновь сформировавшихся мультилинейных структур - процесс, называющийся «клеточной регенерацией» [13]. До сих пор клеточную регенерацию традиционно оценивают путем прослеживания точного клеточного происхождения этих пролиферирующих клеток [12-14], в то время как популяция клеток-предшественников может быть идентифицирована по способности предполагаемых клеток-кандидатов дифференцироваться во многих направлениях [15].
В отличие от других организмов, таких как аквариумная рыбка Данио рерио и насекомые, у которых формирование новых нефронов возникает за счет регенерации поврежденных, у млекопитающих формирование новых нефронов ограничено эмбриогенезом и заканчивается к моменту рождения [16].
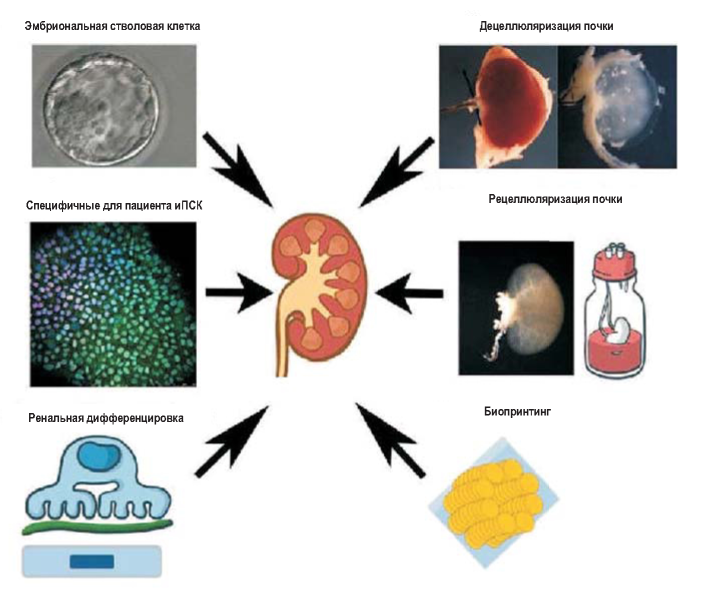
Рисунок. Применение ПСК (как ЭСК, так и иПСК) открывает перспективы для точной оценки необходимых условий, обеспечивающих существование почечных клеток взрослого для клеточной терапии. Также биоинжиниринг почки преследует цель использовать почечный остов как биологическую основу для дальнейшей рецеллюляризации, а появление биопринтинга в последнее время обеспечило реализацию главной стратегии по созданию орган-подобных структур в трехмерном разрешении.
ПСК - плюрипотентная стволовая клетка; ЭСК - эмбриональная стволовая клетка; иПСК - индуцированная плюрипотентная стволовая клетка.
ПЛЮРИПОТЕНТНЫЕ СТВОЛОВЫЕ КЛЕТКИ (ПСК): ПОТЕНЦИАЛЬНЫЙ ИСТОЧНИК ДЛЯ РЕГЕНЕРАТИВНОЙ МЕДИЦИНЫ
Уже в 1998 году было продемонстрировано, что плюрипотентные стволовые клетки (ПСК) могут происходить из внутренней клеточной массы бластоциста эмбриона, превращаясь в эмбриональную стволовую клетку (ЭСК) [17]. Человеческие ЭСК (чЭСК) стали новым объектом для изучения тканевого развития и моделирования заболеваний in vitro. С этого момента интенсивные исследования были посвящены разработке надежного протокола по дифференцировке чПСК с целью создания функционирующих клеток, способных восстанавливать утраченную в результате прогрессирования дегенеративных болезней функцию. Тем не менее, молекулярные механизмы, вовлеченные в ограничение линий дифференцировки чПСК при формирования специализированных типов клеток, до сих пор находятся на стадии исследования. Важно, что самым критичным препятствием для использования чПСК в клинической практике являются потребность в человеческих эмбрионах, что затрагивает этические вопросы, и отторжение тканей после трансплантации.
Существуют другие методы создания ПСК (чПСК) из соматических донорских клеток. Они включают различные способы клеточного репрограммирования, в том числе перенос ядра соматической клетки в энуклеированную яйцеклетку [18], слияние с ПСК [19], воздействие низкомолекулярных химических веществ [20] и транс - дукция факторов репрограммирования [21]. В случаях переноса ядра соматической клетки и репрограммирования, опосредованного слиянием клеток, ядра соматических клеток помещают в тотипотентное или плюрипотентное окружение, соответственно [22].
С другой стороны - трансдукция факторов репрограммирования POU5F1 (POU домен класс 5 фактор транскрипции 1; также известный как октамер-связывающий протеин 3 или октамерсвязывающий протеин 4, ОСТ3/4), SRY (sex determining region Y, определяющий пол, регион хромосомы Y), box 2 (SOX2), Круппель (Kruppel) - подобный фактор 4 (KLF4) и онкоген миелоци- томатоза (c-MYC) [вместе относящиеся к OSKM (по первым буквам в названии факторов) или факторам Яманака] приводит к генерации аутосовместимых индуцированных плюрипотентных стволовых клеток (иПСК), которые совмещают потенциальные способности к самовосстановлению и дифференцировке при сравнении с чЭСК. Большинство первоначальных исследований по созданию иПСК пациента были основаны на использовании интегративных систем, чрезмерно экспрессирующих c-MYC и KLF4, два хорошо известных онкогена [23, 24].
Для решения этих проблем разные лаборатории, включая нашу, проводили поиски различных типов клеток, которые могли бы быть репро- граммированы при отсутствии двух онкогенных факторов, но при использовании преимуществ внутренних свойств выбранных донорских клеток (например, клетки, экспрессирующие относительно высокий уровень любого из факторов Яманака, могут быть репрограммированы при отсутствии этих специальных генов, так, например, невральные стволовые клетки при отсутствии SOX2). Исходя из этого, иПСК были успешно генерированы при отсутствии KLF4 и/или c-MYC из кератиноцитов [24], стволовых клеток пуповины [25] и даже невральных стволовых клеток [26]. Хотя эти открытия показали возможность сокращения числа факторов для генерации иПСК, они по-прежнему были основаны на применении интегративных систем, приводящих к нежелательным эффектам, касающимся случайной трансгенной инсерции (например, риск трансгенной индукции после дифференцировки, неполное репрограммирование и др.). Очень быстро разные лаборатории по всему миру разработали новые методы для создания свободных от трансгенов иПСК [27-32], также внесли важные изменения в клеточные культуры (например матрицы/среды) для получения фидер-независимых человеческих иПСК (чиПСК) [33-35] и идентифицировали растворимые вещества, замещающие факторы Яманака для создания иПСК [20].
Вместе с этими важными трудностями в области получения иПСК были опубликованы результаты интенсивных исследований по созданию специфичных для пациента иПСК с последующей дифференцировкой в определенные виды ткани, поврежденные в результате прогрессирования болезни, обеспечивая уникальный сценарий для моделирования болезни [36-41] и даже для подбора специфичных для пациента лекарств [42, 43].
Еще одна область, привлекающая большой интерес, это коррекция генетических заболеваний в пациент-специфичных иПСК в аспекте персонализированной медицины.
ПСК могут быть источником для исправления генома, так как они могут быть подвержены обширному спектру манипуляций с тканевой культурой (например выбор лекарства и экспансия клонов) с сохранением их плюрипотентности и стабильности генома [44]. Разными исследовательскими группами продемонстрированы генерирование и коррекция пациент-специфичных чиПСК [38, 39, 45-49]. Эти исследования показали функциональную коррекцию болезнь- ассоциированного фенотипа при дифференциров- ке пациент-специфичных чиПСК и даже открыли перспективы для скрининга элементов, восстанавливающих фенотип болезни [49, 50] - достижение, которое, как представляется, является первым применением потенциала чиПСК в регенеративной медицине и здравоохранении [51].
ГЕНЕРИРОВАНИЕ ПОЧЕЧНЫХ КЛЕТОК ИЗ ПСК: МЕТОДОЛОГИИ, ОСНОВАННЫЕ НА ПСК, МОДЕЛИРУЮТ РАЗВИТИЕ ПОЧКИ И ЕЁЗАБОЛЕВАНИЯ
Почка состоит из тысяч нефронов, образующихся в ходе развития в результате реципрокного индуктивного взаимодействия между двумя разными клеточными типами: клетками метанефральной мезенхимы (ММ) и мочеточникового зачатка (МЗ) [16]. ММ дифференцируется в различные типы эпителиальных клеток почки (от клубочка до сегмента собирательных трубочек), а МЗ генерирует систему чашечек.
За последние несколько декад во многих работах определены условия культивирования для изоляции и распространения in vitro этих клеточных популяций, правда, с ограниченным успехом (обзор в [13, 14, 52]). Альтернативной методологией для создания неограниченного количества клеток почечного типа является дифференцировка ПСК. В последние несколько лет независимые исследовательские группы, включая нашу, впервые описали возможность создания различных почечных популяций из ПСК. Song и соавт. были первыми, кто сообщил о получении предшественников по- доцитов из чиПСК, которые были функциональными и эффективно интегрированы в ткань мышиного метанефрия. Однако вопрос о том, какие из эмбриональных клеток-предшественников в ходе развития эквивалентны иПСК-незрелым по- доцитам SongX остается открытым [3].
Позднее в 2013 г. S.I. Мае и соавт. впервые дифференцировали монослой чЭСК в промежуточную мезодерму (ПМ), эмбриональную ткань, которая дает происхождение как ММ, так и МЗ [53]. С этой целью авторы создали разные репортерные линии чиПСК, в которых GFP был направлен в ген OSR-1 (Odd-skipped related 1 - ген, транзиторно экспрессируемый в промежуточной мезодерме в ходе эмбриогенеза). При специальных условиях клеточной культуры иПСК, дифференцированные из ПМ, показали свойства других типов зрелых почечных клеток и ограниченных канальцевых структур. Интересно, что те же авторы добились получения химически определенной среды для получения иПСК из ПМ и недавно описали идентификацию двух ретиноид-подобных молекул, индуцирующих образование ПМ из иПСК. Именно в этих опытах авторы продемонстрировали, что в результате полученные из ПМ иПСК проявляли способность дифференцироваться во множество типов почечных клеток, также образуя 3D-структуру, подобную почечным канальцам в образцах органных культур ex vivo [54].
Аналогично наша группа впервые сообщила о возможности создания предшественников МЗ из клеток ПМ из чПСК и чиПСК, полученных от пациентов с поликистозной болезнью почек. Спустя 4 дня предшественники МЗ экспрессировали HOXB7, RET и GFRA1 в большей степени, чем маркеры ММ. Более того, когда МЗ-подобные чиПСК- клетки были культивированы совместно с диссоциированными клетками мышиного метанефрия Е11-5, образованные клетки включались только в цитокератин 8 позитивные (+) МЗ- подобные структуры, предполагая индукцию коммитированных ПМ клеток МЗ линии ex vivo [55].
С другой стороны - группа Little’a разработала протокол по созданию хорошо изученных предшественников почечных клеток как из чПСК, так и чиПСК в ПМ через заднюю первичную полоску, из которой ПМ образуется в ходе развития. Авторы использовали собственную линию чПСК для мониторирования экспрессии MIXL1 (гена, транзиторно экспрессируемого в первичной полоске в ходе эмбриогенеза) путем включения GFP в локус MIXL1. Группа Little’a создала два разных протокола: один - для одновременной генерации дериватов ММ и МЗ и другой - для МЗ-клеток только из ПСК. Примечательно, что в этой работе использовали повторную агрегацию проб для определения потенциала дифференцировки почечноподобных генерированных клеток, показывая, что повторно агрегированные дифференцированные ПСК могут одни организовать и генерировать нефрон-подобные структуры [56].
Ранее Lam и соавт. опубликовали быстрый и эффективный протокол дифференцировки для получения PAX2+LHX1+ ПМ-клеток из чПСК, которые спонтанно формировали каналец-подобные структуры. Интересно, что Lam удалось показать, что PAX2+LHX1+ ПМ-клетки из чПСК интегрировались в мышиную культуру метанефрия и дифференцировались в мультипотентные стволовые клетки-предшественники нефрона (СКПН) мезенхимы, экспрессируя маркеры SIX2, SALL1 и WT1 [57]. Таким же образом Taguchi и соавт. также показали, что возможно получать СКПН, которые обладают потенциалом реконструирования 3D-нефрон-подобной структуры, содержащей как гломеруло-, так и тубуло-подобные структуры при совместном культивировании in vitro с эмбриональным спинным мозгом из мышиных ЭСК и чиПСК [58]. В этой же работе Taguchi и соавт использовали модели мышиных линий in vivo и изучали разные стадии развития СКПН у мышей с геном-репортером OSR-1-GFP и выявили, что популяция OSR-1-GFP-Integrina+PDGFRa имеет самый высокий потенциал формирования нефро- нов in vitro. Таким образом, авторы пересмотрели пространственную и временную локализацию предшественников нефрона метанефрия in vivo, демонстрируя, что ПМ содержит, по крайней мере, две субпопуляции предшественников метанефрия - передний и задний домены, и что ПМ, расположенный сзади, дает рост линиям ММ [58]. Интересно, что эта последняя работа продемонстрировала, в какой момент времени зарождающаяся мезодерма становится ПМ и как она становится специфичной для ММ- и МЗ-линий [58].
Интересно, что Imberti и соавт. получили почечные клетки-предшественники из чиПСК, следуя двухэтапному протоколу, где сначала чиПСК подвергают воздействию ретиноевой кислотой, ингибиторами в RhpA и PI3K и активином А, индуцируя развитие ПМ. Далее чиПСК, полученные из ПМ, в течение следующих 13 дней были подвергнуты воздействию FGF2, BMP7 и глиального нейротрофического фактора (GDNF) для создания чиПСК из ММ. Хотя другие авторы уже продемонстрировали возможность генерации чПСК из ММ, в этой работе Imberti и соавт. впервые показали, что чиПСК - предшественники почечных клеток - надежно внедряются в поврежденные канальцы, восстанавливая почечную функцию [59].
Недавно Morizane и соавт. показали возможность развития СКПН из чПСК. Работа Morizane элегантно демонстрирует, что возможно воспроизвести ММ почку in vitro и генерировать SIX2+- SALL1+WT1+PAX2+ СКПН с 90% эффективностью через 9 дней. Более важно, что авторы доказали, что СКПН формируют почечный органоид как в 2D-, так и в 3D-образцах после 21-28 дней, содержащий эпителиальные нефрон-подобные структуры, экспрессирующие маркеры подоцитов (PODXL, NPHS1), проксимальных канальцев (CDH2, LTL), петли Генле (CDH1, UMOD) и дистальных канальцев (CDH1, BRN1), копируя развитие нефрона. Важно, что для изучения механизмов токсичности проксимальных и/или дистальных канальцев при воздействии на почечный органоид химических агентов, рутинно применяемым на животных моделях in vivo, была использована система культуры органоидов [60]. Подобным же образом Fredman и соавт. показали, что почечные стволовые клетки, полученные из чПСК- сфероидов, легко могут произвести почечные органоиды, воспроизводя ткань-специфичную эпителиальную физиологию. В частности, авторы смогли выключить гены подокаликсина, PKD1 (полицистин-1) или PKD2 (полицистин-2) с помощью технологии коротких палиндромных повторов, регулярно расположенных группами (CRISPR)/CAS9 с направляющей РНК CRISPR/Cas9, впервые доказав осуществимость создания 3D-почечной структуры для моделирования болезней почек человека [61]. Совсем недавно Takasato и соавт. [62] сделали еще один шаг для создания почечного органоида, содержащего индивидуальные нефроны, далее разделяющиеся на дистальные и проксимальные канальцы, начальную петлю Генле и клубочки, содержащие подоциты с развивающимися ножковыми отростками и проходящие васкуляризацию. Также как Freedman и соавт. [61], Takasato и соавт. показали, что проксимальные канальцы аккумулировали декстран и дифференцированно подвергались апоптозу в ответ на цисплатину [62].
Хотя эти работы показали возможность создания различных почечных популяций из чПСК, они до сих пор различаются в отношении применяемых реагентов, их концентраций и времени выдерживания (табл. 1). Важно отметить, что разные данные по дифференцировке ПСК в клетки почечных линий демонстрируют, что мы еще далеки от выделения генов маркеров или поверхностных протеинов, определяющих разные ПМ популяции, выявленные у мышей [58].
ТЕХНОЛОГИИ РЕДАКТИРОВАНИЯ ГЕНОМА
За последнее время появились как потенциальные средства для редактирования генома в чиПСК пациента вместе с CRISPR/Cas9, разные платформы по редактированию гена для увеличения гомологичной рекомбинантной эффективности, в частности ДНК-нуклеазы (цинк-содержащие нуклеазы, TAL эффекторные нуклеазы и мегануклеазы) [44]. В общем, ДНК-нуклеазы и CRISPR/ Cas9-технологии позволяют выполнять различные манипуляции с геномом сайт-специфичным способом, например, активацию /инактивацию гена, удаление последовательности, замену элементов и хромосомную перестройку [44, 63]. В контексте моделирования заболеваний почек CRISPR/Cas9-технология была использована для получения 3D-почечных структур из чиПСК для выключения генов PKD1 (полицистин-1) и PKD2 (полицистин-2), приводя к возможности моделирования поликистозной болезни почек в 3D-образце, похожей на компартмент почечного эпителия [61].
Помимо огромного влияния на моделирование заболеваний человека платформ геномного редактирования, недавно исследованы другие аспекты, включая использование таких технологий для генерации ПСК репортерных клеточных линий [64-67]. Недавно группа Little’a разработала новый протокол по созданию самоорганизующихся почечных органоидов из чПСК, эквивалентных почкам человеческого плода в течение первого триместра гестации [62]. Эти результаты выявили, что мы, с одной стороны, до сих пор далеки от развития зрелых почечных клеток, имеющих терапевтический потенциал, подразумевая, что новые стратегии должны быть приняты во внимание для развитяи зрелых почечных клеток для клинического применения (например, использование кондиционированной культуры медии из почечных эмбриональных клеток, использование систем реаггрегации совмещенных культур с клетками плода человека и пр.). С другой стороны - профиль экспрессии мРНК в работе Little и соавт. происходит из различных клеточных типов, самоорганизующихся в почечную 3D-структуру, затрудняя анализ молекулярных путей, обеспечивающих почечную дифференцировку из различных индивидуальных клеточных типов, составляющих почечный органоид. С этой точки зрения технологии редактирования генома, в частности система CRISPR/Cas, могут помочь создать линии человеческих репортерных ПСК для детального выявления молекулярных сигналов почечной дифференцировки и, таким образом, пригодных для выявления зрелости генерированных клеток в сравнении с их двойниками in vitro из развивающихся эмбрионов.
До сих пор почечные линии репортерных ПСК генерировали путем искусственной бактериальной векторной хромосомы [53] и лентивируса [56]. Эти плодотворные исследования открыли пригодность линий репортерных клеток для идентификации и размножения требуемых типов почечных клеток (т.е. ПМ-клетки и клетки примитивной полоски) в ходе начала дифференцировки. Важно отметить, что группа Osafune сделала дальнейший шаг в применении OSR-1-GFP ген-репортерных клеточных линий и выявила два агониста рецептора ретиноевой кислоты, а именно АМ580 и TTNPB, которые вместе с CHTR 99021 индуцировали дифференцировку ПМ- клеток путем активации экспрессии КМП4 [54]. Интересно, что новый метод дифференцировки, использующий малые составляющие, обеспечил менее дорогой и более совместимый метод генерации ПМ-клеток по сравнению с методом применения фактора роста, описанный этой же группой ранее [53]. Поскольку идентификация и размножение ткань- специфичных почечных стволовых кле- ток/клеток-предшественников с нефрогенным потенциалом являются критичным шагом в развитии клеточной терапии для заболеваний почек, применение почечного репортера ПСК может привести к разработке условий клеточного культивирования для получения 3D-почечной структуры из чПСК.
Таблица 1
Последние литературные данные по ренальной дифференцировке из человеческих плюрипотентных стволовых клеток
Авторы и год | Происхождение плюрипотентных стволовых клеток | Протокол ренальной дифференцировки |
|
|
|
|---|---|---|---|---|---|
Song etal. (2012) [3] | Человеческие иПСК (мезангиальные клетки) | Формирование тела эмбриоида (3 дня): 10 нг/мл-1 активин А; 15 нг/мл-1 ВМР7, 0,1 цм ретиноидной кислоты | Гломерулярные подоциты (последовательная культура, 8 дней): 10 нг/мл-1 активин А; 15 нг/мл-1 ВМР7, 0,1 цм ретиноидной кислоты |
|
|
Narayanan et al. (2013) [4] | Человеческие эПСК | Клетки проксимальных канальцев (20 дней): 10 нг/мл-1 ВМР2; 2,5 нг/ мл-1 ВМР7; 10 нг/мл-1 активин А; 0,1 цмоль/мл-1 ретиноидной кислоты |
|
|
|
Мае et al. (2013) [53] | Человеческие ЭСК (Н9, khES1 и khES3), человеческие иПСК (201В6, 201В7, 253G1 и 253G4) | Мезендодерма (2 дня): 100 нг/мл-1 активин А; 3 цм CHIR99021, 10 цм Y27632 | Ранний промежуточный мезодерм (8 дней): 100 нг/мл-1 ВМР7; 3 цм CHIR99021 | Промежуточный мезодерм (7 дней): 10 нг/мл-1 TGFpi |
|
Araoka et al. (2014) [54] | Человеческие ЭСК, человеческие иПСК (дермальные фибробласты) | Ранний промежуточный мезодерм (2 дня): 100 нг/мл-1 ВМР7; 3 цм CHIR99021: 1 цм 4-[(Е)-2-(5,6,7,8- тетраги дро-5,5,8,8-тетраметил-2- нафталенил)-1 -пропенил] бензойная кислота (ТТНПБ) | Промежуточный мезодерм (3 дня): 1 цм ТТНПБ |
|
|
Xia et al. (2013) [55] | Человеческие иПСК (дермальные фибробласты) | Мезодермальные предшественники (2 дня): 30 нг/мл-1 ВМР4; 50 нг/мл-1 ФРФ2; 17,5 цг/мл-1 инсулин | Клетки, подобные предшественникам уретрального зачатка промежуточной мезодермы (2 дня): 0,1 цм ретиноидной кислоты; 10 нг/мл-1 активин А; 100 нг/мл-1 ВМР2 |
|
|
Takasato et al. (2014) [56] | Человеческие ЭСК | Задняя примитивная полоска: (а) 2 дня, 30 нг/мл-1 ВМР4; 10 нг/мл-1 активин А; (б) 2 дня, 8 цм CHIR99021 | Промежуточный мезодерм: (а) 4дня, 200 нг/мл-1 ФРФ9; 1 цг/мл-1 гепарин; (б) 10 дней, 200 нг/мл-1 ФРФ9; 1 цг/мл-1 гепарин | Предшественники метанефраль- ной мезенхимы и уретрального зачатка: (а) 11 дней, 200 нг/мл-1 ФРФ9; 50 нг/мл-1 ВМР7; 0,1 цм ретиноидной кислоты; 1 цг/мл-1 гепарин; (б) 6 дней, без факторов |
|
Lam et al. (2013) [57] | Человеческие ЭСК; человеческие иПСК (дермальные фибробласты) | Мезендодермий (2 дня): 5 цм CHIR99021 | Промежуточный мезодерм (4 дня): 100 нг/мл 1 ФРФ2;0,1 цм ретиноидной кислоты | Сар-мезенхима (3 дня): 100 нг/ мл 1 ФРФ9; 10 нг/мл-1 активин А |
|
Taguchi et al. (2014) [58] | Мышиные и человеческие иПСК | ЕВ-формация (1 день): 0,5 нг/мл-1 ВМР4; 10 цм Y27632 | Эпибласт (2 дня): 1 нг/мл-1 активин А; 20 нг/мл-1 ФРФ2 | Задняя образующаяся мезодер- ма(бдней): 1 нг/мл-1 ВМР4; Юцм CHIR99021 | Задняя, промежуточная, мезодерма (2 дня): 10 нг/мл 1 активин А; 3 нг/мл-1 ВМР4; 3 цм CHIR99021; 0,1 цм ретиноидной кислоты; 10 цм Y27632 |
Продолжение табл. 1

Эта таблица представляет обзор нескольких последних публикаций, в которых человеческие плюрипотентные клетки были дифференцированы в почечные клеточные линии. Детально перечислены факторы роста и цитокины, использованные в процессе дифференцировки.
НОВЫЕ СТРАТЕГИИ БИОИНЖИНИРИНГА ПОЧКИ
В области тканевого инжиниринга применяют принципы биологии и инжиниринга для разработки функционального замещения поврежденной ткани [68]. Десятилетиями исследователи напряженно работали для создания техник и методик для разработки биоостова, используя натуральные или синтетические биоматериалы [69, 70]. Общее мнение в данной области таково, что для успешного применения в тканевом инжиниринге такой остов должен обладать несколькими ключевыми характеристиками с целью поддержания правильного формирования ткани и функции: (а) быть биосовместимым; (б) обладать достаточной механической силой; (в) быть биоактивным для изменения 3D-клеточного микроокружения и (г) обеспечивать диффузию питательных веществ и очищение от токсичных продуктов. В этой области произошли значительные достижения, включая успешное создание трансплантатов таких тканей, как кожа [71], хрящ [72, 73], кость [74], мочевой пузырь [75], сосуды [76] и трахея [77]. Однако в наше время исследователи стоят лицом к лицу с новой проблемой, относящейся к биоинжинирингу более сложных 3D-органов: легкие, печень, сердце и почки.
Сложные органы требуют интактной сосудистой сети, которая далее могла бы быть включена в систему циркуляции после трансплантации реципиенту для обеспечения адекватного питания и кислородной поддержки всему органу. Более того, такие органы обычно обладают высокоорганизованными орган-специфичными многоклеточными структурами, ответственными за выполнение основных функций. Почка представляет собой один из наиболее сложных органов в отношении развития, пространственной организации и клеточной специализации. Почка человека состоит из более чем 30 разных типов клеток и тысяч сложных и функционально разделенных эпителиальных структур, называемых нефронами, которые являются функциональной единицей почки. Каждый нефрон дифференцируется из разных регионов, главным образом из капсулы Боумена, которая окружает клубочек, и почечных канальцев, каждый из которых имеет различные анатомические характеристики и физиологичную роль [16]. Такая сложная органная структура не может быть воспроизведена при использовании традиционных методик тканевого инжиниринга остова.
Недавнее получение остова орган-специфичного экстрацеллюлярного матрикса (ЭЦМ) путем децеллюляризации/рецеллюляризации и возможность точного расположения клеток и материалов путем технологии 3D-биопринтинга представляются двумя наиболее обещающими достижениями органного биоинжиниринга.
СОЗДАНИЕ ОРГАННЫХ ОСТОВОВ ПУТЕМ ТЕХНОЛОГИИ ДЕЦЕЛЛЮЛЯРИЗАЦИИ/ РЕЦЕЛЛЮЛЯРИЗАЦИИ
Децеллюляризация целого органа открывает новые перспективы в тканевом инжиниринге [78]. Несколькоми лабораториями было сообщено о создании почечного остова от грызунов [79-85], свиней [86-88], макак-резус [89] и человеческих почек [5, 90, 91] (табл. 2).
Описано много протоколов децеллюляризации (см. [92-94]), которые обычно включают антеградную перфузию очищающих веществ (детергентов), ферментов и других разрушающих клетки растворов через сосудистую систему органа для удаления клеточных компонентов, в то же время сохраняя 3D-архитектонику и биохимический состав нативного ЭЦМ.
После децеллюляризации почечный остов сохраняет гломерулярную и тубулярную архитектонику и сосудистую сеть. Интересно, что некоторые исследования открыли важную роль почечного ЭЦМ в управлении поведением клетки. Nakayama и соавт. показали, что чЭСК, подсаженные в ЭЦМ децеллюляризованной почки макакрезус, формировали канальцы и экспрессировали ряд специфичных для почки маркеров, но эти события не происходили, когда использовали ЭЦМ легкого, показывая определенную специфичность функций почечного ЭЦМ [95]. Действительно, в недавней публикации O’Neill и соавт. [96] было описано, что полученные из сосочка почечные стволовые клетки регулируются по-разному при культивировании в контакте с разными регионами ЭЦМ почки, предполагая регион-специфичный эффект ЭЦМ почки на поведение стволовых клеток. Более того, в недавнем исследовании Yu и соавт. [97] бесклеточный ЭЦМ почечного остова крысы был пересажен в частично нефрэктомированные почки крысы и показал некоторое возобновление роста удаленной области спустя 4 нед после трансплантации. Интересно, что микроскопический анализ показал миграцию нестинпозитивных клеток из поврежденной почки в трансплантированный бесклеточный остов, демонстрируя, что интактный бесклеточный почечный остов сохраняет биоактивные сигналы. Однако ни одного значимого восстановления почечной функции показано не было. В общем, эти работы поддерживают идею, что бесклеточный почечный ЭЦМ сохраняет ренальные специфичные биохимические и биофизические сигналы, которые способны регулировать клеточную пролиферацию и дифференцировку. Хотя лежащие в основе механизмы еще должны быть изучены, эти данные предполагают, что ЭЦМ остова органа, полученный путем децеллюляризации, мог бы быть идеальной системой для обеспечения клеткам необходимого орган-специфичного микроокружения для создания функционирующих почек.
Несмотря на эти впечатляющие данные, количество исследований, продемонстрировавших успешную трансплантацию целиком рецеллю- ляризированных почек, ограничено [80, 83-85, 87]. Одно из главных препятствий до настоящего времени - это необходимость эффективно реэндотелизировать сосудистую сеть созданной почки перед имплантацией для того, чтобы избежать массивных тромбозов при соединении с сосудистой системой реципиента. Orlando и соавт. [87] имплантировали децеллюляризированный почечный остов свиньи в животное-реципиента, поддерживая достаточное кровяное давление в течение операции; однако в отсроченном периоде, составившем 2 нед, авторы доложили о массивных тромбозах, подчеркнув факт того, что эндоте- лизация сосудистой системы остова является решающим требованием для проведения успешной пересадки и длительной жизни трансплантата. Peloso и соавт. [84] также наблюдали ту же проблему формирования тромбов при имплантации децеллюляризированного почечного остова крысам. Примечательно, что в исследовании, проведенном Ott [80], целиком бесклеточные почки крыс были рецеллюляризированы почечными клетками новорожденной крысы и клетками эндотелия пупочной вены человека и далее имплантированы ортотопически, что привело к некоторому восстановлению почечной фильтрации и реабсорбции. В этой важной концептуальной работе не было выявлено признаков кровотечения или образования тромба в течение процесса имплантации, доказывая важность реэндотелизации сосудистой сети бесклеточного остова. Все эти работы подтверждают, что ортотопическая трансплантация почечного остова в наши дни технически возможна, и что надлежащая рецеллюляризация таких остовов необходима для последующего достижения эффективной трансплантации и функционирования органа.
Оптимальный источник клеток для внедрения в бесклеточный почечный остов - это другой нерешенный вопрос. В настоящее время исследователи стараются рецеллюляризировать почечный остов с помощью различных клеточных источников, включая почечные клетки новорожденных [80], эндотелиальные клетки пупочной вены человека [80], мышиные ЭСК [82, 85], эндотелиальные клетки из чиПСК [83], иммортализованные клетки почечного кортикального эпителия человека [83], линию клеток карциномы поджелудочной железы человека [84] и первичные почечные клетки свиньи [98]. Учитывая последние достижения в технологиях иПСК и генного редактирования, а также самый последний прогресс в разработке протоколов для ренальной дифференцировки ПСК в надлежащие типы почечных клеток, представляется, что ПСК-почечные клетки будут идеальным источником для создания целого органа (что обсуждается выше в разделе терапия стволовыми клетками для регенерации почки). Считается, что предшественники почечных клеток из ПСК- клеток будут подходить для биоинжиниринга почки в большей степени, чем зрелые фенотипы почечных. Тем не менее, большой объем работы еще предстоит выполнить, чтобы точно охарактеризовать и признать пригодными популяции клеток из ПСК в отношении клеточной идентичности, дифференцировки и финального созревания для обеспечения надлежащей репопуляции различных почечных отделов, а также выполнения необходимых физиологических функции почки.
В текущих работах обычно используют почечную артерию [79-82, 99] или мочеточник [79, 80] в качестве пути доставки клеток в почечный остов. Однако выбор пути для клеточного осеменения должен быть изучен в большей степени, учитывая, что различные биохимические и биофизические сигналы от различных отделов ЭЦМ могут влиять на клеточную пролиферацию, дифференцировку и дальнейшее созревание, как предполагается некоторыми исследованиями [95, 96]. В настоящий момент для доставки клеток в почечный остов и обеспечения стандартной доставки питательных веществ и кислорода в рецеллюляризированный почечный остов используют самодельные биореакторы. Song и соавт. [80] разработали биореактор, который позволяет осуществлять перфузию как через почечную артерию, так и мочеточник, включая порт для забора воздуха для генерирования среды отрицательного давления и создания трансренального градиента давления, который улучшает прохождение клеток через мочеточник. Однако, до сих пор главной проблемой остается неравномерное распределение клеток, обычно наблюдаемое после осеменения, с неспособностью клеток в ряде случаев достичь клубочка и, как правило, неэффективность формирования клеточной плотности, сравнимой с нативным органом. Поэтому дальнейшая оптимизация систем биореактора будет необходима для достижения полной рецеллюляризации и созревания органа перед имплантацией [100].
В целом возможность совмещения бесклеточного почечного ЭЦМ остова с почечными клетками из чиПСК является уникальной технологической платформой для инжиниринга почки [101]. В нескольких статьях уже показана возможность применения технологии децеллюляризации к почкам человека [5, 90, 91], хотя ни в одном из этих исследований не изучали рецеллюляризацию. Будущие направления потребуют определения оптимальных условий рецеллюляризации (клеточная плотность, путь доставки клеток и методика осеменения) с целью улучшения клеточной плотности, распределения и задержки в различных областях бесклеточного почечного остова. Более того, расширение технологии рецеллюляризирования почечного остова человека потребует улучшения протоколов по клеточной дифференцировке, стратегий эффективной доставки клеток и инновационных систем биореакторов с физиологически необходимыми условиями клеточных культур (объем, давление, скорость потока и механические стимулы) с целью создания функционирующей человеческой почки [100, 102].
Таблица 2
Последние литературные данные по стратегиям децеллюляризации/рецеллюляризации почки
Рецеллюляризация | |||||||
|---|---|---|---|---|---|---|---|
Автор и год | Вид | Децеллюляризация | Засеянные клетки | Метод засеивания | Метод культивирования остова | Имплантация | Основные исходы |
Ross et al. (2009) [79], (2012) [99] | Крыса линии Спрег-Доули | Гравитационная перфузия (при 100 мм рт. ст.) через почечную артерию и мочеточник с (а) 3% Тритоном X-100, (б) деоксирибону- клеазой, (в) 3% Тритоном X-100, (г) 4% додецилсуль- фатом натрия (ДСН) | Мышиные ЭСК | Инъекция через артерию и мочеточник вручную | Автоматизированная перфузионная система, разработанная для поддержания давления на уровне 120/80 мм рт. ст. | Нет | Клетки, введенные в артерию, сначала попали в клубочки, но потом мигрировали в сосудистую сеть в процессе культивирования. Клетки, введенные в мочеточник, распределились неравномерно |
Song et al. (2013) [80] | Крыса линии Спрег-Доули | Перфузия почечной артерии при постоянном давлении 40 мм рт. ст. 1 % ДСН 12 ч, 1% Тритоном X-100 30 мин | Клетки почки новорожденной крысы и эндотелиальные клетки пупочной вены человека (HUVECs) | Засеивание HUVECs при артериальном кровотоке 1 мл/мин 1 с последующей статической инкубацией в течение ночи. Клетки почки новорожденной крысы засеивались через мочеточник при отрицательном градиенте давления, достигнутом в камере биореактора | Культура, перфузируемая артериально со скоростью 1,5 мл/мин 1 в биореакторе | Ортотопи- ческая имплантация крысе | Частичное восстановление почечной фильтрации и реабсорбции электролитов. Рецеллюляризация 70% клубочков. Тромбообразования или кровотечения во время имплантации не было |
Bonandrini et al. (2014) [82] | Крыса линии Спрег-Доули | Перфузия почечной артерии со скоростью 0,4 мл/ мин 1 при давлении 62-107 мм рт. ст. с 1 % ДСН 17 ч | R1мышиные ЭСК | Динамическое засеивание через почечную артерию 0,2 мл/ мин 1 | Культура, перфузируемая в биореакторе | Нет | Снижение экспрессии ОСТ4 и увеличение NCAM, Tie-2 и CD31 |
Sullivan et al. (2012) [86] | Йоркширская свинья | Перфузия почечной артерии с 0,5% ДСН и деоксири- бонуклеазой в течение ночи | Первичные кортикальные почечные клетки человека | 5 X 7 мм биопсии коры были засеяны статически | Статическое культивирование 3-4 дня | Нет | Клеточная пролиферация. Лучшее действие ДСН при сравнении с Тритоном X-100 |
Nakayama et al. (2010) [89], (2013) [95] | Макакрезус | Срезы почки: 1% ДСН 7-10 дней | WA09 человеческие ЭСК | Срезы почки 8 мм в диаметре были статически засеяны клетками | Статическое культивирование в течение 8 дней | Нет | Увеличение экспрессии генных маркеров почечных канальцев |
O’Neill et al. (2013) [96] | Йоркширская свинья | 0,02% трипсин 2 ч, 3%Твин (Tween) 2 ч, 4% деоксихолат натрия 2 ч | Мышиные почечные стволовые клетки и мышиные мезенхимальные стволовые клетки | Клетки помещались на срезы децеллюляризированного остова, ЭСК-гидрогель и растворимый ЭЦМ | Статическое культивирование до 7 дней | Нет | Сосочковый ЭЦМ ингибировал пролиферацию и увеличивал метаболическую активность почечных стволовых клеток |
Caralt et al. (2014) [83] | Крыса линии Спрег-Доули | Три метода: (а) 1% Тритон X-100; (б) 1 % Тритон X-100 и 0,1 % ДС H; (в) 0,05% EDTA с 0,02% трипсином и 1% Тритоном X-100 | Человеческие иПСК- эндотелиальные клетки и оживленные эпителиальные клетки кортикальных почечных канальцев человека (RCTEs) | Вручную инъецированы или инфузированы через антеградную перфузию биореактора в почечную артерию со скоростью 25 мл/мин 1 на 15 мин | Статическое культивирование в течение 36 ч и культивирование при перфузии в биореакторе при скорости 4 мл/мин 1 до I дней | Нет | Эндотелиальные клетки обнаружены в сосудистом русле, a RCTEs образовали структуры канальцев. Доступ кислорода был ограничен в некоторых участках |
Продолжение табл. 2
Peloso et al. (2015) [84] | Крыса линии Льюис | Аортальная антеградная пульсовая перфузия с Тритоном X-100 I % при скоро- сти70мл/мин 1 (1 ч 25мин), затем PBS со скоростью 50 мл/мин 1 (1 ч), после ДСН 1% при скорости 70 мл/ мин 1 (1 ч 25 мин) | Клетки карциномы поджелудочной железы человека (MIA РаСа-2) | Инъецирование вручную через сосудистое русло почечной артерии | Орган перфузировался в биореакторе со специфичным способом 24 ч со скоростью потока 1 мл/мин 1 | Ортотопи- ческая имплантация крысе | Гомогенное распределение клеток в почечном матриксе и отсутствие токсичности остова. Отсутствие эндотелия сосудистой сети после трансплантации обеспечивает прямой контакт между кровью и ЭЦМ, что приводит к интенсивной активации каскада коагуляции и формированию сгустков |
Guan et al. (2015) [85] | Крыса линии Вистар | Перфузия почечной артерии 2 мл/мин 1 с 0,01 м PBS 15 мин, 0,5% ДСН 4 ч и затем PBS 24 ч для удаления ДСН | Мышиные ЭСК | Засеяны вручную через почечную артерию и мочеточник | Клетки могли приживляться в течение ночи, после чего перфузия возобновлялась при скорости 1 мл/мин 1 | Ортотопическая имплантация крысе | Увеличение репопуляции клеток целого почечного остова при контролируемых условиях перфузии. ЭСК прикрепились к ЭЦМ и пролиферировали. Сосудистое дерево полностью было окклюзировано тромбами |
Guan et al. (2015) [88] | Обычная свинья | Перфузия почечной артерии: дистиллированная вода 10 мл/мин 1 2 ч, 1% ДСН 10 мл/мин 1 28 ч и 1 % Тритон X-100 2 ч, финальная отмывка PBS 10 мл/ мин1 4 дня | Мышиные ЭСК | Множественное пункционное засеивание инжектором 28G | Клетки могли приживляться в течение 4 ч, затем почечный остов соединяли с системой биореактора и перфу- зировали при скорости 2 мл/мин 17 дней | Нет | Примененный протокол децеллюляризации значительно снижал содержание ДНК, поддерживая при этом основные структурные особенности и задерживая цитокины |
Orlando et al. (2013) [90] | Удаленные человеческие почки | Дистиллированная вода 12 мл/мин1 12 ч, 0,5% ДСН 12 мл/мин 148 ч как в почечной артерии, таки в мочеточнике, финальная отмывка PBS 6 мл/мин1 5 дней |
|
|
| Нет | Оптимизирование децелл поляризации путем перфузии через артерию и также мочеточник ретроградно в собирательную систему. Продемонстрирована способность к ангиогенезу ЭЦМ остова. |
Peloso et al. (2015) [91] | Удаленные человеческие почки | PBS при скорости 12 мл/ мин1 12ч, 0,5%ДСН 12мл/ мин 1 48 ч как в почечной артерии, так и в мочеточнике, финальная отмывка деоксирибонуклеазой 6 ч при скорости 6 мл/мин 1 и затем PBS 6 мл/мин 1 5 дня |
|
|
| Нет | Морфология и пространственность бесклеточного клубочка и его сосудистая сеть были относительно хорошо сохранены после децеллюляризации и сравнимы с клеточным двойником. Сосудистая сеть сохранила свою нативную эластичность. Цитокины остались внутри матрикса после децеллюляризации в значительной концентрации |
Abolbashari et al. (2016) [98] | Йоркширская свинья | Перфузия почечной артерии 0,5% ДСН 36 ч и деоксирибонуклеазой в течение ночи | Первичные почечные клетки свиньи | Множественные клеточные инъекции в кортикальный регион почечного остова. Оптимизированный метод инъекции клеток, способный восстановить популяцию 50% верхнего полюса почки | Перфузия в биореакторе при скорости 10 мл/мин1 напрямую в почку через почечную артерию | Нет | Клеточная организация в надлежащую структуру почечных канальцев без вовлечения в засеивание сосудистой сети. Уровень активности гидролаз был сравним с нормальной почкой. Продукцияэритропоэтина восстановленными почечными клетками все время увеличивалась при культивировании в биореакторе, показывая на клинически важную функциональную продукцию |
Эта таблица представляет обзор нескольких недавних публикаций, в которых описаны децеллюляризация и рецеллюляризация целой почки in vitro при использовании различных типов клеток. Также подробно описаны видовая принадлежность децеллюляризированной почки, главные условия децеллюляризации, засеянные типы клеток, метод засеивания, методика культивирования почечного остова и основные результаты.
3D-БИОПРИНТИНГ
SD-биопринтинг использует последние разработки в прикладных производственных технологиях (также известный как SD-принтинг) по тщательному депонированию живых клеток или клеточных масс вместе с поддерживающим биоматериалом на основе гидрогеля (вместе называемыми биочернилами) для точной геометрии при построении орган-подобных или тканевых структур в трех измерениях [103, 104]. В последние годы были сделаны новые достижения в разработке различных техник биопринтинга для создания 3D-тканеподобной живой структуры (см. в [6]), включая базирующиеся на инжекторном клеточном принтинге, экструзии, мягкой литографии и лазер-индуцированном переносе. Все они содержат компьютерное устройство, которое транслирует в трех измерениях сложную геометрию с целью повторения специфических биологических признаков ткани или даже целого органа.
Несмотря на огромный потенциал этой технологии в области тканевого инжиниринга, одним из главных препятствий, требующих решения в первую очередь, остается недостаток адекватного биоматериала для успешного биопринтинга живых структур.
Много исследований проводятся в этой области для разработки новых классов биочернил, что полноценно освещено в других источниках [105-107]. Интересно, что в недавней работе Pati и соавт. [108] были изготовлены биочернила из децеллюляризированных жировой, хрящевой и сердечной тканей и использованы для принтинга нагруженных клетками конструкции с регулируемой пористостью. Авторы продемонстрировали возможность создания тканевых аналогов in vitro как с адипогенным, так и хондрогенным потенциалом, показав стволовые клетки из человеческой жировой ткани и мезенхимальные стволовые клетки из ткани нижней носовой раковины человека, напечатанные при использовании ЭЦМ-биочернил, полученных из жировой ткани и хрящевой ткани соответственно. В контексте регенерации почки успешное создание функционального почечного остова путем биопринтинга будет ограничено возможностью повторения ренального ЭЦМ в отношении композиции и пространственной организации, как и депонирования различных популяций почечных клеток организованным образом. В связи с этим биочернила, полученные из бесклеточного почечного ЭЦМ, станут привлекательным материалов, так как это может обеспечить реноспецифичные внутриструктурные сигналы для напечатанных клеток.
Хотя технология 3D-биопринтинга пока только в самом раннем периоде развития, уже показан ее потенциал в создании органов. Группа Atala смогла смоделировать напечатанный мочевой пузырь, используя модифицированную технологию инжекторного биопринтинга [109], показав, что возможно печатать различные типы клеток в организованной 3D-структуре. Эта оригинальная работа открыла новые перспективы в 3D-принтинге органа в целом. Такие достижения, как использование тканевых сфероидов в качестве строительных блоков, продемонстрировали большой успех в создании микротканей, например, сосудистой сети [110, 111], которые в дальнейшем могут быть объединены в организованную макроткань.
Хотя большой объем работы еще должен быть проделан перед тем как полностью функционирующая почка сможет быть напечатана, предварительным шагом будет создание мелких органоидов или функциональных единиц, таких как нефрон, которые будут полезны для применения при лекарственном скрининге и моделировании заболеваний. Уже некоторые работы исследуют применение чПСК в биопринтинге [112, 113] для изучения возможных эффектов параметров процесса биопринтинга на жизнеспособность клетки и потенциал дифференцировки.
В отношении инжиниринга целого органа несколько проблем должны быть приняты во внимание для реализации этой техники [103, 104]: а) разработка новых биочернил (т.е. ткань специфичных биочернил); б) улучшение устройств биопринтинга с достаточным пространственным разрешением для копирования иерархичной структуры сложного органа и сложности клеток органа; с) необходимость васкуляризации; д) разработка адаптированной перфузии биореакторов, подходящих для биопринтинга и дальнейшего созревания органа.
ЗАКЛЮЧЕНИЕ
Последние три года оказались впечатляющими в области инжиниринга почечной ткани.
Недавние работы демонстрируют осуществимость не только создания почечных клеток из пациент-специфичных иПСК, но и понимание сигналов, управляющих их образованием in vitro. Обнаруженные различия в данных указывают, что образованные почечные SD-структуры при комбинации почечных дифференцированных клеток из чПСК имеют различную степень функционального потенциала. Таким образом, предполагается, что необходимо развивать в дальнейшем методики in vivo, доказывающие функциональность созданных из иПСК пациента почечных клеток, например, их трансплантация в нефрэктомически поврежденную почку на мышиных моделях. Кроме того, необходимо понимать, какие молекулярные компоненты определяют почечную идентичность в ходе развития у человека, а создание репортерных ПСК для почечных маркеров являются необходимыми для всестороннего анализа развития почки, приводя к разработке новых протоколов для формирования зрелых и функциональных почечных клеток.
Другая проблема, относящаяся к инжинирингу почки, касается разработки инновационных методов, позволяющих имитировать такую сложную структуру органа. Недавно две разные стратегии привлекли внимание ученых - инжиниринг целого органа путем децеллюляризации/рецеллюляризации и биопринтинг живых орган-подобных структур, что могло бы стать новым источником органного обеспечения.
В заключение, продолжающиеся исследования в области регенеративной медицины будут напрямую способствовать созданию новых стратегий биоинжиниринга почки: от производства биоостова и SD-живых структур до продукции почечных клеток из иПСК пациента в клинической практике.
Список литературы
1. https://www.kidney.org/news/newsroom/factsheets/Organ-Donation-and-Transplantation-Stats.
2. http://optn.transplant.hrsa.gov/3. Song B, Smink AM, Jones CV, et al. The directed differentiation of human iPS cell into kidney podocytes. PLoS One 2012; 7, e46453
3. Narayanan K, Schumacher KM, Tasnim F et al. Human embryonic stem cells differentiate into functional renal proximal tubular-like cells. Kidney 2013; Int 83, 593–603
4. Кatari R, Peloso A, Zambon JP et al. Renal bioengineering with scaffolds generated from human kidneys. Nephron 2014; Exp Nephrol 126, 119–124
5. Mandrycky C, Wang Z, Kim K & Kim DH. 3D bioprinting for engineering complex tissues. Biotechnol 2015; Adv doi: 10.1016/j. biotechadv.2015.12.011
6. Montserrat N, Ramırez-Bajo MJ, Xia Y et al. Generation of induced pluripotent stem cells from human renal proximal tubular cells with only two transcription factors, OCT4 and SOX2. J Biol Chem 2012; 287, 24131–24138
7. Baer PC, Geiger H. Human renal cells from the thick ascending limb and early distal tubule: characterization of primary isolated and cultured cells by reverse transcription polymerase chain reaction. Nephrology 2008; 13, 316–321
8. Baer PC, Nockher WA, Haase W, Scherberich JE. Isolation of proximal and distal tubule cells from human kidney by immunomagnetic separation. Technical note. Kidney 1997; Int 52, 1321–1331
9. Humphreys BD, Czerniak S, DiRocco DP, et al. Repair of injured proximal tubule does not involve specialized progenitors. Proc Natl Acad Sci USA 2011; 108, 9226-9231
10. Song J, Czerniak S, Wang T et al. Characterization and fate of telomerase-expressing epithelia during kidney repair. J Am Soc Nephrol 2011; 22, 2256–2265
11. Humphreys BD, Valerius MT, Kobayashi A et al. Intrinsic epithelial cells repair the kidney after injury. Cell Stem Cell 2008; 2, 284–291
12. Romagnani P, Lasagni L, Remuzzi G. Renal progenitors: an evolutionary conserved strategy for kidney regeneration. Nat Rev Nephrol 2013; 9, 137–146
13. Romagnani P, Anders H-J. What can tubular progenitor cultures teach us about kidney regeneration? Kidney 2013; Int 83, 351–353
14. Osafune K, Takasato M, Kispert A, Asashima MNR. Identification of multipotent progenitors in the embryonic mouse kidney by a novel colonyforming assay. Development 2006; 133, 151–161
15. Little MH, McMahon AP. Mammalian kidney development: principles, progress, and projections.Cold Spring Harb Perspect Biol 2012; 4, 3
16. Thomson JA. Embryonic stem cell lines derived from human blastocysts. Science 1998; 282, 1145–1147
17. Wakayama T, Tabar V, Rodriguez I et al. Differentiation of embryonic stem cell lines generated from adult somatic cells by nuclear transfer. Science 2001; 292, 740–743
18. Tada M, Takahama Y, Abe K et al. Nuclear reprogramming of somatic cells by in vitro hybridization with ES cells. Curr Biol 2001; 11, 1553–1558
19. Hou P, Li Y, Zhang X et al. Pluripotent stem cells induced from mouse somatic cells by smallmolecule compounds. Science 2013; 341, 651–654
20. Takahashi K, Tanabe K, Ohnuki M et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell 2007; 131, 861–872
21. Kazutoshi Takahashi SY. A developmental framework for induced pluripotency. Development 2015; 142,3274–3285
22. .Zhu S, Li W, Zhou H, Wei et al. Reprogramming of human primary somatic cells by OCT4 and chemical compounds. Cell Stem Cell 2010; 7, 651–655
23. Aasen T, Raya A, Barrero MJ et al. Efficient and rapid generation of induced pluripotent stem cells from human keratinocytes. Nat Biotechnol 2008; 26, 1276–1284
24. Giorgetti A, Montserrat N, Aasen T et al. Generation of induced pluripotent stem cells from human cord blood using OCT4 and SOX2. Cell Stem Cell 2009; 5, 353–357
25. Kim JB, Greber B, Ara et al. Direct reprogramming of human neural stem cells by OCT4. Nature 2009; 461, 649–643
26. Gonzalez F, Boue S, Belmonte JCI. Methods for making induced pluripotent stem cells: reprogramming a la carte. Nat Rev Genet 2011; 12, 231–242
27. Zhou H, Wu S, Joo JY et al. Generation of induced pluripotent stem cells using recombinant proteins. Cell Stem Cell 2009; 4, 381–384
28. Kim D, Kim C-H, Moon J-I et al. Generation of human induced pluripotent stem cells by direct delivery of reprogramming proteins. Cell Stem Cell 2009; 4, 472–476
29. Okita K, Matsumura Y, Sato Y et al. A more efficient method to generate integration-free human iPS cells. Nat Methods 2011; 8, 409–412
30. Warren L, Manos PD, Ahfeldt T et al. Highly efficient reprogramming to pluripotency and directed differentiation of human cells with synthetic modified mRNA. Cell Stem Cell 2010; 7, 618–630
31. Anokye-Danso F, Trivedi CM, Juhr D et al. Highly efficient miRNA-mediated reprogramming of mouse and human somatic cells to pluripotency. Cell Stem Cell 2011; 8, 376–388
32. Meng G, Liu S, Rancourt DE. Synergistic effect of medium, matrix, and exogenous factors on the adhesion and growth of human pluripotent stem cells under defined, xeno-free conditions. Stem Cells Dev 2012; 21, 2036–2048
33. Sugii S, Kida Y, Kawamura T et al. Human and mouse adiposederived cells support feeder-independent induction of pluripotent stem cells. Proc Natl Acad Sci USA 2010; 107, 3558–3563.
34. Nakagawa M, Taniguchi Y, Senda S et al. A novel efficient feeder-free culture system for the derivation of human induced pluripotent stem cells. Sci Rep 2014; 4, 3594
35. Raya A, Rodrıguez-Piza I, Guenechea G et al. Diseasecorrected haematopoietic progenitors from Fanconi anaemia induced pluripotent stem cells. Nature 2009; 460, 53–59
36. Ebert AD, Yu J, Rose FF et al. Induced pluripotent stem cells from a spinal muscular atrophy patient. Nature 2009; 457, 277–280
37. Ye L, Chang JC, Lin C et al. Induced pluripotent stem cells offer new approach to therapy in thalassemia and sickle cell anemia and option in prenatal diagnosis in genetic diseases. Proc Natl Acad Sci USA 2009; 106, 9826–9830
38. Liu G-H, Barkho BZ, Ruiz S et al. Recapitulation of premature aging with iPSCs from Hutchinson-Gilford progeria syndrome. Nature 2009; 472, 221–225
39. Itzhaki I, Maizels L, Huber I et al. Modelling the long QT syndrome with induced pluripotent stem cells. Nature 2011; 471, 225–229
40. Nguyen HN, Byers B, Cord B et al. LRRK2 mutant iPSCderived DA neurons demonstrate increased susceptibility to oxidative stress. Cell Stem Cell 2011; 8, 267–280
41. Lee G, Papapetrou EP, Kim H et al. Modeling pathogenesis and treatment of familial dysautonomia using patient specific iPSCs. Nature 2011; 461, 402–406
42. Moretti A, Bellin M, Welling A et al. Patient-specific induced pluripotent stem-cell models for long-QT syndrome. N Engl J Med 2010; 363, 1397–1409
43. Li M, Suzuki K, Kim NY et al. A cut above the rest: targeted genome editing technologies in human pluripotent stem cells. J Biol Chem 2014; 289, 4594–4599
44. Liu G-H, Suzuki K, Qu J et al. Targeted gene correction of laminopathyassociated LMNA mutations in patient-specific iPSCs. Cell Stem Cell 2011; 8, 688–694
45. Howden SE, Gore A, Li Z et al. Genetic correction and analysis of induced pluripotent stem cells from a patient with gyrate atrophy. Proc Natl Acad Sci USA 2011; 108, 6537–6542
46. Papapetrou EP, Lee G, Malani N et al. Genomic safe harbors permit high b-globin transgene expression in thalassemia induced pluripotent stem cells. Nat Biotechnol 2011; 29,73–78
47. Li M, Suzuki K, Qu J et al. Efficient correction of hemoglobinopathycausing mutations by homologous recombination in integration-free patient iPSCs. Cell Res 2011; 21, 1740–1744
48. Liu G-H, Qu J, Suzuki K et al. Progressive degeneration of human neural stem cells caused by pathogenic LRRK2. Nature 2012; 491, 603–607
49. Fattahi F, Steinbeck JA, Kriks S et al. Deriving human ENS lineages for cell therapy and drug discovery in Hirschsprung disease. Nature 2016; 531, 105–109
50. Tiscornia G, Vivas EL, Izpisua Belmonte JC. Diseases in a dish: modeling human genetic disorders using induced pluripotent cells. Nat Med 2011; 17, 1570–1576
51. Shankland SJ, Pippin JW, Reiser J, Mundel P. Podocytes in culture: past, present, and future. Kidney Int 2007; 72, 26–36
52. Mae S-I, Shono A, Shiota F et al. Monitoring and robust induction of nephrogenic intermediate mesoderm from human pluripotent stem cells. Nat Commun 2013; 4, 1367
53. Araoka T, Mae S, Kurose Y et al. Efficient and rapid induction of human iPSCs/ESCs into nephrogenic intermediate mesoderm using small molecule-based differentiation methods. PLoS One 2014; 9, e84881
54. Xia Y, Nivet E, Sancho-Martinez I et al. Directed differentiation of human pluripotent cells to ureteric bud kidney progenitorlike cells. Nat Cell Biol 2013; 15, 1507–1515
55. Takasato M, Er PX, Becroft M et al. Directing human embryonic stem cell differentiation towards a renal lineage generates a self-organizing kidney. Nat Cell Biol 2014; 16, 118–126
56. Lam AQ, Freedman BS, Morizane R et al. Rapid and efficient differentiation of human pluripotent stem cells into intermediate mesoderm that forms tubules expressing kidney proximal tubular markers. J Am Soc Nephrol 2013; 25, 1211–1225
57. Taguchi A, Kaku Y, Ohmori T et al. Redefining the in vivo origin of metanephric nephron progenitors enables generation of complex kidney structures from pluripotent stem cells. Cell Stem Cell 2014; 14, 53–67
58. Imberti B, Tomasoni S, Ciampi O et al. Renal progenitors derived from human iPSCs engraft and restore function in a mouse model of acute kidney injury. Sci Rep 2015; 5, 8826
59. Morizane R, Lam AQ, Freedman BS et al. Nephron organoids derived from human pluripotent stem cells model kidney development and injury. Nat Biotechnol 2015; 33, 1193–1200
60. Freedman BS, Brooks CR, Lam AQ et al. Modelling kidney disease with CRISPR-mutant kidney organoids derived from human pluripotent epiblast spheroids. Nat Commun 2015; 6, 8715
61. Takasato M, Er PX, Chiu HS et al. Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis. Nature 2015; 526, 564–568
62. Xiao-Jie L, Hui-Ying X, Zun-Ping K et al. CRISPR-Cas9: a new and promising player in gene therapy. J Med Genet 2015; 52, 289–296
63. Hu J, Lei Y, Wong W-K, Liu S et al. Direct activation of human and mouse Oct4 genes using engineered TALE and Cas9 transcription factors. Nucleic Acids Res 2014; 42, 4375–4390
64. Elliott DA, Braam SR, Koutsis K et al. NKX2-5eGFP/w hESCs for isolation of human cardiac progenitors and cardiomyocytes. Nat Methods 2011; 8, 1037–1040
65. Den Hartogh SC, Schreurs C, Monshouwer-Kloots JJ et al. Dual reporter MESP1 mCherry/w -NKX2-5 eGFP/w hESCs enable studying early human cardiac differentiation. Stem Cells 2015; 33, 56–67
66. Krentz NA, Nian CLF. TALEN/CRISPRmediated eGFP knock-in add-on at the OCT4 locus does not impact differentiation of human embryonic stem cells towards endoderm. PLoS One 2014; 9, e114275
67. Langer R, Vacanti JP. Tissue engineering. Science 1993; 260, 920–926 69. Kim TG, Shin H, Lim DW. Biomimetic scaffolds for tissue engineering. Adv Funct Mater 2012; 22, 2446–2468
68. Mallick KK, Cox SC. Biomaterial scaffolds for tissue engineering. Front Biosci 2013; 5, 341–360
69. Kamel RA, Ong JF, Eriksson E et al. Tissue engineering of skin. J Am Coll Surg 2013; 217: 533–555
70. Sittinger M, Bujia J, Minuth WW et al. Engineering of cartilage tissue using bioresorbable polymer carriers in perfusion culture. Biomaterials 1994; 15, 451–456
71. Liao J, Guo X, Grande-Allen KJ et al. Bioactive polymer/ extracellular matrix scaffolds fabricated with a flow perfusion bioreactor for cartilage tissue engineering. Biomaterials 2010; 31, 8911–8920
72. Amini AR, Laurencin CT, Nukavarapu SP. Bone tissue engineering: recent advances and challenges. Crit Rev Biomed Eng 2012; 40, 363–408
73. Atala A. Tissue engineering of human bladder. Br Med Bull 2011; 97, 81–104
74. Koike N, Fukumura D, Gralla O et al. Tissue engineering: creation of longlasting blood vessels. Nature 2004; 428, 138–139
75. Kojima K, Vacanti CA.Tissue engineering in the trachea. Anat Rec 2014; 297, 44–50
76. Tapias LF, Ott HC. Decellularized scaffolds as a platform for bioengineered organs. Curr Opin Organ Transplant 2014; 19, 145–152
77. Ross EA, Williams MJ, Hamazaki T et al. Embryonic stem cells proliferate and differentiate when seeded into kidney scaffolds. J Am Soc Nephrol 2014; 20, 2338–2347
78. Song JJ, Guyette JP, Gilpin SE et al. Regeneration and experimental orthotopic transplantation of a bioengineered kidney. Nat Med 2013; 19, 646–651
79. Burgkart R, Tron A, Prodinger P et al. Decellularized kidney matrix for perfused bone engineering. Tissue Eng Part C Methods 2014; 20, 553–561
80. Bonandrini B, Figliuzzi M, Papadimou E et al. Recellularization of wellpreserved acellular kidney scaffold using embryonic stem cells. Tissue Eng Part A 2014; 20, 1486–1498
81. Caralt M, Uzarski JS, Iacob S et al. Optimization and critical evaluation of decellularization strategies to develop renal extracellular matrix scaffolds as biological templates for organ engineering and transplantation. Am J Transplant 2014; 15, 64–75
82. Peloso A, Ferrario J, Maiga B et al. Creation and implantation of acellular rat renal ECM-based scaffolds. Organogenesis 2015; 1, 58–74
83. Guan Y, Liu S, Sun C et al. The effective bioengineering method of implantation decellularized renal extracellular matrix scaffolds. Oncotarget 2015; 6, 36126–36138
84. Sullivan DC, Mirmalek-Sani SH, Deegan DB et al. Decellularization methods of porcine kidneys for whole organ engineering using a high-throughput system. Biomaterials 2012; 33, 7756–7764
85. Orlando G, Farney AC, Iskandar SS et al. Production and implantation of renal extracellular matrix scaffolds from porcine kidneys as a platform for renal bioengineering investigations. Ann Surg 2012; 256, 363–370
86. Guan Y, Liu S, Liu Y et al. Porcine kidneys as a source of ECM scaffold for kidney regeneration. Mater Sci Eng C Mater Biol Appl 2015; 56, 451–456
87. Nakayama KH, Batchelder CA, Lee CI, Tarantal AF. Decellularized rhesus monkey kidney as a three-dimensional scaffold for renal tissue engineering. Tissue Eng Part A 2010; 16, 2207–2216
88. Orlando G, Booth C, Wang Z et al. Discarded human kidneys as a source of ECM scaffold for kidney regeneration technologies. Biomaterials 2013; 34, 5915–5925
89. Peloso A, Petrosyan A, Da Sacco S et al. Renal extracellular matrix scaffolds from discarded kidneys maintain glomerular morphometry and vascular resilience and retains critical growth factors. Transplantation 2015; 99, 1807–1816
90. Crapo PM, Gilbert TW, Badylak SF. An overview of tissue and whole organ decellularization processes. Biomaterials 2012; 32, 3233–3243
91. He M, Callanan A. Comparison of methods for whole-organ decellularization in tissue engineering of bioartificial organs. Tissue Eng Part B Rev 2013; 19, 194–208
92. Keane TJ, Swinehart I, Badylak SF. Methods of tissue decellularization used for preparation of biologic scaffolds and in-vivo relevance. Methods 2015; 84, 25–34
93. Nakayama KH, Lee CCI, Batchelder CA, Tarantal AF. Tissue specificity of decellularized rhesus monkey kidney and lung scaffolds. PLoS One 2013; 8, e64134
94. O’Neill JD, Freytes DO, Anandappa AJ et al. The regulation of growth and metabolism of kidney stem cells with regional specificity using extracellular matrix derived from kidney. Biomaterials 2013; 34, 9830–9841
95. Yu YL, Shao YK, Ding YQ et al. Decellularized kidney scaffold-mediated renal regeneration. Biomaterials 2014; 35, 6822–6828
96. Abolbashari M, Agcaoili SM, Lee MK et al. Repopulation of porcine kidney scaffold using porcine primary renal cells. Acta Biomater 2016; 29, 52–61
97. Ross EA, Abrahamson DR, St. John P et al. Mouse stem cells seeded into decellularized rat kidney scaffolds endothelialize and remodel basement membranes. Organogenesis 2012; 8, 49–55
98. Bijonowski BM, Miller WM, Wertheim JA. Bioreactor design for perfusion-based, highly vascularized organ regeneration. Curr Opin Chem Eng 2013; 2, 32–40
99. Pollock CA. Toward a bioartificial kidney: will embryonic stem cells be the answer? Kidney 2013; Int 83, 543–545
100. Badylak SF, Taylor D, Uygun K. Wholeorgan tissue engineering: decellularization and recellularization of three-dimensional matrix scaffolds. Annu Rev Biomed Eng 2011; 13, 27–53
101. Murphy SV, Atala A. 3D bioprinting of tissues and organs. Nat Biotechnol 2014; 32, 773–785
102. Groll J, Boland T, Blunk T et al. Biofabrication: reappraising the definition of an evolving field. Biofabrication 2016; 8, 013001
103. Skardal A, Atala A. Biomaterials for integration with 3-D bioprinting. Ann Biomed Eng 2015; 43, 730–746
104. Chung JHY, Naficy S, Yue Z et al. Bio-ink properties and printability for extrusion printing living cells. Biomater Sci 2013; 1, 763
105. Ferris CJ, Gilmore KJ, Beirne S et al. Bio-ink for ondemand printing of living cells. Biomater Sci 2013; 1, 224
106. Pati F, Jang J, Ha D-H, et al. Printing threedimensional tissue analogues with decellularized extracellular matrix bioink. Nat Commun 2014; 5, 3935
107. Fullhase C, Soler R, Atala A et al. A novel hybrid printing system for the generation of organized bladder tissue. J Urol 2009; 181, 282–283
108. Williams SK, Touroo JS, Church KH, Hoying JB. Encapsulation of adipose stromal vascular fraction cells in alginate hydrogel spheroids using a direct-write three-dimensional printing system. Biores Open Access 2013; 2, 448–454
109. Mironov V, Visconti RP, Kasyanov V et al. Organ printing: tissue spheroids as building blocks. Biomaterials 2009; 30, 2164–2174
110. Faulkner-Jones A, Greenhough S, King JA et al. Development of a valve-based cell printer for the formation of human embryonic stem cell spheroid aggregates. Biofabrication 2013; 5, 015013
111. Faulkner-Jones A, Fyfe C, Cornelissen DJ, Gardner et al. Bioprinting of human pluripotent stem cells and their directed differentiation into hepatocyte-like cells for the generation of minilivers in 3D. Biofabrication 2015; 7, 044102
Об авторах
Н. МонтсерратИспания
Программы по плюрипотентным стволовым клеткам и активации эндогенной ткани для регенерации органов (PR Lab)
Е. Гаррета
Испания
Программы по плюрипотентным стволовым клеткам и активации эндогенной ткани для регенерации органов (PR Lab)
Х.К.И. Бельмонте
Соединённые Штаты Америки
Лаборатория экспрессии гена
Рецензия
Для цитирования:
Монтсеррат Н., Гаррета Е., Бельмонте Х. РЕГЕНЕРАТИВНЫЕ СТРАТЕГИИ РЕКОНСТРУИРОВАНИЯ ПОЧКИ. Нефрология. 2016;20(6):10-25.
For citation:
Montserrat N., Garreta E., Belmonte J. REGENERATIVE STRATEGIES FOR KIDNEY ENGINEERING. Nephrology (Saint-Petersburg). 2016;20(6):10-25. (In Russ.)
JATS XML








































