Перейти к:
ЭНДОТОКСИН И ХРОНИЧЕСКОЕ ВОСПАЛЕНИЕ ПРИ ХРОНИЧЕСКОЙ БОЛЕЗНИ ПОЧЕК
Аннотация
Эндотоксин – облигатный компонент клеточной стенки грамотрицательных бактерий – один из основных этиологических факторов хронического воспаления у больных хронической болезнью почек. Тяжесть эндотоксинемии возрастает по мере прогрессирования почечной недостаточности. Основными источниками эндотоксина являются микробиом толстой кишки, а также биопленки, формируемые бактериями, в системе водоподготовки, венозных катетеров и т.д. Эндотоксин вызывает различные стойкие нарушения гомеостаза: клеточного и гуморального иммунитета, метаболические расстройства и др. Коррекция указанных нарушений представляет собой сложную задачу. Эндотоксинемия у больных хронической болезнью почек значительно ухудшает результаты лечения и рост летальности.
Для цитирования:
Ватазин А.В., Зулькарнаев А.Б. ЭНДОТОКСИН И ХРОНИЧЕСКОЕ ВОСПАЛЕНИЕ ПРИ ХРОНИЧЕСКОЙ БОЛЕЗНИ ПОЧЕК. Нефрология. 2016;20(6):26-32.
For citation:
Vatazin A.V., Zulkarnaev A.B. ENDOTOXIN AND CHRONIC INFLAMMATION IN PATIENTS WITH CHRONIC KIDNEY DISEASE. Nephrology (Saint-Petersburg). 2016;20(6):26-32. (In Russ.)
Согласно прошлому отчету Российского диализного общества [1], на начало 2014 года заместительную почечную терапию получали 35 305 человек по все России, из них 28 440 больных получали различные варианты диализа. Ежегодный прирост пациентов с 5 стадией хронической болезни почек составляет более 7300 человек. При этом, это лишь «верхушка айсберга», поскольку данный отчет не охватывает больных на додиализных стадиях. Все это позволяет оценить масштаб проблемы. Несмотря на то, что в настоящее время уремия редко является непосредственной причиной смерти больных, хроническая болезнь почек занимает важное место в структуре летальности, поскольку по мере прогрессирования заболевания риск смерти увеличивается в несколько раз.
Эндотоксин или липополисахарид (ЛПС) грамотрицательных бактерий - универсальный фактор патогенеза множества заболеваний. ЛПС является одним из сильнейших пирогенов и способен инициировать системную воспалительную реакцию. Хроническое воспаление низкой степени, свойственное больным с хронической болезнью почек, порождает множественные нарушения гомеостаза, повышает риск развития сердечнососудистых осложнений и ухудшает прогноз выживаемости [2, 3].
Структура и биологическое действие липополисахарида.
Изучение строения ЛПС, а также путей реализации его биологического действия может быть полезно для разработки лечебных и профилактических мер.

Рис. 1. Структура эндотоксина.
По PG. Cardoso et al. с изменениями [4].
Richard Pfeiffer в 1892 году открыл эндотоксин - термостойкий бактериальный яд и впоследствии сформулировал основные положения концепции биологического действия эндотоксина.
Молекула ЛПС представляет собой облигатный компонент клеточной стенки грамотрицательных бактерий. Структурно ЛПС состоит из липида А, который представлен цепями жирной кислоты и консервативного полисахаридного ядра, к сердцевине ядра прикреплена вариабельная углеводная цепочка - О-антиген (рис. 1).
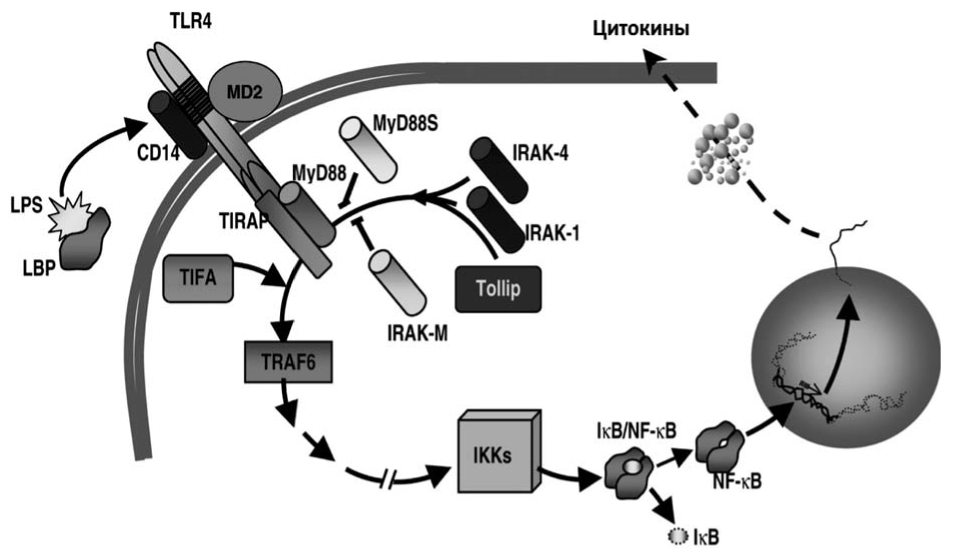
Рис. 2. Схема взаимодействия TLR4 и эндотоксина.
По J. Villar et al. с изменениями [5].
Основной сигнальный путь при взаимодействии клеток организма-хозяина и эндотоксина реализуется через систему Toll-пободных рецепторов - TLR (Toll-like receptor), экспрессируемых моноцитами, дендритными клетками, тучными клетками, В-лимоцитами. Схема взаимодействия эндотоксина и TLR4 представлена на рис. 2.
Специфичным лигандом для TLR4 является эндотоксин. Для активации этого рецептора также необходимо наличие компонентов рецепторного комплекса: CD 14 и LBP (lipopolysaccharide binding protein), а также лимфоцитарного антигена-96 - молекулы MD-2. Взаимодействуя с трансмембранным рецептором - TLR4-MD-2, комплекс эндотоксин-LBP-CD14 специфическим образом активирует мононуклеарные фагоциты, что сопровождается выделением цитокинов - ИЛ-1, ИЛ-6, ИЛ-8, ИЛ-12, ИЛ-23, ИЛ-27, ФНОа и др.
После связывания лиганда разрывается комплекс со специфическим ингибитором - Tollip (Toll interacting protein), происходит активация и связывание TIR-домена рецептора (Toll-interleukin-1 receptor) с различными комбинациями домен-содержащих адаптерных белков. В зависимости от набора адаптерных белков активируются определенные сигнальные пути и опосредуется соответствующий транскрипторный ответ клетки. В прошлые годы было установлено, что различные внутриклеточные пути реакций, вызванные взаимодействием TLR4 и ЛПС, опосредуют разные варианты транскрипторного ответа клетки [6].
Эндотоксин оказывает прямое цитотоксиче- ское действие. Благодаря наличию гидрофобной части молекулы эндотоксин способен внедряться в двухслойную клеточную мембрану, способствуя ее реорганизации: изменению гидрофобности, поверхностного заряда, функциональной стабильности. Это приводит к нарушениям клеточного метаболизма: угнетению клеточного дыхания, нарушению функций митохондрий, ускорению окислительных процессов.
При проникновении в различные жидкие среды организма эндотоксин, обладающий чрезвычайно высокой биологической активностью, приводит к многочисленным патофизиологическим эффектам: активации системы коагуляции, комплемента и клеток крови (моноцитов, макрофагов, нейтрофилов, эозинофилов, базофилов), а также эндотелиоцитов. Развивается комплекс адаптационных реакций, который выражается в активации как клеточного, так и гуморального иммунитета. Массивное выделение медиаторов клинически проявляется системной воспалительной реакцией [4, 7].
Известно, что эндотоксин является специфическим активатором комплемента, в результате чего генерируются анафилотоксины - фракции С3а и С5а. Активация системы комплемента приводит к секреции базофилами биологически активных веществ: гистамина, серотонина, брадикинина. В результате происходят изменение тонуса гладкой мускулатуры и активация клеток эндотелия капилляров, усиление сосудистой проницаемости. Фрагменты С3а и С5а комплемента способствуют хемотаксису, агрегации и дегрануляции клеток крови, что приводит к образованию свободных радикалов кислорода и дополнительному выделению медиаторов [8, 9].
Известно, что инфекция способна активировать коагуляцию крови. Во многом это обусловлено влиянием эндотоксина, который способен инициировать коагуляционный каскад напрямую. Эндотоксин вызывает повышенную экспрессию тканевого фактора на мембранах эндотелиоцитов, активирует фактор XII и ингибитор активатора плазминогена [9, 10].
Низкие концентрации ЛПС, выявленные в крови у здоровых людей, позволяют рассматривать его как фактор, необходимый для нормального развития иммунной системы и облигатного фактора адаптационного синдрома. Физиологическая концентрация ЛПС в крови (выявленная при помощи ЛАЛ-теста) составляет до 1 EU/мл. С точки зрения группы отечественных авторов, активно занимающихся изучением данного вопроса, физиологически контролируемое присутствие ЛПС в крови «обеспечивает поддержание активности жизненно важных систем организма на необходимом в данный момент времени уровне, поскольку эндотоксина является неспецифическим мульти- потентным активатором в силу своей способности активировать протеинкиназу С, снимающую репрессию с генома» [7].
Доказана важная роль хронического воспаления, инициируемого ЛПС, в патогенезе атеросклероза, бронхиальной астмы, псориаза, аллергической реакции. [7]. Помимо этого, повышенное содержание ЛПС в крови способствует прогрессированию инсулинрезистентности, метаболического синдрома, ожирения [11, 12].
При нарастании концентрации эндотоксина выше физиологической его эффекты многократно усиливаются, развивается системная воспалительная реакция. В результате комплекса адаптационных реакций, в которые вовлечены комплемент, клетки крови (моноцитарные и зернистые лейкоциты), а также эндотелиоциты, активируются клеточное и гуморальное звенья иммунитета.
Источники эндотоксина и методы оценки тяжести эндотоксинемии. Важность адекватной оценки тяжести эндотоксинемии у пациентов с хронической болезнью почек обусловлена рядом факторов. Известно, что для больных с ХБП свойствен повышенный уровень ЛПС в крови [3, 13]. Повышение концентрации эндотоксина, а также компонентов рецепторного комплекса TLR4 (растворимой формы CD 14, липополисахаридсвязывающего белка) в крови у больных как на додиализной стадии, так и у больных, получающих гемо- или перитонеальный диализ, связано с повышением риска развития сердечно-сосудистых осложнений и смерти [2, 13, 14, 15].
Основным источником эндогенного ЛПС являются грамотрицательные бактерии толстой кишки. Об этом свидетельствует, с одной стороны, повышенное содержание ЛПС в крови воротной вены и лимфатических протоках толстого кишечника, обнаружение там фрагментов ДНК бактерий. У больных с хронической болезнью почек транслокация ЛПС из просвета кишечника в системную циркуляцию усиливается. Об этом косвенно свидетельствуют хронические воспалительные изменения стенки кишки, обнаруживаемые при аутопсии. При этом тяжесть этих изменений и эндотоксинемии прямо коррелирует со снижением скорости клубочковой фильтрации. Изменению количественного и качественного состава кишечного микробиома способствуют уремия, электролитные нарушения, особенности питания и другие факторы [15].
При этом у данной категории больных, наряду с микробиомом толстой кишки, важным источником ЛПС являются диализат [3] в результате наличия бактериальных биопленок в системе водоочистки и магистралях [16], а также центральные венозные [15, 17] и перитонеальные катетеры [18]. Сложность и неоднозначность исследования последствий системной эндотоксинемии in vivo главным образом обусловлена сложностью определения концентрации или активности (что в целом также косвенно отражает его концентрацию) эндотоксина в крови.
Самым распространенным тестом для выявления и количественной оценки уровня эндотоксина в лекарственных препаратах и воде для ГД является LAL-тест (Limulus amebocyte lysate test) - реакция лизата амебоцитов с эндотоксином, в которой в результате каскада реакций сериновых протеаз формируется гель (течение реакции схоже с течением свертывания крови у млекопитающих). Сложности с определением концентрации ЛПС в крови связаны с особенностями проведения LAL-теста: в различных вариантах этого теста отмечается сильное влияние компонентов плазмы (ферментных систем, солей желчных кислот, липопротеинов и других белков), лекарственных препаратов (антибиотики, гепарин) и даже мембран диализаторов (целлюлозных) на результат. Активность ЛПС разных грамотрицательных бактерий в LAL-тесте неоднородна. В связи с этим реакция организма и результатов LAL-теста не всегда тесно коррелируют. Помимо этого, отмечается значительная неоднородность реактивов. [19, 20] Для стандартизации результатов было предложено выражать содержание эндотоксина не как абсолютную концентрацию, а в единицах эндотоксина на 1 мл по отношению к контрольному стандартному эндотоксина E. coli [20].
Перспективным является вариант LAL-теста с применением светорассеивающего фотометра (endotoxin scattering photometry - ESP). Этот тест способен обнаруживать очень низкие концентрации ЛПС в крови и более информативен, чем классический турбодиметрический LAL-тест [21].
Известен метод детекции ЛПС в препаратах и воде с применением рекомбинантного фактора свертывания С (фактора свертывания крови крабов семейства Limulidae) - внутриклеточной сериновой протеазы (проферемента), которая инициирует каскад коагуляции в ответ на эндотоксин. Каскад реакций в тесте короче, чем при классическом LAL-тесте, метод более чувствителен и более стандартизирован. Тем не менее, пока нет сообщений о применении этого метода для обнаружения ЛПС в крови [22].
Единственным одобренным методом для определения эндотоксина в крови является исследование активности эндотоксина (EAA - endotoxin activity assay) [23]. Однако и этот метод имеет два относительных недостатка: недостаточную информативность при низких концентрациях эндотоксина, а также этот тест выражает не непосредственно концентрацию эндотоксина, а индуцированную ЛПС кислородпродуцирующую способность нейтрофилов конкретного больного в присутствии специфических анти-ЛПС-антител [20], т.е. тест зависит еще и от активности нейтрофилов пациента.
В связи со сложностью детекции и количественной оценки эндотоксинемии предложены другие, косвенные способы оценки. CD14 в растворимой или мембранной форме - необходимый компонент рецепторного комплекса при взаимодействии клеток с ЛПС, причем концентрации этих молекул тесно коррелируют. Доказано, что уровень растворимой формы CD14 повышен у больных с ХБП, что ассоциировано с ростом риска смерти с числом сердечно-сосудистых осложнений [24, 25]. Схожим суррогатным способом оценки тяжести эндотоксинемии у больных на ГД является уровень анти-ЛПС-антител классов IgA, M, G [13, 20].
Уровень эндотоксинемии выше, чем у здоровых людей, но все равно достаточно низок, и ЛПС может не выявляться рутинным методом исследования, особенно в крови. При этом, тем не менее, отмечается значимая корреляция с уровнем С-реактивного белка [2, 26]. Являясь суррогатным маркером системной эндотоксинемии, этот показатель недостаточно специфичен.
Методы борьбы с системной эндотоксинемией.
Существуют филогенетически сложившиеся системы инактивации эндотоксина. В норме большая часть поступающего в кровь воротной вены эндотоксина разрушается в купферовских клетках печени и клетках ретикулоэндотелиальной системы. Тем не менее, постоянное поступление повышенного количества ЛПС кровоток постепенно приводит к несостоятельности антиэндотоксиновых систем.
Предложены множество препаратов, которые должны блокировать биологическое действие эндотоксина: иммунизированная сыворотка [27-29], антиэндотоксиновые IgG и IgM [30], естественные и рекомбинантные антимикробные пептиды [31], липосахаридсвязывающий протеин (естественный акцептор эндотоксина в плазме крови человека) [32], регуляторный белок системы комплемента С1-ингибитор [33], антилипополисахаридный пептид мечехвоста и синтетический антилипополисахаридный пептид [34], пептид М33 [31], антагонист эндотоксина E5564, химерные молекулы TLR4-Fc [35]. Однако на данный момент эти препараты так и не получили широкого распространения, а большинство из них не подтвердили свою клиническую эффективность. Известны работы, посвященные развитию эндотоксиновой толерантности. Ключевые роли в развитии толерантности отводят Toll-подобным рецепторам и их адаптерным белкам, а также активности транскрипционного фактора NF-κβ [36]. Помимо этого, описаны множество природных и синтетических рекомбинантных пептидов [37, 38], которые способны или непосредственно связывать ЛПС, или ингибировать его биологическое действие. Однако пока не существует доступных в клинической практике способов снижения чувствительности к эндотоксину.
На состояние кишечного микробиома, как главного источника эндогенного ЛПС, оказывает влияние характер питания: изменение естественной диеты, а также применение пробиотиков может снизить тяжесть системной эндотоксинемии [15, 39-42]. Помимо этого, доказано, что применение фосфатбиндеров, в частности - севеламера, может оказывать протективный эффект, связывая кишечный ЛПС (как in vitro, так и in vivo) и уменьшая его транслокацию через кишечную стенку, что сопровождается снижением активности системного воспаления (концентрации растворимого CD14, С-реактивного белка, ИЛ-6), окислительного стресса, атерогенеза, дисфункции эндотелия (эндотелина-1, ингибитора-1 активатора плазминогена) [43, 44]. Помимо этого, нормализация микрофлоры кишечника может снизить продукцию уремических токсинов [45, 46].
Материалы, которые в меньшей степени подвержены образованию биопленок - одного из основных источников экзогенного ЛПС, представлены: поливинилхлорид, хлорированный поливинилхлорид, поливинилиденфторид, сшитый полиэтилен, нержавеющая сталь, полипропилен, полиэтилен, акрилонитрил-бутадиен-стирол, политетрафторэтилен и др. Использование этих материалов в системе водоподготовки может уменьшить контаминацию. Эффективными дезинфицирующими средствами могут быть: гипохлорит натрия, надуксусная кислота, формальдегид, озон, растворенный в горячей воде; перуксусная кислота и др. [47]. Также уменьшить содержание эндотоксина в диализате может применение специальных бактериальных и эндотоксиновых фильтров, сухих буферных бикарбонатных систем, а также организационные меры [48-51].
Мембраны, которые используются в диализо- торах, непрерывно эволюционируют. Известны сорбционные способности некоторых мембран, частности, полисульфона [52], AN69 [53], полиметилметакрилата [54]. Различные мембраны \ имеют способность к адсорбции эндотоксина, а также других молекул (в частности, компонентов комплемента, иммуноглобулинов, молекул оксидативного стресса, CD40, цитокинов и др.), при этом они имеют хорошую биосовместимость [55]. Однако сорбционная емкость таких мембран невысока. Интересны исследования по применению комбинированных мембран - «мембран со смешанной матрицей», сочетающих в себе высокие диффузионно-сорбционные показатели [56, 57].
Имеются ряд работ, свидетельствующих, что гепарин обладает способностью дозозависимого ингибирования действия эндотоксина [58-63].
Заключение. Несмотря на то, что за последние годы установлена значительная роль эндотоксина в нормальной физиологии человека, инициируемая при его избытке хроническая воспалительная реакция лежит в основе множества патологических процессов у больных с хроническими заболеваниями почек. Проблема системной эндотоксинемии пока не решена. Основные меры направлены как на борьбу с эндотоксинемией, так и на устранение ее последствий. Дальнейшее изучение данного вопроса позволит улучшить результаты лечения пациентов с хронической болезнью почек.
Список литературы
1. Бикбов БТ, Томилина НА. Заместительная терапия терминальной хронической почечной недостаточности в Российской Федерации в 1998-2013 гг. Отчет по данным российского регистра заместительной почечной терапии. Часть первая. Нефрология и диализ 2015; 17(3, приложение): 5-111 [Bikbov BT, Tomilina NA. Zamestitel’naja terapija terminal’noj hronicheskoj pochechnoj nedostatochnosti v rossijskoj federacii v 1998-2013 gg. Otchet po dannym rossijskogo registra zamestitel’noj pochechnoj terapii. Chast’ pervaja. Nefrologija i dializ 2015; 17(3, prilozhenie): 5-111]
2. Terawaki H, Yokoyama, Yamada Y et al. Low-grade endotoxemia contributes to chronic inflammation in hemodialysis patients: examination with a novel lipopolysaccharide detection method. Ther Apher Dial 2010; 14(5):477-482. doi: 10.1111/j.17449987.2010.00815.x
3. McIntyre CW, Harrison LE, Eldehni MT et al. Circulating endotoxemia: a novel factor in systemic inflammation and cardiovascular disease in chronic kidney disease. Clin J Am Soc Nephrol 2011; 6(1):133-141. doi: 10.2215/CJN.04610510
4. Cardoso PG, Macedo GC, Azevedo V et al. Brucella spp noncanonical LPS: structure, biosynthesis, and interaction with host immune system. Microb Cell Fact 2006; 5:13
5. Villar J, Maca-Meyer N, Perez-Mendez L et al. Bench-tobedside review: understanding genetic predisposition to sepsis. Crit Care 2004; 8(3): 180-189
6. Gyorfy Z, Duda E, Vizler C. Interactions between LPS moieties and macrophage pattern recognition receptors. Vet Immunol Immunopathol 2013; 152(1-2):28-36. doi: 10.1016/j.vetimm.2012.09.020
7. Аниховская ИА, Опарина ОН, Яковлева ММ, Яковлев МЮ. Кишечный эндотоксин как универсальный фактор адаптации и патогенеза общего адаптационного синдрома. Физиология человека 2006; 32(2): 87-91
8. Ward PA. Role of C5 activation products in sepsis. ScientificWorldJournal 2010; 10:2395-2402. doi: 10.1100/tsw.2010.216
9. Kozarcanin H, Lood C, Munthe-Fog L et al. The lectin complement pathway serine proteases (MASPs) represent a possible crossroad between the coagulation and complement systems in thromboinflammation. J Thromb Haemost 2016; 14(3):531-545. doi: 10.1111/jth.13208
10. Esmon CT, Xu J, Lupu F. Innate immunity and coagulation. J Thromb Haemost 2011; 9 Suppl 1:182-188. doi: 10.1111/j.15387836.2011.04323.x
11. Lassenius MI, Pietilainen KH, Kaartinen K et al. Bacterial endotoxin activity in human serum is associated with dyslipidemia, insulin resistance, obesity, and chronic inflammation. Diabetes Care 2011; 34(8):1809-1815. doi: 10.2337/dc10-2197
12. Boutagy NE, McMillan RP, Frisard MI et al. Metabolic endotoxemia with obesity: Is it real and is it relevant? Biochimie 2016; 124:11-20. doi: 10.1016/j.biochi.2015.06.020
13. Белоглазов ВА, Климчук АВ, Гордиенко АИ и др. Динамика показателей гуморального антиэндотоксинового иммунитета и уровень С-реактивного белка у больных хронической болезнью почек, находящихся на программном гемодиализе, при четырехлетнем наблюдении. Нефрология и диализ 2013; 15(2): 140-143 [Beloglazov VA, Klimchuk AV, Gordienko AI i dr. Dinamika pokazatelej gumoral'nogo antijendotoksinovogo immuniteta i uroven' S-reaktivnogo belka u bol'nyh hronicheskoj bolezn'ju pochek, nahodjashhihsja na programmnom gemodialize, pri chetyrehletnem nabljudenii. Nefrologija i dializ 2013; 15(2): 140-143]
14. Feroze U, Kalantar-Zadeh K, Sterling KA et al. Examining associations of circulating endotoxin with nutritional status, inflammation, and mortality in hemodialysis patients. J Ren Nutr 2012; 22(3):317-326. doi: 10.1053/j.jrn.2011.05.004
15. Lau WL, Kalantar-Zadeh K, Vaziri ND. The Gut as a Source of Inflammation in Chronic Kidney Disease. Nephron 2015; 130(2):92-98. doi: 10.1159/000381990
16. Sabatino A, Regolisti G, Brusasco I et al. Alterations of intestinal barrier and microbiota in chronic kidney disease. Nephrol Dial Transplant 2015; 30(6):924-933. doi: 10.1093/ndt/gfu287
17. Shi K, Wang F, Jiang H et al. Gut bacterial translocation may aggravate microinflammation in hemodialysis patients. Dig Dis Sci 2014; 59(9):2109-2117. doi: 10.1007/s10620-014-3202-7
18. Hazzah WA, Hashish MH, El-Koraie AF et al. Circulating bacterial DNA fragments in chronic hemodialysis patients. Saudi J Kidney Dis Transpl 2015; 26(6):1300-1304. doi: 10.4103/13192442.168689
19. Marinho AC, Polay AR, Gomes BP. Accuracy of Turbidimetric Limulus Amebocyte Lysate Assay for the Recovery of Endotoxin Interacted with Commonly Used Antimicrobial Agents of Endodontic Therapy. J Endod 2015; 41(10):1653-1659. doi: 10.1016/j.joen.2015.05.020
20. Wong J, Vilar E, Farrington K. Endotoxemia in end-stage kidney disease. Semin Dial; 28(1):59-67. doi: 10.1111/sdi.12280
21. Shimizu T, Obata T, Sonoda H et al. Diagnostic potential of endotoxin scattering photometry for sepsis and septic shock. Shock 2013; 40(6):504-511. doi: 10.1097/SHK.0000000000000056
22. Ding JL, Ho B. Endotoxin detection-from limulus amebocyte lysate to recombinant factor C. Subcell Biochem 2010; 53:187-208. doi: 10.1007/978-90-481-9078-2_9
23. Yaguchi A, Yuzawa J, Klein DJ et al. Combining intermediate levels of the Endotoxin Activity Assay (EAA) with other biomarkers in the assessment of patients with sepsis: results of an observational study. Crit Care 2012; 16(3):R88. doi: 10.1186/cc11350
24. Poesen R, Ramezani A, Claes K et al. Associations of Soluble CD14 and Endotoxin with Mortality, Cardiovascular Disease, and Progression of Kidney Disease among Patients with CKD. Clin J Am Soc Nephrol 2015; 10(9):1525-1533. doi: 10.2215/CJN.03100315.
25. Raj DS, Shah VO, Rambod M et al. Association of soluble endotoxin receptor CD14 and mortality among patients undergoing hemodialysis. Am J Kidney Dis 2009; 54(6):1062-1071. doi: 10.1053/j.ajkd.2009.06.028
26. Cobo G, Qureshi AR, Lindholm B, Stenvinkel P. C-reactive Protein: Repeated Measurements will Improve Dialysis Patient Care. Semin Dial 2016; 29(1):7-14. doi: 10.1111/sdi.12440
27. Cross AS. Development of an anti-endotoxin vaccine for sepsis. Subcell Biochem 2010; 53: 285-302
28. Muller-Loennies S, Brade L, Brade H. Neutralizing and cross-reactive antibodies against enterobacterial lipopolysaccharide. Int J Med Microbiol 2007; 297(5): 321-340
29. Santos MF, New RR, Andrade GR et al. Lipopolysaccharide as an antigen target for the formulation of a universal vaccine against Escherichia coli O111 strains. Clin Vaccine Immunol 2010; 17(11): 1772-1780
30. Harkin DW, Arnold R, Hoper M. Anti-endotoxin hyperimmune globulin attenuates portal cytokinaemia, phagocytic cell priming, and acute lung injury after lower limb ischaemiareperfusion injury. Eur J Vasc Endovasc Surg 2007; 33(3): 330-339
31. Pini A, Falciani C, Mantengoli E et al. A novel tetrabranched antimicrobial peptide that neutralizes bacterial lipopolysaccharide and prevents septic shock in vivo. FASEB J 2010; 24(4): 1015-1022
32. Li J, Shang G, You M et al. Endotoxin removing method based on lipopolysaccharide binding protein and polyhydroxyalkanoate binding protein PhaP. Biomacromolecules 2011; 12(3): 602-608
33. Liu D, Lu F, Qin G et al. C1 inhibitor-mediated protection from sepsis. J Immunol 2007; 179(6): 3966-3972
34. Kaconis Y, Kowalski I, Howe J et al. Biophysical mechanisms of endotoxin neutralization by cationic amphiphilic peptides. Biophys J 2011; 100(11): 2652-6261
35. Peri F, Piazza M. Therapeutic targeting of innate immunity with Toll-like receptor 4 (TLR4) antagonists. Biotechnol Adv 2012; 30(1): 251-260
36. Fujita T. Molecular mechanism of endotoxin tolerance. Hepatology 2009; 50(4): 1322
37. Brandenburg K, Heinbockel L, Correa W et al. Peptides with dual mode of action: Killing bacteria and preventing endotoxininduced sepsis. Biochim Biophys Acta 2016; 1858(5):971-979. doi: 10.1016/j.bbamem.2016.01.011
38. Sun Y, Shang D. Inhibitory Effects of Antimicrobial Peptides on Lipopolysaccharide-Induced Inflammation. Mediators Inflamm 2015; 2015:167572. doi: 10.1155/2015/167572
39. Moraes C, Fouque D, Amaral AC et al. Trimethylamine N-Oxide From Gut Microbiota in Chronic Kidney Disease Patients: Focus on Diet. J Ren Nutr 2015; 25(6):459-465. doi: 10.1053/j.jrn.2015.06.004
40. Machowska A, Carrero JJ, Lindholm B et al. Therapeutics targeting persistent inflammation in chronic kidney disease. Transl Res 2016; 167(1):204-213. doi: 10.1016/j.trsl.2015.06.012
41. Tzanno-Martins C, Biavo BM, Ferreira-Filho O et al. Clinical efficacy, safety and anti-inflammatory activity of two sevelamer tablet forms in patients on low-flux hemodialysis. Int J Immunopathol Pharmacol 2014; 27(1):25-35
42. Rossi M, Johnson DW, Campbell KL. The Kidney-Gut Axis: Implications for Nutrition Care. J Ren Nutr 2015; 25(5):399-403. doi: 10.1053/j.jrn.2015.01.017
43. Sun PP, Perianayagam MC, Jaber BL. Endotoxinbinding affinity of sevelamer: a potential novel anti-inflammatory mechanism. Kidney Int Suppl 2009; (114):S20-5. doi: 10.1038/ki.2009.403
44. Rodriguez-Osorio L, Zambrano DP, Gracia-Iguacel C et al. Use of sevelamer in chronic kidney disease: beyond phosphorus control. Nefrologia 2015; 35(2):207-217. doi: 10.1016/j.nefro.2015.05.022
45. Mafra D, Fouque D. Gut microbiota and inflammation in chronic kidney disease patients. Clin Kidney J 2015; 8(3):332-334. doi: 10.1093/ckj/sfv026
46. Wing MR, Patel SS, Ramezani A et al. Gut microbiome in chronic kidney disease. Exp Physiol 2016; 101(4):471-477. doi: 10.1113/EP085283
47. Coulliette AD, Arduino MJ. Hemodialysis and water quality. Semin Dial 2013; 26(4):427-438. doi: 10.1111/sdi.12113
48. Schiffl H. High-flux dialyzers, backfiltration, and dialysis fluid quality. Semin Dial 2011; 24(1):1-4. doi: 10.1111/j.1525139X.2010.00786.x
49. Glorieux G, Hulko M, Speidel R et al. Looking beyond endotoxin: a comparative study of pyrogen retention by ultrafilters used for the preparation of sterile dialyis fluid. Sci Rep 2014; 4:6390. doi: 10.1038/srep06390
50. Kashiwagi T, Sato K, Kawakami S et al. The performance evaluation of endotoxin retentive filters in haemodialysis. J Nippon Med Sch 2011; 78(4):214-223
51. Glorieux G, Neirynck N, Veys N, Vanholder R. Dialysis water and fluid purity: more than endotoxin. Nephrol Dial Transplant 2012; 27(11):4010-4021. doi: 10.1093/ndt/gfs306
52. Bowry SK, Gatti E, Vienken J. Contribution of polysulfone membranes to the success of convective dialysis therapies. Contrib Nephrol 2011; 173:110-118. doi: 10.1159/000328960
53. Thomas M, Moriyama K, Ledebo I. AN69: Evolution of the world’s first high permeability membrane. Contrib Nephrol 2011; 173:119-129. doi: 10.1159/000328961
54. Perego AF. Adsorption techniques: dialysis sorbents and membranes. Blood Purif 2013; 35 Suppl 2:48-51. doi: 10.1159/000350848
55. Aucella F, Gesuete A, Vigilante M et al. Adsorption dialysis: from physical principles to clinical applications. Blood Purif 2013; 35 Suppl 2:42-47. doi: 10.1159/000350847
56. Tijink MS, Wester M, Sun J et al. A novel approach for blood purification: mixed-matrix membranes combining diffusion and adsorption in one step. Acta Biomater 2012; 8(6):2279-2287. doi: 10.1016/j.actbio.2012.03.008
57. Tijink MS, Kooman J, Wester M et al. Mixed matrix membranes: a new asset for blood purification therapies. Blood Purif 2014; 37(1):1-3. doi: 10.1159/000356226
58. Li L, Ling Y, Huang M et al. Heparin inhibits the inflammatory response induced by LPS and HMGB1 by blocking the binding of HMGB1 to the surface of macrophages. Cytokine 2015; 72(1):3642. doi: 10.1016/j.cyto.2014.12.010
59. Li X, Liu Y, Wang L et al. Unfractionated heparin attenuates LPS-induced IL-8 secretion via PI3K/Akt/NF-κB signaling pathway in human endothelial cells. Immunobiology 2015; 220(3):399-405. doi: 10.1016/j.imbio.2014.10.008
60. Li X, Li X, Zheng Z et al. Unfractionated heparin suppresses lipopolysaccharide-induced monocyte chemoattractant protein-1 expression in human microvascular endothelial cells by blocking Kruppel-like factor 5 and nuclear factor-κB pathway. Immunobiology 2014; 219(10):778-785. doi: 10.1016/j.imbio.2014.06.005
61. Li X, Zheng Z, Li X, Ma X. Unfractionated heparin inhibits lipopolysaccharide-induced inflammatory response through blocking p38 MAPK and NF-κB activation on endothelial cell. Cytokine 2012; 60(1):114-121. doi: 10.1016/j.cyto.2012.06.008
62. Li X, Zheng Z, Mao Y, Ma X. Unfractionated heparin promotes LPS-induced endothelial barrier dysfunction: a preliminary study on the roles of angiopoietin/Tie2 axis. Thromb Res 2012; 129(5):e223-228. doi: 10.1016/j.thromres.2012.03.003
63. Luan ZG, Naranpurev M, Ma XC. Treatment of low molecular weight heparin inhibits systemic inflammation and prevents endotoxin-induced acute lung injury in rats. Inflammation 2014; 37(3):924-932. doi: 10.1007/s10753-014-9812-6
Об авторах
А. В. ВатазинРоссия
Ватазин Андрей Владимирович, доктор медицинских наук, профессор.
Руководитель отдела трансплантологии, нефрологии и хирургической гемокоррекции.
129110, Москва, ул. Щепкина, д. 61/2, корп. 6.
А. Б. Зулькарнаев
Россия
Зулькарнаев Алексей Батыргараевич, доктор медицинских наук.
Старший научный сотрудник хирургического отделения трансплантологии и диализа.
129110, Москва, ул. Щепкина, д. 61/2, корп. 6.
Рецензия
Для цитирования:
Ватазин А.В., Зулькарнаев А.Б. ЭНДОТОКСИН И ХРОНИЧЕСКОЕ ВОСПАЛЕНИЕ ПРИ ХРОНИЧЕСКОЙ БОЛЕЗНИ ПОЧЕК. Нефрология. 2016;20(6):26-32.
For citation:
Vatazin A.V., Zulkarnaev A.B. ENDOTOXIN AND CHRONIC INFLAMMATION IN PATIENTS WITH CHRONIC KIDNEY DISEASE. Nephrology (Saint-Petersburg). 2016;20(6):26-32. (In Russ.)
JATS XML








































