Перейти к:
ДОНОРЫ С НЕОБРАТИМОЙ ОСТАНОВКОЙ СЕРДЦА: ПОЛНОЦЕННЫЙ РЕСУРС РЕНАЛЬНОЙ ТРАНСПЛАНТАЦИИ
https://doi.org/10.24884/1561-6274-2016-20-6-8-17
Аннотация
ЦЕЛЬ. Предложить трансплантационному сообществу надежный протокол получения полноценных ренальных трансплантатов от доноров с необратимой остановкой сердца, основанный на оценке 5-летних результаты пересадок почек, полученных с помощью нормотермической перфузии и экстракорпоральной оксигенации. МЕТОДЫ. В исследование были включены 29 АСД почек [время первичной тепловой ишемии – 58,1 (19,39) мин], полученных с использованием предложенного протокола, и оценены результаты пересадок таких трансплантатов у 58 реципиентов. Полученные данные были валидированы путем сравнения с результатами пересадок 112 почек от 115 доноров со смертью мозга (ДСМ). РЕЗУЛЬТАТЫ. НФТ в исследуемой группе была у 28 реципиентов из 58 (48,3%), в контрольной группе – 63,4% (71 реципиент). Было четыре случая ПНФТ, эти пациенты не были включены в исследуемую группу. 5-летняя выживаемость трансплантатов составила 82,8% (n = 48), в отличие от 87,5% (n=98) (ДСМ) (p>0,05). Уровень сывороточного креатинина через пять лет после трансплантации в среднем у реципиентов почек от АСД – 0,094(0,06)и 0,103(0,07) ммоль/л (от ДСМ) (p>0,05). ВЫВОДЫ. Восстановление и сохранение жизнеспособности донорских органов у внезапно умерших с критическим периодом асистолии с помощью экстракорпоральной перфузии in situ является многообещающим протоколом. Обязательным является применение тромболитиков и механического перфузионного удаления лейкотромбоагломератов, образующихся в период отсутствия кровообращения. Пятилетние результаты пересадки почек, полученных от АСД, с использованием экстракорпоральной перфузии in situ, не отличаются от результатов трансплантаций почек от ДСМ.
Ключевые слова
Для цитирования:
Скворцов А.Е., Логинов И.В., Кукушкин А.А., Ананьев А.Н., Кутенков А.А., Кузьмин Д.О., Дайнеко В.С., Ульянкина И.В., Шиганов М.Ю., Резник О.Н. ДОНОРЫ С НЕОБРАТИМОЙ ОСТАНОВКОЙ СЕРДЦА: ПОЛНОЦЕННЫЙ РЕСУРС РЕНАЛЬНОЙ ТРАНСПЛАНТАЦИИ. Нефрология. 2016;20(6):90-100. https://doi.org/10.24884/1561-6274-2016-20-6-8-17
For citation:
Skvortsov A.E., Loginov I.V., Kukushkin A.A., Ananiev A.N., Kutenkov A.A., Kuzmin D.O., Daineko V.S., Uljyankina I.V., Shiganov M.Y., Reznik O.N. DONORS WITH CARDIAC DEATH: FULL RESOURCE OF KIDNEY TRANSPLANTATION. Nephrology (Saint-Petersburg). 2016;20(6):90-100. (In Russ.) https://doi.org/10.24884/1561-6274-2016-20-6-8-17
ВВЕДЕНИЕ
Общеизвестно, что главной проблемой трансплантации является дефицит донорских органов. В Российской Федерации ежегодно производятся более 1500 трансплантаций органов, или 10,4 на 1 млн населения, в то время как приблизительное число нуждающихся пациентов оценивается в 15,2 тыс человек [1, 2]. Приходится констатировать, что в настоящее время большинству потенциальных реципиентов такой вид помощи недоступен, несмотря на усилия по организации донорства федерального и регионального порядка. Так, до недавних пор государственное задание являлось основным механизмом финансирования трансплантаций органов в России, его доля в общем числе трансплантаций органов с 2010 г. увеличилась на 27,9% при увеличении в абсолютных значениях на 516 (+65%) трансплантаций органов, при этом органное донорство оставалось без внимания, в настоящее время появляются методы материального стимулирования и этих программ, что не менее важно в условия существующей нехватки донорских органов [2-6].
По данным «United Network for Organ Sharing» («UNOS», США), на январь 2016 года в листе ожидания донорских органов состояло 121 299 пациентов, в то время как количество доноров составило 15 068, и было выполнено лишь 30 970 операций по пересадке [7]. Схожая ситуация наблюдается в странах Евросоюза, по данным организации Eurotransplant, на январь 2016 года в листе ожидания находилось 14 560 пациентов, за 2015 год выполнено 7 145 трансплантаций [8]. Причины дефицита донорских органов хорошо изучены и освещены в работах как зарубежных, так и отечественных авторов [6, 9-12].
«Золотой стандарт» донорства - это умершие с установленным диагнозом смерти мозга, работающим сердцем и функционирующими органами. Однако число таких доноров во всем мире ограничено и постоянно снижается. В то же время, недостаточно используются доноры, смерть которых наступает внезапно, от необратимой остановки сердечной деятельности. Причиной сдержанного отношения к такого рода донорам является время, проходящее от остановки сердца до прибытия донорских служб, которое не позволяет сохранить жизнеспособность органов. Причина заключается в способе осуществления консервации органов до пересадки.
В практике неотложной кардиологии и неврологии широко используются программы применения тромболизиса, которые приводят к купированию в большинстве случаев сосудистых катастроф миокарда и ткани мозга [13-17]. Наилучшие результаты были достигнуты, если помощь оказывалась в течение так называемого «золотого часа». Нами был осуществлен «трансфер» подобной стратегии в практику работы с донорами с внезапной необратимой остановкой кровообращения. Коллективом Центра координации органного донорства НИИ скорой помощи им. И.И. Джанелидзе был в 2009 г. разработан протокол перфузи- онной реабилитации донорских органов у такой категории пациентов in situ, до эксплантации, при сроках асистолии до одного часа, с помощью проведения экстракорпоральной мембранной оксиге- нации и абдоминального тромболизиса. В данной статье приводится опыт применения новой технологии получения трансплантатов и публикуются 5-летние результаты их пересадок.
Цель исследования - доказательство клинической полноценности пересадки почек, полученных от доноров с внезапной необратимой остановкой сердечной деятельности и критическим уровнем первичной тепловой ишемии при применении субнормотермической экстракорпоральной перфузии «in situ» у доноров почек.
ПАЦИЕНТЫ И МЕТОДЫ
Протокол проведенного исследования (применение экстракорпоральной нормотермической гемоперфузии in situ, процедуры изъятия и трансплантации почек) был утвержден этическим комитетом СПбНИИ скорой помощи им. И.И. Джанелидзе №6 от 15.07.2011 г. и разрешением на использование новой медицинской технологии Росздравнадзора РФ №2010/299. Патент № 2441608 от Роспатента на «Способ восстановления и поддержания жизнеспособности ишеми- чески поврежденного донорского органа».
По данным Бюро судебной медицины, за 2009 год от повреждений головного мозга погиб 571 пациент - потенциальный донор, в то же время изъятие проводились только у 47 эффективных доноров, что соответствует 10,5 донора на 1 млн населения. Количество потенциальных доноров, которые умерли от внезапной необратимой остановки сердца в первые сутки нахождения в стационаре, о которых донорская служба не была оповещена заранее, составило 173 пациента с повреждением и заболеванием головного мозга. Это те доноры, почки которых могли бы быть пересажены, однако изъятие которых невозможно без применения специальных перфузионных технологий. В период с 2009 по 2014 год было проведено изъятие у 29 доноров с внезапной необратимой остановкой сердечной деятельности (соответствующим донорам II категории по Маастрихтской классификации, 1993). Критериями включения в исследование доноров были следующие - возраст их не старше 55 лет, причина смерти - тяжелая травма или заболевание головного мозга, приведшая к остановке сердечной деятельности; отсутствие ярко выраженной сосудистой патологии, время первичной тепловой ишемии (время от констатации смерти до начала перфузии in situ) не более 90 мин. Основные характеристики доноров представлены в табл. 1.
Констатация смерти пациента производилась в установленном порядке после проведения полного комплекса реанимационных мероприятий и их неэффективности, а процедура эксплантации - после получения официального разрешения на изъятие от судебно-медицинского эксперта.
После констатации смерти пациента и безуспешных реанимационных мероприятиях, дежурным врачом отделения реанимации донорского стационара или госпитальным трансплантационным координатором осуществлялся вызов бригады Центра органного донорства в стационар. Согласно протоколу, дежурный врач уже после констатации смерти пациента внутривенно через подключичный катетер вводил гепарина 25000 ЕД («Gedeon Richter», Germany) и осуществлял несколько компрессионных движений грудной клетки умершего, как при непрямом массаже сердца, для равномерного распределения антикоагулянта в организме донора. Производился забор крови для экспресс-диагностики инфекций (гепатит В, С, ВИЧ, RW). Расстояние от НИИ скорой помощи им. И.И. Джанелидзе до донорских стационаров составляет от 12 до 25 км. Перфузионная и экс- плантационная бригады прибывали в стационар в течение 25-45 мин, после получения разрешения на изъятие у администрации больницы и вызова судебно-медицинского эксперта (СМЭ). Тело умершего пациента (рассматриваемого как потенциального асистолического донора) перемещалось в операционную, где в случае получения отрицательных результатов экспресс-диагностики инфекций хирургом службы забора органов выполнялся доступ к бедренным сосудам в правом бедренном треугольнике. Осуществлялась катетеризация аорты двухбаллонным трехпросветным катетером («Balton», Warsaw, Польша) для изоляции сосудистого бассейна брюшной полости. В бедренную вену вставлялся катетер для отвода венозной крови из бассейна абдоминальной перфузии. Затем к этим катетерам подсоединялся контур экстракорпорального перфузионного комплекса для проведения изолированной абдоминальной гемоперфузии. Перфузионный контур включал в себя: мехатронный перфузионный модуль, разработка НИИ робототехники и технической кибернетики (Санкт-Петербург); портативный источник кислорода с системой понижающих редукторов («Alternative Science», Санкт- Петербург, Россия); венозный резервуар и оксигенатор («Gish Vision Biomedical», Rancho Santa Margarita, CA, США); набор экстракорпоральных перфузионных систем (трубок) («Tianjin Plastics Research Institute», Tianjin, Китай). Критически важным мы считаем включение в перфузионный контур лейкоцитарного фильтра, для экстракорпорального, по сути, дистанционного, удаления из перфузируемых донорских органов тромбов, конгломератов лейкоцитов и тромбоцитов. В нашем случае мы использовали LeukoGuard-6, т.е. фильтр с пропускной способностью 6 л/мин («Pall GmbH», Dreieich, Германия). На фоне продолжающейся нормотермической гемоперфузии in situ начиналась операция эксплантации донорских органов только после прибытия СМЭ и получения разрешения на изъятие, в среднем на это уходило от 1,5 до 2 ч. Логистическая схема такой модели донорства представлена на рис. 1.
Таблица 1
Характеристики доноров
Характеристики | АСД (n=29), M (SD) | ДСМ (n=115), M (SD) | P |
|---|---|---|---|
Возраст, года | 41,07 (9,32) | 44,07 (10,96) | >0,05 |
Пол: Мужчины Женщины | 19 (65,5%) 10 (34,5%) | 78 (67,8%) 37 (32,2%) | <0,05 >0,05 |
Причина смерти: Повреждение головного мозга | 16 (55,2%) | 31 (26,9%) | >0,05 |
Сосудистые заболевания головного мозга | 13 (44,8%) | 84 (73,1%) | <0,05 |
Доза дофамина, мкг/кг/мин | 5,72 (2,64) | 3,93 (1,30) | <0,05 |
Креатинин, ммоль/л | 0,078 (0,02) | 0,073 (0,02) | >0,05 |
Диурез в последний час, мл | 0,45 (0,38) | 0,60 (0,28) | <0,05 |
Время тепловой ишемии, мин | 58,1 (19,39) | 0 |
|
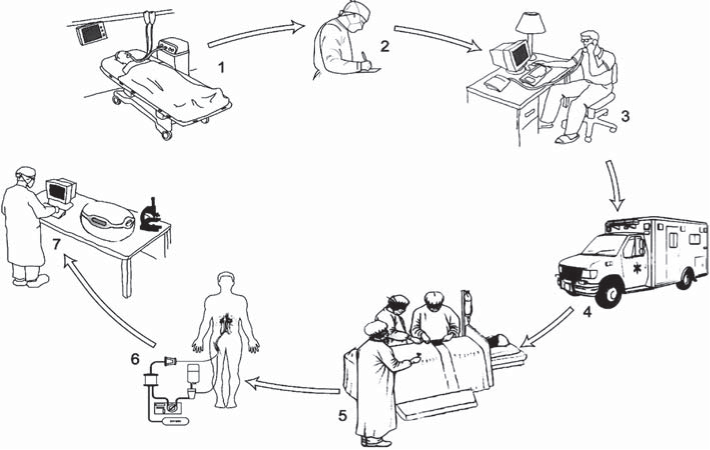
Рис.1. Новая логистическая модель асистолического донорства.
1. Смерть пациента после внезапной необратимой остановки кровообращения и неэффективности реанимационных мероприятий. 2. Госпитальный трансплантационный координатор заполняет документацию. 3. Активация программы донорства после звонка регионального трансплантационного координатора. 4. Прибытие специального транспорта с перфузионной и хирургической командой из ЦОТД. 5. Выделение и канюляция бедренных сосудов донора. 6. Проведение процедуры экстракорпоральной перфузии в теле донора. 7. Оформление протокола изъятия донорских органов и оценка качества донорских органов после процедуры изъятия.
Обязательными компонентами процедуры восстановления жизнеспособности донорских органов являлись: 1. тромболитическая терапия; 2. гепаринизация абдоминального бассейна перфузии; 3. гемодилюция крови в перфузионном контуре; 4. экстракорпоральная трансмембранная оксигенация перфузата; 5. элиминация активированных лейкоцитов из перфузионного контура; применение нормо- (суб)термического режима перфузии (27-32 °С). В качестве перфузата была использована модифицированная кровь асистолического донора. Общая формула перфузата выглядела следующим образом: кровь асистолического донора, кустодиол до 2 л, гепарин 25 000 ЕД, стрептокиназа 1,5 млн ЕД, перфторан не менее 400 мл, солумедрол 500 мг, изоптин 5 мг, нитроглицерин 5 мг. Общая схема перфузионного комплекса и схема его подключения представлены на рис. 2.
Таблица 2
Клинические параметры перфузии
Данные | M (SD) N = 29 |
|---|---|
Гемоглобин, g/L | 34,93 (12,39) |
Гематокрит | 0,33 (0,16) |
рН перфузата | 7,34 (0,27) |
Перфузионное давление, начальное, ml/min | 500 |
Перфузионное давление, в конце, ml/min | 3500 |
Оксигенация, начальное, ml/min | 150 |
Оксигенация, в конце, ml/min | 350 |
Среднее рO2* перфузата, mmHg | 408,4 (49,6) |
Среднее рШ2** перфузата, mmHg | 89,30 (28,86) |
Продолжительность ЭНАП и УЛ***, min | 139 (28,22) |
Кол-во лейкоцитов в перф. контуре, начало | 15,72 (4,47) |
Кол-во лейкоцитов в перф. контуре, в конце | 0,84 (0,59) |
Примечание. *рО2: парциальное давление кислорода, **рСО2: парциальное давление углекислого газа, ***ЭНАП и УЛ: экстракорпоральная нормотермическая аппаратная перфузия с удалением лейкоцитов.
Длительность «сеанса восстановления» функционального состояния донорских почек и время начала изъятия определялось нами на основании результатов исследования содержания лейкоцитов в перфузионном контуре, при достижении значения в 1х109/л и ниже результаты проведения перфузии признавались удовлетворительными (см. табл. 2). Среднее время от момента остановки сердечной деятельности до начала экстракорпоральной гемоперфузии абдоминального региона составило (время тепловой ишемии) 58,1 (19,39) (min. 45, max. 92). Начало операции эксплантации выполнялось на фоне продолжающейся перфузии, которая заканчивалась непосредственно перед извлечением органов.
После окончания перфузии донорские почки извлекались, выполнялась тонкоигольная биопсия (рис. 3), и затем производилась традиционная консервация охлажденным до 4 °С раствором кустодиол, а затем бесперфузионным способом по общепринятой методике в стерильных пластиковых пакетах раствором кустодиола до момента пересадки. Трансплантации почек, полученных с использованием предложенного протокола, были выполнены 58 реципиентам с терминальной хронической почечной недостаточностью, находившихся на заместительной почечной терапии. Характеристика реципиентов представлена в табл. 3.
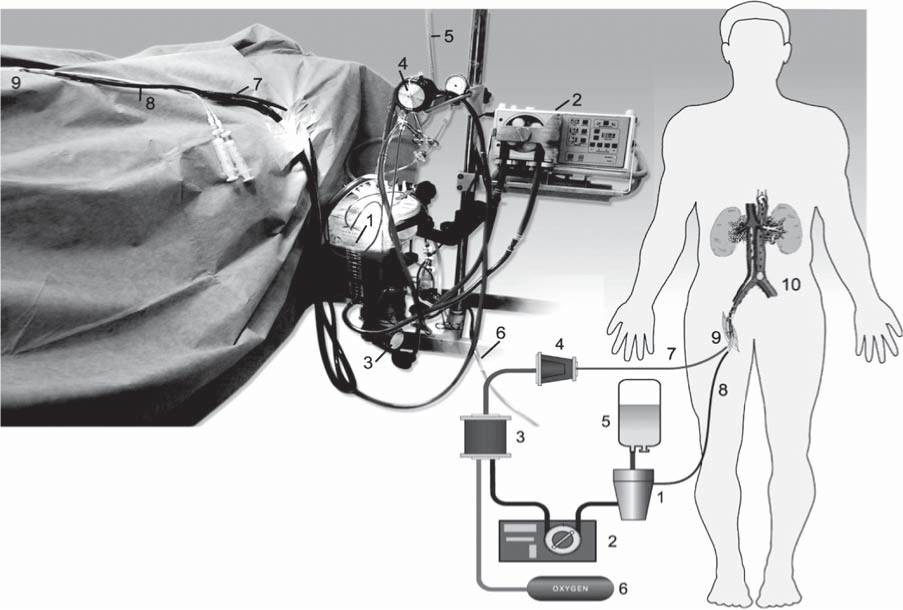
Рис. 2. Схема применения перфузионного протокола. Перфузионный контур включает в себя: 1 - венозный резервуар; 2 - механический перфузионный модуль; 3 - оксигенатор; 4 - лейкоцитарный фильтр; 5 - перфузионный раствор; 6 - источник кислорода; 7 - артериальная линия перфузионного контура; 8 - венозная линия; 9 - хирургический доступ к бедренным сосудам; 10 - «абдоминальный» регион перфузии.
Таблица 3
Характеристики реципиентов, M (SD)
Характеристики | АСД, n=58 | ДСМ, n=112 | р |
|---|---|---|---|
Возраст, лет | 48,94 (9,14) | 42,33 (10,56) | >0,05 |
Вид диализа Гемодиализ (ГД) Перитонеальный диализ (ПД) ГД/ПД | 47 (81,03%) 11 (18,97%) 0 | 89 (79,5%) 15 (13,4%) 8(7,1%) | >0,05 >0,05 |
Время на диализе до трансплантции почки, лет | 3,92 (2,82) | 3,74 (4,09) | >0,05 |
Причина хронической болезни почек Гломерулонефрит Пиелонефрит Поликистоз почек и др. | 50 (86,2%) 2 (3,44%) 6 (10,3%) | 86 (76,9%) 11 (9,8%) 15 (13,3%) | >0,05 <0,05 <0,05 |
Время холодовой ишемии до Тх почки, ч | 13,31 (4,11) | 13,37 (5,54) | >0,05 |
Функция трансплантата НФТ1 ОФТ2 ПНФТ3 | 28 (48,3%) 26 (44,8%) 4(6,9%) | 71 (63,4%) 39 (34,8%) 2(1,8%) | <0,05 >0,05 <0,05 |
Креатинин через 1 год после Тх, ммоль/л | 0,108 (0,04) | 0,112 (0,04) | >0,05 |
Креатинин через 5 лет после Тх, ммоль/л | 0,094 (0,06) | 0,103 (0,07) | >0,05 |
рСКФ4, мл/мин/1,73 м2 | 76,3 (25,1) | 71,2 (25,9) | >0,05 |
Ранние острые реакции отторжения, 3 мес | 6 (10,3%) | 16 (14,3%) | <0,05 |
Поздние реакции отторжения, 12 мес | 9 (12,1%) | 26 (23,2%) | <0,05 |
Выживаемость реципиентов, % | 56 (96,5%) | 108 (96,4%) | >0,05 |
Выживаемость трансплантатов, % | 48 (82,8%) | 98 (87,5%) | >0,05 |
Хирургические осложнения | 3 (5,2%) | 6 (5,4%) | <0,05 |
Примечание. 1НФТ - немедленная функция трансплантата; 2ОФТ - отсроченная функция трансплантата; 3ПНФТ - первично нефункционирующий трансплантат; 4рСКФ - расчетная скорость клубочковой фильтрации по Cockcroft = ((140-age) * mass (kg) [*0,85 if female]) /72 * serum creatinine (mg/dl).
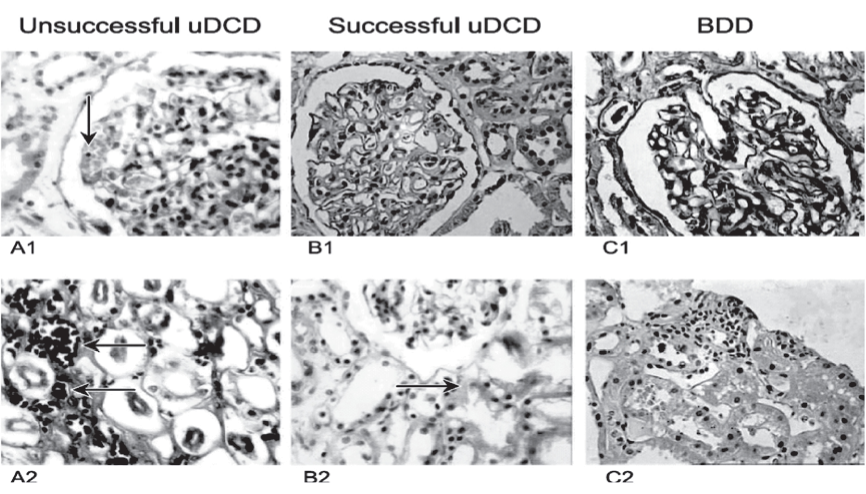
Рис. 3. Результаты «нулевой» биопсии материала, полученного из почечных трансплантатов (после изъятия), световая микроскопия. A1, A2 - образцы неудачной перфузии АСД; B1, B2 - биопсия почек от ДСМ; C1, C2 - результаты морфологических исследований трансплантатов от АСД. Окраска Hematoxylin - Eosin и по Shiff.
Полученные данные были валидированы путем сравнения с результатами пересадок 112 почек от 115 доноров со смертью мозга (ДСМ), полученных в тот же период. Все реципиенты получали стандартную трехкомпонентную иммуносупрессивную терапию с индукцией базилик- симабом («Симулектом») 20 мг до реперфузии и на 4-е сутки после операции.
Статистический анализ данных выполняли с использованием пакета прикладных статистических программ «Microsoft Excel 2010» («Microsoft Corporation», США) и «STATISTICA 8.0» («StatSoft Inc.», США). Результаты представлены в виде среднего арифметического±стандартное отклонение. Статистическую значимость различий двух средних определяли с помощью t-критерия Стьюдента; частот - х2-критерия Пирсона. Оценку силы взаимосвязи между количественными признаками проводили с помощью коэффициента корреляции (r) Пирсона. Нулевую статистическую гипотезу об отсутствии различий и связей отвергали при p<0,05.
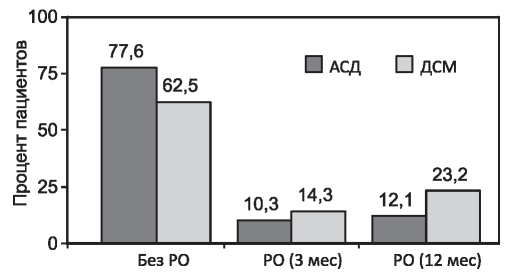
Рис. 4. Ранние и поздние реакции отторжения (PO) (подтвержденные биопсией) (р<0,05).
РЕЗУЛЬТАТЫ
Среднее время первичной тепловой ишемии в исследуемой группе АСД составило 58,1 (19,39) (min 45, max 92), а длительность проведения нормотермической экстракорпоральной гемоперфузии in situ - 139 (28,22) (min = 120, max = 210). В контрольной группе - 0 мин. Однако, несмотря на значительный период отсутствия кровообращения у донора, после выполнения описанных выше мероприятий, как правило, во время операции эксплантации цвет и консистенция органов брюшной полости соответствовали прижизненному или точно такому же, какой мы привыкли видеть при работе с донорами с констатированной смертью мозга, т.е. отмечалась живая перистальтика кишечника и мочеточников в ответ на механические стимулы, у 14 доноров было зафиксировано выделение мочи от 100 до 400 мл в ходе выполнения эксплантации.
Немедленная функция трансплантатов почек в исследуемой группе наблюдалась у 28 из 58 (48,3%) реципиентов. Было зафиксировано четыре случая первично-нефункционирующих трансплантатов. К концу первого года после трансплантации было диагностировано 9 эпизода острого Т-клеточного отторжения (12,1%) в группе АСД против 26 эпизодов отторжения (23,2%) в группе ДСМ (доказанного биопсией) (рис. 4).
Скорость клубочковой фильтрации составила в группе АСД 76,3 (25,1) и 71,2 (25,9) в группе от ДСМ, статистической разницы получено не было (p>0,05). Актуариальная выживаемость трансплантатов через 5 лет составила 82,8% (n = 48) в группе АСД и 87,5% (n = 98) в группе ДСМ (рис. 5, 6). Уровень сывороточного креатинина к концу пятого года был 0,094 ± 0,06 и 0,103 ± 0,07 ммоль/л в группах реципиентов от АСД и ДСМ, соответственно (p>0,05) (рис. 7). Хирургические осложнения в группе реципиентов от АСД были отмечены в трех (5,2%) случаях, в группе реципиентов от ДСМ в 6 (5,4%) (<0,05).
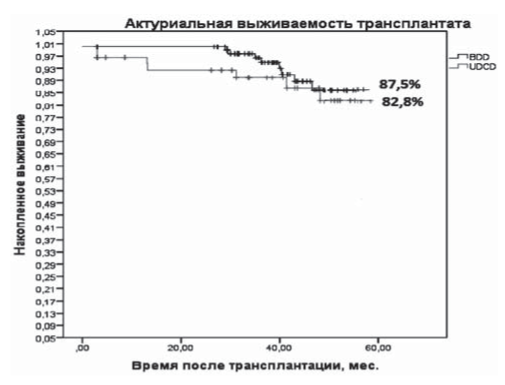
Рис. 5. 5-летняя выживаемость трансплантатов по Kaplan- Meier (р < 0,312, SE = 0,041). BDD - трансплантаты от доноров со смертью мозга, UDCD - трансплантаты от асистолических доноров.
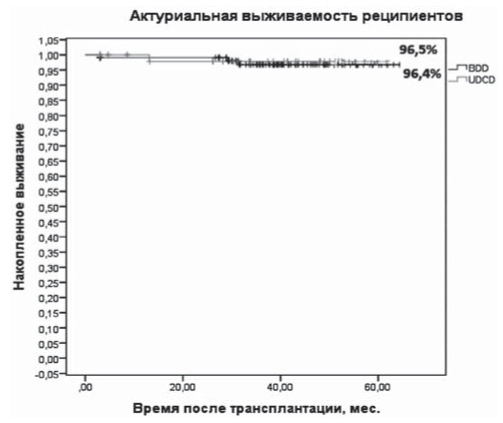
Рис. 6. 5-летняя выживаемость реципиентов по Kaplan-Meier (р < 0,312, SE = 0,041). BDD - трансплантаты от доноров со смертью мозга, UDCD - трансплантаты от асистолических доноров.
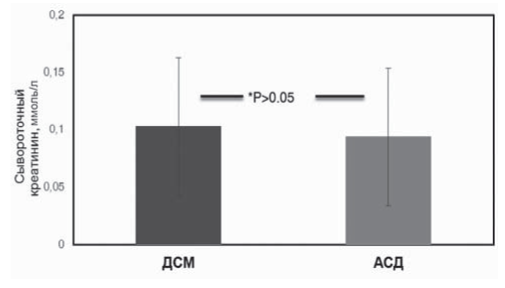
Рис. 7. Сравнение уровня сывороточного креатинина в группах реципиентов от АСД и ДСМ через 5 лет после Тх (р < 0,965).
ОБСУЖДЕНИЕ
Современной трансплантации присущ «врожденный порок развития» - дефицит донорских органов. Причины донорского дефицита многосторонни [5, 6, 9-11], однако в последнее десятилетие обнаруживаются новые, закономерные факторы, препятствующее эффективному развитию посмертного донорства. Быстрый прогресс в области организации скорой нейрохирургической и неврологической помощи кроется парадоксальная угроза развитию трансплантологии, так как неизменно сокращается число умерших от острых заболеваний ЦНС. Успешность трансплантационных программ в западном полушарии достигается за счет государственных программ, многие из которых не приживаются на отечественной почве, - это и донорство после эвтаназии [18], и широко распространённое в странах Евросоюза и США донорство органов при контролируемом наступлении смерти у обреченных пациентов от асистолии [19, 20]. «Медицинским алиби» для трансплантологов здесь служит широко обсуждаемая сегодня практика прижизненного волеизъявления [21], которая неоднозначно может «читаться» с этической точки зрения. Более оправданным является интерес к использованию для трансплантации таких органов, получение которых не вызывает вопросов об определении момента смерти человека. Таковыми являются органы, полученные от доноров с необратимой остановкой кровообращения. Непреодолимым же препятствием для их использования до последнего времени являлось неизбежное ишемическое повреждение, отчего такие трансплантаты относят к «полученным от доноров с расширенными критериями» (ДРК) [22-27]. Внезапно умершие пациенты считались перспективным ресурсом трансплантации еще в 2006 году, по сообщению Института Медицины, США (Institute of Medicine, IOM), общее число таких доноров могло бы составить 22 000 [28].
Главными в патогенезе ишемическиреперфузионной травмы являются адгезивный каскад [29, 30] и активация системы комплемента [31] и лейкоцитов с последующим тромбообразо- ванием [32] в системе микро- и макроциркулятор- ного русла органов, что делает их непригодными к повторному запуску кровотока в теле реципиента. Использование устройств для эксракорпоральной гемоперфузии in situ с удалением лейкоцитов, тромболизисом и оксигенацией донорской крови достоверно позволяет восстанавливать и поддерживать жизнеспособность донорских органов от доноров с внезапной необратимой остановкой сердечной деятельности (АСД). В то же время, максимально быстрое восстановление кровотока с помощью перфузионного модуля в теле донора дает возможность полноценного использования данного донорского пула [33]. Усилия в этом направлении предпринимаются с 60-х годов прошлого столетия, они сводятся к попыткам обеспечить более близкие к физиологическим условия хранения органов, что достигалось при помощи проточной аппаратной гипотермической перфузии. Однако основным и решающим недостатком таких устройств выступает акцент именно на ги- потермической перфузии, при которой происходит лишь понижение кислородного запроса и, соответственно, замедление метаболизма. Устройства для проведения аппаратной перфузии целого региона в теле донора in situ или изолированных донорских органов ex vivo применяются сейчас в основном для продления сроков хранения трансплантатов, оценки их функционального состояния, механического воздействия на микроциркуляторное русло, проведения селекции органов на основе перфузионных характеристик [34].
Все больший интерес в мире вызывают программы нормотермической перфузии донорских органов, что является не совсем традиционным способом перфузии, так как основным ее принципом долгое время считалось понижение кислородного запроса тканей за счет их охлаждения [34]. В экспериментальных работах C. Fondevila приводятся аргументы в пользу нормотермической перфузии печеночных и почечных трансплантатов от доноров всех категорий. Искусственное кровообращение при температуре 37 °С, доставка кислорода в орган способствуют восстановлению функционального резерва трансплантатов и поддержанию в них уровня метаболизма, близкого к физиологическому [36, 37]. Нормотермическая перфузия изолированных почечных трансплантатов в сочетании с гипотермической рассматривается авторами из университета Лейстера как один из возможных способов реабилитации органов от доноров с расширенными критериями, применение которого позволит добиться снижения частоты развития отсроченной функции трансплантатов сомнительного качества [38].
С появлением нормотермической перфузии донорских органов имеет смысл говорить об изменении термина, а вместе с ним и всей парадигмы современной трансплантации - на смену гипо- термической перфузионной консервации органов приходит концепция восстановления, сохранения жизнеспособности органов, ремоделирования их свойств, вместо консервации зачастую поврежденного органа [33, 39, 40].
ЗАКЛЮЧЕНИЕ
Результаты нашего 5-летнего исследования показывают, что пересадка почек от асистолических доноров с критическим, до одного часа, временем тепловой ишемии могут успешно использоваться для трансплантации при условии применения перфузионного восстановления жизнеспособности донорских органов in situ, за счет тромболизиса и дистанционного удаления лейкоцитов и тромбов из циркуляторного русла. Иными словами, применение различных вариантов управляемой реперфузии донора может оказывать лечебное воздействие на донорские органы еще до их изъятия.
Требованием времени является разработка и внедрение в практику работы анестезиолога- реаниматолога портативных перфузионных устройств для экстренного восстановления кровообращения при внезапной остановке сердца и исчерпанности традиционных методов реанимации человека. В этом случае экстракорпоральные пер- фузионные методы управления кровообращением могут послужить «реанимации» донорских органов. Особое значение приобретают перфузионные технологии в контексте скорого принятия нового Закона о трансплантации, согласно которому необходимо будет соблюдать 2-часовый интервал после констатации смерти пациента для выяснении позиции близких умершего по отношению к процедуре эксплантации.
Реализация этого подхода может существенно расширить возможности использования органов от доноров с внезапной необратимой остановкой кровообращения и тем самым повысить доступность трансплантологической помощи.
Список литературы
1. Готье СВ, Хомяков СМ. Оценка потребности населения в трансплантации органов, донорского ресурса и планирование эффективной сети центров трансплантации. Вестн трансплантол и искусственных органов 2013; 3: 11-24 [Got’ye SV, Khomyakov SM. Otsenka potrebnosti naseleniya v transplantatsii organov, donorskogo resursa i planirovanie effektivnoy seti tsentrov transplantatsii. Vestnik transplantologii i iskusstvennykh organov 2013; 3: 11-24]
2. Готье СВ, Мойсюк ЯГ, Хомяков СМ. Донорство итрансплантация органов в Российской Федерации в 2014 году VII сообщение регистра Российского трансплантологического общества. Вестн трансплантол и искусственных органов 2015;17(2):7-22. DOI:10.15825/1995-1191-2015-2-7-22 [Got'ye SV, Moysyuk YaG, Khomyakov SM. Donorstvo i transplantatsiya organov v Rossiyskoy Federatsii v 2014 godu VII soobshchenie registra rossiyskogo transplantologicheskogo obshchestva. Vestnik transplantologii i iskusstvennykh organov 2015;17(2):7-22. DOI:10.15825/1995-1191-2015-2-7-22]
3. Распоряжения Комитета здравоохранения СанктПетербурга № 672-р от 11.08.2014 г. "О совершенствовании организации органного донорства в Санкт-Петербурге " [Rasporyazheniya Komiteta Zdravookhraneniya Sankt-Peterburga № 672-r ot 11.08.14 g. "O sovershenstvovanii organizatsii organnogo donorstva v Sankt-Peterburge "].
4. Николаев ГВ, Гордеев МЛ, Карпенко МА и др. Организационные аспекты органного донорства в СанктПетербурге. Вестн трансплантол и искусственных органов 2015;17(2):134-138. DOI:10.15825/1995-1191-2015-2-134-138 [Nikolaev GV, Gordeev ML, Karpenko MA i dr. Organizatsionnye aspekty organnogo donorstva v Sankt-Peterburge. Vestnik transplantologii i iskusstvennykh organov. 2015;17(2):134-138. DOI:10.15825/1995-1191-2015-2-134-138]
5. Логинов ИВ. Анализ причин дефицита доноров органов и основные направления его преодоления: автореф. ... дис. кандидат медицинских наук. НИИТ и ИО. М, 2011, С. 27 [Loginov IV. Analiz prichin defitsita donorov organov i osnovnye napravleniya ego preodoleniya: avtoreferat dis. k-t med. nauk /I.V. Loginov; NIIT i IO. M, 2011. – S. 27]
6. Логинов ИВ, Кечаева НВ, Резник ОН. Значение организационных факторов в преодолении дефицита донорских органов. Вестн трансплантол и искусственных органов. 2011; 13(1): 100-107 [Loginov IV, Kechaeva NV, Reznik ON. Znachenie organizatsionnykh faktorov v preodolenii defitsita donorskikh organov. Vestnik transplantologii i iskusstvennykh organov 2011; 13(1): 100-107]
7. http://www.UNOS.org, доступ 16.03.2016
8. http://www.eurotransplant.org/, доступ 16.03.2016
9. Багненко СФ, Логинов ИВ, Резник ОН. Причины дефицита донорских органов и пути его преодоления. Мед акад журн 2011; 4 (11): 13-25 [Bagnenko SF, Loginov IV, Reznik ON. Prichiny defitsita donorskikh organov i puti ego preodoleniya. Meditsinskiy akademicheskiy zhurnal 2011; 4 (11): 13-25]
10. Rozenthal R. Organ Donation: Quo vadis? / R. Rozenthal. Annals of Transplantation 2006; 11(3): 49-51
11. Hanto DW, Veatch RM. Uncontrolled donation after circulatory determination of death (UDCDD) and the definition of death. Am J Transplant 2011; 11(7): 1351–1352. doi: 10.1111/j.16006143.2011.03583.x
12. Mone TD. The business of organ procurement. Curr Opinion in Organ Transplant 2002; 7: 60-64 13. Durandy Y. Warm pediatric cardiac surgery: European experience. Asian Cardiovasc Thorac Ann 2010; 18(4): 386–395. doi: 10.1177/0218492310376675
13. Fan Y, Zhang AM, Xiao YB. Warm versus cold cardioplegia for heart surgery: a meta-analysis. Eur J Cardiothorac Surg 2010; 37(4): 912–919. doi: 10.1016/j.ejcts.2009.09.030
14. Jacob S, Kallikourdis A, Sellke F. Is blood cardioplegia superior to crystalloid cardioplegia? Interact Cardiovasc Thorac Surg 2008; 7(3): 491–498. doi: 10.1510/icvts.2008.178343
15. Одинак ММ, Вознюк ИА, Янишевский СН и др. Острый церебральный тромбоз – реканализация за пределами окна тромболитической терапии. В: Дисфункция эндотелия. Патогенетическое значение и методы коррекции, ред. Н.Н. Петрищев; ВМедА, СПб., 2007; 121-139 [Odinak MM, Voznyuk IA, Yanishevskiy SN i dr. Ostryy tserebral'nyy tromboz – rekanalizatsiya za predelami okna tromboliticheskoy terapii / Disfunktsiya endoteliya. Patogeneticheskoe znachenie i metody korrektsii / Pod red. N.N. Petrishcheva. SPb.: VMedA, 2007, 121-139]
16. Одинак ММ, Вознюк ИА, Кузнецов АН и др. Возможности реопозитивной терапии при острой ишемии головного мозга. Регионарное кровообращение и микроциркуляция 2003; 2 (1):21-27. [Odinak MM, Voznyuk IA, Kuznetsov AN i dr. Vozmozhnosti reopozitiv- noy terapii pri ostroy ishemii golovnogo mozga // Regionarnoe krovoobrashchenie i mikrotsirkulyatsiya 2003; 2 (1): 21-27]
17. van Dijk G, Giezeman A, Ultee F et al. Organ donation after active euthanasia in a patient with a neurodegenerative disease. Ned Tijdschr Geneeskd 2013;157(39): A6548. PMID: 24063672
18. Domı ́nguez-Gil B., Delmonico F.L., Faissal A. M. Shaheen et al. The critical pathway for deceased donation: reportable uniformity in the approach to deceased donation. Transplant International European Society for Organ Transplantation 2011; 24: 373–378
19. Dominguez-Gil B, Haase-Kromwijk B, Van Leiden H. Current situation of donation after circulatory death in European countries. Transpl Int 2011; 24(7): 676–686. doi: 10.1111/j.14322277.2011.01257.x
20. Bramhall S. Presumed consent for organ donation: a case against. Ann R Coll Surg Engl 2011; 93(4): 270–272. doi: 10.1308/147870811X571136b
21. White SL, Leichtman AB, O’Connor K et al. Predictors of liver donation without kidney recovery in a cohort of expanded criteria donors: identifying opportunities to improve expanded criteria donor kidney utilization. Transplant Proc 2012; 44(7):2223-2226. doi: 10.1016/j.transproceed.2012.07.103
22. Sung RS, Christensen LL, Leichtman AB et al.Determinants of discard of expanded criteria donor kidneys: impact of biopsy and machine perfusion. Am J Transplant 2008; 8(4):783-792. doi: 10.1111/j.1600-6143.2008.02157.x. Epub 2008 Feb 19.
23. Manara AR, Murphy PG, O’Callaghan G. Donation after circulatory death. Br J Anaesth 2012; 108(1): 1108–1121. doi: 10.1093/bja/aer357
24. Garcia CE, Bramhall S, Mirza DF. Use of marginal donors. Current Opinion in Organ Transplantation 2000; 5: 50–56
25. Reznik ON, Bagnenko SF, Skvortsov AE et al. Rehabilitation of Ischemically Damaged Human Kidneys by Normothermic Extracorporal Hemoperfusion In Situ With Oxygenation and Leukocyte Depletion. Transplantation proceedings 2010; 42 (5): 1536-1538
26. Reznik ON, Bagnenko SF, Skvortsov AE. Uncontrolled Donors with Controlled Reperfusion after Sixty Minutes of Asystole: A Novel Reliable Resource for Kidney Transplantation. PloS One 2013; 8(5): e64209
27. James F.C, Catharyn TL. Organ Donation: Opportunities for Action. Institute of Medicine (U.S.). Committee on Increasing Rates of Organ Donation. 2006.
28. Xu H, Wang D, Peng C et al. Rabbit sera containing compound danshen dripping pill attenuate leukocytes adhesion to TNF-alpha--activated human umbilical vein endothelial cells by suppressing endothelial ICAM-1 and VCAM-1 expression through NF-kappaB signaling pathway. J Cardiovasc Pharmacol 2014; 63(4):323-332. doi: 10.1097/FJC.0000000000000046.
29. Toledo-Pereyra LH. Leukocyte depletion, ischemic injury, and organ preservation. J of Surg Research 2011; 169(2): 188–189. doi: 10.1016/j.jss.2010.09.048
30. Wang X, Xiong M, Zeng Y et al. Mechanistic studies of a novel mycophenolic acid-glucosamine conjugate that attenuates renal ischemia/reperfusion injury in rat. Mol Pharm 2014; 11(10):3503-3514. doi: 10.1021/mp500282g
31. Duehrkop C, Rieben R. Ischemia/reperfusion injury: effect of simultaneous inhibition of plasma cascade systems versus specific complement inhibition. Biochem Pharmacol 2014; 88(1):1222. doi: 10.1016/j.bcp.2013.12.013
32. Резник ОН, Скворцов АЕ, Резник АО. Теоретическое обоснование концепции реабилитации донорских органов. Мед акад журн;12(4): 25-41 [Reznik ON, Skvortsov AE, Reznik AO. Teoreticheskoe obosnovanie kontseptsii reabilitatsii donorskikh organov. Meditsinskiy akademicheskiy zhurnal; 12(4): 25-41]
33. Reznik ON, Bagnenko SF, Skvortsov AE et al. Rehabilitation of Ischemically Damaged Human Kidneys by Normothermic Extracorporal Hemoperfusion In Situ With Oxygenation and Leukocyte Depletion. Transplantation proceedings 2010; 42 (5): 1536-1538
34. Vogel T, Brockmann JG, Friend PJ. Ex-vivo normothermic liver perfusion: an update. Current Opinion in Organ Transplanta tion 2010; 15(2): 167-172
35. Fondevila C, Hessheimer AJ, Garcнa-Valdecasas JC. Extracorporeal machine liver perfusion: are we warming up? Current Opinion in Organ Transplantation 2012; 17(2): 143–147
36. Fondevila C, Garcia-Valdecasas JC. In-vivo normothermic recirculation: an update. Current Opinion in Organ Transplantation 2010; 15 (2): 173-176
37. Hosgood SA, Nicholson ML. Normothermic kidney preservation. Current Opinion in Organ Transplantation 2011; 16 (2): 169–173
38. Cypel M, Yeung J, Waddell T et al. Successful emergent lung transplantation after remote ex vivo perfusion optimization and transportation of donor lungs. Am J Transplant 2012; 12 (10):2838-2844
39. Баранова АВ, Резник ОН, Скоблов МЮ и др. Перспективы применения предтрансплантационной антисмысловой генной терапии донорских органов для подавления апоптоза при проведении нормотермической изолированной перфузии ex vivo. Мед акад журн;12 (4): 7984 [Baranova AV, Reznik ON, Skoblov MYu i dr. Perspektivy primeneniya predtransplantatsionnoy antismyslovoy gennoy terapii donorskikh organov dlya podavleniya apoptoza pri provedenii normotermicheskoy izolirovannoy perfuzii ex vivo. Meditsinskiy akademicheskiy zhurnal;12 (4): 79-84]
Об авторах
А. Е. СкворцовРоссия
Скворцов Андрей Евгениевич, кандидат медицинских наук.
Клиника научно-исследовательского института хирургии и неотложной медицины.
197022, Россия, Санкт-Петербург, ул. Л. Толстого, д. 17, корп. 54.
И. В. Логинов
Россия
Логинов Игорь Валентинович, кандидат медицинских наук.
Городской центр координации органного донорства
192242, Санкт-Петербург, Будапештская ул., д. 3, лит. А.
А. А. Кукушкин
Россия
Кукушкин Андрей Александрович.
Городской центр органного и тканевого донорства.
192242, Санкт-Петербург, Будапештская ул., д. 3, лит. А.
А. Н. Ананьев
Россия
Ананьев Алексей Николаевич, кандидат медицинских наук.
Клиника научно-исследовательского института хирургии и неотложной медицины.
197022, Россия, Санкт-Петербург, ул. Л. Толстого, д. 17, корп. 54. >
А. А. Кутенков
Россия
Кутенков Алексей Анатольевич
Городской центр органного и тканевого донорства.
192242, Санкт-Петербург, Будапештская ул., д. 3, лит. А.
Д. О. Кузьмин
Россия
Кузьмин Денис Олегович
Городской центр органного и тканевого донорства.
192242, Санкт-Петербург, Будапештская ул., д. 3, лит. А.
В. С. Дайнеко
Россия
Дайнеко Василий Сергеевич
Городской центр органного и тканевого донорства.
192242, Санкт-Петербург, Будапештская ул., д. 3, лит. А
И. В. Ульянкина
Россия
Ульянкина Ирина Владимировна
Городской центр органного и тканевого донорства.
192242, Санкт-Петербург, Будапештская ул., д. 3, лит. А.
М. Ю. Шиганов
Россия
Шиганов Михаил Юрьевич, кандидат медицинских наук.
Кафедра анестезиологии и реаниматологии.
197022, Россия, Санкт-Петербург, ул. Л. Толстого, д. 17, корп. 54.
О. Н. Резник
Россия
Резник Олег Николаевич, доктор медицинских наук.
Клиника научно-исследовательского института хирургии и неотложной медицины.
197022, Россия, Санкт-Петербург, ул. Л. Толстого, д. 17, корп. 54.
Рецензия
Для цитирования:
Скворцов А.Е., Логинов И.В., Кукушкин А.А., Ананьев А.Н., Кутенков А.А., Кузьмин Д.О., Дайнеко В.С., Ульянкина И.В., Шиганов М.Ю., Резник О.Н. ДОНОРЫ С НЕОБРАТИМОЙ ОСТАНОВКОЙ СЕРДЦА: ПОЛНОЦЕННЫЙ РЕСУРС РЕНАЛЬНОЙ ТРАНСПЛАНТАЦИИ. Нефрология. 2016;20(6):90-100. https://doi.org/10.24884/1561-6274-2016-20-6-8-17
For citation:
Skvortsov A.E., Loginov I.V., Kukushkin A.A., Ananiev A.N., Kutenkov A.A., Kuzmin D.O., Daineko V.S., Uljyankina I.V., Shiganov M.Y., Reznik O.N. DONORS WITH CARDIAC DEATH: FULL RESOURCE OF KIDNEY TRANSPLANTATION. Nephrology (Saint-Petersburg). 2016;20(6):90-100. (In Russ.) https://doi.org/10.24884/1561-6274-2016-20-6-8-17








































