Перейти к:
ФОКАЛЬНО-СЕГМЕНТАРНЫЙ ГЛОМЕРУЛОСКЛЕРОЗ, АССОЦИИРОВАННЫЙ С ХРОНИЧЕСКИМ ЛИМФОЛЕЙКОЗОМ: КЛИНИЧЕСКИЙ СЛУЧАЙ И ЛИТЕРАТУРНЫЙ ОБЗОР
Аннотация
Хронический лимфолейкоз (ХЛЛ) – самый частый вид лейкозов в Западной Европе. Несмотря на относительную частоту этого вида лейкоза, публикации о поражении почек при ХЛЛ встречаются редко. Нефробиопсии рутинно не выполняются этим больным при появлении нефротического синдрома или неясной почечной недостаточности, в результате о механизмах почечного поражения при ХЛЛ известно мало. К настоящему времени в литературе описано всего около 130 случаев гломерулярных и интерстициальных поражений почек при ХЛЛ, подтвержденных результатами нефробиопсий. Наиболее частой формой гломерулопатии, вызывающей нефротический синдром при ХЛЛ, является мембранно-пролиферативный гломерулонефрит, реже встречаются болезнь минимальных изменений, мембранозная нефропатия; фокально-сегментарный гломерулосклероз (ФСГС) является редкостью, и к настоящему времени опубликовано 6 случаев ФСГС, ассоциированного с ХЛЛ. Мы представляем клинический случай, описывающий пациента, страдавшего ХЛЛ, у которого развился нефротический синдром, вызванный ФСГС, успешно леченный ритуксимабом , а также литературный обзор по паранеопластическим гломерулопатиям, ассоциированных с ХЛЛ, проявляющимся нефротическим синдромом.
Ключевые слова
Для цитирования:
Аниконова Л.И., Ряснянский В.Ю., Макарьева Е.Ю., Воробьева О.А. ФОКАЛЬНО-СЕГМЕНТАРНЫЙ ГЛОМЕРУЛОСКЛЕРОЗ, АССОЦИИРОВАННЫЙ С ХРОНИЧЕСКИМ ЛИМФОЛЕЙКОЗОМ: КЛИНИЧЕСКИЙ СЛУЧАЙ И ЛИТЕРАТУРНЫЙ ОБЗОР. Нефрология. 2016;20(6):101-110.
For citation:
Anikonova L.I., Ryasnyanskiy V.U., Makarjyeva E.U., Vorobjyеva O.A. FOCAL SEGMENTAL GLOMERULOSCLEROSIS ASSOCIATED WITH CHRONIC LYMPHOCYTIC LEUKAEMIA: CASE REPORT AND LITERATURE REVIEW. Nephrology (Saint-Petersburg). 2016;20(6):101-110. (In Russ.)
ВВЕДЕНИЕ
Хронический лимфолейкоз (ХЛЛ) - самый частый вид лейкозов в Западной Европе, диагноз которого устанавливается при выявлении более 5*109/л лимфоцитов в периферической крови и результатов иммунофенотипического исследования (клетки ХЛЛ экспрессируют антиген CD5 и B-клеточные маркеры CD19, CD20 и CD23) [1]. Медиана возраста пациентов на момент установления диагноза 65 лет; мужчины болеют чаще. Течение ХЛЛ вариабельное, около 40% пациентов имеют медленно-прогрессирующее течение, продолжительность их жизни близка к общепопуляционной. В этой связи при ХЛЛ принята тактика выжидательного наблюдения до появления показаний к терапии [1].
Несмотря на относительную частоту этого вида лейкозов, публикаций о почечных поражениях при ХЛЛ мало. В 1957 г. Scott первым сообщил о связи нефротического синдрома (НС) с ХЛЛ. С конца 1960-х годов стали появляться статьи, описывающие различные морфологические формы нефропатий в ассоциации с ХЛЛ, проявляющихся НС или почечной дисфункцией. Однако общее количество представленных в литературе больных остается небольшим.
ХЛЛ, как и множественная миелома, относятся к В-клеточным лимфопролиферативным заболеваниям. При множественной миеломе злокачественный клон В-лимфоцитов характеризуется пролиферацией плазматических клеток, которые продуцируют в повышенном количестве моноклональный иммуноглобулин (MIg) в виде свободных легких/тяжелых цепей или интактного MIg. Почки являются органом-мишенью при множественной миеломе, и при этой опухоли формы их поражения изучены достаточно хорошо и связаны или с закупоркой канальцев свободными легкими цепями (цилиндровая нефропатия), или депонированием MIg в гломерулах (AL-/AH-/ ALH-амилоидоз, Randel- и не-Randel-тип отложения MIg, иммунотактоидный гломерулонефрит и др.) [2]. При ХЛЛ и лимфоме из малых лимфоцитов (аналог ХЛЛ, отличается от ХЛЛ отсутствием лимфоцитоза в периферической крови) субстратом опухоли являются В-лимфоциты, которые не дифференцируются до плазматических клеток, и соответственно MIg не продуцируется или секретируется в небольших количествах. Как следствие, гломерулярные поражения при ХЛЛ возникают значительно реже, чем при множественной миеломе, причем спектр поражений при ХЛЛ более разнообразный, а пути патогенеза не всегда понятны, имея гипотетический характер.
В результате того, что НС сравнительно нечасто развивается при ХЛЛ и редкости выполнения нефробиопсий у этих больных, в литературе накопилось всего около 130 случаев поражений почек при ХЛЛ, доказанных биопсией, из которых приблизительно у 80 пациентов выявили клубочковые поражения, у остальных - интерстициальные [3, 4].
Наиболее частой формой паранеопластических гломерулопатий, ассоциированных с ХЛЛ, на светооптическом уровне является мембраннопролиферативный гломерулонефрит МБПГН), за которым следуют болезнь минимальных изменений (БМИ), мембранозная нефропатия (МН), ALамилоидоз. В литературе нам встретилось всего 6
случаев фокально-сегментарного гломерулосклероза (ФСГС) как причины НС при ХЛЛ [4–9].
Представляемый нами клинический случай описывает пациента, у которого через 6 лет после установления диагноза ХЛЛ развился тяжелый НС с острым повреждением почек, а по результатам нефробиопсии были диагностированы ФСГС и острые канальцевые повреждения. НС регрессировал до полной ремиссии, почечная функция восстановилась вслед за нормализацией числа лимфоцитов при лечении ритуксимабом.
Описываемый пациент обследовался и получал лечение в нефрологическом и гематологическом отделениях СЗГMУ им. И.И. Mечникова. Проанализированы опубликованные клинические случаи и обзоры, индексированные в PubMed как «нефротический синдром, ассоциированный с хроническим лимфолейкозом».
КЛИНИЧЕСКИЙ СЛУЧАЙ
Mужчина, 51 год, поступил в нефрологическую клинику 22.09.2015 года с жалобами на появление и быстрое нарастание отеков с прибавкой массы тела в 15 кг в течение последних двух недель, одышку при незначительной физической нагрузке.
История заболевания. В марте 2009 г. при диспансеризации выявлен лейкоцитоз с абсолютным лимфо- цитозом (лимфоцитов 77*109/л), увеличение шейных, подмышечных, паховых лимфатических узлов. В ноябре 2009 г. обследован в гематологическом отделении, где диагностирован хронический лимфолейкоз II стадии по Rai. Диагноз был подтвержден результатами проточной цитофлюориметрии - иммунологический фенотип: CD5+, CD19+, CD20+, СО23+, с коэкспрессией на части клеток CD22. Цитогенетическое исследование - 46ХҮ, ПЦР- диагностика на 13q 14, 17p13, 11 q 13, CEP12- патологии не выявила. В дальнейшем наблюдался гематологом по месту жительству. В период с марта 2009 г. по сентябрь 2015 г. в клинических анализах крови отмечались колебания лимфоцитов в диапазоне 37-70*109/л; год тому назад было рекомендовано начало специфической терапии, однако от лечения пациент уклонялся. Сопутствующая патология: ИБС, постинфарктный кардиосклероз (не-Q^M в 2002 г.), гипертоническая болезнь III стадии, степень II (диагностирована в 2002 г.).
С 05.09.2015 г. отметил прогрессирующее нарастание описанных выше жалоб, выявлены изменения в анализах мочи, в связи с чем был госпитализирован. Постоянно принимает конкор 5 мг/сут, эналаприл 10 мг/сут, тромбо- АСС 100 мг/сут.
Объективные данные. Общее состояние средней тяжести. Рост - 185 см, масса тела - 101,7 кг. Периферические отеки степени анасарки. Mножественные подчелюстные, шейные, подмышечные, паховые лимфатические узлы размером до 3-4 см. Пульс 84 уд/мин, АД 150/100 мм рт. ст. ЧД - 18 в 1 мин, при аускультации - жесткое дыхание. Ординаты печени по Курлову 16×12×10 см. В остальном без значительных отклонений от нормы.
Лабораторные и инструментальные исследования. В клиническом анализе крови гемоглобин - 144 г/л, лейкоциты -108,3 х109/л, лимфоциты - 84,4 х109/л, тромбоциты - 243 х1012/л, СОЭ - 20 мм/ч. Суточная потеря белка (СПБ) - 5,3 г; в осадке мочи - микрогематурия. В биохимическом анализе крови: общий белок - 47 г/л, альбумин - 22 г/л, креатинин - 108 мкмоль/л (рСКФ-EPI - 69 мл/мин), общий холестерин - 9,8 ммоль/л, мочевая кислота - 525 мкмоль/л. УЗИ почек: размеры правой почки - 128x52 мм, левой - 130x54 мм; изменений эхоструктуры почек и деформации чашечно-лоханочной системы не отмечено.

Рис. 1. Пациент, 51 год, диагноз ХЛЛ. а - световая микроскопия. Клубочек с сегментарным склерозом в тубулярном полюсе - «пенистые» клетки, инсудативные изменения, формирование синехии. Гломерулярная базальная мембрана без патологических изменений (импрегнация солями серебра по Джонсу. Ув. 200). б-в - иммунофлюоресцентная микроскопия. б - экспрессия IgM в участке сегментарного гломерулосклероза (IgM. Ув. 200); в - экспрессия С3 в участке сегментарного гломерулосклероза (С3. Ув. 200).
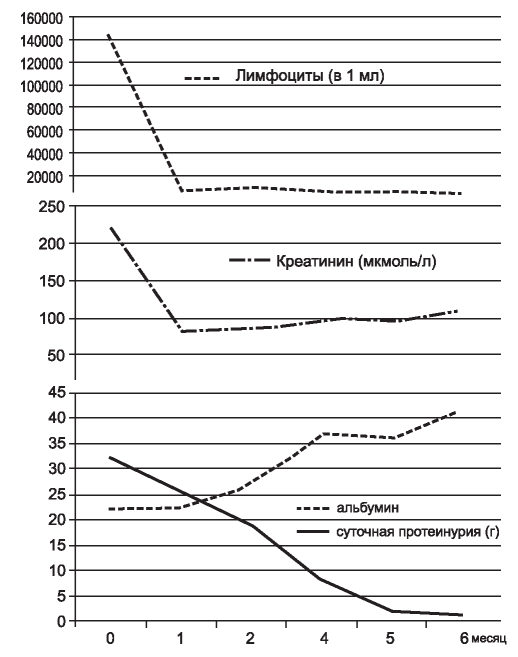
Рис. 2. Динамика показателей числа лимфоцитов (клеток/ мл), креатинина (мкмоль/л), суточной потери белка (г/сут), альбумина (г/л) с начала курса ритуксимаба.
В течение ближайших 2-3 нед отмечалось прогрессирующее нарастание числа лейкоцитов с абсолютным лимфоцитозом, их максимальные значения составили 162х109/л и 144,1х109/л соответственно. Параллельно прогрессировали НС и почечная дисфункция - СПБ возросла до 32,9 г/24 ч; уровень креатинина - до 0,247 ммоль/л, альбумин крови снизился до 20 г/л. Пациент был обследован на титр антинейтрофильных цитоплазматических антител (АНЦА), наличие антител к гломерулярной базальной мембране АНФ, уровень комплемента С3,С4, которые были в пределах референтных значений; криоглобулины также не выявлены. Концентрация свободных легких цепей в сыворотке крови κ-типа - в пределах нормы, λ- типа - 14,4 мкг/мл (при норме 2-10 мкг/мл), в моче - превышение нормы в два раза: κ-тип - 19 мкг/мл, λ- тип - 8,5 мкг/мл (при норме 3-8 и 0,3-4,2 мкг/мл соответственно). Серологические маркеры HCV-ZHBV-инфекции не выявлены. MСКТ грудной клетки, брюшной полости: картина внутригрудной, забрю- шинной и тазовой лимфоденопатии (лимфатические узлы размером до 6,8 см); двусторонний гидроторакс (слой жидкости 22 мм). Вертикальный размер правой доли печени 164 мм; селезёнка - 63х109х146 мм. Нефробиопсия была отложена из-за тяжести состояния больного.
В связи с признаками прогрессирования гематологического заболевания пациент переведен в гематологическое отделение, где при стернальной пункции отмечена субтотальная лимфоидная инфильтрация костного мозга (78,8%), преимущественно за счет зрелых лимфоидных элементов и единичных переходных форм (1,4%), с присутствием лимфоидных элементов макрогенерации (0,8%) с неправильными ядрами, сглаженной структурой хроматина, серо-голубой цитоплазмой. Данные миелограммы и периферической крови указывали на возможную лей- кемизацию зрелой лимфоидной опухоли, однако результаты проведенной далее проточной цитофлюориметрии соответствовали диагнозу В-клеточного ХЛЛ/лимфоме из малых лимфоцитов. Суммарный фенотип клеток периферической крови: CD19+ CD5+ sKappa+ CD23+ CD200+ CD22dim+ CD20dim-/+ CD79b- FMC7+/- CD38. 15.12.2015 г. пациенту сделана нефробиопсия (на фоне лечения).
Биопсия почки. Светооптическое исследование выполнено па парафиновых срезах с использованием следующих окрасок: гематоксилин-эозин, PAS-реакция, трихром по Mассону, импрегнация солями серебра по Джонсу, конго красный. В материале нефробиопсии представлены корковый и мозговой слои ткани почки; 23 клубочка СМ-1- 10, ИФ-13), из них полностью склерозированы 3 (13%) клубочка СМ-1, ИФ-2). Клубочки значительно увеличены; с одноконтурной капиллярной стенкой; с фокальным и сегментарным незначительным расширением мезангиального пространства за счет внеклеточного матрикса и его слабовыраженной гиперклеточности; без признаков эндокапиллярной гиперклеточности и формирования полулуний (рис. 1А).
Гломерулярные базальные мембраны визуально не утолщены; равномерно импрегнированы солями серебра. В тубулярном полюсе 5 (22%) клубочков (СМ-3, ИФ-2) - сегментарный склероз в промежуточной и поздней стадиях эволюции: умеренная гипертрофия подоцитов, «пенистые» клетки в просветах вовлеченных капилляров, инсудативные изменения и формирование сращений с капсулой клубочков (см. рис. 1). Цитоплазма эпителия канальцев крупнозернистая; мультифокальное острое повреждение эпителия канальцев в виде утраты щеточной каймы и частичного уплощения клеток. В просветах канальцев мозгового слоя немногочисленные цилиндры, представленные патологическим белком. Диффузно-очаговая незначительная атрофия канальцев с утолщением и сморщиванием тубулярной базальной мембраны (20%). Диффузно-очаговый слабовыраженный интерстициальный фиброз (20%). Стенки артериол и артерий мелкого калибра значительно утолщены за счет выраженной гипертрофии мышечного слоя и неравномерных очаговых инсудативных изменений. Стенки артерий среднего калибра резко утолщены за счет тяжелого фиброза интимы.
Иммунофлюоресцентное исследование выполнено на криостатных срезах с использованием FITC-коньюгированных антител к человеческим IgA, IgG, IgM, СЗ, Clq, фибрину, легким цепям kappa и lambda. В участках сегментарного гломерулосклероза — экспрессия IgM 3+ и СЗ 4+ (см. рис. 1б-в). В стенках артериол - диффузная субэндотелиальная экспрессия СЗ 3+.
Заключение. Гистологическая картина фокального сегментарного гломерулосклероза (22%), вариант «tip-lesion», с мультифокальным острым повреждением канальцев, незначительным тубулоинтерстициальным фиброзом (20%) и выраженным артериолоартериосклерозом; полный склероз 13% клубочков. Признаков иммунокомплексного и парапротеинемического поражения в представленном материале нет.
Окончательный диагноз: паранеопластический фокально-сегментарный гломерулосклероз, вариант «tip-lesion». Нефротический синдром. Острый канальцевый некроз. ОПП С2 от 28.09.2015 г.
Терапия и проспективное наблюдение. Учитывая развитие тяжелого нефротического синдрома с нарастающим снижением почечной функции на фоне прогрессирования лимфопролиферативного заболевания, было принято решение о начале специфической терапии. С 15.10.2015 г. начата монотерапия ритуксимабом; всего в качестве инициальной терапии пациент получил 5 введений ритуксимаба по 800 мг (375 мг/м2): 4 из них с интервалами в неделю и последнее - 22.12.2015 г. С момента госпитализации назначены малосолевая диета, и-АПФ (принимает с 2002 г.), статины, петлевые диуретики (фуросемид). Сопутствующая терапия включала профилактический прием ко- тримоксазола по 960 мг 2 раза в день через день, кардиотропные препараты.
На 2-й день после введения ритуксимаба лимфоцитоз упал в 3 раза (с 144,1 до 52,3х109/мл). Спустя 2 нед общий лейкоцитоз составил 10x109/ мл, число лимфоцитов - 5,4x109/мл, значения оставались практически такими же через месяц и моменту окончания инициальной терапии (лейкоцитоз - 9,5 х109/мл, лимфоциты - 5,2х109/мл). Динамика креатинина была более замедленной. На 2-3-й день после введения ритуксимаба отмечалось даже его нарастание с 0,247 до 0,332 ммоль/л, затем началось снижение, и спустя неделю уровень креатинина упал до 0, 165 ммоль/л, а через месяц колебался в диапазоне 0,08 - 0,09 ммоль/л (рис. 2 а,б). Быстро наметился регресс отечного синдрома. Спустя 2 нед масса тела снизилась на 10 кг, периферические отеки были минимальными. Тем не менее, у пациента сохранялась протеинурия нефротического уровня: через 2 нед СПБ была 25,6 г/сут, после окончания инициального курса лечения - 8,5 г/сут. В то же время, наметилась положительная динамика уровня альбумина, уровень которого после курса терапии был 26,8 г/л.
Пациент был выписан на амбулаторное лечение 28.12.2015 г. с рекомендациями продолжения поддерживающей терапии ритуксимабом 1 раз в 3 мес, соблюдения малосолевой диеты, приема и-АПФ, фуросемида (по потребности), сопутствующей терапии в прежнем объеме. В апреле 2016 г. выполнено плановое введение ритуксимаба (800 мг). Спустя 5 мес от начала лечения ритуксимабом отмечено снижение протеинурии до 1,8 г/24 ч с нормализацией концентрации альбумина сыворотки крови (38 г/л), общего холестерина (4,5 ммол/л); лимфоциты периферической крови - 3,96х109/мм3; креатинин сыворотки -0,09 ммоль/л (см. рис. 2 а-д). Пациент соблюдал прежние рекомендации. Через 8 мес от начала курса ритуксимаба получены следующие результаты: СПБ - 0,046 г/л, альбумин крови - 41 г/л, холестерин - 5,1 ммоль/л, креатинин крови - 0,11 моль/л (рСКФ- EPI - 67 мл/мин). Диагностирована полная ремиссия НС, ХБП 2 стадии.
ОБСУЖДЕНИЕ
Понятие паранеопластической гломерулопатии было введено в 1922 г. J. Galloway, описавшим пациента с лимфомой Ходжкина, осложнившейся протеинурией. В современном понимании концепция паранеопластической гломерулопатии пришла от P.M.Ronco, отметившего, что манифестация паранеопластического синдрома не связана непосредственно с бурным ростом опухоли, инвазией или метастазами ее в почку, а вызывается секрецией опухолевыми клетками гормонов, факторов роста, цитокинов, опухолевого антигена [6]. Классическими критериями паранеопластической гломерулопатии считаются: 1) существование хронологической связи между диагнозом гломерулярного синдрома и опухоли; 2) параллельная эволюция опухоли и синдрома достигнутой специфической цитотоксической терапией; 3) существование патогенетической связи между гломерулопатией и опухолью (например, продукция опухолью MIg, криоглобулинов, «фактора проницаемости») [6, 10, 31]. На практике до 50% случаев паранеопластического НС опережает проявления опухоли, нередко способствуя ее выявлению; не всегда отмечается параппелизм между рецидивами опухоли и почечным сидромом, также не всегда удается установить молекулярную сзязь между опухолью и почечным поражением.
Длительное время публикации по почечным осложнениям ХЛЛ были представлены описанием единичных случаев. Первая самая большая серия, включившая 13 пациентов, была представлена B. Moulin и соавт. в 1992 году [7]. В 2015 г. было опубликовано исследование A.L. Poitou- Verkinder и соавт. из Франции и работа P.Strati и соавт. из клиники Мэйо, представивших серии из 15 и 49 пациентов соответственно [3, 4].
К настоящему моменту суммарно в литературе имеется описание около 130 пациентов с почечными поражениями, ассоциированными с ХЛЛ, которым выполнялась нефробиопсия в связи НС или неясной почечной дисфункцией. Из этих пациентов у 104 диагностированы гломерулярные поражения, а у 26 - тубулоинтерстициальные (лимфоидная инфильтрация без гломерулопатии, тубулоинтерстициальный нефрит).
В таблице суммированы случаи гломерулярных поражений, описанных в литературе как клинические случаи, серии или упомянутые в обзорах [3-9, 12-30].
Как следует из таблицы, пациенты с ХЛЛ являются гетерогенными по характеру почечного поражения. Из гломерулопатий наиболее часто встречается МБПГН (36%), за которым следует БМИ (16%) и мембранозная нефропатия (14%). Остальные случаи представлены другими формами пролиферативных гломерулонефритов, ФСГС, AL-/АН-амилоидозом, болезнью отложения моноклонального иммуноглобулина (преимущественно легких цепей).
Таблица
Спектр гломерулярных поражений, ассоциированных с хроническим лимфолейкозом/лимфомой из малых лимфоцитов [3-9, 12-30]
Варианты гломерулопатий по результатам морфологического исследования | Количество пациентов, n (%) |
|---|---|
Мембраннопролиферативный гломерулонефрит | 37 (36) |
Болезнь минимальных изменений | 17 (16) |
Мембранозная нефропатия | 15 (14) |
Фокально-сегментарный гломерулонефрит | 7* (7) |
Другие пролиферативные гломерулонефриты | 12 (11) |
Амилоидоз | 11 (11) |
Болезнь отложения моноклонального иммуноглобулина | 3 (3) |
Иммунотактоидный гломерулонефрит | 8**(8) |
Фибриллярный гломерулонефрит | 4** (4) |
Неклассифицируемые изменения | 2 (2) |
Всего | 104 (100) |
*Вместе с описывемым пациентом; **случаи, классифицированные до ультратруктурного исследования как другие морфологические формы гломерулонефритов.
Связь гломерулопатии с ХЛЛ наиболее убедительно удается подтвердить, когда появляется В-клон, секретирующий криоглобулины (криоглобулинемия I или II типа) или некриопреципитирующий MIg (интактный или фрагменты в виде свободных цепей). Повреждение клубочков может вызываться прямым депонированием MIg (пролиферативный ГН с депозитами моноклонального IgG, иммунотактоидный ГН, AL-/АН- амилоидоз, болезнь депонирования MIg), моноклонального криоглобулина (криоглобулинемический ГН) или другими, непрямыми путями (МБПГН без депозитов MIg и криоглобулинов, опосредованный дизрегуляцией альтернативного пути комплемента).
Использование световой, иммунофлюорес- центной, электронной микроскопии и клиниколабораторных показателей позволяет диагностировать следующие клинико-морфологические варианты МБПГН, ассоциированного с ХЛЛ: 1) криоглобулинемический ГН; 2) пролиферативный ГН с депозитами моноклонального иммуноглобулина IgG1; 3) иммунотактоидный ГН с моноклональными IgG-депозитами; 4) фибриллярный ГН, преимущественно с поликлональными IgG-депозитами; 5) С3-гломерулонефрит [3, 4, 6, 13, 15].
Следует отметить, что у пациентов с депозитами MIg в клубочках (по результатам иммунофлюоресценции) MIg в сыворотке (методом иммунофиксации) выявляется не у всех, но часто обнаруживается нарушенное соотношение свободных цепей κ:λ.
Гломерулярные поражения, связанные с криоглобулинами, вызываются иммунными комплексами или присоединением моноклонального криоглобулина к местному или внешнему, осевшему ранее антигену in sity, с последующей активацией комплемента. Криоглобулинемический МБПГН имеет некоторые морфологические особенности: наличие внутрикапиллярных тромбов, состоящих из преципитатов криоглобулинов и имеющих вид микротрубчатых структур при электронной микроскопии; массивная инфильтрация клубочков макрофагами; васкулиты артерий мелкого и среднего калибра [29].
Иммунотактоидный ГН - редкая форма ГН, однако в ассоциация с ХЛЛ встречается значительно чаще (8%), более того - преимущественно при ХЛЛ [30]. Диагноз устанавливается при электронной микроскопии; ультраструктурным признаком являются организованные депозиты в виде микротрубочек (в отсутствие криоглобулинемии). Микротубулярные депозиты монотипные, их интенсивность связана с количеством MIg, секретируемого В-клеточным клоном (MIg при иммунофиксации выявляется в 63-86%). Аналогичные микротубулярные образования находят в аппарате Гольджи злокачественных лимфоцитов. В отличие от криоглобулинового МБПГН для иммунотактоидного ГН не характерны макрофагальная инфильтрация, тромбы и сосудистые повреждения [4, 30].
Дисфункцию Т-лимфоцитов рассматривают в качестве причины развития БМИ/ФСГС, которые находят у части больных с ХЛЛ в отсутствие криоглобулинов и MIg. Патогенез БМИ и ФСГС часто обсуждается вместе, как вариантов подоцитопатии, и, как в случае первичной БМИ/ФСГС, до конца не понят. Основной является гипотеза, что НС при БМИ/ФСГС является результатом Т-клеточной дисфункции с последующей продукцией цитокинов, нарушающих проницаемость клубочкового фильтра, в первую очередь, поражающих подоциты. Множество молекул являются кандидатом на роль фактора проницаемости, вызывающих дисфункцию подоцитов, включая лимфокины.
БМИ/ФСГС ассоциируется преимущественно с опухолями, исходящими из В-клеток (94,4%), в 1-ю очередь, с лимфомой Ходжкина (встречается у 1% больных), поэтому внимание исследователей сфокусировалось на этой болезни. Было показано, что уровень интерлейкина-13 при лимфо- ме Ходжкина повышен в несколько раз [10, 32]. Также обнаружено, что С-maf - индуцирующий белок, препятствующий взаимодействию нефрина с тирозинкиназой fyn, что приводит к дезорганизации цитоскелета и слиянию ножек подоцитов, избирательно повышается в подоцитах и в клетках Березовского-Рид-Штернберга (клетки В-клеточного происхождения, гистологический признак лимфомы Ходжкина) только тех больных лимфомой, у кого диагностирована БМИ/ФСГС [31, 32]. Отсутствие эффекта от стандартной терапии НС при лимфоме Ходжкина и быстрый результат после начала специфического лечения опухоли являются сильным аргументом в пользу того, что злокачественные клетки продуцируют токсический фактор. Нарушения в продукции цитокинов находят и при неходжкинских лимфомах, включая ХЛЛ, также осложняющихся БМИ/ФСГС. Может показаться странным, что БМИ и ФСГС встречаются в основном при В-клеточных опухолях, хотя все больше данных в пользу дисфункции Т-клеток [23, 31]. Однако следует учитывать, что В-клетки играют важную роль как иммунорегуляторные клетки, тесно взаимодействуют с Т-клетками, антиген-представляющими клетками, сами участвуют в процессинге и презентации антигена, секретируют цитокины. Злокачественные В-клетки могут продуцировать свой профиль цитокинов, поэтому сочетанная дисфункция Т-клеток и В-клеток может рассматриваться как основной фактор в патогенезе БМИ/ФСГС при В-клеточных опухолях [23, 31].
В литературе описано 17 случаев БМИ и 7 случаев ФСГС (вместе с нашим пациентом) при ХЛЛ/лимфоме из малых лимфоцитов [3-9, 11-15, 23, 33]. Низкая встречаемость ФСГС, по сравнению с БМИ, может быть связана с гиподиагностикой ФСГС, особенно если биопсия выполняется на ранних стадиях болезни. НС может предшествовать (за 3 мес) диагностике опухоли, появляться одновременно (50%) или в течении ХЛЛ.
В нашем случае тяжелый НС (протеинурия до 32 г/сут, альбумин 20 г/л, холестерин 9,8 ммоль/л, резистентные отеки степени анасарки ) развился через 6 лет после диагноза ХЛЛ, на фоне прогрессирования опухоли. Нефробиопсия выявила ФСГС со склерозом 13% клубочков на фоне сосудистых изменений. Электронная микроскопия не выполнялась, так как при иммунофлюоресценции не было обнаружено депозитов Ig.
У пациента была получена полная ремиссия НС на фоне лечения ритуксимабом. Ритуксимаб - химерное моноклональное антитело, специфически связывающееся с CD20 на В-лимфоцитах, с доказанной эффективностью при ХЛЛ. Связывание ритуксимаба с CD20 на В-лимфоцитах вызывает лизис В-клеток. В литературе имеется описание клинических случаев эффективности ритуксимаба при резистентном ФСГС. Однако столь быстрый эффект терапии, направленной на В-клетки, полученный у нашего пациента, дает основание считать, что произошло восстановление функции подоцитов, поскольку прекратилась продукция злокачественными клетками нефротоксического циркулирующего цитокина.
Мембранозная нефропатия встречается при ХЛЛ/лимфоме из малых лимфоцитов в 15-19 % случаев среди других гломерулопатий [7-9, 15-22, 34]. Паранеопластическая МН типично ассоциируется с солидными опухолями [10]. Следующие механизмы могут участвовать в развитии МН: 1) образование иммунных комплексов (ИК) in situ, когда антитела образуются против опухолевого антигена (например ПСА), локализованного в субэпителиальном пространстве, или против подоцитарного антигена, идентичного или схожего с опухолевым; 2) способность опухолевых антигенов формировать циркулирующие ИК, оседающие затем в клубочках; 3) воздействие внешних факторов или нарушение иммунной функции, вызывающие параллельно опухоль и ГН [10, 31].
Эти же механизмы могут учитываться при МН, ассоциированной с ХЛЛ. Кроме того, развитию МН в этом случае могут способствовать усиление аутоиммунитета вследствие Т-клеточной дисрегуляции, гиперглобулинемия, цитокин- обусловленное повышение клубочковой проницаемости [34].
У части пациентов светооптически находят атипичную форму мембранозной нефропатии, а при ультраструктурном анализе - субэпителиаль- ные депозиты, организованные в микротрубочки, или в других случаях - фибриллярные депозиты, соответствующие критериям иммунотактоидного или фибриллярного ГН [6, 7].
AL-/АН--амилоидоз встечается при ХЛЛ реже, чем можно было бы ожидать, учитывая, что до 35% больных ХЛЛ имеют нарушенное соотношение свободных легких цепей. Теоретическим объяснением может быть то, что количество свободных цепей обычно умеренное, и клон В-клеток при ХЛЛ чаще продуцирует kappa-цепи, которые менее амилоидогенные, чем lambda [25, 26]. Реже почечная патология проявляется признаками, характерными для болезни отложения MIg (MIDD) или Randell-типа отложения MIg [4, 7].
Острое повреждение почек (ОПП) - нередкое осложнение при ХЛЛ, встречается в 7,5% на момент диагноза и еще в 16,2% в течение болезни [35]. Патогенез ОПП может быть различным. Причиной, непосредственно связанной с ХЛЛ, является инфильтрация паренхимы опухолевыми лимфоцитами, которая при обычном морфологическом исследовании имеет много общего с острым тубулоинтерстициальным нефритом (ОТИН) [4]. В пользу опухолевого инфильтрата свидетельствуют большие скопления малых, мономорфных лимфоцитов; диагноз подтверждается или исключается при иммуногистохимическом окрашивании на CD3, CD20, CD5 и CD23. Опухолевая инфильтрация в 44-90% случаев выявляется на аутопсии, однако при жизни чаще бессимптомна. Несмотря на то, что показаниями для нефробиопсии у описываемых больных с ХЛЛ, как уже отмечалось, были НС или неясная ОПП, в литературе имеются менее двух десятков случаев, когда инфильтрация являлась главной причиной почечной патологии [3]. Другие потенциальные причины ОПП - контраст-индуцированная нефропатия (КИН); синдром лизиса опухоли, токсичность химиопрепаратов, обструкция мочеточников увеличенными лимфатическими узлами.
В нашем случае у пациента в период максимальной протеинурии (32 г/24 ч) отмечена ОПП II стадии (AKIN). Исследование нефробиоптата (биопсия, выполненная после восстановления почечной функции на фоне лечения ритуксимабом, но сохраняющимся НС), помимо ФСГС, показало наличие слабовыраженного диффузно-очагового интерстициального фиброза на фоне значительно утолщенных стенок артериол, артерий мелкого калибра и среднего калибра, что согласуется с диагнозом гипертонической болезни, а также признаки мультифокального острого повреждения канальцев в виде утраты эпителием щеточной каймы и частичного уплощения клеток, генез которого остался не вполне ясным. Предположительно острое повреждение эпителия канальцев могло быть вызвано массивной протеинурией в сочетании с редукцией кровотока (артериоло- и артериосклероз), что присутствовало у нашего пациента и с чем мы на практике нередко встречаемся. С другой стороны - повреждения могли быть спровоцированы ишемией почки, поскольку у пациента с предсуществующей редукцией кровотока нельзя исключить дополнительный фактор гиповолемии в период тяжелого и резистентного к диуретикам отечного синдрома. Далее пациенту выполнялась МСКТ брюшной полости и грудной клетки с введением рентгеноконтрастного препарата (профилактика КИН проводилась в виде инфузии физраствора до и после исследования, приема ацетилцистеина), что, безусловно, могло быть причиной ОПП.
Стандартом терапии ХЛЛ у относительно молодых пациентов с хорошим соматическим статусом является режим FCR (флударабин, циклофосфан, риткусимаб), который является наиболее эффективным, однако флударабин может оказывать выраженное иммуносупрессивное действие. Препарат на 40-60 % выводится почками, поэтому при снижении скорости клубочковой фильтрации противопоказан из-за усиления токсичности; оптимальным выбором терапии в таких случаях является схема BR (бендамустин + ритуксимаб). Для лиц преклонного возраста первой линией терапии является хлорамбуцил; используют также более эффективные без усиления токсичности схемы Chl-R (хлорамбуцил + ритуксимаб) или FCR-Lite. По показаниям назначаются другие, основанные на ритуксимабе, режимы: R-HDMP (ритуксимаб + высокие дозы метиопреднизоло- на), R-CD (ритуксимаб, циклофосфан, дексаметазон/преднизолон), R-CD с добавлением винкри- стина и т.д.
По данным литературы, при МБПГН эффективными (с параллельной гематологической ремиссией и резолюцией НС) были режимы, содержащие алкилирующие препараты: R-CD (± винкристин), монотерапия хлорамбуцилом или хлорамбуцил + стероиды, Chl-R. Также отмечено, что при монотерапии ритуксимабом или сочетании ритуксимаба с кортикостероидами эффект наблюдался у меньшей части пациентов [3, 4, 7]. Всем пациентам назначались малосолевая диета, диуретики, и-АПФ.
У больных с ХЛЛ с БМИ использовались разные схемы лечения: ритуксимаб + преднизолон, монотерапия в виде обинутузумаба (гуманизированное моноклональное антитело к SD20) или хлорамбуцина, ритуксимаба, преднизолона [3, 4, 23]. Ремиссии НС были получены у всех больных, однако при монотерапии преднизолоном чаще, чем при специфической и комбинированной терапии, развивались рецидивы (77,8 и 25% соответственно) [23].
Полная ремиссия ФСГС, согласно предыдущим наблюдениям, отмечалась при комбинированной терапии по схеме FCR [5]. В нашем случае резолюция НС была получена при монотерапии ритуксимабом через 8 мес от начала лечения, на фоне нормализации числа лимфоцитов.
При лечении мембранозной нефропатии, ассоциированной с ХЛЛ, отмечено, что наиболее активным препаратом был флудабарин, который в настоящее время рекомендован как препарат первой линии при этом заболевании [34].
В целом, единичные наблюдения и анализ всех опубликованных случаев свидетельствуют, что агрессивная химиотерапия является наиболее эффективной, чтобы индуцировать полную и продолжительную ремиссию НС, связанную с ХЛЛ [3-5, 7, 10, 21, 23, 34].
ЗАКЛЮЧЕНИЕ
Для ХЛЛ характерен широкий спектр почечных поражений, и ФСГС - редкая форма гломе- рулопатии, ассоциируемая с этим видом опухоли. Развитие ФСГС при ХЛЛ не является случайностью, учитывая появление НС на фоне прогрессирования ХЛЛ. Параллельная регрессия опухоли и НС на фоне терапии ритуксимабом, направленной на злокачественные клетки, является косвенным, но убедительным аргументом в пользу того, что секреция токсического фактора опухолевыми клетками может быть причиной дисфункции и повреждения подоцитов, а прекращение синтеза лимфокинов под действием препарата приводит к восстановлению функции подоцитов.
Нефробиопсия предоставляет важную информацию, особенно в случаях почечной патологии, протекающих с НС или ОПП, позволяющую исключить у больных с ХЛЛ потенциально токсическую и обычно неэффективную в этих случаях стандартную терапию гломерулонефритов и с учетом накопленного межнационального опыта провести в содружестве с гематологами специфическое лечение с оптимальным результатом.
Список литературы
1. Российские клинические рекомендации по диагностике и лечению лимфопролиферативных заболеваний. Под руководством проф. ИВ Поддубной, проф. ВГ Савченко. Медиа Медика, М., 2013; 108-118 [Rossii`skie clinicheskie rekomendatcii po diagnostike i lecheniiu limfoproliferativny`kh zabolevanii`. Pod rukovodstvom prof. IV Poddubnoi`, prof. VG Savchenko. M.: Media Medika, 2013; 108-118]
2. Радченко ВГ, Аниконова ЛИ, Полякова ВВ. Поражение почек при множественной миеломе и моноклональных гаммапатиях почечного значения (научный обзор). Профилактическая и клин мед 2014; 4 (53): 97-106 [Radchenko VG, Anikonova LI, Poliakova VV. Porazhenie pochek pri mnozhestvennoi` mielome i monoclonal`ny`kh gammapatiiakh pochechnogo znacheniia (nauchny`i` obzor). Profilakticheskaia i clinicheskaia meditcina 2014; 4 (53): 97-106]
3. Strati P, Nasr SH, Leung N et al. Renal complications in chronic lymphocytic leukemia and monoclonal B-cell lymphocytosis: the Mayo Clinic experience. Haematologica 2015; 100(9). doi:10.3324/haematol.2015.128793
4. Poitou-Verkinder AL, Francois A, Drieux F et al. The spectrum of kidney pathology in B-cell chronic lymphocytic leukemia / small lymphocytic lymphoma: a 25-year multicenter experi ence. PLoS One 2015; 10 (3): e0119156. doi:10.1371/journal.pone. 0119156
5. Arampatzis S, Giannakoulas N, Liakopoulos V et al. Simultaneous clinical resolution of focal segmental glomerulosclerosis associated with chronic lymphocytic leukaemia treated with fludarabine, cyclophosphamide and rituximab. BMC Nephrol 2011; 12:33
6. Ronco PM. Nephrology Forum: Paraneoplastic glomerulopathies: new insights into an old entity. Kidney Int 1999; 56: 355-377
7. Moulin B, Ronco PM, Mougenot B et al. Glomerulonephritis in chronic lymphocytic leu kemia and related B-cell lymphoma. Kidney Int 1992; 42:127–135
8. Kowalewska J, Nicosia RF, Smith KD et al. Patterns of glomerular injury in kidneys infil trated by lymphoplasmacytic neoplasms. Hum Pathol 2011; 42(6):896–903. doi: 10.1016/j. humpath.2010.09.009
9. Da’as N, Polliack A, Cohen Y et al. Kidney involvement and renal manifestations in non-Hodgkin’s lymphoma and lymphocytic leukemia: a retrospective study in 700 patients. Eur J Hematol 2001; 67:158–164
10. Latcha S, Sechan SV. Paraneoplastic Glomerulopathy. In: Finkel KW, Howard SC, eds. Renal Disease in Cancer Patients, 1st ed. Academic Press, New York, 2013; 209-249
11. Eagen JW, Lewis EJ. Glomerulopathies of neoplasia. Kidney Int 1977; 11:297–306
12. Alpers CE, Cotran RS. Neoplasia and glomerular injury. Kidney Int 1986; 30:465–473
13. Moulin B, Chantrel F, Petitjean P et al. Chronic lymphoproliferative disorders and glomerular diseases: Review of the literature and pathophysiologic considerations. J Nephrol 1995; 8:20–26
14. Seney FD, Federgreen WR, Stein H et al. A review of nephrotic syndrome as sociated with chronic lymphocytic leukemia. Arch Intern Med 1986; 146:137–141
15. Touchard G, Preud’homme JL, Aucouturier P et al. Nephrotic syndrome associated with chronic lymphocytic leukemia: An immunological and pathological study. Clin Nephrol 1989; 31:107–116
16. Cameron S, Ogg CS. Nephrotic syndrome in chronic lymphatic leukaemia. Br Med J 1974; 4:164
17. Ziakas PD, Giannouli S, Psimenou E et al. M. Membranous glomerulonephritis in chronic lymphocytic leukemia. Am J Hematol 2004; 76(3):271–274
18. Row PG, Cameron JS, Turner DR et al. Membranous nephropathy. Long-term follow up and association with neoplasia. Q J Med 1975; 44:207–239
19. White CA, Dillman RO, Royston I. Membranous nephropathy associated with an unusual phenotype of chronic lymphocytic leukemia. Cancer 1983; 52:2253–2255
20. Eisterer W, Neyer U, Hilbe W, et al. Effect of cyclosporin A in a patient with refractory nephrotic syndrome associated with B chronic lymphocytic leukemia. Nephron 1996; 72: 468–471
21. Butty H, Asfoura J, Cortese F et al. Chronic lymphocytic leukemia-as sociated membranous glomerulopathy: remission with fludarabine. Am J Kidney Dis 1999; 33:E8
22. Abdel-Raheem MM, Jamil MG, Potti A et al. Fludarabine therapy in chronic lym phocytic leukemia associated severe nephrotic syndrome. Hematologica 2000; 85(11): 1224–1225
23. Kofman T, Zhang SY, Copie-Bergman C et al. Minimal Change Nephrotic Syndrome Associated With Non-Hodgkin Lymphoid Disorders. Medicine 2014;93:350–358 DOI: 10.1097/ MD.0000000000000206
24. Dabbs DJ, Striker LM, Mignon F et al. Glomerular lesions in lymphomas and leukemias. Am J Med 1986; 80:63–70. PMID: 3510541
25. Sanchorawala V, Blanchard E, Seldin DC et al. AL amyloidosis associated with B-cell lymphoproliferative disorders: frequency and treatment outcomes. Am J Hematol 2006; 81:692– 695. PMID: 16795060
26. Dou X, Hu H, Ju Y et al. Systemic amyloidosis associated with chronic lympho cytic leukemia/small lymphocytic lymphoma. Am J Hematol 2013; 88: 375–378. doi: 10.1186/1746-1596-6-99
27. Sethi S, Fervenza FC, Zhang YZ et al. Proliferative Glomerulonephritis secondary to dys function of the alternative pathway of complement. Clin J Am Soc Nephrol 2011; 6(5):1009-1017
28. Barbour SJ, Beaulieu MC, Zalunardo NY et al. Proliferative glomerulonephritis with monoclonal IgG deposits secondary to chronic lymphocytic leukemia. Report of two cases. Nephrol Dial Transplant 2011; 26(8):2712-2714
29. Козловская ЛВ, Гордовская НБ, Коротчаева ЮВ. Гломерулонефрит при HBV-, HCV-инфекциях, включая гломерулонефрит при криоглобулинемическом васкулите. В: Шилов ЕМ, Смирнов АВ, Козловская НЛ. Нефрология. ГЭОТАР-Медиа, М., 2016 [Kozlovskaia LV, Gordovskaia NB, Korotchaeva IUV. Glomerulonefrit pri HBV-, HCV-infektciiakh, vcliuchaia glomerulonefrit pri krioglobulinemicheskom vaskulite. V: Shilov EM, Smirnov AV, Kozlovskaia NL. Nefrologiia. GE`OTARMedia, M., 2016]
30. Leung N, Nasr S. Myeloma-related Kidney Disease. Advances in Chronic Kidney Disease 2014; 2(1): 36-41
31. Jhaveri KD. Shah HH, Patel C et al. Glomerular Diseases Associated With Cancer, Chemotherapy, and Hematopoietic Stem Cell Transplantation. Advances in Chronic Kidney Disease 2014; 21(1):48-55. doi.org/10.1053/j.ackd.2013.08.003
32. Kuppers R, Schwering I, Brauninger A et al. Biology of Hodgkin’s lymphoma. Ann Oncol 2002; 13 (suppl 1):11-18
33. Dabbs DJ, Striker LM, Mignon F et al. Glomerular lesions in lymphomas and leukemias. Am J Med 1986; 80:63–70
34. Rocca AR, Giannakakis C, Serriello I et al. Fludarabine in Chronic Lymphocytic Leukemia with Membranous Nephropathy. Renal Failure 2013; 35(2): 282–285
35. Shanafelt TD, Rabe KG, Hanson CA, et al. Renal disease in patients with chronic lymphocytic leukemia (CLL). Blood 2013;122 (21):abstr.
Об авторах
Л. И. АниконоваРоссия
Аниконова Людмила Ивановна, кандидат медицинских наук, доцент.
Кафедра внутренних болезней и нефрологии.
192283, Санкт-Петербург, ул. Олеко Дундича, д. 8, корп. 2.
В. Ю. Ряснянский
Россия
Ряснянский Владимир Юрьевич, кандидат медицинских наук, доцент.
Кафедра внутренних болезней и нефрологии.
192283, Санкт-Петербург, ул. Олеко Дундича, д. 8, корп. 2.
Е. Ю. Макарьева
Россия
Макарьева Екатерина Юрьевна, больничный ординатор отделения диализа № 2 кафедры внутренних болезней и нефрологии.
195067, Санкт-Петербург, Пискаревский пр., д. 47.
О. А. Воробьева
Россия
Воробьева Ольга Алексеевна, кандидат медицинских наук.
192283, Санкт-Петербург, ул. Олеко Дундича, д. 8, корп. 2
Рецензия
Для цитирования:
Аниконова Л.И., Ряснянский В.Ю., Макарьева Е.Ю., Воробьева О.А. ФОКАЛЬНО-СЕГМЕНТАРНЫЙ ГЛОМЕРУЛОСКЛЕРОЗ, АССОЦИИРОВАННЫЙ С ХРОНИЧЕСКИМ ЛИМФОЛЕЙКОЗОМ: КЛИНИЧЕСКИЙ СЛУЧАЙ И ЛИТЕРАТУРНЫЙ ОБЗОР. Нефрология. 2016;20(6):101-110.
For citation:
Anikonova L.I., Ryasnyanskiy V.U., Makarjyeva E.U., Vorobjyеva O.A. FOCAL SEGMENTAL GLOMERULOSCLEROSIS ASSOCIATED WITH CHRONIC LYMPHOCYTIC LEUKAEMIA: CASE REPORT AND LITERATURE REVIEW. Nephrology (Saint-Petersburg). 2016;20(6):101-110. (In Russ.)








































