Перейти к:
ВЛИЯНИЕ ЭМПАГЛИФЛОЗИНА НА СОСТОЯНИЕ ПОЧЕК У НОРМОГЛИКЕМИЧЕСКИХ КРЫС С СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТЬЮ
https://doi.org/10.24884/1561-6274-2017-21-2-83-92
Аннотация
ЦЕЛЬ ИССЛЕДОВАНИЯ – оценить влияние ингибитора глюкозо-натриевого котранспортера SGLT-2 эмпаглифлозина на состояние почек у недиабетических крыс линии Wistar c экспериментальной сердечной недостаточностью. МАТЕРИАЛ И МЕТОДЫ. Хроническую сердечную недостаточность (ХСН) моделировали путем лигирования левой коронарной артерии. Первую группу составили 11 животных с ХСН, у которых проводили лечение эмпаглифлозином («Джардинс®», «Берингер Ингельхайм») внутрь в дозе 1 мг/кг в течении 1 мес. Во второй группе крыс с ХСН (n=10) препарат не назначали. У животных измеряли систолическое АД, частоту сердечных сокращений, мочевые концентрации и величины суточной экскреции глюкозы, альбумина, креатинина, мочевины и важнейших ионов. В образцах мочи также устанавливалась экспрессия миРНК-21. РЕЗУЛЬТАТЫ. Назначение эмпаглифлозина приводило к нарастанию глюкозурии, альбуминурии и экспрессии микроРНК-21 в моче. Выведение неорганического фосфора под влиянием данного препарата уменьшалось. Уровни АД, частоты сердечных сокращений и экскреции веществ, включая натрий, под влиянием эмпаглифлозина существенно не менялись. ЗАКЛЮЧЕНИЕ. Полученные данные позволяют полагать, что ингибиторы SGLT-2 могут оказывать определенное негативное непосредственное воздействие на состояние почек. Тем не менее, при сахарном диабете такие эффекты данных препаратов могут маскироваться мощными нефропротекторными влияниями, связанными со способностью ингибиторов SGLT-2 противодействовать гипергликемии и гломерулярной гиперфильтрации.
Для цитирования:
Куликов А.Н., Береснева О.Н., Парастаева М.М., Оковитый С.В., Иванова Г.Т., Ивкин Д.Ю., Ивкина А.С., Левыкина Е.Н., Зарайский М.И., Карпов А.А., Кучер А.Г., Зубина И.М., Галкина О.В., Каюков И.Г. ВЛИЯНИЕ ЭМПАГЛИФЛОЗИНА НА СОСТОЯНИЕ ПОЧЕК У НОРМОГЛИКЕМИЧЕСКИХ КРЫС С СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТЬЮ. Нефрология. 2017;21(2):83-92. https://doi.org/10.24884/1561-6274-2017-21-2-83-92
For citation:
Kulikov A.N., Beresneva O.N., Parastaeva M.M., Okovityi S.V., Ivanova G.T., Ivkin D.Yu., Ivkina A.S., Levykina E.N., Zaraiskii M.I., Karpov A.A., Kucher A.G., Zubina I.M., Galkina O.V., Kaiukov I.G. INFLUENCE OF EMPAGLIFLOZIN ON THE KIDNEYS IN NORMOGLYCEMIC RATS WITH HEART FAILURE. Nephrology (Saint-Petersburg). 2017;21(2):83-92. (In Russ.) https://doi.org/10.24884/1561-6274-2017-21-2-83-92
ВВЕДЕНИЕ
В настоящее время в мире насчитывается примерно 387 млн страдающих сахарным диабетом (СД). При этом заболеваемость и распространенность СД непрерывно увеличиваются на протяжении последних 20 лет [1]. Общеизвестно, что СД является тяжелым мультисистемным заболеванием, ассоциирующимся с наличием сердечнососудистых проявлений, в том числе поражений коронарных, цереброваскулярных и периферических артерий. Последнее во многом определяет летальность у больных с СД. Кроме того, при СД возникают тяжелые повреждения почек и мочевыводящих путей [2]. В Западной Европе и США примерно у 40% всех пациентов, требующих регулярной диализной терапии, причиной терминальной почечной недостаточности (ТПН) является СД [3]. В свою очередь, развитие ТПН определяется наличием при СД экстра- и интраренального атеросклероза и диабет-ассоциированного повреждения клубочков (диабетическая нефропатия - ДН). Кроме того, в почках у больных с СД часто наблюдается выраженное интерстициальное воспаление [4]. Наконец, пациенты-диабетики составляют группу высокого риска в отношении контрастиндуцированного острого повреждения почек (КИ-ОПП). Они же часто страдают от бактериальных инфекций мочевых путей, иногда приводящих к поражениям почечной ткани как таковой [5].
Мультисистемность СД требует терапевтических подходов и лекарственных препаратов, способных оказывать плейотропные воздействия [6-8]. Например, желательно, чтобы антигипер- гликемические препараты оказывали прямое, кардио- и(или) нефропротекторное воздействия [9].
В настоящее время класс сахароснижающих средств непрерывно пополняется не только отдельными препаратами, но и целыми группами лекарств, зачастую обладающими принципиально новыми механизмами действия. Очень интересными в данном аспекте представляются конкурентные ингибиторы мембранного натрий/глю- козного котранспортера SGLT-2.
Несколько крупных рандомизированных исследований, результаты которых суммированы в ряде недавних обзоров, дали важную информацию о последствиях применения ингибиторов SGLT-2 у пациентов с сахарным диабетом. В этих работах получены согласующиеся результаты, подтверждающие, что назначение ингибиторов SGLT-2 приводит к редукции гипергликемии, улучшает гликемический контроль, ассоциируется со снижением массы тела, вызванной нарастанием экскреции глюкозы, и уменьшением артериального давления. Такие эффекты имели место при использовании ингибиторов SGLT-2 как в виде монотерапии, так и в комплексе с другими противогликемическими средствами [6-8, 10]. Отчетливое кардиопротективное действие ингибиторов SGLT-2 у больных с сахарным диабетом выражалось в снижении смертности от кардиоваскулярных причин, числа госпитализаций по поводу сердечной недостаточности и уменьшении общей смертности. В плане нефропротекции применение данных препаратов ассоциировалось с существенным снижением частоты развития новых случаев диабетической нефропатии или ухудшения течения уже существующей. Использование SGLT-2 противодействовало также достижению таких композитных конечных точек, как удвоение концентрации сывороточного креатинина, начало заместительной почечной терапии или смерть от почечных причин. Кроме того, результаты экспериментальных и клинических исследований свидетельствуют о том, что данные средства способны снижать степень гломерулярной гиперфильтрации, уменьшать альбуминурию и выраженность почечной гипертрофии и воспаления [6-10].
Имеющиеся данные не оставляют сомнений в том, что ингибиторы SGLT-2 обладают целым рядом позитивных плейотропных терапевтических эффектов, однако далеко не все вопросы относительно последствий их применения (в том числе в плане кардио- и, особенно, нефропротекции) остаются разрешенными. В частности, не известны многие конкретные механизмы воздействия этих средств на сердечно-сосудистую систему и почки. Кроме того, большинство исследований, подтвердивших нефро- и кардиопротективное действия ингибиторов SGLT-2, выполнены на пациентах с сахарным диабетом или экспериментальных моделях данного заболевания. В такой ситуации нефро- и кардиопротективные эффекты данных препаратов могли быть следствием их метаболического (антигипергликемического) действия. Собственное же влияние ингибиторов SGLT-2 на сердечно-сосудистую систему и почки может оказаться замаскированным. В связи с этим мы предприняли настоящее исследование, в котором изучали потенциальные нефро- и кардиопротекторные эффекты ингибитора SGLT-2 эмпаглифлозина у крыс линии Wistar c экспериментальной сердечной недостаточностью. При этом данное сообщение посвящено, преимущественно, результатам воздействия эмпаглифлозина на состояние почек.
МАТЕРИАЛ И МЕТОДЫ
Исследование проведено на взрослых крысах- самцах линии Wistar массой 190-210 г (n=21), разделенных с помощью рандомизации на две группы. Хроническую сердечную недостаточность (ХСН) моделировали путем перманентного лигирования левой коронарной артерии [11]. Первую группу (группа интервенции) составили 11 крыс, у которых моделировали ХСН, и через 1 мес после операции начинали лечение эмпаглифлозином («Джардинс®», «Берингер Ингельхайм») внутрь в дозе 1 мг/кг. Вторую группу (группа сравнения) составили 10 крыс с ХСН, не получавших лечения. Через 1 мес после операции оценивали эффективность модели эхокардиографическим методом, критериями успешности модели ХСН считали наличие участков истончения миокарда, нарушений локальной и/или глобальной сократимости левого желудочка (ЛЖ).
Животные получали стандартный пищевой рацион (0,34% NaCl). Доступ к воде был свободным.
Через 1 мес после начала лечения эмпаглиф- лозином у бодрствующих крыс измеряли систолическое АД манжеточным методом. Для этого животному, помещенному в индивидуальную камеру, на хвост надевали окклюзионную манжетку, соединенную с электроманометром «ENEMA» (Швеция). Уровень АД соответствовал величине давления в манжетке в момент прекращения пульсовых колебаний. Каждому животному выполняли 4-5 замеров АД и частоты сердечных сокращений (ЧСС) и рассчитывали среднее значение трех последних измерений.
На следующий день после измерения АД крыс помещали в метаболические клетки, в которых проводился сбор мочи в течение суток. измерялся объем мочи (V) и с помощью стандартных лабораторных анализаторов определялись мочевые концентрации натрия (UNa), глюкозы (UGlu), кальция (UCa), магния (UMg), неорганического фосфора (UPi), альбумина (UA), мочевины (UUr) и креатинина (UCr). Рассчитывались величины суточной экскреции (UX24, где Х - концентрация соответствующего вещества) этих веществ.
В образцах мочи также устанавливалась экспрессия миРНК-21 при помощи реакции амплификации (RealTime PCR-протокол). Расчет проводился по методу 2deltaCt.
Статистический анализ выполнялся с помощью пакета прикладных программ STATISTICA 10. Результаты представлялись как медиана [ин- терквартильный размах]. Использованы тест Манна-Уитни и коэффициент ранговой корреляции Спирмена.
Таблица
Показатели состояния почек у лабораторных животных
Показатели | n | СН+ЭМП (Me[IQR]) | n | СН (Me[IQR]) | р |
|---|---|---|---|---|---|
V, мл/сут | 11 | 4,0[3,2-5,6] | 10 | 3,2[2,8-5,0] | 0,291 |
UNa, ммоль/л | 11 | 32,7[10,0-51,0] | 10 | 10,0[10,0-48,9] | 0,503 |
UCa, ммоль/л | 11 | 2,76[1,24-4,74] | 10 | 2,58[2,34-3,20] | 0,999 |
UMg, ммоль/л | 11 | 12,76[7,16-14,12] | 10 | 13,1[12,12-13,44] | 0,999 |
UPi, ммоль/л | 11 | 59,5[44,5-96,0] | 10 | 172,3[149,5-209,5] | 0,0022 |
UCr, ммоль/л | 11 | 17,65[12,6-23,85] | 10 | 21,9[15,5-26,7] | 0,275 |
UUr, ммоль/л | 11 | 1337,5[877,0-1674,5] | 10 | 1516,0[1426,5-1898,0] | 0,149 |
UNa24, мкмоль/сут | 11 | 137,3[102,0-208,3] | 10 | 64,1[28,1-190,0] | 0,218 |
UCa24, мкмоль/сут | 11 | 10,4[6,6-17,1] | 10 | 10,6[6,4-14,1] | 0,597 |
UMg24, мкмоль/сут | 11 | 48,8[31,6-67,2] | 10 | 41,3[34,9-66,1] | 0,751 |
UPi24, мкмоль/сут | 11 | 285,6[211,2-374,4] | 10 | 487,5[358,0-853,1] | 0,0022 |
UCr24, мкмоль/сут | 11 | 71,0[52,5-89,8] | 10 | 81,9[56,7-95,4] | 0,805 |
UUr24, мкмоль/сут | 11 | 5752[4550-6199] | 10 | 5988[3994-7116] | 0,972 |
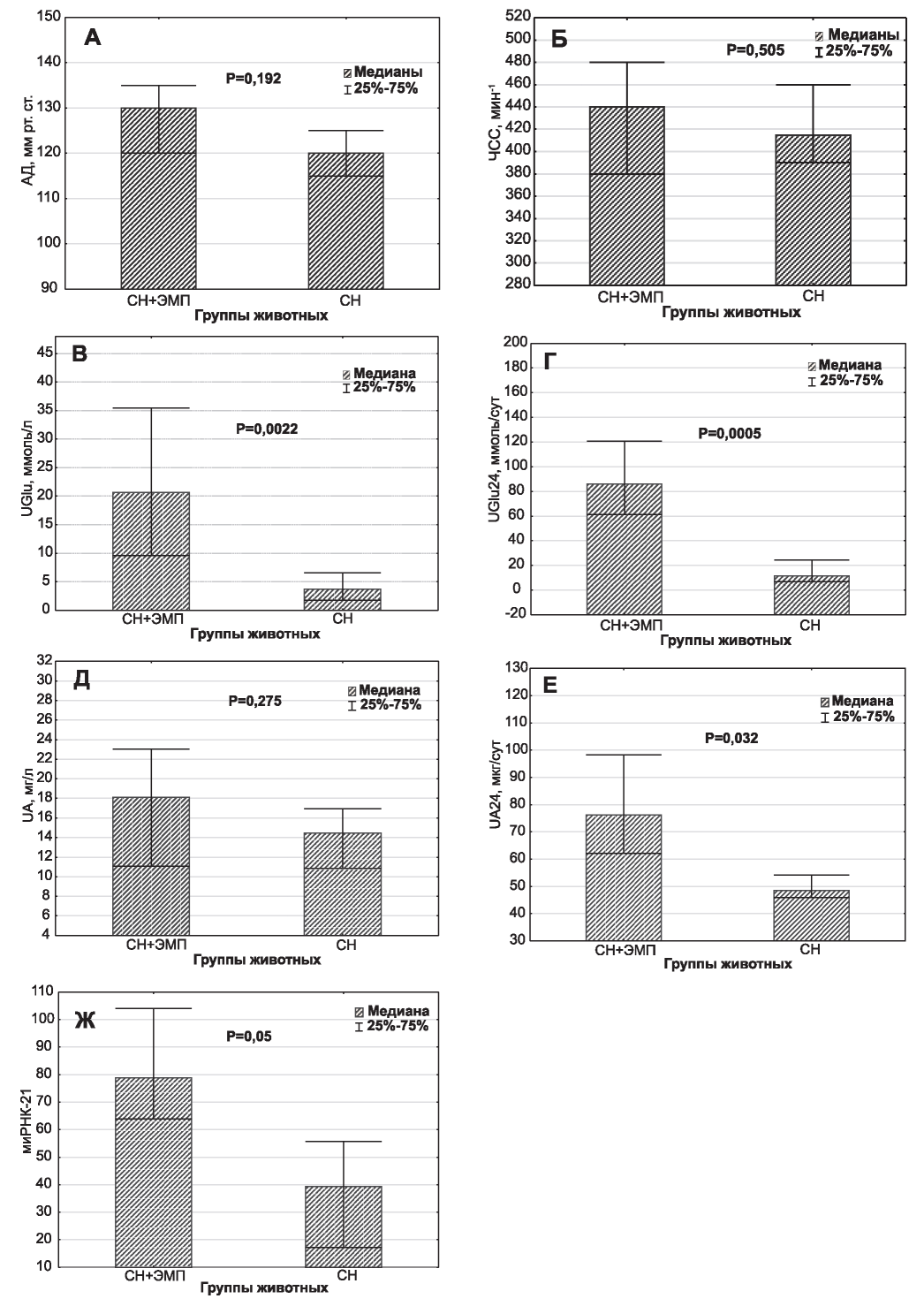
Рис. 1. Характеристики состояния сердечно-сосудистой системы и почек у крыс с сердечной недостаточностью, получающих (СН+ЭМП; n=11) и не получающих (СН; n=10) эмпаглифлозин. А - уровни АД, Б - частота сердечных сокращений, В - концентрация глюкозы в моче, Г - суточная экскреция глюкозы, Д - концентрация альбумина в моче, Е - суточная экскреция альбумина, Ж - уровень экспрессии микроРНК-21 в моче. Тест Манна-Уитни.
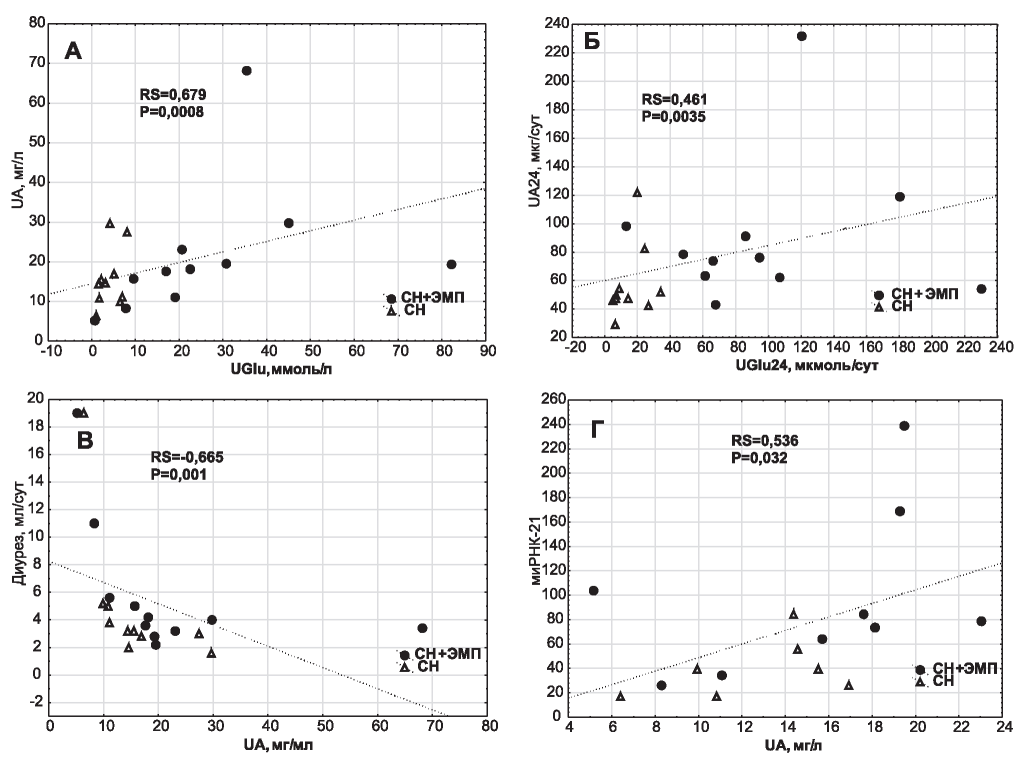
Рис. 2. Взаимосвязи между показателями состояния почек у крыс с сердечной недостаточностью, получающих и не получающих эмпаглифлозин (коэффициент ранговой корреляции Спирмена). А - взаимосвязь между концентрациями глюкозы (UGlu) и альбумина (UA) в моче, Б - взаимосвязь между суточной экскрецией глюкозы (UGlu24) и альбумина (UA24), В - взаимосвязь между концентрацией альбумина (UA) в моче и диурезом, Г - взаимосвязь между концентрацией альбумина (UA) в моче и экспрессией микроРНК-21 в моче.
РЕЗУЛЬТАТЫ
Назначение эмпаглифлозина существенно не сказывалось на уровнях артериального давления (рис. 1А) или частоты сердечных сокращений (см. рис. 1Б).
При этом у крыс, получавших эмпаглифлозин, наблюдалось закономерное нарастание концентрации глюкозы в моче (см. рис. 1В) и ее суточной экскреции (см. рис. 1Г).
Концентрация альбумина в моче у лабораторных животных сравниваемых групп значимо не различалась (см. рис. 1Д). Между тем, суточная экскреция этого белка у крыс группы интервенции оказалась значимо большей (см. рис. 1Е).
Уровень экспрессии миРНК-21 в моче у крыс, получавших эмпаглифлозин, также был выше, чем у животных, не получавших препарат (см. рис. 1Ж).
Назначение эмпаглифлозина не приводило к существенным изменениям экскреции большинства изученных веществ, включая характеристики почечного выведения натрия (таблица). Интересно, однако, что и концентрация неорганического фосфора в моче и величина его суточной экскреции у крыс, получавших ингибитор SGLT-2, оказались значимо ниже, чем у животных группы сравнения (см. таблицу).
Концентрация глюкозы в моче прямо коррелировала с мочевой концентрацией альбумина (рис. 2А). Аналогичная связь отмечена между величинами суточной экскреции этих веществ (см. рис. 2Б). Выявлены также обратная корреляция между концентрацией альбумина в моче и диурезом (см. рис. 2В) и прямая связь первого параметра с уровнем мочевой экспрессии миРНК-21 (см. рис. 2Г).
ОБСУЖДЕНИЕ
В нашем исследовании у крыс, получавших эмпаглифлозин, наблюдалось закономерное нарастание концентрации глюкозы в моче (см. рис. 1В) и ее суточной экскреции (см. рис. 1Г). Такой эффект, очевидно, определяется механизмом действия данного препарата.
С другой стороны - при воздействии эмпаглиф- лозина мы не отмечали нарастания экскреции натрия (см. таблицу). Это может показаться несколько неожиданным. Переносчики SGLT-2 и SGLT-1 являются котранспортерами, участвующими в реабсорбции не только глюкозы, но и натрия (при стехиометрии 1:1; на одну молекулу глюкозы переносится 1 ион натрия). Поэтому подавление активности SGLT-2 за счет эмпаглифлозина должно снизить реабсорбцию натрия и, соответственно, увеличить его экскрецию. Такое, действительно, было показано в ряде экспериментальных [12] и клинических исследований [13]. Однако данный эффект отмечался только на ранних этапах применения эмпаглифлозина. С течением времени экскреция данного катиона при приеме и отсутствии приема ингибиторов SGLT-2 уравнивалась. В нашей работе экскреция натрия измерялась через 1 мес после начала терапии эмпаглифлозином, что, по-видимому, является достаточным сроком для нивелировки натрийуретического эффекта препарата. На наш взгляд, отмеченный выше феномен не выглядит чем-то удивительным. Объяснением всех этих данных может быть то, что почки (и организм в целом) стремятся не допустить неконтролируемых потерь натрия. Снижение реабсорбции данного катиона в одном месте (или за счет подавления одной транспортной системы, например, SGLT-2) приводит к реципрокному нарастанию его всасывания в других отделах почечных канальцев или за счет активации других транспортеров (в частности, NAPI-IIa - см. ниже).
Cуточная экскреция альбумина у крыс группы интервенции оказалась значимо больше, чем у животных, не получавших эмпаглифлозин (см. рис. 1Е). Эти данные, вообще говоря, противоречат результатам ряда клинических [14-17] и экспериментальных [18-21] исследований, в которых обычно наблюдали уменьшение альбуминурии. Антиальбуминурический эффект ингибиторов SGLT-2 при СД обычно связывают с их способностью уменьшать гломерулярную гиперфильтрацию, возникающую на ранних стадиях этого заболевания. Полагают, что при начальной гипергликемии возрастает фильтрационный заряд глюкозы (количество профильтровавшегося олигосахарида). В свою очередь, это активирует системы ее реабсорбции (SGLT-2 и SGLT-1), что дополнительно может приводить и к развитию гипертрофии проксимальных канальцев. Однако нарастание реабсорбции глюкозы, как уже указывалось выше, неизбежно ассоциируется и с ростом обратного всасывания натрия. Все это уменьшает доставку натрия, воды и, возможно, других веществ (хлора, калия) в нижележащие отделы нефрона, в том числе, к области плотного пятна (macula densa). В конечном итоге, это приводит к включению механизма канальце-клубочковой обратной связи и в данном случае преимущественной афферентной вазодилатации с последующим ростом гломерулярного кровотока, внутриклубочкового гидростатического давления и развитием гиперфильтрации («тубулярная» гипотеза развития гиперфильтрации при СД) [22,23]. Напротив, при применении ингибиторов SGLT-2 модифицируются патофизиологические процессы, согласующиеся с «тубулярной» гипотезой развития гиперфильтрации при СД. Эти препараты повышают поступление натрия к началу дистального извитого канальца, что вызывает усиление входа этого катиона в клетки плотного пятна с последующим усилением секреции АТФ и накоплением аденозина в интерстиции и экстрагломерулярных мезангиальных клетках, что в итоге обеспечивает констрикцию приносящей артериолы. Афферентная вазоконстрикция, в свою очередь, приводит к уменьшению интрагломерулярного давления, гиперфильтрации и повреждения почек [22, 23]. Изученные нами животные не страдали СД. Поэтому нет оснований ожидать у них и наличия каких-либо проявлений гломерулярной гиперфильтрации. В таком случае нефропротектронный эффект эмпаглифлозина, связанный с его возможным вмешательством во внутриклубочковую гемодинамику, едва ли возможен. С другой стороны - наши данные не исключают того, что данный ингибитор SGLT-2 может оказывать определенное неблагоприятное воздействие на почки, усиливая альбуминурию и, возможно, экспрессию микроРНК-21 (см. рис. 1Ж) - малой некодирующей регуляторной РНК, которая, по-видимому, является важным участником и свидетелем развития повреждений почек [24-27].
Причины, по которым ингибиторы SGLT-2 могут способствовать развитию альбуминурии у исследованных нами животных, не ясны. Мы склонны полагать, что альбуминурия в данном случае носит тубулярный характер и связана с изменениями химического состава содержимого проксимальных канальцев. Во всяком случае, у экспериментальных животных обнаружены значимые прямые связи между экскрецией глюкозы и альбумина (см. рис. 2А, Б).
У животных с СН, получавших эмпаглифлозин, отмечено снижение экскреции неорганического фосфора по сравнению с крысами, которым данный препарат не назначался (см. таблицу). Насколько нам известно, гипофосфатурический эффект ингибиторов SGLT-2 никем ранее не описывался. Причины этого явления остаются неясными. Однако необходимо иметь в виду следующее. Около 80% профильтровавшегося фосфата в условиях его обычного поступления с пищей реабсорбируется в начале извитой части проксимального канальца, главным образом, юкстамедуллярных нефронов [28, 29]. Иными словами, реабсорбция большей части фосфата происходит там же, где и основной массы глюкозы.
Всасывание фосфата опосредуется натрий- зависимыми котранспортерами для неорганического фосфата (Pi), локализованными в мембранах щеточной каймы.
Идентифицировано три представителя семейства Na+-зависимых котранспортеров типа II, кодирующихся семейством генов SLC34 [29]. SLC34A1 (NAPI-IIa) экспрессируется, главным образом, в почках и ответствен примерно за 7080% общей реабсорбции фосфата [30]. Другой представитель этого семейства - SLC34A3 (NA- PI-IIc) также выявляется почти исключительно в почках [31]. SLC34A2 (NAPI-IIb) в основном экспрессируется в тонком кишечнике, а также других органах: яичках, легких, печени и лактирующих молочных железах [32].
В почках также выявлены натрий-зависимые транспортеры фосфата, относящиеся к семейству SLC20. PIT-2 (SLC20A2) локализован в мембранах щеточной каймы проксимальных канальцев, тогда как точное место расположения PIT-1 в почках неизвестно [33].
PIT-2 широко распространен в большинстве тканей. Его точная роль в ренальной реабсорбции фосфата в настоящее время не раскрыта. Однако у мышей с отсутствием обоих транспортеров NaPi- IIa и NaPi-IIc реабсорбция фосфата редуцируется более чем на 90%. Это может указывать на то, что вклад PIT-2 (и других возможных транспортеров фосфата) минимален [34].
Так или иначе, основные транспортеры для фосфата (NAPI-IIa) и глюкозы (SGLT-2) являются котранспортерами, участвующими в реабсорбции не только фосфора или глюкозы, но и натрия. Подавление активности SGLT-2 за счет эмпаглифлозина первоначально снижает и реабсорбцию натрия. Однако, как мы уже отмечали выше, такое нарастание экскреции натрия носит транзиторный характер [12, 13]. Это может быть связано с компенсаторной активацией других транспортеров, перемещающих натрий, в частности, NAPI-IIa. Конкретные механизмы активации фосфат-натриевых котранспортеров в данной ситуации неизвестны.
Существуют исследования, выполненные в основном в 80-90-х годах прошлого века, результаты которых могут иметь косвенное отношение к последнему вопросу. В ряде работ было найдено, что у людей [35-37] или экспериментальных животных [38, 39] эугликемическая гиперинсули- немия ассоциируется с ограничением почечной экскреции фосфата. При этом, не исключено, что гиперинсулинемия подавляет секрецию паратгормона, за счет чего и достигается антифосфатурический эффект [36]. Следует, однако, иметь в виду, что снижение экскреции фосфора у людей, несмотря на уменьшение секреции паратгормона, в условиях гиперинсулинемии наблюдалось не всеми исследователями [40].
Инсулин, по-видимому, также может стимулировать 1а,25(ОН)^Э3 [41] - еще один фактор, способствующий усилению тубулярной реабсорбции фосфата [28]. Сведений о возможных ассоциациях между инсулином и FGF-23 в доступной литературе мы не обнаружили.
Не исключено, что инсулин способен и непосредственно стимулировать тубулярный транспорт как глюкозы [42], так и фосфата [43]. Возможно, эти эффекты сопрягаются через протеин- киназу Akt/PKB - один из ключевых ферментов в реализации действия инсулина на субцеллюляр- ном уровне [44]. Следует, правда, иметь в виду, что активация реабсорбции глюкозы через Akt2/ ΡΚΒβ показана для SGLT1 [42]. О таком эффекте в отношении SGLT2 неизвестно.
Так или иначе, имеющиеся данные свидетельствуют о возможной роли инсулина в сопряжении проксимальной реабсорбции глюкозы и фосфата. К сожалению, на основе этих сведений трудно объяснить антифосфатурический эффект эмпаф- лиглозина, поскольку, по крайней мере, в одной работе зафиксировано снижение концентрации инсулина под влиянием данного препарата у предиабетических крыс линии SHRcp [12].
ЗАКЛЮЧЕНИЕ
Результаты проведенного исследования свидетельствуют о том, что назначение эмпаглифлозина в течение 1 мес недиабетическим крысам с экспериментальной сердечной недостаточностью приводит к нарастанию глюкозурии, альбуминурии и экспрессии микроРНК-21 в моче. Выведение неорганического фосфора под влиянием данного препарата уменьшалось. Полученные данные позволяют полагать, что описанные в ряде исследований нефропротективные эффекты ингибиторов SGLT-2, скорее всего, являются непрямыми и, преимущественно, определяются способностью данных препаратов устранять гипергликемию и гломерулярную гиперфильтрацию при сахарном диабете. В то же время, нельзя исключить, что ингибиторы SGLT-2 могут оказывать определенное негативное непосредственное воздействие на состояние почек. Возможность таких эффектов, по-видимому, должна учитываться в клинической практике. Тем не менее, «почечные» последствия применения ингибиторов SGLT-2 и механизмы таких эффектов требуют дальнейшего изучения.
Список литературы
1. Aziz Z, Absetz P, Oldroyd J et al. A systematic review of real-world diabetes prevention programs: learnings from the last 15 years. Implement Sci 2015;10, article 172 doi: 10.1186/ s13012-015-0354-6
2. Смирнов АВ, Добронравов ВА, Кисина АА и др. Клинические рекомендации по диагностике и лечению диабетической нефропатии. Нефрология 2015;19(1): 67-77 [Smirnov AV, Dobronravov VA, Kisina AA i dr. Klinicheskie rekomendacii po diagnostike i lecheniyu diabeticheskoj nefropatii. Nefrologiya 2015;19(1): 67-77]
3. Mima A. Diabetic nephropathy: protective factors and a new therapeutic paradigm. J Diabetes Complications 2013;27(5):526–530
4. Hoshino J, Mise K, Ueno T et al. A pathological scoring system to predict renal outcome in diabetic nephropathy. Am J Nephrol 2015;41(4-5):337–344
5. Patschan D, Muller GA. Acute kidney Injury in diabetes mellitus. Int J Nephrol 2016; 2016:6232909
6. Tang SC, Chan GC, Lai KN. Recent advances in managing and understanding diabetic nephropathy. F1000Res. 2016 May 31;5. pii: F1000 Faculty Rev-1044. doi: 10.12688/f1000research. 7693.1
7. Vallianou NG, Geladari E, Kazazis CE. SGLT-2 inhibitors: Their pleiotropic properties. Diabetes Metab Syndr 2016; pii: S1871-4021(16)30226-0. doi: 10.1016/j.dsx.2016.12.003. [Epub ahead of print]
8. Vallon V, Thomson SC. Targeting renal glucose reabsorption to treat hyperglycaemia: the pleiotropic effects of SGLT2 inhibition. Diabetologia 2017; 60(2):215-225
9. Бабенко АЮ, Байрашева ВК. Диабетическая нефропатия. Зависит ли ренопротекция от выбора сахароснижающей терапии. Мед совет 2015; (7): 32-43 [Babenko AYU, Bajrasheva VK. Diabeticheskaya nefropatiya. Zavisit li renoprotekciya ot vybora saharosnizhayushchej terapii. Medicinskij sovet 2015; (7): 32-43]
10. Kalra S, Singh V, Nagrale D. Sodium-Glucose Cotransporter2 Inhibition and the Glomerulus: A Review. Adv Ther 2016; 33(9):1502-1518
11. Карпов АА, Ивкин ДЮ, Драчева АВ и др. Моделирование постинфарктной сердечной недостаточности путем окклюзии левой коронарной артерии у крыс: техника и методы морфофункциональной оценки. Биомедицина 2014; (3):32-48 [Karpov AA, Ivkin DYU, Dracheva AV i dr. Modelirovanie postinfarktnoj serdechnoj nedostatochnosti putem okklyuzii levoj koronarnoj arterii u krys: tekhnika i metody morfofunkcional’noj ocenki. Biomedicina 2014; (3):32-48]
12. Kusaka H, Koibuchi N, Hasegawa Y et al. Empagliflozin lessened cardiac injury and reduced visceral adipocyte hypertrophy in prediabetic rats with metabolic syndrome. Cardiovasc Diabetol 2016;15(1):157-171
13. Heise T, Jordan J, Wanner C, Heer M et al. Pharmacodynamic effects of single and multiple doses of empagliflozin in patients with type 2 diabetes. Clin Ther 2016; Sep 28. pii: S01492918(16)30716-0. doi: 10.1016/j.clinthera.2016.09.001
14. Neal B, Perkovic V, de Zeeuw D et al. Efficacy and safety of canagliflozin, an inhibitor of sodium-glucose cotransporter 2, when used in conjunction with insulin therapy in patients with type 2 diabetes. Diabetes Care 2015;38(3):403–411
15. Kohan DE, Fioretto P, Tang W, List JF. Long-term study of patients with type 2 diabetes and moderate renal impairment shows that dapagliflozin reduces weight and blood pressure but does not improve glycemic control. Kidney Int 2014; 85(4): 962–971
16. Barnett AH, Mithal A, Manassie J et al. EMPA-REG Renal Trial investigators Efficacy and safety of empagliflozin added to existing antidiabetes treatment in patients with type 2 diabetes and chronic kidney disease: a randomised, double-blind, placebocontrolled trial. Lancet Diabetes Endocrinol 2014; 2(5): 369–384
17. Yale JF, Bakris G, Cariou B et al. Efficacy and safety of canagliflozin in subjects with type 2 diabetes and chronic kidney disease. Diabetes Obes Metab 2013; 15(5): 463–473
18. De Nicola L, Gabbai FB, Liberti ME et al. Sodium/glucose cotransporter 2 inhibitors and prevention of diabetic nephropathy: targeting the renal tubule in diabetes. Am J Kidney Dis 2014; 64(1): 16–24
19. Vallon V, Richter K, Blantz RC et al. Glomerular hyperfiltration in experimental diabetes mellitus potential role of tubular reabsorption. J Am Soc Nephrol 1999; 10(12): 2569–2576
20. Terami N, Ogawa D, Tachibana H et al. Long-term treatment with the sodium glucose cotransporter 2 inhibitor, dapagliflozin, ameliorates glucose homeostasis and diabetic nephropathy in db/db mice. PLoS One 2014; 9(6): e100777. doi: 10.1371/journal.pone.0100777
21. Gembardt F, Bartaun C, Jarzebska N et al. The SGLT2 inhibitor empagliflozin ameliorates early features of diabetic nephropathy in BTBR ob/ob type 2 diabetic mice with and without hypertension. Am J Physiol Renal Physiol 2014; 307(3): F317–F325
22. Cherney DZ, Perkins BA, Soleymanlou N et al. The renal hemodynamic effect of SGLT2 inhibition in patients with type 1 diabetes. Circulation 2013:CIRCULATIONAHA. 113.005081
23. Takenaka T, Inoue T, Watanabe Y. How the kidney hyperfiltrates in diabetes: From molecules to hemodynamics. World J Diabetes 2015; 6(4): 576-582
24. Liu X, Hong Q, Wang Z et al. Transforming growth factorβ-sphingosine kinase 1/S1P signaling upregulates microRNA-21 to promote fibrosis in renal tubular epithelial cells. Exp Biol Med (Maywood) 2016; 241(3): 265-272
25. Yang Y, Xiao L, Li J et al. Urine miRNAs: potential biomarkers for monitoring progression of early stages of diabetic nephropathy. Med Hypotheses 2013; 81(2):274-278
26. Смирнов АВ, Кучер АГ, Добронравов ВА и др. Диетарный соевый протеин замедляет развитие интерстициального почечного фиброза у крыс с односторонней обструкцией мочечточника: введение в нутритивную эпигеномику. Нефрология 2012; 16(4): 75-83 [Smirnov AV, Kucher AG, Dobronravov VA i dr. Dietarnyj soevyj protein zamedlyaet razvitie intersticial‘nogo pochechnogo fibroza u krys s odnostoronnej obstrukciej mochechtochnika: vvedenie v nutritivnuyu ehpigenomiku. Nefrologiya 2012; 16(4): 75-83]
27. Смирнов АВ, Карунная АВ, Зарайский МИ и др. Экспрессия микроРНК-21 в моче у пациентов с нефропатиями. Нефрология 2014; 18 (6): 59-63 [Smirnov AV, Karunnaya AV, Zarajskij MI i dr. Ehkspressiya mikroRNK-21 v moche u pacientov s nefropatiyami. Nefrologiya 2014; 18 (6): 59-63]
28. Wagner CA, Hernando N, Forster IC et al. The SLC34 family of sodium-dependent phosphate transporters. Pflugers Arch 2014; 466:139-153
29. Wagner CA, Rubio-Aliaga I, Biber J, Hernando N. Genetic diseases of renal phosphate handling. Nephrol Dial Transplant 2014; 29 (Suppl 4): iv45-54
30. Beck L, Karaplis AC, Amizuka N et al. Targeted inactivation of Npt2 in mice leads to severe renal phosphate wasting, hypercalciuria, and skeletal abnormalities. Proc Natl Acad Sci USA 1998;95: 5372-5377
31. Segawa H, Kaneko I, Takahashi A et al. Growth-related renal type II Na/Pi cotransporter. J Biol Chem 2002;277:19665-19672
32. Hilfiker H, Hattenhauer O, Traebert M et al. Characterization of a murine type II sodium-phosphate cotransporter expressed in mammalian small intestine. Proc Natl Acad Sci USA 1998; 95:14564-14569
33. Villa-Bellosta R, Ravera S, Sorribas V et al. The Na+-Pi cotransporter PiT-2 (SLC20A2) is expressed in the apical membrane of rat renal proximal tubules and regulated by dietary Pi. Am J Physiol Renal Physiol 2009; 296: F691-F699
34. Segawa H, Onitsuka A, Furutani J et al. Npt2a and Npt2c in mice play distinct and synergistic roles in inorganic phosphate metabolism and skeletal development. Am J Physiol Renal Physiol 2009; 297: F671-F678
35. Raskin P, Pak CY. The effect of chronic insulin therapy on phosphate metabolism in diabetes mellitus. Diabetologia 1981; 21(1): 50-53
36. Shimamoto K, Higashiura K, Nakagawa M et al. Effects of hyperinsulinemia under the euglycemic condition on calcium and phosphate metabolism in non-obese normotensive subjects. Tohoku J Exp Med 1995;177(4):271-278
37. Ishimura E, Nishizawa Y, Emoto M et al. Effect of insulin on urinary phosphate excretion in type II diabetes mellitus with or without renal insufficiency. Metabolism 1996; 45(6):782-786
38. Guntupalli J, Rogers A, Bourke E. Effect of insulin on renal phosphorus handling in the rat: interaction with PTH and nicotinamide. Am J Physiol 1985; 249(4 Pt 2):F610-618
39. Guntupalli J, Allon M, Bourke E. Effects of physiologic hyperinsulinemia on renal phosphate handling in the rat: a role for calcium. Miner Electrolyte Metab 1989;15(6):338-345
40. Nowicki M, Kokot F, Surdacki A. The influence of hyperinsulinaemia on calcium-phosphate metabolism in renal failure. Nephrol Dial Transplant 1998;13(10):2566-2571
41. Ikeda K, Matsumoto T, Morita K et al. The role of insulin in the stimulation of renal 1,25-dihydroxyvitamin D synthesis by parathyroid hormone in rats. Endocrinology 1987;121(5):1721-1726
42. Kempe DS, Siraskar G, Frohlich H et al. Regulation of renal tubular glucose reabsorption by Akt2/PKBβ. Am J Physiol Renal Physiol 2010;298(5):F1113-F1117
43. Kempe DS, Ackermann TF, Boini KM et al. Akt2/PKBbetasensitive regulation of renal phosphate transport. Acta Physiol (Oxf) 2010;200(1):75-85 44. Lizcano JM, Alessi DR. The insulin signalling pathway. Curr Biol 2002;12(7):R236-R238
Об авторах
А. Н. КуликовРоссия
О. Н. Береснева
Россия
Береснева Ольга Николаевна, кандидат биологических наук, старший научый сотрудник.
Научно-исследовательский институт нефрологии, лаборатория клинической физиологии почек
197022, Россия, Санкт-Петербург, ул. Л. Толстого, д. 17, корп. 54.
М. М. Парастаева
Россия
Парастаева Марина Магрезовна, кандидат биологических наук, старший научый сотрудник.
Научно-исследовательский институт нефрологии, лаборатория клинической физиологии почек
197022, Россия, Санкт-Петербург, ул. Л. Толстого, д. 17, корп. 54.
С. В. Оковитый
Россия
Г. Т. Иванова
Россия
Иванова Галина Тажимовна, кандидат биологических наук, старший научный сотрудник.
Лаборатория экспериментальной и клинической кардиологии
199034, Россия, Санкт-Петербург, наб. Макарова, д. 6
Д. Ю. Ивкин
Россия
Ивкин Дмитрий Юрьевич, кандидат биологических наук
Центр экспериментальной фармакологии, директор.
197376, Россия, Санкт-Петербург, ул. проф. Попова, д. 14, лит. А.
А. С. Ивкина
Россия
Ивкина Арина Сергеевна
Центр экспериментальной фармакологии, лаборатория фармакологических исследований, научный сотрудник.
197376, Россия, Санкт-Петербург, ул. проф. Попова, д. 14, лит. А.
Е. Н. Левыкина
Россия
Левыкина Елена Николаевна, кандидат химических наук
Научноисследовательский институт нефрологии, лаборатория биохимического гомеостаза, научный сотрудник.
197022, Россия, Санкт-Петербург, ул. Л.Толстого, д. 17, корп. 54
М. И. Зарайский
Россия
Профессор Зарайский Михаил Игоревич.
Кафедра клинической лабораторной диагностики с курсом молекулярной медицины.
197022, Россия, Санкт-Петербург, ул. Л.Толстого, д. 17, корп. 54.
А. А. Карпов
Россия
Карпов Андрей Александрович - младший научный сотрудник
194156, Россия, Санкт-Петербург, ул. Пархоменко, д. 15.
А. Г. Кучер
Россия
Профессор Кучер Анатолий Григорьевич
Научно-исследовательский институт нефрологии, заместитель директора.
197022, Россия, Санкт-Петербург, ул. Л. Толстого, д. 17
И. М. Зубина
Россия
Зубина Ирина Михайловна, кандидат биологических наук
Научно-исследовательский институт нефрологии, лаборатория биохимического гомеостаза, старший научный сотрудник.
197022, Россия, Санкт-Петербург, ул. Л.Толстого, д. 17, корп. 54.
О. В. Галкина
Россия
Галкина Ольга Владимировна, кандидат биологических наук
Научно-исследовательский институт нефрологии, лаборатория биохимического гомеостаза, зав. лабораторией
197022, Россия, Санкт-Петербург, ул. Л.Толстого, д. 17, корп. 54.
И. Г. Каюков
Россия
Профессор Каюков Иван Глебович
Научно-исследовательский институт нефрологии, лаборатория клинической физиологии почек, заведующий
197022, Россия, Санкт-Петербург, ул. Л.Толстого, д. 17, корп. 54.
Рецензия
Для цитирования:
Куликов А.Н., Береснева О.Н., Парастаева М.М., Оковитый С.В., Иванова Г.Т., Ивкин Д.Ю., Ивкина А.С., Левыкина Е.Н., Зарайский М.И., Карпов А.А., Кучер А.Г., Зубина И.М., Галкина О.В., Каюков И.Г. ВЛИЯНИЕ ЭМПАГЛИФЛОЗИНА НА СОСТОЯНИЕ ПОЧЕК У НОРМОГЛИКЕМИЧЕСКИХ КРЫС С СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТЬЮ. Нефрология. 2017;21(2):83-92. https://doi.org/10.24884/1561-6274-2017-21-2-83-92
For citation:
Kulikov A.N., Beresneva O.N., Parastaeva M.M., Okovityi S.V., Ivanova G.T., Ivkin D.Yu., Ivkina A.S., Levykina E.N., Zaraiskii M.I., Karpov A.A., Kucher A.G., Zubina I.M., Galkina O.V., Kaiukov I.G. INFLUENCE OF EMPAGLIFLOZIN ON THE KIDNEYS IN NORMOGLYCEMIC RATS WITH HEART FAILURE. Nephrology (Saint-Petersburg). 2017;21(2):83-92. (In Russ.) https://doi.org/10.24884/1561-6274-2017-21-2-83-92








































