Перейти к:
СОСТОЯНИЕ ЛИПИДНОГО СПЕКТРА КРОВИ У ДЕТЕЙ С ХРОНИЧЕСКИМ ПИЕЛОНЕФРИТОМ
https://doi.org/10.24884/1561-6274-2017-3-75-80
Аннотация
ЦЕЛЬ: изучение липидного спектра крови у детей с вторичным пиелонефритом с различным его течением.
ПАЦИЕНТЫ И МЕТОДЫ: обследованы 80 детей с вторичным хроническим пиелонефритом. Липидный спектр определяли на аппарате AU 400 OLYMPUS (BECKMAN COULTER Inc., США). Для выявления очагов нефросклероза проводили статическую нефросцинтиграфию. Статистический анализ полученных данных осуществляли с помощью пакета прикладных статистическиъ программ «Statistica 6.1».
РЕЗУЛЬТАТЫ: у 60% детей уровень общего холестерина (ОХС) оставался в диапазоне низкого сердечно-сосудистого риска, 25% входили в группу умеренного риска (ХС 4,4-5,15 ммоль/л) и 15% имели высокий сердечно-сосудистый риск (ХС более 5,18 ммоль/л). Мы не выявили достоверных различий в липидном спектре у детей с редкими и частыми рецидивами заболевания, а также у детей с дисметаболическим и обструктивным пиелонефритом.
ЗАКЛЮЧЕНИЕ: больные, имеющих признаки нефросклероза, отличались более высоким уровнем ОХС.
Для цитирования:
Нестеренко О.В., Попков В.М., Бородулин В.Б., Горемыкин В.И., Комарова Е.В., Бобылева Е.В. СОСТОЯНИЕ ЛИПИДНОГО СПЕКТРА КРОВИ У ДЕТЕЙ С ХРОНИЧЕСКИМ ПИЕЛОНЕФРИТОМ. Нефрология. 2017;21(3):75-80. https://doi.org/10.24884/1561-6274-2017-3-75-80
For citation:
Nesterenko O.V., Popkov V.M., Borodulin V.B., Goremykin V.I., Komarova E.V., Bobyleva E.V. LIPID STATUS IN CHILDREN WITH CHRONIC PYELONEPHRITIS. Nephrology (Saint-Petersburg). 2017;21(3):75-80. (In Russ.) https://doi.org/10.24884/1561-6274-2017-3-75-80
ВВЕДЕНИЕ
В последние годы отмечается отчетливая тенденция к росту вторичного пиелонефрита у детей, в том числе его маломанифестных и латентных форм [1]. У пациентов с хроническим пиелонефритом сохраняется высокий риск формирования терминальной почечной недостаточности и снижением качества жизни уже в детском возрасте. Ряд авторов считают, что по данным динамического наблюдения, через 7 лет после дебюта хронического пиелонефрита у 14% детей удается добиться полного выздоровления [1, 2]. По данным литературы начальные признаки дисфункции почек регистрируют уже в первые 5 лет заболевания [2, 3]. Расширение знаний о факторах риска развития тубулоинтерстициального фиброза, патогенезе патологических изменений ренальной паренхимы и особенностях клинико-параклинических, структурных, гемодинамических изменений в зависимости от этиологического фактора, требуют возможности проведения адекватных превентивных мероприятий, адекватного патогенетического лечения и коррекции осложнений.
Формирование очагов нефросклероза возникает в зонах образования мононуклеарного инфильтрата [2]. Этому способствует накопление в паренхиме макрофагов особого класса, секретирующих фибробластстимулирущие факторы (ФНОа, MCP;1, TGFβ и др.). Нередко процесс протексет на фоне сниженной клеточной биоэнергетики [3,4]. В качестве еще одного механизма стимуляции фиброзирующих факторов роста рассматриваются гипоксия и ишемия почечной ткани (унифицированная «гипоксическая» гипотеза) [5]. Однако классические факторы риска развития фиброзной ткани не могут полностью объяснить различия в скорости их формирования и частоте рецидивов у различных больных. Вследствие этого интенсивно продолжается поиск других причин развития нефросклероза при хроническом пиелонефрите [6].
Наряду с иммунными факторами прогрессирования нефропатий в последние годы широко обсуждается роль неиммунных механизмов. A. Bohle и соавт. (1992) считают, что при хронической почечной недостаточности вступление последних в действие определяет, в первую очередь, прогрессирование почечной недостаточности, независимо от первичных иммунных механизмов. Следует заметить, что на связь между жировым обменом и поражением почек впервые было указано Р. Вирховым в 1860 г., когда он сообщил о «жировом метаморфозе» почек и одновременно высказал мысль о неопределенности его происхождения (паренхиматозном или плазменном). Становится все более очевидным, что почка в результате нарушения своих разнообразных функций может активно вмешиваться в процессы формирования и модификации предикторов сосудистого повреждения - воспаления, оксидатив- ного стресса, анемии, альбуминурии, фосфорнокальциевого метаболизма [7, 8].
Частым спутником заболеваний почек является гиперлипидемия. К сожалению, практически всегда наличие нарушений липидного обмена у почечного больного ухудшает прогноз в связи с тесными кардиоренальными взаимосвязями [9-11].
В ряде клинических исследований показано, что гиперлипидемия ускоряет прогрессирование дисфункции почек независимо от природы нефропатии. Причем процесс коррелирует с уровнем общего холестерина (ОХС), триглицеридов (ТГ), липопротеидов очень низкой плотности (ЛПОНП), апоВ и липопротеидов высокой плотности (ЛПВП) сыворотки крови [12, 13]. Для нефротической дислипидемии характерно, прежде всего, значительное повышение уровня ОХС за счет ЛПНП, ЛПОНП при нормальном или несколько сниженном содержании липопротеидов высокой плотности (ЛПВП). В дальнейшем повышается и уровень ТГ. Наблюдаются изменения субфракций ЛПВП, увеличивается уровень апоА1, снижается соотношение ОХС/апоА1 во всех субфракциях ЛПВП. По мере прогрессирования нефротического синдрома повышаются уровни фосфолипидов [5, 14, 15].
Значимость нарушений липидного спектра в патогенезе и прогрессировании хронической болезни почек изучены в первую очередь при гломерулонефрите. Однако, исследования, посвященные липидному обмену при вторичных пиелонефритах у детей, малочисленны.
Целью нашей работы явилось изучение липидного спектра крови у детей с вторичным пиелонефритом в зависимости от частоты обострений заболевания.
ПАЦИЕНТЫ И МЕТОДЫ
В исследовании приняли участие 80 детей (59 девочек и 21 мальчик) с вторичным хроническим пиелонефритом, находящихся на стационарном лечении и обследовании в клинике факультетской педиатрии Клинической больницы им. С.Р. Миротворцева г. Саратова. Средний возраст пациентов составил 10,4±0,5 лет (от 5 до 16). Исследование липидного спектра крови проводилось вне обострения пиелонефрита. Группу контроля составили 24 ребенка с отсутствием патологических изменений в анализах крови и мочи, структурных изменений при ультразвуковом исследовании, отсутствием изменений в анализах мочи в анамнезе.
Всем детям проводилось обследование, включающее в себя общеклинические анализы крови и мочи, бактериологическое исследование мочи, накопительные пробы, проводилось ультразвуковое и рентгеноурологическое обследование (экскреторная урография, микционная цистоуретерография по показаниям), допплерографическое исследование почек. Уровень артериального давления контролировали с помощью ежедневного измерения и СМАД. Оценку производили в соответствии с центильными таблицами САД и ДАД у детей подростков[16]. Липидный спектр крови (ОХС, ЛПВП, ЛПНП, ТГЦ) определяли на аппарате «AU 400 OLYMPUS» («BECKMANCOULTERInc.») в условиях клиникодиагностической лаборатории Клинической больницы №3 им. С.Р. Миротворцева. Для выявления очагов нефросклероза выполняли статическую нефросцинтиграфию с Тс-99м на двухдетекторной сцинтиграфической гамма-камере «PhilipsBrightViewSpect» через 1 час после в/в введения РФП, в положении лежа, в статическом режиме, в двух проекциях. Обработка полученных сцинтиграмм была выполнена при помощи пакета прикладных программ «JemStream» («Philips»). Уровень ОХС менее 4,4 ммоль/л расценивали как оптимальный (низкий сердечно-сосудистый риск), 4,4-5,15 ммоль/л - как умеренный сердечно-сосудистый риск и более 5,16 - как гиперхолестеринемию (высокий сердечнососудистый риск). Уровень ТГ менее 1,2 ммоль/л, ЛПНП - менее 3 ммоль/л, ЛПВП более 1,2ммоль/л оценивали как оптимальный.
Статистическая анализ полученных данных осуществляли с помощью пакета прикладных статистических программ «Statistica 6.1» (StatSoft Inc», США). Данные представлены как среднеарифметическое (Х) ± стандартное отклонение (SD). Проверяли гипотезы о нормальности распределения показателей при помощи критерия Шапиро-Уилка. При нормальном распределении показателя для выявления междугрупповых различий использовали t-критерий Стьюдента, при асимметричном распределении - U-критерий Манна-Уитни. Анализ корреляционных взаимоотношений осуществляли с помощью коэффициента корреляции Спирмена. Нулевую статистическую гипотезу об отсутствии различий и связей отвергали при p<0,05.
РЕЗУЛЬТАТЫ
Уровень креатинина крови у всех детей не отличался от референсных значений. Среднее значение скорости клубочковой фильтрации, рассчитанной по формуле в целом по группе составило 100,3±6,67 мл/мин/1,73 м2.
Данные о полученных показателях липидного спектра представлены в табл. 1 и 2. Средние значения ОХС составили 4,15±0,73 ммоль/л. У 48 детей (60%) уровень ОХС оставался в диапазоне оптимального уровня, 20 пациентов (25%) входили в группу умеренного середечно-сосудистого риска (ХС 4,4-5,15 ммоль/л) и 12 (15%) - имели ОХС более 5,18 ммоль/л) (рис. 1). Средний уровень ТГ составил 0,95±0,47 ммоль/л. При этом у 20 детей (25%) также отмечено повышение его уровня выше оптимального.
Средний уровень ЛПВП составил 1,21±0,6 ммоль/л. У 25% отмечено снижение ЛПВП менее желательного (1,0 ммоль/л.) Уровень ЛПНП составил 2,52±0,6 ммоль/л, превышение оптимального уровня отмечалось у 12% больных.
В зависимости от частоты рецидивирования пиелонефрита мы разделили детей на 2 группы (табл. 1) - с рецидивами 1 раз в год и более (частые) и менее 1 раза в год (редкие). Не обнаружено достоверных различий по уровню ОХС в этих группах. При этом в группе детей с частыми рецидивами уровень ОХС превышал оптимальный у 13 (38%), из них 24% имели умеренно повышенный уровень (4,4-5,15), 14% - высокий (более 5,16). Среди детей с редко рецидивирующим пиелонефритом у 17 (37,8%) выявлен умеренно повышенный уровень ОХС. Уровни ТГЦ, ЛПВП И ЛПНП не имели достоверных различий в этих группах.
Таблица 1
Показатели липидограммы у детей в зависимости от частоты рецидивов хронического пиелонефрита в сопоставлении с контрольной группой
Показатель | Группа сравнения | Редкие рецидивы | Частые рецидивы | ||
|---|---|---|---|---|---|
(здоровые, n=24) | 5-10 лет (n=24) | 11-15 лет (n=21) | 5-10 лет (n=17) | 11-15 лет (n=18) | |
ОХС, ммоль/л | 3,49±0,29 | 4,49±1,05 | 3,84±0,81 | 4,25±0,81 | 4,21±0,76 |
ТГЦ, ммоль/л | 0,85±0,34 | 0,88±0,47 | 1,15±0,45 | 0,83±0,52 | 0,99±0,4 |
ЛПВП, ммоль/л | 1,24±0,25 | 1,19±0,33 | 1,13±0,25 | 1,33±0,32 | 1,25±0,3 |
ЛПНП, ммоль/л | 2,36±0,5 | 2,58±0,58 | 2,47±0,91 | 2,35±0,5 | 2,33±0,57 |
Примечание: р> 0,05.
Таблица 2
Показатели липидограммы детей с различным этиопатогенезом пиелонефрита в сравнении с контрольной группой
Показатель | Группа сравнения | Обструктивный | Дисметаболический | ||
|---|---|---|---|---|---|
| (здоровые, n=24) | 5-10 лет (n=25) | 11-15 лет (n=22) | 5-10 лет (n=16) | 11-15 лет (n=17) |
ОХС, ммоль/л | 3,49±0,29 | 4,36±0,67 | 4,04±0,74 | 4,18±0,75 | 3,83±0,96 |
ТГЦ, ммоль/л | 0,85±0,34 | 0,92±0,51 | 1,17±0,48 | 0,75±0,43 | 0,93±0,27 |
ЛПВП, ммоль/л | 1,24±0,25 | 1,23±0,27 | 1,16±0,3 | 1,25±0,41 | 1,18±0,2 |
ЛПНП, ммоль/л | 2,36±0,5 | 2,46±0,62 | 2,59±0,75 | 2,57±0,46 | 2,03±0,82 |
Примечание: р> 0,05.
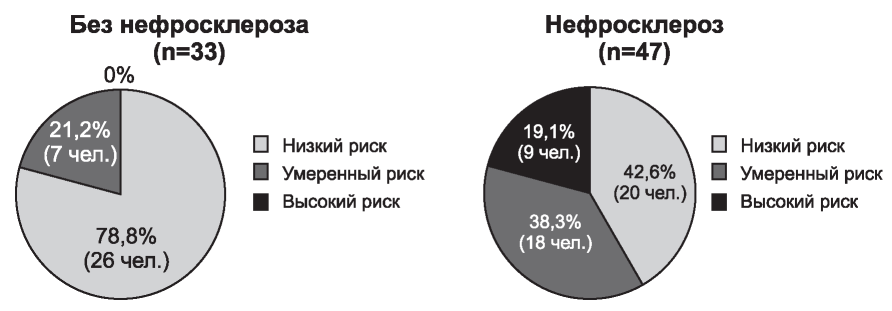
Рисунок. Сердечно-сосудистый риск с учетом уровня ОХС у детей с хроническим пиелонефритом в зависимости от наличия нефросклероза.
В зависимости от этиопатогенеза дети были разделены на группы с вторичным обструктив- ным и вторичным дисметаболическим пиелонефритом (табл. 2.) В этих группах также не было выявлено статистически значимых различий.
Таблица 3
Показатели липидограммы у детей с очагами нефросклероза
Группа сравнения | Без нефросклероза | С очагами нефросклероза | |||
|---|---|---|---|---|---|
(здоровые, n=24) | 5-10 лет (n=18) | 11-15 лет (n=15) | 5-10 лет (n=23) | 11-15 лет (n=24) | |
ОХС, ммоль/л | 3,49±0,29*, *** | 3,87±0,52** | 3,67±0,45 | 4,82±0,49*, ** | 4,18±0,92*, *** |
ТГЦ, ммоль/л | 0,85±0,34 | 0,83±0,49 | 1,13±0,39 | 0,91±0,49 | 1,06±0,49 |
ЛПВП, ммоль/л | 1,24±0,25 | 1,14±0,31 | 1,08±0,27 | 1,39±0,31 | 1,21±0,2 |
ЛПНП, ммоль/л | 2,36±0,5 | 2,35±0,29 | 2,47±0,93 | 2,72±0,77 | 2,3±0,67 |
Примечание. * - группа сравнения (здоровые) и дети 5-10 лет с очагами нефросклероза, p< 0,001; ** - группа дети 5-10 лет без нефросклероза и группа дети 5-10 лет с очагами нефросклероза, р=0,000148; *** - группа сравнения (здоровые) и дети 11-15 лет с очагами нефросклероза, р=0,002.
Изучен липидный спектр у 33 детей, которые имели анамнез хронического пиелонефрита с рецидивами, однако на сцинтиграммах у них не выявлено признаков нефросклероза. ОХС у них составил 3,56±0,54 ммоль/л, умеренно повышенный уровень отмечен у 20,8%. Уровень ТГЦ - 0,88±0,4ммоль/л, повышение более оптимального - у 22% больных, значения ЛПВП составили 1,12±0,28 ммоль/л, снижение отмечено у 35% больных, значения ЛПНП - 2,46±0,64 ммоль/л. У 47 больных, имеющих признаки склерозирования почечной паренхимы, ОХС был достоверно выше - 4,56±0,57 ммоль/л, повышение уровня отмечено у 28 (59,6%), при этом средний риск у 18 (38,3%) и гиперхолестеринемия у 10 (21,3%). Уровень ТГЦ также оказался более высоким, однако, разница не имела статистической достоверности - 0,96±0,54 ммоль/л, повышение отмечено у 10 (21,3%). Уровень ЛПВП составил 1,30±0,32 ммоль/л, снижение выявлено у 17,0% (8 человек). Также мы разделили детей в зависимости от длительности заболевания (табл.3). В первую группу вошли дети с анамнезом болезни 2-8 лет (возраст этих детей составил 5-10 лет), во вторую - с историей заболевания 9-13 лет (возраст детей 11-15 лет).
У детей с анамнезом болезни более 9 лет очаги нефросклероза встречались чаще (в 54,5% случаев), чем среди детей с длительностью болезни 8 лет и меньше (в 33,3% случаев). Среди детей с анамнезом заболевания менее 8 лет, имеющих очаги склерозирования почечной ткани, средние значения ОХС оказались достоверно выше, чем у детей без очагов нефросклероза (p<0,05). Уровень ОХС детей без очагов нефросклероза не отличался от такового у здоровых детей во всех возрастных группах. При этом ОХС был достоверно выше среди детей с очагами нефросклероза по сравнению с контрольной группой. Можно предположить, что нарушение липидного спектра, в частности, повышение уровня ОХС, способствует более быстрому возникновению нефросклероза на ранних сроках развития заболевания, в то время как при более длительном течении эти факторы не будут иметь такого значения.
Кроме того, мы выявили сильную прямую корреляционную взаимосвязь между уровнем ОХС (р=0,80) и наличием нефросклероза у детей с пиелонефритом вне зависимости от длительности течения заболевания.
ОБСУЖДЕНИЕ
Практическим врачам хорошо известны случаи, когда, несмотря на частые рецидивы пиелонефрита, нефросклероз длительно не формируется. В то же время существует когорта детей, которые не имели частых рецидивов или значимой обструкции мочевыводящих путей или рефлюкса, однако, у них сформировались очаги склерозирования [17]. Считается, что адекватная антибиотикотерапия уменьшает риск формирования очагов нефросклероза [18]. Тем не менее, в двух недавних исследованиях было показано, что раннее лечение (не позднее суток от начала лихорадки) острого пиелонефрита у детей не оказывает существенного влияния на частоту последующего возникновения очагов нефросклероза, по сравнению с детьми, получивших лечение в более поздние сроки [19].
Прогрессирование всех заболеваний почек характеризует одна общая черта - клеточная пролиферация с последующим накоплением внеклеточного матрикса и сморщиванием ткани. Исследования последних лет указывают на возможность влияния на процессы фиброгенеза ряда дополнительных факторов (гуморальных и клеточных). В зависимости от степени и объема поражения процесс заживления может идти по двум направлениям: регенерация и фиброплазия. Основным молекулярным компонентом фиброза является коллаген, который присутствует не только в коллагеновых волокнах и базальной мембране, но и в аморфном веществе соединительной ткани [4]. На первых этапах формирования склеротических очагов при пиелонефрите изменения происходят в интерстициальной ткани почек. Однако, в дальнейшем по мере прогрессирования заболевания, происходит вовлечение клубочков в патологический процесс. В механизме формирования фиброзно-склеротических участков принимают участие многие патогенетические факторы. Одним из таких факторов может являться гипер - и дислипидемия [20].
Патогенетическое значение гиперлипидемии определяется двумя процессами - отложением липидов в сосудистой стенке с развитием атеросклероза и накоплением их в мезангии и почечном тубулоинтерстиции. Поражение мезангиоцитов носит сходный характер с поражением миоцитов сосудов при атеросклерозе. Это неудивительно с учетом морфофункционального подобия миоцитов и контрактильных (гладкомышечных) мезангиоцитов. Повышенное содержание липидов в первичной моче приводит к захвату их эпителием канальцев и депозиции внутри клеток. Отложение липидов в мезангиоцитах и канальцевом эпителии придает клеткам характерный «пенистый» вид, приводит к дистрофии и атрофии с накоплением липидного материала в межклеточном пространстве. Фильтрующиеся в клубочках липопротеины, осаждаясь в канальцах почек, индуцируют тубулоинтерстициальные процессы, склероз интерстиция. При избыточном накоплении крупных липидных включений мезангиальные клетки, макрофаги и эпителиальные клетки канальцев приобретают вид «пенистых». Предполагается, что окклюзия капилляров клубочков липидными депозитами и «пенистыми» клетками уменьшает клубочковую фильтрацию. Это в свою очередь приводит к повышению внутриклубочкового давления в интактных нефронах и таким образом способствует гломерулосклерозу [5, 21, 22].
ЗАКЛЮЧЕНИЕ
В нашем исследовании повышенный уровень ОХС крови выявлен у детей с очагами нефросклероза вне зависимости от возраста и длительности заболевания. Сопоставление уровня липидов крови и данных нефросцинтиграфии может явиться перспективным направлением в оценке факторов риска развития нефросклероза у детей с хроническим пиелонефритом [22, 23].
Список литературы
1. Игнатова МС, ред. Детская нефрология. ООО «Медицинское информационное агентство», М., 2011; 696 с. [Ignatova MS, red. Detskaja nephrologija. OOO “MIA”, М., 2011; 696 p.]
2. Лучанинова ВН. К дискуссии о хронической болезни почек и тубулоинтерстициальных нефропатиях в педиатрической нефрологии. Педиатрия 2008; 87(3):131-134 [Luchaniniova VN. K diskussii o hronicheskoj bolezni pochek i tubulointersticialnyh nephropatijah v pediatricheskoj nephrologii. Pediatrija 2008;87(3):131-134]
3. Паунова СС. Патогенетические основы нефросклероза. Нефрология и диализ 2005;7(2):130-135 [Paunova SS. Patogeneticheskije osnovy nephrosclerosa. Nephrologija i dializ 2005;7(2):130-135]
4. Невструева ВВ, Клембовский АИ, Харина ЕА и др. Клинические и патогенетические проблемы нарушенной клеточной энергетики. М., 1999. [Nevstrueva VV, Klembovskij AI, Harina EA i dr. Klinicheskije i patogeneticheskije problemy narushennoj kletochnoj energetiki. М., 1999]
5. Колина ИБ. Гиперлипидемии при хронической болезни почек: особенности и подходы к лечению. Лечащий врач 2012; (1) [Kolina IB. Giperlipidemii pri hronicheskoj bolezni pochek: osobennosti i podhody k lecheniju. Lechashij vrach 2012; (1)]
6. Fine LG, Bandyopadbay D, Norman GT. Kidney Int 2000; 57 (Suppl. 75):22-26
7. Jeppe Hagstrup Christensen, Erik Berg Schmidt. N-3 Polyunsaturated Fatty Acids, Lipids and Lipoproteins in End-stage Renal Disease. Clin Lipidology 2011; 6 (5): 563–576
8. Игнатова МС, Шатохина ОВ. Клинико-генетические аспекты диагностики нефропатий у детей. Нефрология и диализ 2003; (1):8-14. [Ignatova MS, Shatohina OV. Kliniko-geneticheskije aspekty diagnostiki nephropatij u detej. Nephrologija I dializ 2003; (1):8-14]
9. Charles R Harper, Terry A Jacobson. Managing Dyslipidemia in Chronic Kidney Disease. J Am CollCardiol 2008; 51 (25): 2375–2384
10. National Kidney Foundation. KDOQI Clinical Practice Guideline for Diabetes and CKD: 2012 update. Am J Kidney Dis 2012;60(5):850-886
11. Saravanan P, Davidson NC, Schmidt EB, Calder PC. Cardiovascular effects of marine omega-3 fatty acids. Lancet 2011; 376 (9740): 540–550
12. Grundy S, De Groot LJ, Chrousos G et al. Risk Assessment and Guidelines for the Management of High Blood Cholesterol. Endotext [Internet]. South Dartmouth (MA): MDText.com, Inc. 2000-2015 Jun 12
13. Waters DD LDL-cholesterol lowering and renal outcomes. Curr Opin Lipidol 2015 Jun; 26(3):195-9. doi: 10.1097/MOL.0000000000000176
14. Смирнов АВ. Клиническое и прогностическое значение дислипидемий у больных ХГН. Дис. … д.м.н. СПб 1997; 244 [Smirnov AV. Klinicheskoje I prognosticheskoje znachenije dislipidemij u bolnyh HGN. Dis. … d.m.n. SPb1997; 244]
15. Колина ИБ. Статины при хронической болезни почек: безопасность применения. Эффективная фармакотерапия. Урология и нефрология. Спец. Выпуск 2012; 62-68 [Kolina IB. Statiny pri hronicheskoj bolezni pochek: bezopasnost primenenija. Effektivnaja farmakoterapija. Urologija I nephrologija. Spez. vypusk2012; 62-68]
16. Рекомендации по профилактике сердечно-сосудистых заболеваний в детском и подростковом возрасте. Российский кардиологический журнал, №6 (98)–2012, приложение 1, с. 23-28 [Rekomendacii po profilaktike serdechno-sosudistyh zabolevanij v detskom I podrostkovom vozraste. Rossijskij kardiologicheskij jurnal, №6 (98) – 2012, prilojenije 1, с. 23-28
17. Mirjam Harmsen, Michel Wensing, Jozé CC Braspenning, René J Wolters, Johannes C van der Wouden, Richard PTM Grol. Management of children’s urinary tract infections in Dutch family practice: a cohort study. BMC Family Practice 2007; (8):9
18. Hussein A, Askar E, Elsaeid M, Schaefer F.Functional polymorphisms in transforming growth factor-beta-1 (TGFbeta-1) and vascular endothelial growth factor (VEGF) genes modify risk of renal parenchymal scarring following childhood urinary tract infection. Nephrol Dial Transplan 2010;25(3):779-85
19. Lundstedt AC, McCarthy S, Gustafsson MC-U et al. A genetic basis of susceptibility to acute pyelonephritis. PLoS ONE 2007;(2):825doi:10.1371/journal.pone. 0000825
20. Wong MG, Wanner C, Knight J, Perkovic V. Lowering cholesterol in chronic kidney disease is it safe and effective? Eur Heart J 2015 Nov 14;36(43):2988-95. doi: 10.1093/eurheartj/ehv393
21. Vaziri ND. Dyslipidemia of chronic renal failure: the nature, mechanisms, and potentialconsequences. Am J Physiol Ren Physiol 2005; 290: 262–272
22. Banach M, Aronow WS, Serban MC et al. Lipids, blood pressure and kidney update 2015. Lipids Health Dis 2015 Dec 30; 14:167. doi: 10.1186/s12944-015-0169-0
23. Marks SD, Gordon I, Tullus K. Imaging in childhood urinary tract infections: time toreduce investigations. Pediatr Nephrol 2008;23(1):9-17
Об авторах
О. В. НестеренкоРоссия
кафедра факультетской педиатрии, доцент, к.м.н.
410012, Саратов, ул. Б. Казачья, д. 112
В. М. Попков
Россия
проф., д.м.н., заведующий кафедрой урологии, ректор,
410012, Саратов, ул. Б. Казачья, д. 112
В. Б. Бородулин
Россия
проф., д.м.н., заведующий кафедрой биохимии,
410012, Саратов, ул. Б. Казачья, д. 112
В. И. Горемыкин
Россия
проф., д.м.н., заведующий кафедрой факультетской педиатрии,
410012, Саратов, ул. Б. Казачья, д. 112
Е. В. Комарова
Россия
Клиническая больница им. С.Р. Миротворцева, клинико-диагностическая лаборатория,
410054, Саратов, Большая Садовая, д. 137
Е. В. Бобылева
Россия
к.м.н., кафедра биохимии, ассистент,
410012, Саратов, ул. Б. Казачья, д. 112
Рецензия
Для цитирования:
Нестеренко О.В., Попков В.М., Бородулин В.Б., Горемыкин В.И., Комарова Е.В., Бобылева Е.В. СОСТОЯНИЕ ЛИПИДНОГО СПЕКТРА КРОВИ У ДЕТЕЙ С ХРОНИЧЕСКИМ ПИЕЛОНЕФРИТОМ. Нефрология. 2017;21(3):75-80. https://doi.org/10.24884/1561-6274-2017-3-75-80
For citation:
Nesterenko O.V., Popkov V.M., Borodulin V.B., Goremykin V.I., Komarova E.V., Bobyleva E.V. LIPID STATUS IN CHILDREN WITH CHRONIC PYELONEPHRITIS. Nephrology (Saint-Petersburg). 2017;21(3):75-80. (In Russ.) https://doi.org/10.24884/1561-6274-2017-3-75-80
JATS XML








































