Перейти к:
БЕЛОК KLOTHO, ФАКТОР РОСТА ФИБРОБЛАСТОВ 23 И ПОЧЕЧНАЯ ЭКСКРЕЦИЯ КАЛЬЦИЯ НА НАЧАЛЬНЫХ СТАДИЯХ ЭКСПЕРИМЕНТАЛЬНОЙ ХРОНИЧЕСКОЙ БОЛЕЗНИ ПОЧЕК
https://doi.org/10.24884/1561-6274-2018-22-6-70-76
Аннотация
ВВЕДЕНИЕ. Фактор роста фибробластов 23 (FGF23) и его ко-рецептор Klotho могут быть связаны с изменениями кальциевого обмена при хронической болезни почек (ХБП) благодаря способности регулировать внутриклеточный транспорт Ca за счет модуляции катионных каналов TRPV5/ TRPV6.
ЦЕЛЬ: установить, связаны ли Klotho и FGF23 с ренальной экскрецией Са на начальных стадиях экспериментальной ХБП.
МАТЕРИАЛ И МЕТОДЫ. Для моделирования ХБП у крыс линии SHR выполняли резекцию 3/4 или 5/6 почек. Определяли концентрации интактных FGF23 и PTH в сыворотке крови методом ИФА и экспрессию белка Klotho в почке методом ИГХ, а также рассчитывали экскретируемую фракцию (FECa) и абсолютную экскрецию (UCa24) Ca с мочой.
РЕЗУЛЬТАТЫ. Концентрация креатинина в сыворотке крови, его клиренс и выраженность интерстициального фиброза у экспериментальных моделей соответствовали начальным стадиям хронического повреждения почек. UCa24 и FECa были выше, экспрессия Klotho ниже в группах с более выраженной дисфункцией почек без достоверных различий в уровнях FGF23 и РТН. При множественном регрессионном анализе FECa и UCa24 не были ассоциированы с FGF23, Klotho и РТН.
ЗАКЛЮЧЕНИЕ. Ренальная экскреция Са в условиях начальных стадий экспериментальной дисфункции почек не зависит от Klotho и FGF23.
Ключевые слова
Для цитирования:
Богданова E.О., Галкина О.В., Зубина И.М., Береснева О.H., Иванова Г.Т., Парастаева М.М., Каюков И.Г., Добронравов В.А. БЕЛОК KLOTHO, ФАКТОР РОСТА ФИБРОБЛАСТОВ 23 И ПОЧЕЧНАЯ ЭКСКРЕЦИЯ КАЛЬЦИЯ НА НАЧАЛЬНЫХ СТАДИЯХ ЭКСПЕРИМЕНТАЛЬНОЙ ХРОНИЧЕСКОЙ БОЛЕЗНИ ПОЧЕК. Нефрология. 2018;22(6):70-76. https://doi.org/10.24884/1561-6274-2018-22-6-70-76
For citation:
Bogdanova E., Galkina O.V., Zubina I.M., Beresneva O.N., Ivanova G.T., Parastaeva M.M., Kayukov I.G., Dobronravov V.A. KLOTHO PROTEIN, FIBROBLAST GROWTH FACTOR 23 AND RENAL CALCIUM EXCRETION IN INITIAL STAGES OF EXPERIMENTAL CHRONIC KIDNEY DISEASE. Nephrology (Saint-Petersburg). 2018;22(6):70-76. (In Russ.) https://doi.org/10.24884/1561-6274-2018-22-6-70-76
ВВЕДЕНИЕ
α-Klotho (Klotho) - трансмембранный белок типа 1 с молекулярной массой (м.м.) 130 кДа, содержит крупный внеклеточный домен, состоящий из двух внутренних повторов (KL1 и KL2), имеющих гомологию с β-глюкозидазой [1]. Внеклеточный домен может подвергаться протеолитическому процессингу металлопротеазами ADAM10/17 (A Disintegrin And Metalloproteinase domain 10/17), попадать в циркуляцию и представляет собой вторую изоформу белка Klotho (116 кДа) [2]. Помимо этого, в результате альтернативного сплайсинга образуется третья секретируемая изоформа Klotho с м.м. 68 кДа, которая содержит только субъединицу KL1 и не может быть заякорена на плазматической мембране [3]. Klotho экспрессируется различными тканями и органами [1]. Однако считается, что почка является основным местом синтеза Klotho и источником его циркулирующих изоформ [4]. Функциональная роль различных изоформ Klotho все еще является предметом споров. Циркулирующий Klotho предположительно обладает FGF23-независимыми гормональными или ферментативными функциями, тогда как трансмембранная изоформа Klotho является корецептором гормона костного происхождения - фактора роста фибробластов 23 (FGF23). Предполагают, что благодаря глюкозидазной активности циркулирующий Klotho способен модифицировать углеводный компонент катионных каналов TRPV5/ TRPV6, что приводит к их накоплению на плазматической мембране эпителиоцитов [5]. FGF23 действует на дистальные канальцы нефрона, где на базолатеральной мембране эпителиоцитов экспрессируются его канонический рецептор FGFR1c и ко-рецептор Klotho. Взаимодействие FGF23 с рецепторным комплексом приводит к запуску внутриклеточного сигнального каскада с участием ERK1/2, SGK1, WNK4 и увеличению количества TRPV5 на апикальной мембране [6]. По некоторым данным, при высокой концентрации FGF23 способен осуществлять свои биологические функции через связывание с FGFR3 и FGFR4 даже в условиях дефицита белка Klotho [7]. С целью определения роли FGF23 и Klotho в регуляции канальцевой реабсорбции Са при ХБП была изучена взаимосвязь между уровнем ренальной экспрессии белка Klotho, сывороточной концентрацией FGF23 и экскрецией Са при экспериментальной дисфункции почек.
МАТЕРИАЛ И МЕТОДЫ
Экспериментальное моделирование. Исследование выполнено на взрослых самцах крыс SHR массой тела 190-230 г (биоколлекция Института физиологии им. И.П. Павлова РАН). Общее количество экспериментальных животных составило 54. Эксперимент проводили в соответствии с требованиями по работе с лабораторными животными, после согласования с комиссией по контролю содержания и использования лабораторных животных ПСПбГМУ им. И.П. Павлова. Животных содержали в стандартных условиях вивария, в клетках площадью 0,2 м2 по пять крыс в каждой со свободным доступом к воде. Световой режим контролировался автоматически: 12 ч свет/12 ч темнота; температура в помещении составляла 20-22 oC. Животные получали стандартный лабораторный корм, содержащий 0,8 % Pi. Кормление осуществляли ежедневно по 25-30 г корма на крысу. Для создания экспериментальной ренальной дисфункции применяли хирургические модели резекции 3/4 или 5/6 почек [8, 9], контролем служили ложнооперированные животные с соответствующим сроком эксперимента (табл. 1).
За сутки до выведения из эксперимента у животных измеряли артериальное давление (АД) и частоту сердечных сокращений (ЧСС) манжеточным методом, затем помещали в метаболические камеры и фиксировали для сбора мочи на 24 ч в условиях водной депривации. Взятие образцов крови и почечной ткани проводили при выведении животных из эксперимента.
Биохимическое исследование Кровь и мочу центрифугировали при 1500 g в течение 10 мин, после чего проводили исследования. Часть биоматериала хранили при температуре -80 оС. Срок хранения составил не более 6 мес при постоянном контроле температурного режима. Концентрацию Ca, креатинина (Cr) определяли на автоматическом анализаторе SYNCHRON CX DELTA (Beckman Сoulter, США).
Таблица 1 / Table 1
Модели хронической болезни почек
Chronic kidney disease models
№ | 1 | 2 | 3 | 4 | 5 | 6 |
|---|---|---|---|---|---|---|
Модель | SHR1 | SHR2 | SHR1(3/4) | SHR2(3/4) | SHR1(5/6) | SHR2(5/6) |
Условия эксперимента | Ложная операция, 1 мес | Ложная операция, 2 мес | Резекция 3/4 почки, 1 мес | Резекция 3/4 почки, 2 мес | Резекция 5/6 почки, 1 мес | Резекция 5/6 почки, 2 мес |
n | 9 | 9 | 9 | 10 | 9 | 8 |
Абсолютную экскрецию Ca (UCa24) рассчитывали по формуле:
UCa24 (ммоль) = uCa х D, где uCa - концентрация Ca в моче (ммоль/л), D - диурез за 24 ч (л).
Фракционную экскрецию Ca (FECa) рассчитывали по формуле:
FECa (%) = (uCa х sCr)/(sCa х uCr) х 100, где uCa - концентрация Ca в моче (ммоль/л), sCa - концентрация Ca в сыворотке (ммоль/л), uCr - концентрация креатинина в моче (ммоль/л), sCr - концентрация креатинина в сыворотке (ммоль/л).
Скорость клубочковой фильтрации у крыс оценивали по клиренсу креатинина, рассчитанному по формуле:
CCr (мл/мин) = (uCr х D)/(sCr х 1440), где uCr - концентрация креатинина в моче (ммоль/л), sCr - концентрация креатинина в сыворотке (ммоль/л), D - диурез (мл), 1440 - количество минут в сутках.
Концентрации интактных PTH и FGF23 в сыворотке крови крыс определяли иммуноферментным методом с использованием тест-систем «Rat Intact PTH ELISA Kit» (Immutopics, Inc., США) и «FGF23 ELISA Kit» (Kainos Laboratories, Inc., Япония).
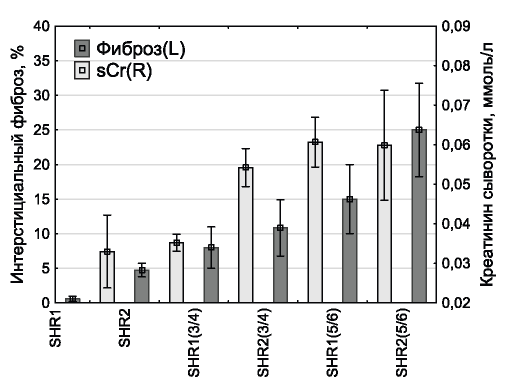
Рис. 1. Концентрация креатинина в крови и ренальный фиброз в экспериментальных моделях.
Figure 1. The levels of serum creatinine and renal fibrosis in experimental models.
Гистологическое исследование. Почку фиксировали в 5 % нейтральном формалине (рН 7,2) при комнатной температуре (22 °С) в течение 16 ч, готовили срезы толщиной не более 4 мкм. Площадь коллагенового фиброза измеряли в 10 полях зрения для каждого микропрепарата почки, окрашенного по методике трихром по Массону.
Таблица 2 / Table 2
Корреляционный анализ
Correlation analysis
| FGF23 | PTH | Klotho | sCr |
|---|---|---|---|---|
FECa | 0,35 | 0,43 | -0,43 | 0,72 |
(0,01) | (0,002) | (0,002) | (<0,001) | |
UCa24 | 0,40 | 0,36 | -0,41 | 0,56 |
(0,001) | (0,01) | (0,001) | (<0,001) |
Примечание. Указаны значения коэффициента корреляции Спирмена и p (в скобках); FGF23 - фактор роста фибробластов 23, PTH - паратиреоидный гормон, sCr - концентрация креатинина сыворотки, FECa - фракционная экскреция Ca, UCa24 - абсолютная экскреция Ca.
The values of Spearman’s correlation coefficient and p (in brackets) are represented; FGF23 - serum fibroblast growth factor 23, PTH - serum intact parathyroid hormone, sCr - serum creatinine; sCa - serum calcium, FECa - fractional excretion of Ca, UCa24 - daily Ca excretion.
Для детекции Klotho в паренхиме почки использовали первичные поликлональные антитела кролика ab69208 (Abcam, Великобритания), систему Dako EnVision (Dako, США) и подкрашивали гематоксилином. Содержание Klotho исследовали в корковом веществе почки на участках тубулоин- терстиция без существенных фибропластических изменений в 10 полях зрения для каждого гистологического препарата при помощи программы «Видео ТесТ-Морфология 5.2» (ООО «Видеотест», Россия).
Доля S2 продукта (%) = [(Σ10 А/Б)/10] х100,
где А - площадь масок со специфическим продуктом реакции; Б - площадь поля зрения.
Статистический анализ проводили при помощи пакета SAS/STAT 6.1. Данные представлены как среднее и стандартное отклонение (M±SD) или медиана с интерквартильным размахом (m [25 %-75 %)]. Для сравнения групп в зависимости от типа переменной и характера распределения применяли следующие тесты: F-критерий Фишера, критерий Краскелла-Уоллиса. Для исследования связей между переменными применяли корреляционный анализ Спирмена и множественный регрессионный анализ. Межгрупповые различия и регрессионные коэффициенты считали статистически значимыми при p<0,05.
РЕЗУЛЬТАТЫ
Соответствие моделей начальным стадиям хронической болезни почек (ХБП) подтверждалось закономерными изменениями показателей функции почек и выраженностью ренального фиброза у экспериментальных животных (рис. 1).

Рис. 2. Показатели обмена кальция при моделировании ХБП. А - концентрация кальция в крови (ммоль/л), Б - относительная и абсолютная экскреция кальция, В - концентрация FGF23 в сыворотке крови (пг/мл), Г - экспрессия белка Klotho в почке (доля площади поля зрения), Д - концентрация PTH в сыворотке крови (пг/мл).
Figure 2. Indices of calcium exchange in CKD models: А - the levels of serum calcium (mmol/L), B - daily and fractional Ca excretion, C - the levels of serum FGF23 (pg/ml), D - renal Klotho protein expression (part of FOV), E - the levels of serum PTH (pg/ml).
При снижении функции почек у спонтанно гипертензивных крыс наблюдали рост экскретируемой фракции и абсолютной экскреции Ca (рис. 2, Б), сопровождающийся снижением ренальной экспрессии белка Klotho (см. рис. 2, Г) при отсутствии достоверных изменений концентраций PTH и FGF23 (см. рис. 2, В, Д). Концентрация Ca в сыворотке крови значимо не изменялась (см. рис. 2, А).
Ренальная экскреция кальция имела достоверные корреляционные связи с концентрациями PTH, FGF23, экспрессией Klotho в почке и в сыворотке крови (табл. 2).
При регрессионном моделировании FECa и UCa24 были независимо связаны с sCr, но не с экспрессией белка Klotho в почке, концентрациями FGF23 и PTH. Ассоциаций sCa с исследуемыми показателями выявлено не было (табл. 3).
Таблица 3 / Table 3
Множественный регрессионный анализ
Multiple regression analysis
Модели (зависимая переменная) Models (dependent variable) | Независимые переменные Independent variables | Beta | SE(Beta) | Значение p p-value |
|---|---|---|---|---|
Модель 1 (sCa) Adjusted R2=0,05; р=0,65 | FGF23 | 0,168 | 0,147 | 0,257 |
PTH | -0,107 | 0,142 | 0,456 | |
Klotho | 0,064 | 0,162 | 0,692 | |
sCr | -0,069 | 0,164 | 0,678 | |
Модель 2 (FECa) Adjusted R2=0,45; р<0,001 | FGF23 | 0,053 | 0,114 | 0,647 |
PTH | 0,076 | 0,110 | 0,496 | |
Klotho | 0,121 | 0,138 | 0,388 | |
sCr | 0,746 | 0,136 | <0,001 | |
Модель 3 (UCa24) Adjusted R2=0,21; р=0,006 | FGF23 | 0,190 | 0,137 | 0,171 |
PTH | 0,067 | 0,132 | 0,614 | |
Klotho | 0,062 | 0,166 | 0,713 | |
sCr | 0,478 | 0,163 | 0,005 |
Примечание. Указаны скорректированные коэффициенты детерминации R2, значения р для моделей, стандартизованные коэффициенты регрессии Beta, стандартная ошибка среднего SE(Beta) и значения р для коэффициента Beta. FGF23 - фактор роста фибробластов 23, PTH - паратиреоидный гормон, sCr - концентрация креатинина в сыворотке, sCa - кальций в сыворотке, FECa - фракционная экскреция Ca, UCa24 - абсолютная экскреция Ca.
Adjusted determination coefficients R2 and their p values, standardized regression coefficients Beta, their standard errors SE(Beta) and p values for the Beta coefficient are represented. FGF23 - serum fibroblast growth factor 23, PTH - serum intact parathyroid hormone, sCr - serum creatinine; sCa - serum calcium, FECa - fractional excretion of Ca, UCa24 - daily Ca excretion.
ОБСУЖДЕНИЕ
До недавнего времени PTH считался главным гормоном, противодействующим гипокальциемии, закономерно развивающейся при ХБП. В экспериментальных исследованиях последних лет было показано, что FGF23 и его ко-рецептор Klotho также способны регулировать реабсорбцию Ca в тубулярном эпителии [5, 10]. При этом активация регуляторной системы FGF23/Klotho/ FGFRs предположительно происходит несколько раньше реакции паращитовидных желез и роста концентрации PTH [11].
В настоящем исследовании при снижении функции почек у спонтанно гипертензивных крыс наблюдали рост относительной и абсолютной экскреции кальция при тенденции к увеличению концентраций PTH и FGF23 в крови, а также закономерном снижении ренальной экспрессии белка Klotho. Однако выявленные корреляционные зависимости противоречат предполагаемым молекулярным механизмам действия исследуемых гормонов [5, 6, 10]. Уровень FGF23 прямо коррелировал с FECa. Эффекты FGF23, напротив, способствуют увеличению реабсорбции Ca, а рост его концентрации должен был бы приводить к снижению экскреции Са почками. Наблюдаемая корреляционная зависимость может быть связана с FGF23-опосредованным нарушением образования кальцитриола [12, 13]. Известно, что действие FGF23 связано с угнетением синтеза активной формы D-гормона [12]. В свою очередь кальцитриол участвует в регуляции реабсорбции Са не только через действие на экспрессию и секрецию PTH, но также стимулирует внутриклеточный транспорт через цитоплазматический D-зависимый кальций-связывающий белок (кальбиндин-D) и АТФ-зависимую Са-помпу на базолатеральной мембране [13].
Физиологически обоснованной могла бы являться обратная корреляционная зависимость между мочевой экскрецией кальция и Klotho. Как предполагают, последний может обладать разнообразными FGF23-независимыми свойствами, включая регуляцию Са-каналов (TRPC5/TRPC6) [14-20].
Полученные нами данные регрессионного моделирования не подтверждают предположений о том, что Klotho и FGF23 независимо связаны с регуляцией почечной экскреции Са, как и данные других исследований [21]. Существенно более высокие показатели UCa24 и FECa при увеличении степени выраженности экспериментальной дисфункции почек, очевидно, обусловлены действием иных Са-регулирующих механизмов.
ЗАКЛЮЧЕНИЕ
Экскреция Са почками в условиях ранних стадий экспериментальной ХБП, по-видимому, не зависит от эффектов Klotho и FGF23.
Работа выполнена при поддержке Российского Фонда фундаментальных исследований (гранты №1304-01886, №18-015-00425, №18-315-00342).
Список литературы
1. Kuro-o M, Matsumura Y, Aizawa H et al. Mutation of the mouse klotho gene leads to a syndrome resembling ageing. Nature 1997;390:45–51. Doi: 10.1038/36285
2. Imura A, Iwano A, Tohyama O et al. Secreted Klotho protein in sera and CSF: implication for post-translational cleavage in release of Klotho protein from cell membrane. FEBS Lett 2004;565:143–147. Doi: 10.1016/j.febslet.2004.03.090
3. Matsumura Y, Aizawa H, Shiraki-Iida T et al. Identification of the human klotho gene and its two transcripts encoding membrane and secreted klotho protein. Biochem Biophys Res Commun 1998;242:626–630. Doi: 10.1006/bbrc.1997.8019
4. Lindberg K, Amin R, Moe OW et al. The kidney is the principal organ mediating klotho effects. J Am Soc Nephrol 2014;25:2169–2175. Doi: 10.1681/ASN.2013111209
5. Van Husen M, Fischer AK, Lehnhardt A et al. Fibroblast growth factor 23 and bone metabolism in children with chronic kidney disease. Kidney Int 2010;78:200–206. Doi: 10.1038/ki.2010.107
6. Andrukhova O, Smorodchenko A, Egerbacher M et al. FGF23 promotes renal calcium reabsorption through the TRPV5 channel. EMBO J 2014;33:229–246. Doi: 10.1002/embj.201284188
7. Alexander Grabner, Karla Schramm, Neerupma Silswal et al. FGF23/FGFR4-mediated left ventricular hypertrophy is reversible. Sci Rep 2017; 7: 1993. Doi: 10.1038/s41598-017-02068-6
8. Takahashi S, Okada K, Nagura Y et al. Three-quarters nephrectomy in rats as a model of early renal failure. Jpn J Nephrol 1991;33(1):27–31. Doi: 10.14842/jpnjnephrol1959.33.27
9. Береснева ОН, Парастаева ММ, Иванова ГТ и др. Оценка кардиопротективного действия малобелковой соевой диеты и уровень неорганических анионов сыворотки крови у спонтанно-гипертензивных крыс с нефрэктомией. Нефрология 2007; 11(3): 70–76. Doi: 10.24884/1561-6274-2007-11-3-70-76
10. Huang CL. Regulation of ion channels by secreted Klotho. Adv Exp Med Biol 2012;728:100–106. Doi: 10.1007/978-1-4614-0887-1_7
11. Isakova T, Wahl P, Vargas GS et al. Fibroblast growth factor 23 is elevated before parathyroid hormone and phosphate in chronic kidney disease. Kidney Int 2011;79(12):1370–1378. Doi: 10.1038/ki.2011.47
12. Armbrecht HJ, Wongsurawat N, Zenser TV, Davis BB. Effect of PTH and 1,25(OH)2D3 on renal 25(OH)D3 metabolism, adenylate cyclase, and protein kinase. Am J Physiol 1984;246(1 Pt 1):102–107. Doi: 10.1152/ajpendo.1984.246.1.E102
13. Johnson JA, Kumar R. Vitamin D and renal calcium transport. Current Opinion in Nephrology and Hypertension 1994;3(4):424–429
14. Kurosu H, Yamamoto M, Clark JD et al. Suppression of aging in mice by the hormone Klotho. Science 2005; 309:1829–1833. Doi: 10.1126/science.1112766
15. Xu Y, Sun Z. Molecular basis of Klotho: from gene to function in aging. Endocr Rev 2015; 36:174–193. Doi: 10.1210/er.2013-1079
16. Cha SK, Ortega B, Kurosu H, et al. Removal of sialic acid involving Klotho causes cell-surface retention of TRPV5 channel via binding to galectin1. Proc Natl Acad Sci USA 2008; 105:9805–9810. Doi: 10.1073/pnas.0803223105
17. Tohyama O, Imura A, Iwano A, et al. Klotho is a novel betaglucuronidase capable of hydrolyzing steroid beta-glucuronides. J Biol Chem 2004;279:9777–9784. Doi: 10.1074/jbc.M312392200
18. Hu MC, Shi M, Zhang J, et al. Klotho: a novel phosphaturic substance acting as an autocrine enzyme in the renal proximal tubule. FASEB J 2010;24:3438–3450. Doi: 10.1096/fj.10-154765
19. Chang Q, Hoefs S, Van Der Kemp AW, et al. The betaglucuronidase Klotho hydrolyzes and activates the TRPV5 channel. Science 2005;310:490–493. Doi: 10.1126/science.1114245
20. Huang CL. Regulation of ion channels by secreted Klotho. Adv Exp Med Biol. 2012; 728:100–106. Doi:10.1007/978-1-4614-0887-1_7
21. Andrukhova O, Bayer J, Schüler C et al. Klotho Lacks an FGF23-Independent Role in Mineral Homeostasis. JBMR 2017;32(10):2049–2061. Doi: 10.1002/jbmr.3195
Об авторах
E. О. БогдановаРоссия
197022, Россия, Санкт-Петербург, ул. Л. Толстого, д. 17, корп. 54.
Богданова Евдокия Олеговна, лаборатория биохимического гомеостаза.
Тел.: (812) 338-69-31.
О. В. Галкина
Россия
197022, Россия, Санкт-Петербург, ул. Л. Толстого, д. 17, корп. 54.
Галкина Ольга Владимировна, канд. биол. наук, лаборатория биохимического гомеостаза.
Тел.: (812) 338-69-31.
И. М. Зубина
Россия
197022, Россия, Санкт-Петербург, ул. Л. Толстого, д. 17, корп. 54.
Зубина Ирина Михайловна, канд. биол. наук, лаборатория биохимического гомеостаза.
Тел.: (812) 338-69-31.
О. H. Береснева
Россия
197022, Россия, Санкт-Петербург, ул. Л. Толстого, д. 17, корп. 54.
Береснева Ольга Николаевна, канд. биол. наук, лаборатория клинической физиологии почки.
Тел.: (812) 338-69-31.
Г. Т. Иванова
Россия
199034, Санкт-Петербург, наб. Макарова, д. 6.
Иванова Галина Тажимовна, канд. биол. наук.
Тел.: (812) 328-11-01.
М. М. Парастаева
Россия
197022, Россия, Санкт-Петербург, ул. Л. Толстого, д. 17, корп. 54.
Парастаева Марина Магрезовна, канд. биол. наук, лаборатория клинической физиологии почки.
Тел.: (812) 338-69-01.
И. Г. Каюков
Россия
197022, Россия, Санкт-Петербург, ул. Л. Толстого, д. 17, корп. 54.
Проф. Каюков Иван Глебович, д-р мед. наук, лаборатория клинической физиологии почки.
Тел.: (812) 338-69-01.
В. А. Добронравов
Россия
197022, Россия, Санкт-Петербург, ул. Л. Толстого, д. 17, корп. 54.
Проф. Добронравов Владимир Александрович, д-р мед. наук, заместитель директора.
Тел.: (812) 338-69-01.
Рецензия
Для цитирования:
Богданова E.О., Галкина О.В., Зубина И.М., Береснева О.H., Иванова Г.Т., Парастаева М.М., Каюков И.Г., Добронравов В.А. БЕЛОК KLOTHO, ФАКТОР РОСТА ФИБРОБЛАСТОВ 23 И ПОЧЕЧНАЯ ЭКСКРЕЦИЯ КАЛЬЦИЯ НА НАЧАЛЬНЫХ СТАДИЯХ ЭКСПЕРИМЕНТАЛЬНОЙ ХРОНИЧЕСКОЙ БОЛЕЗНИ ПОЧЕК. Нефрология. 2018;22(6):70-76. https://doi.org/10.24884/1561-6274-2018-22-6-70-76
For citation:
Bogdanova E., Galkina O.V., Zubina I.M., Beresneva O.N., Ivanova G.T., Parastaeva M.M., Kayukov I.G., Dobronravov V.A. KLOTHO PROTEIN, FIBROBLAST GROWTH FACTOR 23 AND RENAL CALCIUM EXCRETION IN INITIAL STAGES OF EXPERIMENTAL CHRONIC KIDNEY DISEASE. Nephrology (Saint-Petersburg). 2018;22(6):70-76. (In Russ.) https://doi.org/10.24884/1561-6274-2018-22-6-70-76








































