Перейти к:
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ПРЕЭКЛАМПСИИ У ПАЦИЕНТОК С ХРОНИЧЕСКОЙ БОЛЕЗНЬЮ ПОЧЕК
https://doi.org/10.24884/1561-6274-2019-23-1-45-50
Аннотация
ЦЕЛЬ: оценить значимость прогностических маркеров преэклампсии – sFlt-1 и PlGF в дифференциальной диагностике преэклампсии и хронической болезни почек. ПАЦИЕНТЫ И МЕТОДЫ: произведён отбор пациенток, у которых было получено и подписано информированное добровольное согласие с последующим забором образца крови в III триместре беременности. В исследуемую группу вошли 36 пациенток с преэклампсией (ПЭ), в группу сравнения – 46 беременных женщин с ХБП и в контрольную группу (КГ) – 40 соматически здоровых пациенток с физиологически протекающей беременностью. РЕЗУЛЬТАТЫ: Были выявлены существенные различия уровней сывороточного sFlt-1 и PlGF: между ПЭ и группой сравнения (ХБП), а также между ПЭ и контрольной группой (КГ), тогда как между КГ и ХБП не было обнаружено различий. Уровень белка sFlt-1 был значительно увеличен в ПЭ по сравнению с ХБП и КГ (5.12- и 4.25-кратно выше соответственно). Уровни сывороточного PlGF были значительно уменьшены в ПЭ относительно ХБП и КГ (в 17,4 и 12,5 раза ниже соответственно). Отношение sFlt-1/PlGF было значительно увеличено в ПЭ по сравнению с ХБП и контрольной группой (примерно в 25 раз выше в обеих группах), но существенной разницы между группой с ХБП и КГ не было выявлено. ЗАКЛЮЧЕНИЕ: Таким образом, определение отношения sFlt-1, PlGF, sFlt-1/PlGF может быть использовано при дифференциальной диагностике преэклампсии и хронической болезни почек.
Ключевые слова
Для цитирования:
Темирбулатов Р.P., Беженарь В.Ф., Смирнов A.В. ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ПРЕЭКЛАМПСИИ У ПАЦИЕНТОК С ХРОНИЧЕСКОЙ БОЛЕЗНЬЮ ПОЧЕК. Нефрология. 2019;23(1):45-50. https://doi.org/10.24884/1561-6274-2019-23-1-45-50
For citation:
Temirbulatov R.R., Bezhenar V.F., Smirnov A.V. DIFFERENTIAL DIAGNOSTICS OF PREECLAMPSIA IN PATIENTS WITH CHRONIC KIDNEY DISEASE. Nephrology (Saint-Petersburg). 2019;23(1):45-50. (In Russ.) https://doi.org/10.24884/1561-6274-2019-23-1-45-50
ВВЕДЕНИЕ
Интерес к сложной взаимосвязи между почками и плацентой появился с самого начала развития современной медицины. Важность дифференциального диагноза между существующей патологией почек, усугубляющейся во время гестации и беременностью, осложненной протеинурией и гипертензией, была подчеркнута более века назад [1]. Распространенность хронической болезни почек (ХБП) и преэклампсии (ПЭ) увеличивается. Преэклампсия осложняет 12-21 % всех беременностей [1, 2], в то время как хроническая болезнь почек поражает 2-3 % женщин детородного возраста [3, 5].
Дифференциальная диагностика между ПЭ и ХБП по-прежнему остаётся актуальной проблемой. Определения обоих этих заболеваний были недавно пересмотрены, и в одном, и в другом направлениях ведутся активные исследования в поисках путей ранней диагностики [4, 5]. Гломерулонефрит, так же как и другие системные воспалительные заболевания, может дебютировать, рецидивировать и прогрессировать во время беременности. Поражения клубочков, такие как IgA- нефропатия, могут вызывать протеинурию или гипертензию, в том числе во время беременности [6, 7]. Отличие преэклампсии от ХБП имеет важное клиническое значение. Так как для клинической картины ПЭ характерно более агрессивное и бурное течение, то при тяжёлых формах рационально досрочное родоразрешение, в то время как в случае ХБП целесообразна тактика выжидания и наблюдения [2].
Недавние исследования подчеркнули связь между ПЭ и развитием терминальной стадии почечной недостаточности (тПН) в отдалённом периоде [5, 7]. В частности, в одном из проведённых когортных исследований более чем одного миллиона женщин с наличием от одной до трёх беременностей, сообщается, что ПЭ можно считать клиническим маркером увеличения риска последующего развития тПН. В основе связи ПЭ с высоким риском развития тПН, по-видимому, лежит генерализованная эндотелиальная дисфункция, возникшая при ПЭ и персистирующая в дальнейшем на протяжении всей жизни. Этот риск особенно высокий, если последствием ПЭ стало рождение ребёнка с задержкой внутриутробного роста или преждевременные роды, либо если ПЭ встречалась более чем в одной беременности [5].
Несмотря на большой интерес к этому сложному вопросу, на данный момент отсутствуют достоверные клинические критерии или биомаркеры, необходимые для проведения дифференциального диагноза между ХБП и ПЭ.
Вопросы этиологии и патогенеза преэклампсии до сих пор остаются дискутабельными. Существуют доказательства, указывающие на то, что гипертензия, протеинурия и генерализованная эндотелиальная дисфункция непосредственно вызваны дисбалансом в синтезе плацентарных про- и антиангиогенных молекул. В частности, дисбаланс sFlt-1 и PlGF, как маркер генерализованной эндотелиальной дисфункции, как полагают, имеет решающее значение в патогенезе развития преэклампсии [8, 9]. При нормальном развитии плаценты ключевую роль в регуляции роста и дифференциации трофобласта, ангиогенезе ворсин хориона и ремоделировании материнских спиральных артерий играют васкулоэндотелиальный фактор роста и PlGF [8, 9]. При преэклампсии недостаточная инвазия трофобласта приводит к нарушению перфузии, гипоксии/ишемии и окислительному стрессу [10]. Такое состояние вызывает гиперактивацию гипоксия-индуцируемого фактора 1a, который является основным фактором клеточного ответа на гипоксию [11]. Гипоксия- индуцируемый фактор 1а активирует гены, способствующие повышенной экспрессии проангиогенного васкулоэндотелиального фактора роста и антиангиогенного sFlt-1 [12]. Аномально повышенные концентрации плацентарного и циркулирующего sFlt-1, индуцированнного гипоксией и окислительным стрессом, ингибируют свободный васулоэндотелиальный фактор роста и PlGF, внося свой вклад в патологический плацентарный ангиогенез и генерализованную эндотелиальную дисфункцию [12]. В последнее время отмечается, что васкулоэндотелиальный фактор роста, специфически продуцируемый подоцитами, необходим для поддержания целостности клубочкового фильтрационного барьера [13].
Выявление дисбаланса sFlt-1/PlGF в качестве ключевого звена патогенеза преэклампсии привело к появлению новых диагностических и терапевтических перспектив. Оба фактора можно обнаружить в материнском кровотоке как минимум за пять недель до начала клинической картины преэклампсии [14, 15]. При нормально протекающей беременности, уровень sFlt-1 в сыворотке матери непрерывно увеличивается на протяжении всей беременности тогда как уровень PlGF увеличивается до середины III триместра, а затем уменьшается к концу беременности [16]. С патофизиологической точки зрения можно предположить, что серологическая картина при ХБП будет отличаться от таковой при преэклампсии в связи с тем, что у пациенток с ХБП отсутствует патологический вариант инвазии трофобласта. Согласно этой гипотезе, отношение sFlt-1/PlGF должно быть нормальным у беременных с ХБП, несмотря на протеинурию или гипертензию, что позволит дифференцировать эти состояния.
ПАЦИЕНТЫ И МЕТОДЫ
Исследование проводилось в отделении патологии беременности клиники акушерства и гинекологии ФГБОУ ВО ПСПбГМУ им. И.П. Павлова Минздрава России.
Согласно критериям включения, произведён отбор пациенток, у которых было получено и подписано информированное согласие с последующим забором образца крови.
В исследуемую группу вошли 36 пациенток с ПЭ, в контрольную группу (КГ) - 46 беременных женщин с ХБП и в группу сравнения - 40 соматически здоровых пациенток с физиологически протекающей беременностью.
Критериями преэклампсии являлась гипертензия с систолическим артериальным давлением >140 мм рт. ст. и/или диастолическим артериальным давлением >90 мм рт. ст., наличие протеи- нурии >0,3 г/24 ч после 20 нед беременности у женщины без эпизодов подъёма артериального давления в анамнезе. Критериями включения в КГ беременных с наличием ХБП являлись продолжающиеся в течение >3 мес нарушения анатомического строения или функции почек (по данным лабораторных данных) или снижение скорости клубочковой фильтрации (СКФ) ниже 60 мл/мин. СКФ была рассчитана по формулам Кокрофта-Голта и MDRD по данным, полученным за 3 мес до зачатия, либо по данным креатинина сыворотки, измеренном при первом визите на сроке беременности до 20 нед. В интересах исследования были включены только пациенты с ранее установленным диагнозом ХБП и наличием симптоматики в виде гипертензии и протеинурии не менее 0,3 г/24 ч. Таким образом, клиническая и лабораторная картина была аналогична критериям преэклампсии. Структура пациенток с ХБП была представлена следующей патологией: верифицированная до беременности патология клубочков (IgA-нефропатия) (23,9 %), диффузные заболевания соединительной ткани (23,9 %), хронический нефритический синдром (13 %), мультикистозное поражение почек (4,3 %), трансплантированная почка (13 %), гипоплазия почки (4,3 %) и единственная почка (17,5 %). У всех пациенток в КГ и группе ПЭ функция почек была нормальной (СКФ > 90 мл/мин); в группе сравнения - у 38 пациенток с ХБП I стадии, у 4 пациенток - ХБП II ст., у двух пациенток - ХБП Ша ст., у двух пациенток - ХБП IV ст. Одна пациентка из группы сравнения с ХБП IV стадии была исключена в связи антенатальной гибелью плода. Пациентки группы сравнения имели нормально протекающую беременность без признаков преэклампсии, ХБП или других заболеваний матери или плода. Критериями невключения являлись беременность двойней, врождённые пороки развития плода.
Во всех трёх группах был осуществлён анализ следующих показателей: суточная протеинурия, сывороточный креатинин, скорость клубочковой фильтрации, альбумин сыворотки, артериальное давление, возраст, паритет, срок гестации в момент исследования, срок и способ родоразрешения, осложнения беременности и родов, масса плода при рождении, оценка по шкале Апгар. У каждой пациентки был осуществлён забор венозной крови в объеме 2 мл. Все образцы анализировались одновременно. Уровни сыворотки sFlt-1 и PlGF были определены параллельно с помощью иммуноанализа (Elecsys, Roche, Penzberg, Germany) с использованием иммуноанализатора Cobas-e-411 согласно инструкциям изготовителя.
Статистический анализ полученных результатов проводили с использованием общепринятых параметрических и непараметрических методов. Для анализа и оценки полученных данных применяли стандартные методы описательной статистики. Центральные тенденции при нормальном распределении признака оценивали по величине средних значений и среднеквадратического отклонения (Μ±σ); при асимметричном - по медиане и квартилям. Статистическую значимость межгрупповых различий количественных переменных определяли с помощью дисперсионного анализа (ANOVA), критерия Манна-Уитни или Уилкоксона, бинарных переменных - с помощью Х2-критерия. Определение поправки Бонферрони использовалось для ретроспективного анализа между двумя группами параметрических данных, для непараметрических данных использовался критерий Краскела-Уоллиса и хи-квадрат. ROC-анализ был использован для определения пороговых значений измерений sFlt-1, PlGF и их оотношения. Нулевую гипотезу (ошибка первого рода) отвергали при p<0,05. Для расчетов использовали пакет прикладных статистических программ «Statistica Ver. 8.0» («StatSoft, Inc.», США).
РЕЗУЛЬТАТЫ
Были выявлены существенные различия уровней сывороточного sFlt-1 и PlGF между ПЭ и группой сравнения (ХБП) и между ПЭ и контрольной группой (КГ), тогда как между КГ и ХБП не было обнаружено различий (табл. 1). Уровень белка sFlt-1 был значительно увеличен в ПЭ по сравнению с ХБП и КГ (5.12- и 4.25-кратно выше соответственно, р<0,0001). Уровни сывороточного PlGF были значительно уменьшены в ПЭ относительно как ХБП, так и КГ (в 17,4 и 12,5 раза ниже соответственно, р<0,0001). Анализ ROC-кривой показал, что пороговая концентрация (cut off point) sFlt-1 для различения ПЭ и ХБП была равна 7715 пг/мл (чувствительность 97 %, специфичность 96 %), а для PlGF - 88,15 пг/мл (чувствительность 90 %, специфичность 100 %). Отношение sFlt-1/PlGF было значительно увеличено в ПЭ по сравнению с ХБП и контролем (примерно в 25 раз выше в обеих группах, р<0,0001), но существенной разницы между ХБП и КГ не было выявлено (см. табл. 1, рисунок) При анализе ROC-кривой было выявлено пороговое значение отношения sFlt-1/PlGF для различия ПЭ и ХБП, равное 150,75 (чувствительность 100 %, специфичность 100 %). Тем не менее, поскольку нет перекрытия пределов, любое значение между 137,69 и 160,9 может быть в равной степени использовано для дифференциального диагноза двух патологий.
Таблица 1 / Table 1
Сравнение концентрации биомаркеров в группах
Comparison of biomarker concentrations in groups
Показатель | ПЭ (n=36) | ХБП (n=46) | КГ (n=40) | p-value |
|---|---|---|---|---|
sFlt-1 (пг/мл) (пределы) | 13519,5 (6059-34398) | 1988 (692-11172) | 2499 (823-14833) | p<0,0001 p1<0,0001 р2=НЗ |
PlGF (пг/мл) (пределы) | 32,6 (11-86,9) | 426,5 (55,9-2632) | 279,3 (43,5-1262) | p<0,0001 p1<0,0001 р2=НЗ |
sFlt-1/PlGF (пределы) | 435,79 (160,90-1153,53) | 4,003 (0,51-137,69) | 9,36 (1,38-126,83) | p<0,0001 p1<0,0001 р2=НЗ |
Примечание. р = ПЭ в сравнении с ХБП; р1 = ПЭ в сравнении с КГ; р2 = ХБП в сравнении с КГ; НЗ - статистически незначимое различие.
Таблица 2 / Table 2
Результаты сравнительной характеристики групп
The results of the comparative characteristics of the groups
Показатель | ПЭ (n=36) | ХБП (n=46) | КГ (n=40) | p-value |
|---|---|---|---|---|
Возраст на момент начала беременности | 34,5±4,88 | 29,5±5,87 | 31,5±5,37 | p=0,03 P1=HG р2=НЗ |
Первобеременные (%) | 19 (52,8%) | 24 (52,2%) | 17 (42,5%) | р=НЗ P1=HG р2=НЗ |
Суточная протеинурия (г/24ч) | 2,62 (0,45-18,36) | 0,75 (0,3-6,83) | - | р=0,0002 |
Частота тяжёлой преэклампсии, % | 10 (27,8%) | - | - |
|
Срок родоразрешения (нед) | 35,6±2,15 | 37,1±2,82 | 40,1±1,41 | p<0,0001 p1<0,0001 р2<0,0001 |
Преждевременные роды (<37 нед) | 10 (27,8%) | 4 (12,5%) | 3 (7,9%) | p<0,0001 p1<0,0001 р2=НЗ |
Кесарево сечение | 11 (30,5%) | 3 (9,4%) | 1(2,6%) | p<0,0001 p1=0,0001 р2=НЗ |
Масса при рождении (г) | 2263±545,8 | 2531,2±633,17 | 3212,4±486,35 | p=H3 p1<0,0001 р2<0,0001 |
Частота СЗВРП (< 10 перцентили) | 46,7%* | 21,7%* | 6,80% | р=НЗ p1<0,005 р2=НЗ |
Примечание. р = ПЭ в сравнении с ХБП; р1 = ПЭ в сравнении с КГ; р2 = ХБП в сравнении с КГ; НЗ – статистически незначимое
различие; СЗВРП – синдром задержки внутриутробного роста плода.
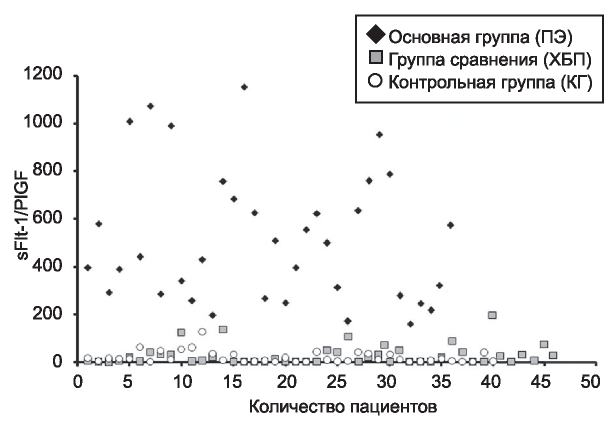
Рисунок. Диаграмма распределения.
Figure. Dispersion diagram.
Данные сравнительной популяционной характеристики приведены в табл. 2. Протеинурия, по определению, отсутствующая в контрольной группе, была значительно выше в группе пациенток, у которых развилась ПЭ, чем в группе пациенток с ХБП и ГС. Клинические исходы отличались у пациенток с ПЭ и были менее благоприятными по сравнению с КГ и ГС (см. табл. 2).
ОБСУЖДЕНИЕ
Основные результаты нашего исследования должны были подтвердить наличие разницы в исходах беременности при ПЭ и ХБП, а также возможности дифференциальной диагностики с помощью специфических циркулирующих биомаркеров (см. табл. 1, рисунок). Метод определения отношения sFlt-1/PlGF позволил дифференцировать два этих состояния, а превышение порогового значения более 150 может быть использовано в клинической практике в качестве лабораторного дифференциально-диагностического критерия преэклампсии.
Таким образом, наше исследование демонстрирует разницу патогенеза осложнений беременности при ХБП и ПЭ. В первом случае они связаны с экстрагенитальной патологией, при которой концентрация маркеров плацентации не отличается от уровней маркеров в сыворотке пациенток с нормально протекающей беременностью. При ПЭ патогенез осложнений связан с первичным дефектом плацентации.
Своевременное выявление пациенток с ХБП должно способствовать разработке оптимальной стратегии ведения беременности. При строгом контроле лабораторных показателей, даже при выраженной протеинурии, возможно пролонгирование беременности у пациенток с ХБП и достижение оптимального срока гестации на момент родоразрешения, в то время как при тяжёлой ПЭ агрессивное течение заболевания и высокий риск ассоциированных с ПЭ осложнений требуют досрочного прерывания беременности. Установленный диагноз ХБП в послеродовом периоде может дать возможность планирования путей диагностики и терапии для пациентов, которые, в противном случае, могли бы остаться без внимания узких специалистов.
ЗАКЛЮЧЕНИЕ
Таким образом, определение отношения sFlt-1/ PlGF на данный момент является единственным дифференциально-диагностическим биомаркером преэклампсии. Наше исследование показывает различия, связанные с беременностью осложнений при ХБП и ПЭ. Можно предположить, что sFlt-1 является распространенным антиангиоген- ным маркером, который, как ожидается, будет увеличен при обоих патологических состояниях. Вероятно, при ХБП сосудистое повреждение ограничено почкой, тогда как ишимезированная плацента при ПЭ высвобождает антиангиогенные и провоспалительные молекулы в материнское кровообращение, вызывающее генерализованное повреждение эндотелия.
Список литературы
1. Савельева ГМ, Серов ВН, Сухих ГТ. Акушерство и гинекология: Клинические рекомендации. ГЭОТАР-Медиа, М., 2015. 1024 с. [Saveleva GM, Serov VN, Suhih GT. Akusherstvo i ginekologiya: Klinicheskie rekomendacii.: GEHOTAR-Media, М., 2015. 1024 s.]
2. ACOG practice bulletin. Diagnosis and management of preeclampsia and eclampsia. Number 33, January 2002. Obstet Gynecol 2002; 99: 159–167
3. Williams D, Davison J. Chronic kidney disease in pregnancy. BMJ 2008; 336: 211–215
4. National Kidney Foundation. K/DOQI clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification. Am J Kidney Dis 2002; 39: S1–266
5. Vikse BE, Irgens LM, Leivestad T et al. Preeclampsia and the risk of end-stage renal disease. N Engl J Med 2008; 359: 800–809
6. Jones DC, Hayslett JP. Outcome of pregnancy in women with moderate or severe renal insufficiency. N Engl J Med 1996; 335: 226–232
7. Murakami S, Saitoh M, Kubo T et al. Renal disease in women with severe preeclampsia or gestational proteinuria. Obstet Gynecol 2000; 96: 945–949
8. Demir R, Seval Y, Huppertz B. Vasculogenesis and angiogenesis in the early human placenta. Acta Histochem 2007; 109: 257–265
9. Huppertz B, Peeters LL. Vascular biology in implantation and placentation. Angiogenesis 2005; 8: 157–167
10. Hung TH, Skepper JN, Burton GJ. In vitro ischemiareperfusion injury in term human placenta as a model for oxidative stress in pathological pregnancies. Am J Pathol 2001; 159: 1031–1043
11. Li H, Gu B, Zhang Y et al. Hypoxia-induced increase in soluble Flt-1 production correlates with enhanced oxidative stress in trophoblast cells from the human placenta. Placenta 2005; 26: 210–217
12. Semenza GL. Hypoxia-inducible factor 1: master regulator of O2 homeostasis. Curr Opin Genet Dev 1998; 8: 588–594
13. Eremina V, Jefferson JA, Kowalewska J et al. VEGF inhibition and renal thrombotic microangiopathy. N Engl J Med 2008; 358: 1129–1136
14. De Vivo A, Baviera G, Giordano D et al. Endoglin, PlGF and sFlt-1 as markers for predicting pre-eclampsia. Acta Obstet Gynecol Scand 2008; 87: 837–842
15. Levine RJ, Maynard SE, Qian C et al. Circulating angiogenic factors and the risk of preeclampsia. N Engl J Med 2004; 350: 672–683
16. Verlohren S, Galindo A, Schlembach D et al. An automated method for the determination of the sFlt-1/PIGF ratio in the assessment of preeclampsia. Am J Obstet Gynecol 2010; 202: 161 e161–161 e111
Об авторах
Р. P. ТемирбулатовРоссия
Темирбулатов Ринат Рафаилевич, врач-акушер-гинеколог
197022, Санкт-Петербург, ул. Л. Толстого, д. 6–8, корп. 4. Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова, кафедра акушерства, гинекологии и неонатологии.
Тел.: 8(931)223-40-93
В. Ф. Беженарь
Россия
Проф. Беженарь Виталий Фёдорович, д-р мед. наук
197022, Санкт-Петербург, ул. Л. Толстого, д. 6–8, корп. 4. Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова, руководитель клиники акушерства и гинекологии, заведующий кафедрами акушерства, гинекологии и неонатологии; акушерства, гинекологии и репродуктологии.
Тел.: (812)338-67-15
A. В. Смирнов
Россия
Проф. Смирнов Алексей Владимирович, д-р мед. наук
197022, Санкт-Петербург, ул. Льва Толстого, д. 17. Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова, директор НИИ нефрологии, заведующий кафедрой пропедевтики внутренних болезней с клиникой.
Тел.: (812)338-69-01
Рецензия
Для цитирования:
Темирбулатов Р.P., Беженарь В.Ф., Смирнов A.В. ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ПРЕЭКЛАМПСИИ У ПАЦИЕНТОК С ХРОНИЧЕСКОЙ БОЛЕЗНЬЮ ПОЧЕК. Нефрология. 2019;23(1):45-50. https://doi.org/10.24884/1561-6274-2019-23-1-45-50
For citation:
Temirbulatov R.R., Bezhenar V.F., Smirnov A.V. DIFFERENTIAL DIAGNOSTICS OF PREECLAMPSIA IN PATIENTS WITH CHRONIC KIDNEY DISEASE. Nephrology (Saint-Petersburg). 2019;23(1):45-50. (In Russ.) https://doi.org/10.24884/1561-6274-2019-23-1-45-50








































