Перейти к:
ХРОНИЧЕСКАЯ БОЛЕЗНЬ ПОЧЕК И АРИТМИИ: ИТОГИ КОНФЕРЕНЦИИ KDIGO ПО СПОРНЫМ ВОПРОСАМ
https://doi.org/10.24884/1561-6274-2019-23-2-18-40
Аннотация
Пациенты, страдающие хронической болезнью почек (ХБП), имеют предрасположенность к развитию таких нарушений ритма, как фибрилляция предсердий (ФП)/ трепетание предсердий, наджелудочковая тахикардия и внезапная сердечная смерть (ВСС). Несмотря на то, что существуют разнообразные терапевтические возможности, включая лекарственное лечение, использование приборов и применение других мероприятий, их использование при ХБП остается затруднительным и ограниченным. Пациентов с ХБП, в том числе с терминальной почечной недостаточностью, обычно не включают в рандомизированные исследования по лечебным стратегиям при аритмиях, хотя эта ситуация в настоящее время претерпевает изменения. Консенсус сердечно-сосудистого общества кардиологов не так давно выявил этот пробел в лечении пациентов с ХБП и нарушениями сердечного ритма. С целью установления основных аспектов, относящихся к наилучшему предотвращению, оптимальному ведению таких больных и лечению аритмий и их осложнений, группа Kidney Disease: Improving Global Outcomes (KDIGO) провела международную мультидисциплинарную конференцию «ХБП и аритмии» в Берлине, Германия, в октябре 2016 г.
Ключевые слова
Для цитирования:
Турахия М.П., Бланкештин П.Д., Карреро Х., Клазе К.М., Део Р., Герцог Ч.А., Каснер С.Е., Пассам Р.С., Пекуа-Фийо Р., Райнеке Х., Шрофф Г.Р., Зареба В., Чеунг М., Вилер Д.К., Ваннер К., Винкельмайер В.К. ХРОНИЧЕСКАЯ БОЛЕЗНЬ ПОЧЕК И АРИТМИИ: ИТОГИ КОНФЕРЕНЦИИ KDIGO ПО СПОРНЫМ ВОПРОСАМ. Нефрология. 2019;23(2):18-40. https://doi.org/10.24884/1561-6274-2019-23-2-18-40
For citation:
Turakhia M.P., Blankestijn P.J., Carrero J., Clase C.M., Deo R., Herzog Ch.A., Kasner S.E., Passman R.S., Pecoits-Filho R., Reinecke H., Shrof G.R., Zareba W., Cheung M., Wheeler D.C., Wanner Ch., Winkelmayer W.C. CHRONIC KIDNEY DISEASE AND ARRHYTHMIAS: CONCLUSIONS FROM A KIDNEY DISEASE: IMPROVING GLOBAL OUTCOMES (KDIGO) CONTROVERSIES CONFERENCE. Nephrology (Saint-Petersburg). 2019;23(2):18-40. (In Russ.) https://doi.org/10.24884/1561-6274-2019-23-2-18-40
ВВЕДЕНИЕ
Пациенты, страдающие хронической болезнью почек (ХБП), имеют предрасположенность к развитию таких нарушений ритма, как фибрилляция предсердий (ФП)/ трепетание предсердий, наджелудочковая тахикардия и внезапная сердечная смерть (ВСС). Несмотря на то, что существуют разнообразные терапевтические возможности, включая лекарственное лечение, использование приборов и применение других мероприятий при ХБП остается затруднительным и ограниченным. Пациентов с ХБП, в том числе с терминальной почечной недостаточностью (тПН), обычно не включают в рандомизированные исследования по лечебным стратегиям при аритмиях [1], хотя эта ситуация в настоящее время претерпевает изменения [2]. Консенсус сердечно-сосудистого общества кардиологов не так давно выявил этот пробел в лечении пациентов с ХБП и нарушениями сердечного ритма [3-7].
С целью установления основных аспектов, относящихся к наилучшему предотвращению, оптимальному ведению таких больных и лечению аритмий и их осложнений, группа Kidney Disease: Improving Global Outcomes (KDIGO) провела международную мультидисциплинарную конференцию «ХБП и аритмии» в Берлине, Германия, в октябре 2016 г. Программа конференции и перечень обсужденных вопросов доступны на сайте KDIGO (http://kdigo.org/conferences/ckd-arrhythmias/; 13 February 2018).
ФИБРИЛЛЯЦИЯ ПРЕДСЕРДИЙ И ОСТРОЕ НАРУШЕНИЕ МОЗГОВОГО КРОВООБРАЩЕНИЯ У ПАЦИЕНТОВ С ХБП
Эпидемиология
ФП является наиболее частой формой постоянного нарушения ритма [8]. ХБП страдают около 10 % взрослого населения во всем мире [9], и у таких пациентов более часто развивается ФП. Распространенность ФП высокая: установленный диапазон составляет от 16 до 21 % при додиализ- ных стадиях ХБП [10-12] и от 15 до 40 % у пациентов на диализе [13-18]. ХБП и ФП имеют много общих факторов риска, что затрудняет оценку вклада какого-либо фактора в развитие заболевания или его связи с прогнозом (рис. 1). Наличие додиализной стадии ХБП независимо ассоциировано с риском ФП [19-25], хотя эта связь не так хорошо исследована в аспекте уровня расчетной скорости клубочковой фильтрации (рСКФ) или протеинурии [13, 14, 26, 27]. В США среди пациентов, получающих диализ, возрастает как частота, так и распространенность ФП [27, 28], что может быть связано с большим возрастом пациентов, лучшей диагностикой ФП и улучшением выживаемости после сердечно-сосудистых событий.
Последствия ФП при ХБП
Риск острого нарушения мозгового кровообращения (ОНМК) повышен как при додиализной стадии ХБП [29-32], так и при диализе [29, 31, 33]. По отдельности и ХБП, и ФП являются факторами риска ОНМК, но на текущий момент неизвестно, независимо или взаимозависимо прогностическое значение маркеров ХБП и ФП. Связь между ФП и ХБП может быть двунаправленной, так как ФП является предиктором начала снижения СКФ и протеинурии [21]. Скорректированное отношение рисков ОНМК при ФП значительно варьирует от 4,2 у женщин в общей популяции ХБП [34], 1,3 у диализных больных [33, 35] и до слабо значимых (1,4) [36] и незначимых [37] связей после трансплантации почки. Такие различия могут происходить в результате выраженных конкурирующих рисков смерти при тяжелых стадиях ХБП [35], что выше, чем базовый риск ОНМК при ХБП без ФП или выше распространенность не диагностированной ФП.
При ФП повышен риск развития ХБП и ее прогрессии до терминальной стадии [21, 38-40], а также риск смерти независимо от стадии заболевания [13, 35, 41, 42]. Риск других исходов, связанных с ФП, включая сердечную недостаточность, ВСС и инфаркт миокарда (ИМ), требует дальнейшего изучения, как и вклад ФП в развитие ОНМК и его подтипов при ХБП. Конкурирующий риск смерти при ХБП может снижать вклад ФП в развитие ОНМК, что, в свою очередь, может уменьшать эффективность некоторых стратегий по предотвращению инсульта [35].
Шкалы риска ОНМК
Прогностическая ценность и проверка шкал оценки риска инсульта CHADS2 и CHA2DS2-VASc были изучены только у диализных больных, у которых эти показатели были такими же, как и в общей популяции [16, 33, 43, 44].
При включении ХБП в шкалы рисков с целью улучшения предикции ОНМК были продемонстрированы различные результаты. Добавление двух баллов при клиренсе креатинина <60 мл/мин к шкале CHADS2 (R2CHADS2) улучшило индекс реклассификации (Net Reclassification Index, ИР), но не С-индекс (ROC-анализ) по данным одного крупного исследования, где применяли внешнюю валидизацию [30]. Однако влияния на ОИР или С-индекс в других исследованиях показано не было [45, 46].
Шкала ATRIA, включающая СКФ <45 мл/ мин/1,73 м2 и протеинурию, демонстрировала улучшенный ИР и пограничное улучшение С-индекса при сравнении с CHADS2 и CHA2DS2- VASc при внешней валидизации [47], хотя ИР мог не иметь клинического значения [48]. В связи с этими обстоятельствами и целью определения необходимости назначения пероральных антикоагулянтов (ОАК) для большинства пациентов с ХБП без учета конкурирующих рисков шкала CHA2DS2-VASc остается наиболее часто рекомендуемой для стратификации риска [5, 49], а обсервационные исследования показывают, что назначение ОАК при сумме баллов по этой шкале >2 ассоциировано с благоприятными эффектами даже при ХБП [50].
Шкалы риска кровотечения Такие шкалы риска кровотечения, как HAS- BLED, ORBIT, Hemorr2HAGES и ATRIA, учитывают наличие ХБП. Несмотря на то, что использование этих шкал риска кровотечения не рекомендовано большинством руководств, разработанных профессиональным сообществом [49, 51], повышенный риск кровотечения при применении ОАК и без при ХБП хорошо известен и должен быть учтен при принятии клинического решения.
ПРЕДУПРЕЖДЕНИЕ ИНСУЛЬТА И ПРИМЕНЕНИЕ ПЕРОРАЛЬНЫХ АНТИКОАГУЛЯНТОВ
Патофизиологические механизмы инсульта/ тромбоэмболии у пациентов с ХБП и ФП многофакторны и малопонятны; точный вклад кардио- эмболических против не кардиоэмболических факторов не ясен. ФП может быть непосредственной причиной кардиоэмболического инсульта, как и маркером риска ишемического инсульта, включая его атеротромботические подтипы, а в редких случаях последствием инсульта [52].
Пациенты с ХБП и расчетным клиренсом креатинина 30-50 мл/мин
По результатам основных рандомизированных контролируемых исследований (РКИ) было установлено, что прямые оральные антикоагулянты (ПОАК) по эффекту сопоставимы с варфарином у пациентов с расчетным по Кокрофту-Голту клиренсом креатинина (рКК) 30-50 мл/мин (для апиксабана 25-50 мл/мин) [53-56]. Однако в отношении преимуществ применения какого-то конкретного ПОАК в этой популяции доказательной базы недостаточно, так как отсутствуют прямые сравнительные исследования по изучению отдельных ПОАК [57-62] (табл. 1). Непрямое сравнение затруднительно, поскольку эти исследования различаются по критериям включения и определению исходов.
Несмотря на эффективность в предотвращении инсульта и системной эмболии, не уступаю- щию варфарину, профиль безопасности ПОАК не лучше, чем у варфарина. Во всех основных РКИ ПОАК были ассоциированы со значительным снижением (около 50 %) риска внутричерепного кровоизлияния по сравнению с варфарином. У пациентов с рКК между 25 и 50 мл/мин применение апиксабана и эдоксабана привело к значительному снижению числа эпизодов массивных кровотечений при сравнении с варфарином (рис. 2). Хотя эти наблюдения неопровержимо не говорят о превосходстве апиксабана и эдоксабана над другими ПОАК, они могут оказаться полезными для клиницистов при лечении пациентов с высоким риском кровотечения или коротким периодом нахождения МНО в терапевтическом диапазоне при применении варфарина или других антагонистов витамина К (АВК).
Таблица 1 / Table 1
Данные рандомизированных клинических исследований по терапевтическому применению антикоагулянтов на основании функции почек [4, 63, 64]
Evidence from randomized trial data regarding therapeutic anticoagulation on the basis of kidney function [4, 63, 64]
рКК (мл/мин) а | Варфарин | Апиксабан* | Дабигатран | Эдоксабан** | Ривароксабан |
>95 | Коррекция дозы (целевое МНО 2-3) | 5 мг 2 р/д | 150 мг 2 р/д | 60 мг 1 р/д*** | 20 мг 1 р/д |
51-95 | Коррекция дозы (целевое МНО 2-3) | 5 мг 2 р/д | 150 мг 2 р/д | 60 мг 1 р/д | 20 мг 1 р/д |
31-50 | Коррекция дозы (целевое МНО 2-3) | 5 мг 2 р/д (рКК 25-50 мл/мин) | 150 мг 2 р/д или 110 мг 2 р/д**** | 30 мг 1 р/д | 15 мг 1 р/д |
Примечание. МНО - международное нормализированное отношение; рКК - расчетный клиренс креатинина по Кокрофту-Голту. * Снижение дозы апиксабана с 5 мг 2 р/д до 2,5 мг 2 р/д, если пациент имеет любые два фактора из следующих: креатинин сыворотки >1,5 мг/дл, возраст >80 лет, масса тела < 60 кг. ** В исследовании ENGAGE-AF TIMI 48 доза была уменьшена вдвое в случае наличия одного из следующих: рКК 30-50 мл/мин, масса тела < 60 кг, сопутствующий прием верапамила или хинидина (потенциальный ингибитор Р-гликопротеина). *** Эта доза не была одобрена Управлением по контролю за продуктами и лекарствами США (US Food and Drug Administration) для такого уровня функции почек. **** В странах, где одобрена доза 110 мг 2 р/д, клиницисты могли предпочесть эту дозу после клинической оценки риска тромбоэмболии против кровотечения. Эта доза не была одобрена Управлением по контролю за продуктами и лекарствами США (US Food and Drug Administration).
Хроническая болезнь почек С4, С5 и С5Д стадий
При отсутствии данных клинических исследований результаты обсервационных наблюдений по эффективности и безопасности антикоагулянтов для профилактики ОНМК у пациентов с ХБП не на диализе и рКК < 30 мл/мин противоречивы в отношении пациентов с ХБПС5Д (табл. 2) [65]. На настоящий момент недостаточно высококачественной доказательной базы, позволяющей рекомендовать варфарин или другие АВК для профилактики инсульта при ХБП С5Д и ФП, особенно, если есть значительный риск кровотечения, выраженная сосудистая кальцификация и кальцифицирующая уремическая артериопатия, ассоциированная с терапией АВК [66]. Совокупный мета-анализ 56146 пациентов с ХБП С5Д и ФП в 20 обсервационных когортных исследованиях продемонстрировал учащение эпизодов, ассоциированных с АВК кровотечений по любой причине без преимущества в отношении снижения ОНМК или ишемического инсульта, произошедших в результате любой причины [65]. При этом хорошо выполненный обсервационный анализ пациентов с ИМ и ФП из регистра SWEDENHEART (2003-2010) выявил, что терапия АВК была ассоциирована со снижением риска комбинированных причин смерти, ИМ, ишемического инсульта при отсутствии повышения риска кровотечения у пациентов с ХБП [67]. Длинный период нахождения МНО в терапевтическом диапазоне в Швеции (>75 %) скорее способствовал получению этих результатов, являясь достаточно трудным для воспроизведения в другой популяции больных [68]. Крупный анализ базы данных системы здравоохранения США показал, что тяжесть ХБП ассоциирована со снижением периода нахождения МНО в терапевтическом диапазоне, несмотря на такую же частоту мониторирования МНО [69]. Эти данные предполагают, что период нахождения МНО в терапевтическом диапазоне при ХБП скорее снижен, что может обусловливать повышенный риск инсульта и кровотечения [70]. АВК могут привести к ХБП в результате повторяющихся субклинических гломерулярных кровоизлияний [71] или ускорения кальцификации тканей и сосудов [72].
Таблица 2 / Table 2
Категории хронической болезни почек, не представленные в рандомизированных клинических исследованиях по применению антикоагулянтов [4, 63, 64]
Chronic kidney disease categories lacking randomized clinical trial data on the utility of anticoagulation [4, 63, 64]
рКК, мл/мин* | Варфарин | Апиксабан** | Дабигатран | Эдоксабан | Ривароксабан |
|---|---|---|---|---|---|
15-30 | Может обсуждаться доза, скорректированная по целевому уровню МНО 2,0-3,0 | Может обсуждаться доза 2,5 мг 2 р/д перорально | Неизвестно (75 мг 2 р/д перорально) ***, **** | Может обсуждаться доза 30 мг 1 р/д***** | Может обсуждаться доза 15 мг 1 р/д |
<15 не на диализе | Эквивалентная доза на основании обсервационных наблюдений и мета-анализа | Неизвестно (2,5 мг 2 р/д перорально)*** | Не рекомендовано | Не рекомендовано | Неизвестно (15 мг 1 р/д)*** |
<15 на диализе | Эквивалентная доза на основании обсервационных наблюдений и мета-анализа | Неизвестно (2,5 мг 2 р/д перорально)*** | Не рекомендовано | Не рекомендовано | Неизвестно (15 мг 1 р/д)*** |
Примечание. МНО - международное нормализированное отношение. Дозы ПОАК рассчитаны только на основании ограниченных данных фармакокинетики и фармакодинамики (нет рандомизированных данных по эффективности и безопасности).
* Расчетный клиренс креатинина по Кокрофту-Голту; ** снижение дозы апиксабана с 5 мг 2 р/д до 2,5 мг 2 р/д, если пациент имеет любые два фактора из следующих: креатинин сыворотки >1,5 мг/дл, возраст >80 лет, масса тела < 60 кг; *** перечисленные в скобках дозы ПОАК, для которых на текущий момент нет данных по клиническим безопасности и эффективности. Дозы ПОАК - апиксабан 5 мг 2 р/д, ривароксабан 15 мг 1 р/д и дабигатран 75 мг 2 р/д включены в одобренный перечень Управления по контролю за продуктами и лекарствами США на основании данных по фармакокинетики и фармакодинамики ограниченной дозы без сведений в отношении клинической безопасности. Мы предлагаем применять апиксабана в сниженной дозе 2,5 мг перорально 2 р/д при ХБП С5/С5Д с целью снижения риска кровотечения до получения данных по клинической безопасности. **** Дабигатран в дозе 75 мг доступен только в США; ***** доза была уменьшена вдвое в случае наличия одного из следующих: рКК 30-50 мл/мин, масса тела < 60 кг, сопутствующий прием верапамила или хинидина (потенциальный ингибитор Р-гликопротеина).
Управление по контролю за продуктами и лекарствами США недавно одобрило применение дозы апиксабана 5 мг дважды в сутки (с модификацией дозы при необходимости) и ривароксаба- на 15 мг ежедневно при ХБП С5 и С5Д (а также дабигатран 75 мг перорально дважды в день при рКК 15-30 мл/мин) в соответствующем перечне на основании единственных/ ограниченных данных по фармакокинетики и фармакодинамики без сведений по клинической безопасности [73-76]. Участники конференции предлагают применять апиксабан в сниженной дозе 2,5 мг перорально 2 р/д при ХБП С5/С5Д с целью снижения риска кровотечения до получения данных по клинической безопасности, поскольку такой подход был подкреплен данными недавнего исследования фармакокинетики, сравнивающего две дозировки [77]. Учитывая, что много пациентов с ХБП в любом случае (если возраст ≥ 80 лет или масса тела ≤ 60 кг) будут квалифицированы в группы с редуцированной дозой апиксабана 2,5 мг перорально дважды в день, принимали во внимание принцип «не навреди» при отсутствии данных по клинической эффективности и безопасности (см. табл. 2). Для оценки применения АВК у пациентов с ХБП С5Д необходимо проведение РКИ. Планируется клиническое исследование по сравнению АВК и не пероральных антикоагулянтов (AVKDI- AL, NCT02886962). Неизвестно, имеют ли ПОАК какие-либо преимущества по сравнению с АВК у пациентов с ХБП С5Д и ФП. Сейчас проходит набор пациентов в Германии и США в исследования апиксабана против АВК при терминальной стадии ХБП (AXADIA (NCT02933697), RENAL-AF (NCT02942407)).
Практические соображения по применению антикоагулянтов при ХБП
В основных РКИ критерии включения и выбор доз ПОАК были основаны на функции почек, определенной по рКК (Кокрофт-Голт). Однако в клинической практике применяют другие методы измерения, например, рСКФ. Учитывая разные методы определения расчетной функции почек, индивидуализация дозы ПОАК, основанная на ином методе, оправдана [78-80]. Важные вопросы безопасности, в основном повышение фатальных и нефатальных кровотечений, появились после назначения дабигатрана и ривароксабана «off- label» у пациентов с ХБП С5Д [81-83]. Недавнее исследование 1473 пациентов с ФП и почечными показаниями для редукции дозы показало, что в 43 % случаев имела место потенциальная передозировка ПОАК, приводящая к более высокому риску кровотечения [84]. Эти признаки предполагают необходимость систематических измерений с фокусом на безопасность пациентов для создания клинических рекомендаций в отношении применения ПОАК [85]. Командное мультидисципли- нарное обсуждение с участием нефрологов, кардиологов (или аритмологов), врачей первичного звена и, если возможно, клинических фармакологов может быть полезным для оценки соотношения риск-польза при принятии решения в пользу АВК или ПОАК [5, 85]. У пациентов с ХБП, получающих ПОАК, мы рекомендуем периодическое мониторирование функции почек, поскольку ее снижение может потребовать модификации дозы [86]. Нет данных по оптимальной частоте мониторирования, но клиническим может быть обоснованным измерение функции почек каждые 6-12 мес (или по крайней мере ежегодно в соответствии рекомендациям профессионального сообщества) [5] с более частым мониторированием при необходимости - начале терапии ПОАК, тяжести и особенностей течения ХБП. У всех пациентов, получающих антикоагулянтную терапию, необходимы ежегодная переоценка целей лечения и обсуждение за и против продолжения лечения. Применение ПОАК при оперативных вмешательствах зависит от конкретного препарата и рКК, по поводу чего существуют рекомендации (табл. 3) [4, 87]. Для пациентов с ХБП С5Д, получающих антикоагулянты, стратегии, направленные на снижение кровотечения, требуют систематических исследований, но могут включать минимизацию гепарина при диализе, использование цитратной катетерной заглушки [88], мероприятия по профилактике желудочно-кишечного кровотечения в случае клинической необходимости, строгий контроль артериального давления и прекращение сопутствующей антитромбоцитарной терапии.
Протоколы по отмене антикоагулянтов достаточно полно разработаны для варфарина и АВК. Идацизумаб одобрен для купирования действия дабигатрана, а андексанет альфа разрабатывается как антидот для анти-Xa агентов. Данные по подобному применению этих препаратов у пациентов с ХБП ограничены [89].
Таблица 3 / Table 3
Рекомендации по прекращению приема прямых пероральных антикоагулянтов до хирургического вмешательства, основанные на риске кровотечения при определенной процедуре (низкий риск кровотечения при процедуре против высокого)
Recommendations for discontinuation of direct oral anticoagulant prior to elective procedures, according to the risk of bleeding of any specific procedure intervention (low vs. high risk procedures)
Показатель | Дабигатран | Апиксабан - Эдоксан - Ривароксабан | ||
|---|---|---|---|---|
Незначительный риск кровотечения и/или есть возможность адекватного местного гемостаза: выполнение манипуляции при минимальном уровне препарата (т.е. > 12 или 24 ч после последнего приема) | ||||
низкий риск, ч | высокий риск, ч | низкий риск, ч | высокий риск, ч | |
КК > 80 мл/мин | ≥24 | ≥48 | ≥24 | ≥48 |
КК 50-80 мл/мин | ≥36 | ≥72 | >24 | ≥48 |
КК 30-50 мл/мин* | ≥48 | ≥96 | ≥24 | ≥48 |
CrCl 15-30 мл/мин* | Нет официальных показаний к назначению | ≥36 | ≥48 | |
CrCl < 15 мл/мин | Нет официальных показаний к назначению | |||
| Нет необходимости для низкомолекулярного гепарина и нефракционированного гепарина | |||
Примечание. Данные значения отличны от общепринятых правил прекращения приема препаратов - при низком риске за 24 ч, при высоком риске - за 48 ч. Низкий риск - низкая частота кровотечения и/или минимальная выраженность кровотечения. Высокий риск - высокая частота кровотечения и/или клинически значимое кровотечение. Адаптировано по Heidbuchel et al.[4] КК - клиренс креатинина. * Многие из таких пациентов могут быть на низкой дозе дабигатрана (110 мг 2 р/д) или апиксабана (2,5 мг 2 р/д), или вынуждены принимать небольшую дозу ривароксабана (15 мг 1 р/д), или эдоксабана (30 мг 1 р/д). Дабига- тран 110 мг 2 р/д не одобрен Управлением по контролю за продуктами и лекарствами США.
Антиагрегантная терапия для профилактики инсульта при фибрилляции предсердий при ХБП
В общей популяции больных без ХБП исследование AVERROES по изучению аспирина против апиксабана было прекращено в связи с высоким риском ОНМК при приеме аспирина и одинаковым риском кровотечения в обеих группах [90]. Однако доказательной базы для того, чтобы рекомендовать одинарную или двойную антиагре- гантную терапию для предотвращения инсульта/ тромбоэмболии при ФП среди пациентов с ХБП С4, С5 и С5Д, нет. Также эти пациенты не должны принимать сопутствующую терапию антикоагулянтами до появления определенных показаний (например стентирование коронарной артерии). Продолжительность сопутствующей одинарной или двойной антиагрегантной терапии у больных, получающих антикоагулянты, необходимо минимизировать и индивидуализировать на основании клинических факторов и типа стента [91].
Окклюзия ушка левого предсердия при ХБП
Ушко левого предсердия считается местом формирования тромбов при большинстве кардио- эмболических инсультах, ассоциированных с ФП. Выключение ушка из кровотока является нефармакологическим методом профилактики ОНМК, что может быть методом выбора при среднем- высоком риске инсульта у пациентов с ХБП, в частности имеющих противопоказания к длительному приему ПОАК. Пятилетние данные двух рандомизированных исследований Watchman* демонстрируют, что окклюзия ушка левого предсердия приводит к уменьшению риска инсульта, сравнимого с варфарином, но дополнительно снижает риск значимых кровотечений [92]. Однако распространенность и тяжесть ХБП не обозначены в исследовании, в связи с чем данные могут быть недостаточно презентативны. Большинство пациентов, получивших такое лечение, в исследовании и практике продолжают принимать двойную или одинарную антиагрегантную терапию, что может быть ассоциировано с более высоким риском кровотечения при ХБП. Более того, пациенты не имели противопоказаний и тем не менее были включены. Данные по другому похожему прибору для окклюзии Amplatzer Cardiac Plug показали при ХБП и нормальной функции почек сравнимую безопасность [93]. В настоящее время продолжается рандомизированное исследование по окклюзии ушка против АВК при ХБП С4 и 5 (https://clinicaltrials.gov/ct2/show/NCT02039167; 13 February 2018).
КОНТРОЛЬ ЧАСТОТЫ СЕРДЕЧНЫХ СОКРАЩЕНИЙ ПРОТИВ КОНТРОЛЯ СИНУСОВОГО РИТМА ПРИ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ
Показания по контролю ритма у пациентов с ХБП схожи с таковыми у пациентов в общей популяции. Главным показанием для контроля ритма, имеющем доказательную базу, является уменьшение выраженности симптомов, хотя многие пациенты их не имеют [5, 49]. Старые рандомизированные исследования демонстрировали, что контроль ритма и частоты эквивалентен эффекту по снижению рисков развития сердечной недостаточности, инсульта и выживаемости [94-97]. Ретроспективные анализы предполагали, что контроль ритма с помощью аблации обеспечивает наилучший исход, но доказательства ограничены. Вне зависимости от того, какая стратегия избрана, антикоагулянты должны быть продолжены на основании риска ОНМК (согласно шкалам CHADS2 или CHA2DS2-VASc) до появления противопоказаний. Другие факторы, которые могут влиять на контроль ритма, - трудности в достижении адекватной частоты, более молодой возраст, кардиомиопатия, ассоциированная с тахикардией, первый эпизод ФП, ФП, развившаяся на фоне острого заболевания или после хирургического вмешательства и предпочтения пациента (рис. 3) [5, 49]. У диализных пациентов, имеющих нестабильность гемодинамики вследствие ФП в течение процедуры гемодиализа, контроль ритма может оказать положительное действие. Влияние такого лечения на исход неизвестно [98]. У пациентов без четких показаний к контролю ритма необходимо применять контроль частоты. В общей популяции у пациентов с персистирующей формой ФП и сохранной фракцией выброса левого желудочка (ФВ ЛЖ) гибкий контроль частоты (т.е. ЧСС в покое менее 110 уд/мин) эквивалентен строгому контролю частоты, учитывая комбинированные конечные точки, включая инсульт, сердечную недостаточность и смерть, а также необходимость постановки ЭКС или кардиовертера- дефибриллятора (КВД) [99].
Таблица 4 / Table 4
Характеристика антиаритмиков для контроля частоты при ХБП (модифицировано по Potpara et al. [101] и Weir et al. [102])
Characteristics of antiarrhythmic drugs for rate control in chronic kidney disease
Препарат | Связывание с белком,% | Выделение | Выведение при гемодиализе | Доза при ХБП |
|---|---|---|---|---|
Атенолол | 5 | Выделяется с мочой в неизмененном виде | Да | Может потребоваться уменьшение дозы |
Пропранолол | >90 | Метаболизм в печени | Нет | Креатинин сыворотки может повышаться, но коррекция дозы не требуется |
Бисопролол | 30 | 50 % выделяется в неизмененном виде почками | Нет | Может потребоваться снижение дозы при выраженных стадиях ХБП |
Метопролол | 12 | Метаболизм в печени | Да | Снижение дозы не нужно |
Карведилол | 99 | В основном с желчью, 16 % с мочой | Нет | Особые рекомендации по коррекции дозы при поражении почек отсутствуют; считается, что нет необходимости снижать дозу |
Лабеталол | 50 | Неактивные метаболиты выделяются с мочой (5 % в неизмененном виде) и желчью | Нет | Снижение дозы рекомендовано у пожилых пациентов |
Верапамил | 90 | 70 % выделяется с мочой и 16 % с калом | Нет | Снижени дозы на 20-25 % при КК < 10 мл/ мин, не выводится при диализе |
Дилтиазем | 70-80 | 2-4 % неизмененного вещества выделяется с мочой | Нет | Применять с осторожностью |
Дигоксин | 20-30 | Основной путь элиминации через почки (строго коррелирует с СКФ), не почечный путь - только 25-28 % | Нет | Требуются коррекция дозы и монитори- рование уровня дигоксина в сыворотке |
Примечание. Данные по элиминации метопролола по Hoffman et al. [103]. Данные по связыванию лабеталола с белком - по Drugbank.ca [104], данные (in vitro) по выведению при диализе - по Daheb et al. [105]. Все остальные данные по выведению препаратов при диализе - по Frishman [106]. ХБП - хроническая болезнь почек; КК - клиренс креатинина; СКФ - скорость клубочковой фильтрации.

Рис. 1. Связь между ХБП и ФП: общие факторы риска и исходы. ХБП и ФП разделяют многие факторы риска и сопутствующие состояния, которые определяют их распространенность, вероятно, за счет реализации единых системных процессов, например, воспаления, оксидативного стресса или фиброза. Установлено, что ХБП увеличивает частоту ФП, и есть также данные, позволяющие предполагать, что ФП увеличивает темпы прогрессии ХБП. При изучении силы этих связей мы не можем не учитывать потенциальное влияние системной ошибки, связанной с оценкой исходов, имеющей место при обсервационных исследованиях, когда более частое обращение за медицинской помощью в данной коморбидной популяции скорее будет способствовать диагностике этих клинических состояний.
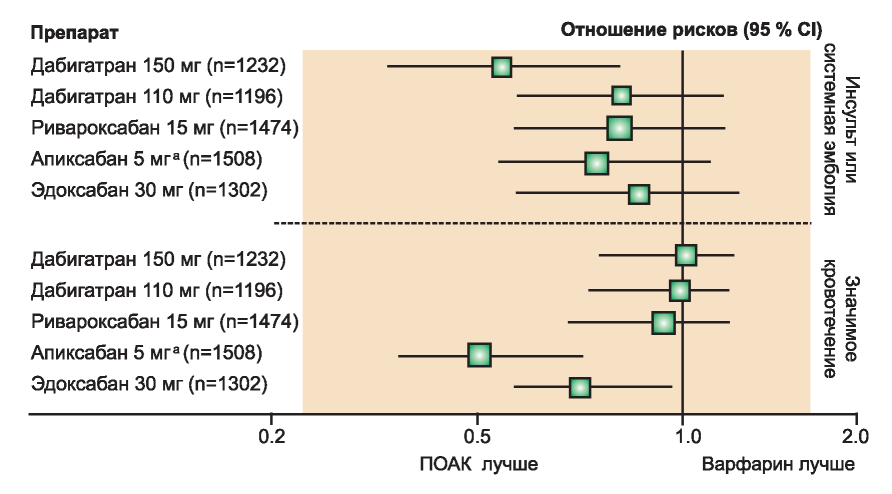
Рис. 2. Эффективность и безопасность прямых пероральных антикоагулянтов (ПОАК) против варфарина в подгруппе больных с умеренной хронической болезнью почек (ХБП) по данным рандомизированного контролируемого исследования по фибрилляции предсердий. Сравнение отношения рисков и 95% доверительный интервал для первичных конечных точек по эффективности и безопасности для 150 мг и 110 мг дабигатрана 2 раза/сут, 15 мг ривароксабана 1 раз/сут, 5 мг апиксабана 2 раза/сут и 30 мг эдоксабана 1 раз/сут. ХБП определяли как расчетный клиренс креатинина от 30 до 49 мл/мин или от 25 до 49 мл/мин для апиксабана.
а Апиксабан 2,5 мг 2 раза в день в случае наличия любых двух факторов из следующих: креатинин сыворотки >1,5 мг/дл, возраст >80 лет, масса тела < 60 кг. Опубликовано по данным Qamar and Bhatt [63] с разрешения издателя.
Figure 2. Efficacy and safety of direct oral anticoagulants (DOACs) vs. warfarin in the subgroup of patients with moderate chronic kidney disease from randomized controlled trials in atrial fibrillation. Comparison of hazard ratios and 95% confidence intervals for primary efficacy and safety outcomes for 150 and 110mg dabigatran twice daily, 15mg rivaroxaban once daily, 5 mg apixaban twice daily, and 30mg edoxaban once daily. Chronic kidney disease was defined as estimated creatinine clearance of 30 to 49mL/min or as 25 to 49mL/ min for apixaban.
a Apixaban 2.5mgt wice daily if patient had any two of the following: age > 80 years, body weight < 60 kg, or serum creatinine >1.5mg/ dL. Reproduced from Qamar and Bhatt [63] with permission from the publisher
Рандомизированных клинических исследований, которые бы прицельно сравнивали контроль частоты против контроля ритма или гибкого контроля частоты у пациентов с ХБП и терминальной стадией почечной недостаточности, нет. При ретроспективном анализе исследования GUSTO III было продемонстрировано, что стратегии, направленные на контроль ритма или частоты, не оказывали значимого влияния на ближайший и отдаленной прогноз в отношении смертности вне зависимости от статуса болезни почек [100].
Основания для контроля частоты сердечных сокращений
Особые основания при ХБП включают наличие симптомов и потенциальную возможность развития кардиомиопатии, ассоциированной с тахикардией, с ведущим значением именно структурного поражения сердца. Более того, фармакокинетика и клиренс при гемодиализе препаратов для контроля частоты при ХБП также должны быть учтены (табл. 4). В случае, если только медикаментозная терапия не контролирует частоту сокращения желудочков, должны рассматриваться аблация АВ-соединения и имплантация электрокардиостимулятора (ЭКС). Однако высокая частота осложнений при трансвенозном доступе для ЭКС у больных на гемодиализе должна приниматься во внимание при принятии решения [107]. Можно ли использовать беспроводной ЭКС в подобной ситуации, необходимо исследовать.
Основания для контроля синусового ритма
Кардиоверсия постоянным током (КВПТ) - наиболее частый метод восстановления ритма у пациентов с персистирующей формой ФП. Эффективность этого метода не зависит от функции почек [108]. Однако риск рецидива ФП выше при сниженной рСКФ, хотя у пациентов с начальной или средней степенью тяжести ХБП, у которых сохраняется синусовый ритм, может наблюдаться улучшение функции почек [109]. Исключительно КВПТ обычно недостаточно для сохранения синусового ритма, в связи с чем необходимы длительный прием антиаритмических препаратов или аблация с целью контроля ритма. Применение антиаритмических препаратов для контроля ритма у пациентов с ХБП ограничено в связи с влиянием почечного клиренса и проаритмических рисков в случае структурного поражения сердца (табл. 5). Амиодарон, наиболее часто применяемый антиа- ритмик для лечения ФП, не влияет негативно на выживаемость вне зависимости от рСКФ, даже при тХБП [111]. Имеется ли более выраженная органная токсичность у пациентов с ХБП на фоне приема амиодарона, остается неизвестным.
Катетерная аблация более эффективна для удержания синусового ритма, чем только антиа- ритмические препараты. Безопасность и эффективность аблации при ХБП была исследована на 21091 больном, из которых 1593 случая (7,6 %) имели ХБП, а 60 человек получали гемодиализ [112]. Среди пациентов, отобранных для аблации при ФП, с ХБП и без имели схожую частоту осложнений, связанных с процедурой, и последующих госпитализаций в связи с ФП, КВПТ, повторной аблации, хотя пациенты с ХБП имели более высокую частоту госпитализации в связи с СН. По данным мета-анализа 4 исследований по радиочастотной абляции и изоляции легочных вен пациенты с ХБП имели почти двукратный риск рецидива ФП, возможно в результате большего объема левого предсердия до аблации, что может являться триггером ФП, локализованным не в легочных венах [113]. При сравнении пациентов с ХБП, подвергшихся криобаллонной аблации, больные с С3 стадией имели более высокий риск рецидива, чем таковые с С1 и С2 [114]. Случаев контраст-индуцированной нефропатии не было. В целом, удержание синусового ритма с помощью аблации ассоциировано с улучшением рСКФ, в то время как неудачная аблация связана со снижением рСКФ [115]. При ФП аблация является потенциально благоприятной в аспекте сниженной ФВ ЛЖ и сердечной недостаточности. Данные недавнего рандомизированного исследования по катетерной аблации в сравнении с обычными методами лечения при ФП и ФВЛЖ < 35 % показали улучшение выживаемости, ассоциированного с аблацией [116, 117] (https://clinicaltrials.gov/ct2/show/NCT00643188; 13 February 2018). В отличие от ФП радиочастотная аблация для контроля ритма при трепетании предсердий должна считаться первой линией терапии у пациентов с ХБП в связи с высокой эффективностью и низкой частотой осложнений. Пациенты с ХБП имеют более высокий риск развития ФП после аблации, выполненной по поводу трепетания предсердий, и могут требовать длительного мониторирования рецидива ФП в случае отмены антикоагулянтов [118].
Таблица 5 / Table 5
Характеристика антиаритмических препаратов для удержания синусового ритма при ХБП (модифицировано по Potpara et al. [101])
Characteristics of antiarrhythmic drugs for maintaining sinus rhythm in chronic kidney disease (modified from Potpara et al. [101])
Препарат | Связывание с белком, % | Выделение | Выведение при гемодиализе | Доза при ХБП | Особенности применения при ХБП |
|---|---|---|---|---|---|
Флекаинид | 40 | 35 % выделяется с мочой в неизмененном виде | Нет | Снижение дозы при рСКФ <35 мил/мин/1,73 м2 | Не применять при выраженном структурном поражении сердца |
Пропафенон | 95 | 38-50 % выделяется с мочой в виде активного метаболита (1 % в неизмененном виде) | Нет | Рекомендуется тщательное мониторирование(при выраженных стадиях ХБП начало лечения в условиях стационара) | Не применять при выраженном структурном поражении сердца |
Амиодарон | 99 | Не выводится почками | Нет | Неттребований по коррекции дозы; не удаляется при диализе; много лекарственных взаимодействий |
|
Дронедарон | 98 | 6 % выделяется почками | Вероятно, нет | При утрате функции почек не требует коррекции дозы | Нельзя применять при ФВ <35 % или недавней декомпенсации СН |
Дофелитид | 60-70 | 80 % выделяется почками как в неизмененном виде (80 %), так и в виде неактивного/ минимально активного метаболита | Неизвестно | Начальная доза индивидуальна и зависит от КК и далее корригируется на основании КК и QT | Противопоказан при КК <20 мл/мин |
Соталол | Не связывается с белком | 70 % выделяется с мочой в неизмененном виде | Да - необходимо назначать прием после диализа или дополнительно назначать 80 мг после сеанса | Относительно противопоказан в связи с проаритми- ческим риском; в редких отдельных случаях приходится снижать дозу наполовину или до % | Относительно противопоказан в связи с проаритмическим риском |
Примечание. СН - сердечная недостаточность; ХБП - хроническая болезнь почек; ФВ - фракция выброса; КК - клиренс креа- тинина; СКФ - скорость клубочковой фильтрации. Данные по выведению пропафенона по Drugbank.ca [110]. Выведение при гемодиализе по Frishman [106].
Дополнительная таблица 5 / Supplemental Table 5
Определение внезапной смерти, внезапной сердечной смерти и купированной остановки сердца у больных с ХБП
Definitions of sudden death, sudden cardiac death, and aborted cardiac arrest in patients with chronic kidney disease
| Внезапная смерть |
| Не обусловленное травмой, неожидаемое освидетельствованное фатальное событие, произошедшее в течение 1 ч от начала симптомов или в течение 24 ч при отсутствии свидетелей (48–72 ч между сеансами гемодиализа в случае, если пациент проживает один) |
| Отсутствие тяжелого острого заболевания (например сепсиса), несоблюдение режима диализа или отсутствие ожидания летального исхода у пациента с тПН. Поэтому пациенты хосписа с терминальной онкологией и проч. должны быть исключены, поскольку в таких случаях смерть ожидаема |
| Внезапная сердечная смерть |
| Определяется, как указано выше, но при отсутствии доказательств в пользу внесердечных причин (цереброваскулярная травма, разрыв аорты, травма и т.д.) |
| Купированная остановка сердца |
| Неожиданная остановка сердечно-сосудистой деятельности, произошедшая в течение 1 ч после начала острых симптомов, которая купирована в результате успешных реанимационных мероприятий (например дефибрилляции) |

Рис. 3. Алгоритм принятия решения по контролю частоты или ритма при ХБП. Особенно в связи с тем, что пациенты ХБП имеют специфические характеристики, включая анамнез, коморбидность и личные предпочтения, в каждом случае должно быть принято индивидуальное решение. Должны быть приняты во внимание многие аспекты: продолжительность ФП, выраженность симптомов, ренальный клиренс (риск токсичности, выведение при диализе) и потенциальные противопоказания для применения антиаритмических препаратов при структурном поражении сердца, что часто встречается у этих больных (такие как гипертрофия левого желудочка, сниженная фракция выброса, коронарная болезнь сердца). Более того, проаритмический эффект (например удлинение QT) может быть более выраженным в результате дизэлектролитемии при ХБП. На рисунке представлен алгоритм, объединяющий наиболее важные критерии, которые должны быть учтены при мультидисциплинарном процессе принятия решения с участием нефролога, аритмолога, а также других специалистов при необходимости. Следует заметить, что, несмотря на то, какая стратегия выбрана, пероральные антикоагулянты должны быть назначены на ранней стадии ХБП и по крайней мере их применение должно быть обсуждено при выраженных стадиях ХБП (см. раздел Профилактика OHMK и пероральные антикоагулянты). ИБС - ишемическая болезнь сердца; ФП - фибрилляция предсердий; ГД - гемодиализ; ЯП - левое предсердие; ГЛЖ - гипертрофия левого желудочка; ФВ - фракция выброса; ХБП - хроническая болезнь почек. Адаптировано по Kirchhofetal. [5].
Дополнительная таблица 6 / Supplemental Table 6
Факторы риска внезапной сердечной смерти у пациентов с терминальной стадией хронической болезни почек
Risk factors for sudden cardiac death in patients with end-stage kidney disease
Немодифицируемые факторы | Модифицируемые факторы |
|---|---|
Возраст Пол Раса Семейный анамнез Генетические факторы Продолжительность нахождения на заместительной почечной терапии ГД (?) | Факторы риска пациента |
Сердечно-сосудистые Ишемическая болезнь сердца, ишемия миокарда Дисфункция левого желудочка Желудочковые аритмии Гипертрофия левого желудочка | |
Почечная недостаточность Плохой контроль уровней паратгормона/ кальция/ фосфора; дефицит витамина D Белково-энергетическая недостаточность Артериальная гипертензия в результате гиперволемии и/или гиперсимпатикотонии Дизрегуляция автономной нервной системы Воспаление Гипокалиемия или гиперкалиемия Ацидоз Гипо- или гиперкальциемия | |
Другие Плохой контроль гликемии при сахарном диабете Явный дефицит основных компонентов питания Некоторые лекарственные препараты Высокий индекс массы тела Малоподвижный образ жизни | |
Связанные с лечением | |
Параметры диализа: высокий объем или скорость ультрафильтрации, перераспределение калия, кальция, бикарбоната и/или магния Некорректная оценка «сухого веса», приводящая к гипер- или гиповолемии |
Модификация образа жизни
Снижение массы тела и физическая активность могут снизить вероятность возникновения ФП в общей популяции больных [119, 120], как и лечение обструктивного ночного апноэ [121, 122]. Пациенты на гемодиализе имеют 4-кратный риск развития нарушений дыхания во сне при сравнении с контрольной группой больных таких же возраста, пола, расы и индекса массы тела [123, 124]. Однако в проведенном исследовании среди пожилых пациентов в США расстройства дыхания во сне не было ассоциировано с ФП [125].
ПРЕДУПРЕЖДЕНИЕ ВНЕЗАПНОЙ СЕРДЕЧНОЙ СМЕРТИ
Заболеваемость и этиология внезапной сердечной смерти при ХБП и тПН
При ХБП риск ВСС повышен [126-132]. ВСС является причиной смерти больных на диализе в 25-29 % случаев и в 30-35 % случаев среди пациентов, которым только начат диализ [133-139]. Последние данные говорят о том, что, несмотря на снижение смертности в связи с любой причиной у пациентов на диализе, частота ВСС остается той же, указывая на возросшую долю больных, умирающих в результате ВСС [140]. Риск смерти в результате любой причины намного выше на диализе (15-20 % в год), чем при сердечной недостаточности или после инфаркта миокарда (3-8 % в год) [140-143]. Риск ВСС в течение 12 мес выше у пациентов на ГД в сравнении с другими популяциями больных (рис. 4): 5-7 % - у больных на ГД, 4 % - при сердечной недостаточности, 1,5-2,7 % - у недиализных пациентов. Заболеваемость у не диализных больных сравнима с таковой у пациентов, перенесших инфаркт миокарда [126, 132, 136, 140, 142-144]. Нефрологи должны быть осведомлены и обучены обсуждать риск и потенциальные терапевтические возможности с пациентами, включая участие в клинических исследованиях.
Имеет место существенный пробел в понимании электрических и гемодинамических механизмов, лежащих в основе ВСС (рис. 5). В ретроспективном исследовании 80 % гемодиализных пациентов, которые использовали носимый КВД, имели остановку сердца, зарегистрированную как желудочковая тахиаритмия (желудочкавая тахикардия или фибрилляция желудочков) в сравнении с 20 % с брадиаритмией [145]. В недавнем исследовании при продолжительном мониториро- вании ЭКГ брадиаритмии и асистолия в большей степени являлись определяющими ВСС при тПН, чем тахиаритмии [146].
Определение внезапной смерти и ВСС при тПН нуждаются в пояснении. Необходимо акцентировать внимание на неожиданной природе смерти для того, чтобы избежать неверной классификации. В дополнительной табл. 5 предложены определения внезапной смерти, ВСС и купированной остановки сердца, характерных для ХБП.
Факторы риска внезапной сердечной смерти у пациентов с ХБП и тПН
Механизмы ВСС при ХБП и терминальной стадии почечной недостаточности объединяют длительно существующие патофизиологические механизмы, которые способствуют аритмогенно- му состоянию и являются триггерами, обусловливающими внезапную аритмию (рис. 6).
Роль ишемии миокарда, электролитов и перераспределения объема с гемодинамической нестабильностью, гипертрофии левого желудочка, его фиброза и дисфункции, а также автономной диз- регуляции и симпатической гиперактивности в механизмах ВСС требуют дальнейшего изучения.
Факторы риска ВСС у диализных пациентов известны (дополнительная табл. 6), и к ВСС обычно приводит их комбинация [136, 147]. Для уточнения специфических факторов необходимы дальнейшие исследования [7]. Поскольку достаточно трудно идентифицировать специфические факторы риска ВСС у пациентов не с тПН, возможно, что будет достаточно только сердечно-сосудистых факторов, ассоциированных со смертью, чтобы определить необходимость жизнеспасающих мероприятий у больных с тПН [148]. В первую очередь следует обратить внимание на изучение модифицируемых факторов риска, на прекращение которых могли бы быть направлены лечебные воздействия (см. дополнительную табл. 6) [147].
Значение модифицируемых биомаркеров (определяемых лабораторно при измерении в крови, моче или слюне) было изучено при стратификации риска ХБП и тПН, но требует дальнейшего уточнения [149]. Тропонины и мозговой натрий- уретический пептид могут иметь дополнительное значение и должны быть исследованы для уточнения их роли для адекватной оценки риска ВСС [150-153]. Крайне мало данных представлено в отношении прогностического значения внезапно детектированной аритмии у пациентов с ХБП, включая терминальную стадию. Диагностика эпизодов неустойчивой желудочковой тахикардии, частых желудочковых экстрасистол, брадиа- ритмий и пауз может быть полезной в выявлении пациентов, имеющих риск ВСС [154]. Продолжающиеся исследования по продолжительному мо- ниторированию ЭКГ с помощью различных приборов (имплантируемый петлевой регистратор ЭКГ и наружные электроды для мониторирования ЭКГ, носимые в течение нескольких дней-недель) вскоре обеспечат данные в отношении частоты возникновения и прогностического значения таких аритмий. Потеря сознания - еще одно важное и нередкое событие у пациентов с ХБП, прогностическое значение которого не до конца понятно [155]. Транзиторная потеря сознания в связи с гиповолемией или гипотензией должно считаться синкопальным состоянием в отношении оценки прогноза и при лечении.
Роль дефибриллятора при первичной и вторичной профилактике внезапной сердечной смерти при тПН
Данные в отношении вторичной профилактики КВД показывают некоторые преимущества такой терапии, но требуют проведения дальнейших исследований с целью оценки отдаленного риска против пользы с учетом конкурирующих рисков смерти [7, 156, 157]. Первичная профилактика КВД показана пациентам с ФВ ЛЖ <35 %, хотя результаты подобного варианта лечения при застойной СН и выраженной ХБП не воодушевляют [158] в связи с высоким риском влияния конкурирующих заболеваний, развития осложнений и смерти. Среди пациентов на диализе около 10-15 % имеют фракцию выброса ЛЖ < 35 % [159, 160], однако, нет данных о большинстве пациентов с ФВ > 35 %. Польза КВД снижается при уменьшении СКФ в аспекте конкурирующих рисков коморбидности и смертности и высокого риска осложнений [129, 161]. Необходимы исследования эффективности подкожного дефибриллятора без внутрисердечных металлических частей, поскольку такой подход может оказаться связан с меньшей частотой осложнений, например инфекций, и их меньшей выраженностью [162]. Носимый КВД может обеспечить защиту на короткий период высокого риска [145]. Также необходимы дальнейшие исследования в отношении ЭКС при брадиаритмиях (включая беспроводной водитель ритма) [146].
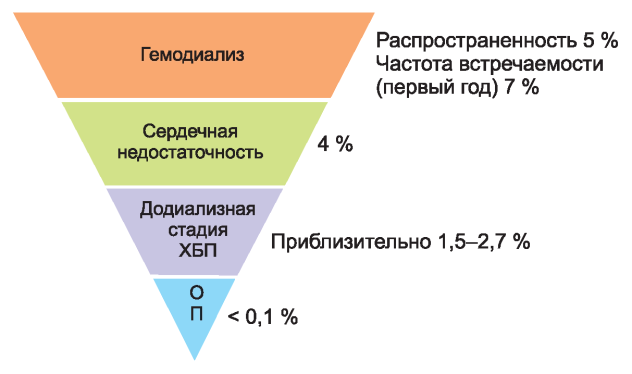
Рис. 4. Годовой уровень внезапной сердечной смерти. ХБП - хроническая болезнь почек; ОП - общая популяция.

Рис. 5. Механизм смерти у пациентов с хронической болезнью почек.
ОБМЕН КАЛИЯ ПРИ ХРОНИЧЕСКОЙ БОЛЕЗНИ ПОЧЕК И НА ДИАЛИЗЕ
Электролитные нарушения и риск сердечнососудистых событий или аритмий
Хотя нет точных доказательств причинной взаимосвязи, обычно все же гипер- или гипокалиемию ассоциируют с более высоким риском общей смертности, в том числе и сердечно-сосудистой смерти у пациентов с тПН. У больных при додиализном уровне калия в крови выше или ниже 5 ммоль/л риск внезапной остановки сердца возрастает [147]. Среди пациентов на гемодиализе наибольшая частота смерти и госпитализации приходится на период сразу после двухдневного междиализного перерыва [163, 164]. Способствующими факторами могут быть накопление большого объема жидкости и последующей массивной ультрафильтрации и изменчивые концентрации калия в сыворотке [165]. Напротив, гипокалиемия - более частое событие у пациентов, получающих перитонеальный диализ, и ассоциирована с повышенным риском смерти в связи со всеми причинами сердечно-сосудистой смерти или инфекций в этой подгруппе больных [166].
Лечебные мероприятия, направленные на улучшение обмена калия
Лечение гиперкалиемии включает ограничение потребления калия с пищей, коррекцию ацидоза, повышение дистальной нагрузки натрием и петлевые диуретики, а в случае гипокалиемии - применение калийсберегающих диуретиков и препаратов калия [167]. Также возможна отмена или снижение дозы препаратов, которые участвуют в обмене калия, например, нестероидных противовоспалительных средств, сульфаметазола- триметоприма, ингибиторов кальциневрина и неселективных бета-блокаторов. Фармакологическое лечение гиперкалиемии включает применение катион-обменных смол (Кайексалат - полистеренсульфонат натрия) [168], Кальциум Резониум [169], калийсвязывающий полимер па- тиромер [170] и «ловушку» калия ZS-9 - циклосиликат циркония натрия [167]. Помимо лечения гиперкалиемии, эти препараты могут также позволять пациентам с ХБП принимать или продолжать рекомендованные в руководствах ингибиторы ренин-ангиотензин-альдостероновой системы (РААС), и этот аспект в настоящее время проходит исследование [167]. Кроме снижения уровня калия, патиромер способен снижать уровень альдостерона в сыворотке у пациентов с ХБП и ги- перкалиемией, принимающих ингибиторы РААС [171]. Другими важными вопросами в отношении калийсвязывающих препаратов остаются аспекты их безопасности и эффективности у пациентов после трансплантации почки, при почечном канальцевом ацидозе IV типа или приеме ингибиторов кальциневрина. Данные трех клинических исследований указывают на то, что двойная блокада РААС повышает риск гиперкалиемии у пациентов с ХБП [172-174]. Результаты мета-анализа говорят о том, что минералокортикоиды могут провоцировать гиперкалиемию у пациентов на диализе, но для большего понимания этих процессов и их клинической значимости необходимы более масштабные исследования [175]. У пациентов с СД тип 2 ингибиторы котранспортера 2 натрия и глюкозы (SGLT2) связаны с небольшими изменениями электролитов сыворотки и в меньшей степени гиперкалиемией в сравнении с плацебо, особенно при одновременном приеме антигипертензивных средств, участвующих в выведении калия [176].

Рис. 6. Потенциальные предрасполагающие факторы внезапной сердечной смерти. ГЛЖ - гипертрофия левого желудочка; ЛЖ - левый желудочек; СН - сердечная недостаточность; ХБП-МКН - минеральные и костные нарушения при ХБП.
Таблица 6 / Table 6
Аритмии и хроническая болезнь почек: текущие пробелы в понимании и рекомендации для будущих научных исследований
Arrhythmias and chronic kidney disease: current knowledge gaps and future research recommendations
• Должна ли ФП быть обязательной вторичной конечной точкой в предстоящих сердечно-сосудистых клинических исследованиях у пациентов с ХБП? Это позволит будущим клиническим исследованиям изучить влияние ФП на различные исходы (например когнитивную дисфункцию) • Можем ли мы улучшить оценку риска у пациентов с ХБП/ХБП С5Д с помощью изучения отдельных факторов риска инсульта (например протеинурии) и кровотечения (например, протеинурия, дисфункция тромбоцитов, сосудистый доступ, антикоагулянты при диализе)? • Основываясь на крупных обсервационных исследованиях, можем ли мы прояснить, какая комбинация факторов риска прогнозирует конкурирующие исходы и конечные точки: ВСС против не ВСС и сердечно-сосудистая смерть против не сердечно-сосудистой смерти при ХБП/ХБП С5Д? • Есть ли модифицируемые факторы риска (например длительное применение омега-3 жирных кислот) или фармакологическая терапия ВСС, достойные исследования? • Каковы частота и прогностическая значимость потери сознания у пациентов на диализе (традиционная или модифицированная процедура), а также транзиторной гипотензии, гиповолемии и брадикардии в ходе и вне диализа? • Имеют ли значение биомаркеры (например, тропонины, натриуретический пептид) и маркеры автономной дизрегуляции и симпатической гиперактивности в предикции сердечной смерти и ВСС? Имеет ли случайно зарегистрированная аритмия прогностическое значение? • Можем ли мы использовать современные визуализирующие методы у пациентов на диализе (например, МРТ сердца с картированием в Т1 режиме или спекл-трекинг эхокардиографию в диализный и не диализный дни), длительное монито- рирование ЭКГ и экстренные биомаркеры для уточнения предрасполагающих факторов ВСС? • Поскольку пациенты с ХБП С5Д имеют постоянно короткое время нахождения в терапевтическом интервале МНО, несмотря на сравнительно более интенсивную частоту мониторирования, что может приводить к более высокому риску кровотечения, каковы доказательства в отношении роли времени нахождения в терапевтическом интервале при принятии решения о назначении ПОАК при субоптимальном значении этого показателя? • Измерение функции почек с помощью рСКФ и КК не равнозначны, что может привести к важным расхождениям в дозировании ПОАК. Участники конференции и Европейское общество кардиологов настаивают на применении рСКФ в будущих исследованиях в связи с установленным преимуществом рСКФ и с целью стандартизации в клинической практике. Для принятия рСКФ в будущих исследованиях мы понимаем, что понадобится предварительное подтверждение от регулирующих органов того, что рСКФ является предпочтительным методом расчета функции почек • Должно ли предприниматься неоднократное измерение функции почек для оценки того, ассоциированы ли антикоагулянты с изменениями функции почек? • Влияет ли применение гепарина в ходе диализа на соотношение риск-польза при одновременном приеме пероральных антикоагулянтов? Имеются ли данные об эффективности и безопасности применения эритропоэтина в сочетании с антикоагулянтами в отношении снижения частоты инсульта? • Есть ли польза от выполнения окклюзии левого предсердия у пациентов с ХБП С5Д при наличии у пациента высокого риска кровотечения и эндоваскулярных инфекций? • Какова роль ПОАК у пациентов с трансплантированной почкой? Являются ли какие-то препараты лучше других в отношении межлекарственных взаимодействий? • Эффективен ли КВД при первичной и вторичной профилактике ВСС при терминальной ХБП? Если да, каково соотношение риск-польза? Есть ли польза беспроводного водителя ритма? Дополнительные исследования по изучению трансвенозного, подкожного и носимого дефибрилляторов необходимы у пациентов с ХБП и ФВ >35 %, поскольку это 90 % от всей популяции больных с терминальной ХБП • Каковы отдаленные исходы при контроле ритма против контроля частоты при ХБП и на диализе? Чем мы должны руководствоваться при выборе стратегии контроля частоты или ритма в этой популяции больных? Каков оптимальный контроль частоты и какие предпочтительны лекарственные средства для этой цели? Какова польза трансвенозного против беспроводного ЭКС после аблации АВ-узла? При контроле ритма каково соотношение риск-польза аблации против антиаритмических препаратов? • Каков идеальный способ аблации? Есть ли сравнительное исследование, которое предоставило бы информацию по безопасности, фармакокинетики и эффективности различных антиаритмических агентов (например амиодарона)? Требуется ли длительный прием ПОАК при успешном контроле ритма? • Снижает ли персонализированный диализ (электролиты в диализате, тщательное мониторирование уровня калия или объема) риск ВСС? Влияют ли изменения уровня электролитов, ассоциированных с аритмогенным действием, на клинический исход у диализных пациентов? |
Диализат и параметры диализа
У пациентов на гемодиализе как концентрация калия в диализате, так и расписание процедур диализа влияют на риск внезапной смерти (см. рис. 6). Другие потенциальные факторы - питание, приверженность лечению, коморбидность не были достаточно изучены. Также не до конца ясно, влияют ли и в какой степени центральное венозное давление, гиперволемия и легочная гипертензия на возникновение аритмий. В трех исследованиях было показано, что низкая концентрация калия в диализате (менее 2 ммоль/л) ассоциирована с более высокой частотой внезапной смерти, особенно при предиализном уровне калия менее 5 ммоль/л [147, 177, 178]. У пациентов с предиализным уровнем калия в сыворотке более 5 ммоль/л риск, связанный с низким уровнем этого иона в диализате, не был статистически значимым. В исследовании Dialysis Outcomes and Practice Patterns Study (DOPPS) частота смерти была одинакова у пациентов с концентрацией калия в диализате как 2 ммоль/л, так и с 3 ммоль/л [179]. Быстрая коррекция ацидемии, низкий уровень кальция в сыворотке и диализате и высокий уровень ультрафильтрации могут способствовать аритмогенному потенциалу низкого уровня калия в диализате [147, 180]. В исследовании 50 пациентов, получавших диализ три раза в неделю, риск ВСС и значимые аритмии были больше выражены в течение 72-часового перерыва, чем 48-часового. В этом исследовании не проводили специального анализа в отношении уровня калия [146]. Приведет ли уменьшение интервала между диализными сессиями к клинически значимому снижению частоты внезапной остановки сердца и изменениям уровня калия, пока неизвестно и требует дальнейших исследований. Концентрации в диализате бикарбоната, кальция, магния и глутаминовой кислоты также скорее всего имеют отношение к возникновению аритмий. Возможно, что персонализация параметров диализа для конкретного больного могла бы снизить риск ВСС, но это не изучено и представляется достаточно трудно для внедрения.
Контроль жидкости в ходе диализа
Частота ультрафильтрации больше чем 10 мл/ч/ кг ассоциирована с большей вероятностью интрадиализной гипотензии и риском смерти [181]. Гемодинамический стресс в ходе диализа провоцирует оглушение миокарда, которое в течение времени может прогрессировать, вплоть до развития региональной местной систолической дисфункции в сочетании с развитием гибернации и фиброза миокарда [182]. В ретроспективном анализе было показано, что большая прибавка массы тела в междиализный период связана с повышенным риском сердечно-сосудистых событий [183], таким образом, стратегии, направленные на снижение междиализной прибавки массы тела, требуют изучения.
ЗАКЛЮЧЕНИЕ
Пациенты с ХБП имеют больший шанс развития ФП в сравнении с популяцией без ХБП, как и более высокий риск инсульта. С целью профилактики ОНМК у пациентов с КК 30-50 мл/ мин применение ПОАК не уступает варфарину и более безопасно. У пациентов с ХБП С5Д и ФП недостаточно доказательной базы по эффективности и безопасности рутинного применения АВК с целью профилактики ОНМК.
Доказательная база, основанная на старых рандомизированных исследованиях, подтверждает, что фармакологический контроль синусового ритма и частоты сердечных сокращений равнозначны в их эффективности в отношении рисков сердечной недостаточности, инсульта и выживаемости. Однако катетерная аблация, являясь наилучшим методом в сравнении с антиаритмической терапией для купирования ФП, сравнима по безопасности при ХБП и без ХБП. Аблация при ФП может также играть роль при других коморбидных состояних, например сердечной недостаточности. Несмотря на то, какая стратегия избрана - контроля ритма или частоты, антикоагулянты должны быть назначены с целью профилактики ОНМК при отсутствии противопоказаний.
Риск ВСС повышен у пациентов с ХБП, в том числе с терминальной стадией, и идентифицированы несколько связанных с ним факторов. Необходимы дальнейшие исследования для выявления риска ВСС у пациентов с не диализными стадиями ХБП. Для предотвращения ВСС при тПН первично показана имплантация КВД при ФВ ЛЖ < 35 %, несмотря на то, что данные по пользе этой процедуры у таких больных не воодушевляют. Данные в отношении вторичной профилактики с помощью КВД говорят о некоторой эффективности, но необходимы дальнейшие исследования с целью оценки отдаленного соотношения риск-польза. Имеющиеся данные указывают на то, что наличие КВД снижает темпы прогрессии ХБП.
У пациентов на гемодиализе как концентрация калия в диализате, так и расписание процедур диализа влияют на риск внезапной смерти. Приведет ли уменьшение интервала между диализными сессиями к клинически значимому снижению частоты внезапной остановки сердца и изменениям уровня калия, пока неизвестно и требует дальнейших исследований. Возможно, что персонализация параметров диализа для конкретного больного могла бы снизить риск ВСС, но это не изучено и было бы достаточно трудно для внедрения.
Последние рекомендации включают практические и научные аспекты ведения аритмий при ХБП [3-7, 85, 184]. Однако имеют место существенные пробелы в понимании некоторых вопросов, что требует проведения клинических исследований, и, если возможно, надежные данные наблюдений. Мы наметили некоторые рекомендации по научным исследованиям в надежде, что будущие исследования в этой области смогут получить достаточную доказательную базу (табл. 6). Мультидисциплинарный подход необходим для понимания механизмов аритмии при ХБП, как и для разработки лечебных подходов и улучшения клинического результата. Нефрологи и кардиологи должны начать и продолжать сотрудничество в разработке и проведении клинических исследований, а также в лечение пациентов с ХБП и ФП.
**Дополнительные материалы за исключением дополнительных табл. 5 и 6 представлены на сайте European Heart Journal.
Благодарности
Мы благодарим Jennifer King, PhD за помощь в подготовке рукописи.
Гранты
Спонсором конференции было KDIGO (Kidney Disease: Improving Global Outcomes), неограниченные образовательные гранты также были предоставлены AstraZeneca, Bayer HealthCare, Boston Scientific, Daiichi-San- kyo, Fresenius Medical Care, Sanofi-Genzyme, Medtronic, Relypsa и Vifor Fresenius Medical Care Renal Pharma. Все участники конференции получили поддержку в отношении транспортных расходов для участия в конференции.
Конфликт интересов: M.P.T. - научная поддержка от компании AstraZeneca, Boehringer Ingelheim, Cardiva Medical, Janssen, Medtronic и Veterans Health Administration; работа консультантом для Akebia, AliveCor, Boehringer Ingelheim, Cardiva Medical, iBeat, iRhythm, Medtronic, Precision Health Economics и St Jude Medical; получил гонорар лектора от Medscape/theheart.org; имеет интерес в AliveCor, iBeat, Zipline Medical; является редактором JAMA Cardiology. PJ.B. получил научную поддержку от the Dutch Kidney Foundation, the European Commission, Medtronic, The Netherlands Organisation for Health Research and Development и St. Jude Medical. Все деньги были выплачены институту. J.J.C. получил институтский научный грант от AstraZeneca, Vifor Frese- nius Medical Care Renal Pharma и Swedish Heart and Lung Foundation и гонорары лектора от Vifor Fresenius Medical Care Renal Pharma. C.A.H. является консультантом в Abbvie, Bristol-Myers Squibb, Fibrogen, Relypsa, Sanifit, ZS Pharma; получил научную поддержку от Amgen и Zoll; имеет поддержку компаний Boston Scientific, GE, Johnson & Johnson и Merck. S.E.K. получил научную поддержку от WL Gore and Associates, Bayer и Bristol- Myers Squibb; является консультантом Abbvie, Boeh- ringer Ingelheim and Johnson & Johnson. R.S.P. получил персональную оплату от Biotronic и Medtronic; нефинансовую поддержку от Kardic и научную от Pfizer. R.P.- F. является членом редколлегии и/или получил гонорар лектора от Akebia, AstraZeneca, Baxter, Fresenius Medical Care, Janssen, and Novartis. Также он получил научную поддержку от Baxter and Fresenius Medical Care. H.R. получил персональную оплату и нефинансовую поддержку от Bristol-Myers Squibb and Pfizer. W.Z. получил научную поддержку от Boston Scientific и Zoll. D.C.W. являлся консультантом to Amgen, AstraZeneca, Boeh- ringer Ingelheim, GSK, Janssen и Vifor Fresenius Medical Care Renal Pharma; получил гонорары лектора от Amgen и Kyowa Kirin. W.C.W. является научным редактором для AMAG, Amgen, AstraZeneca, Bayer, Daiichi Sankyo, Vifor Fresenius Medical Care Renal Pharma и ZS Pharma; работает в исполнительном комитете клинических исследований в Akebia и комитете по утверждению конечных точек в Medtronic; является консультантом Relypsa и получил гонорары спикера от Fibrogen. C.W. является консультантом Boehringer-Ingelheim и Sanofi Genzyme и получил гонорары спикера от Fibrogen. Другие авторы объявляют об отсутствии конфликта интересов.
Примечание
Мнения, высказанные в данной публикации, могут не совпадать с таковыми у редакторов European Heart Journal или Европейского общества кардиологов.
Информация по участникам
Участниками конференции были Kerstin Amann, De- basish Banerjee, Nisha Bansal, Giuseppe Boriani, Jared Bunch, Christopher T Chan, David M Charytan, David Conen, Allon N Friedman, Simonetta Genovesi, Rachel M Holden, Andrew A House, Michel Jadoul, Alan G Jar- dine, David W Johnson, Min Jun, Laura Labriola, Patrick B Mark, Peter A McCullough, Thomas D Nolin, Tatjana S Potpara, Patrick H Pun, Antonio L P Ribeiro, Patrick Rossignol, Jenny I Shen, Manish M Sood, Yusuke Tsuka- moto, Angela Yee-Moon Wang, Matthew R Weir, James B Wetmore, Jerzy K Wranicz и Hiro Yamasaki.
Список литературы
1. Charytan D, Kuntz RE. The exclusion of patients with chronic kidney disease from clinical trials in coronary artery disease. Kidney Int 2006;70:2021–2030. Doi: https://Doi.org/10.1038/ sj.ki.5001934
2. Konstantinidis I, Nadkarni GN, Yacoub R et al. Representation of patients with kidney disease in trials of cardiovascular interventions: an updated systematic review. JAMA Intern Med 2016;176: 121–124. Doi: https://Doi.org/10.1001/jamainternmed.2015.6102
3. Boriani G, Savelieva I, Dan GA et al. Chronic kidney disease in patients with cardiac rhythm disturbances or implantable electrical devices: clinical significance and implications for decision making-a position paper of the European Heart Rhythm Association endorsed by the Heart Rhythm Society and the Asia Pacific Heart Rhythm Society. Europace 2015;17: 1169–1196. Doi: https://Doi. org/10.1093/europace/euv202
4. Heidbuchel H, Verhamme P, Alings M et al. Updated European Heart Rhythm Association Practical Guide on the use of nonvitamin K antagonist anticoagulants in patients with non-valvular atrial fibrillation. Europace 2015;17: 1467–1507. Doi: https://Doi. org/10.1093/europace/euv309
5. Kirchhof P, Benussi S, Kotecha D et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J 2016;37:2893–2962. Doi: https://Doi. org/10.1093/ejcts/ezw313
6. Piepoli MF, Hoes AW, Agewall S et al. 2016 European Guidelines on cardiovascular disease prevention in clinical practice: the Sixth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of 10 societies and by invited experts)Developed with the special contribution of the European Association for Cardiovascular Prevention & Rehabilitation (EACPR). Eur Heart J 2016;37:2315–2381. Doi: https://Doi. org/10.1093/eurheartj/ehw106
7. Priori SG, Blomström-Lundqvist C, Mazzanti A et al. 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: the Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death of the. European Society of Cardiology (ESC). Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC). Eur Heart J 2015;36:2793–2867. Doi: https://Doi.org/10.1714/2174.23496
8. Chugh SS, Havmoeller R, Narayanan K et al. Worldwide epidemiology of atrial fibrillation: a Global Burden of Disease 2010 Study. Circulation 2014;129: 837–847. Doi: https://Doi. org/10.1161/CIRCULATIONAHA.113.005119
9. Eckardt KU, Coresh J, Devuyst O et al. Evolving importance of kidney disease: from subspecialty to global health burden. Lancet 2013;382:158–169. Doi: https://Doi.org/10.1016/S0140-6736(13)60439-0
10. Soliman EZ, Prineas RJ, Go AS, Xie D et al. Chronic kidney disease and prevalent atrial fibrillation: the Chronic Renal Insufficiency Cohort (CRIC). Am Heart J 2010;159:1102–1107. Doi: https://Doi.org/10.1016/j.ahj.2010.03.027
11. Ananthapanyasut W, Napan S, Rudolph EH et al. Prevalence of atrial fibrillation and its predictors in nondialysis patients with chronic kidney disease. Clin J Am Soc Nephrol 2010;5: 173–181. Doi: https://Doi.org/10.2215/CJN.03170509
12. McManus DD, Corteville DC, Shlipak MG et al. Relation of kidney function and albuminuria with atrial fibrillation (from the Heart and Soul Study). Am J Cardiol 2009;104:1551–1555. Doi: https://Doi.org/10.1016/j.amjcard.2009.07.026
13. Zimmerman D, Sood MM, Rigatto C et al. Systematic review and meta-analysis of incidence, prevalence and outcomes of atrial fibrillation in patients on dialysis. Nephrol Dial Transplant 2012;27: 3816–3822. Doi: https://Doi.org/10.1093/ndt/gfs416
14. Wetmore JB, Mahnken JD, Rigler SK et al. The prevalence of and factors associated with chronic atrial fibrillation in Medicare/ Medicaid-eligible dialysis patients. Kidney Int 2012; 81:469–476. Doi: https://Doi.org/10.1038/ki.2011.416
15. Genovesi S, Pogliani D, Faini A et al. Prevalence of atrial fibrillation and associated factors in a population of longterm hemodialysis patients. Am J Kidney Dis 2005;46:897–902. Doi: https:// Doi.org/10.1053/j.ajkd.2005.07.044
16. Wizemann V, Tong L, Satayathum S et al. Atrial fibrillation in hemodialysis patients: clinical features and associations with anticoagulant therapy. Kidney Int 2010;77: 1098–1106. Doi: https:// Doi.org/10.1038/ki.2009.477
17. Roy-Chaudhury P, Williamson DE, Tumlin JA, Charytan DM, Prakash K, Kher VK. Arrhythmic risk in patients with type II diabetes on hemodialysis: preliminary results from the Monitoring in Dialysis (MiD) Clinical Study. Abstract THPO805. J Am Soc Nephrol 2015;26:275A
18. Konigsbrugge O, Posch F, Antlanger M et al. Prevalence of atrial fibrillation and antithrombotic therapy in hemodialysis patients: cross-sectional results of the Vienna InVestigation of AtriaL Fibrillation and Thromboembolism in Patients on HemoDI-alysis (VIVALDI). PLoS One 2017;12:e0169400. Doi: https://Doi. org/10.1371/journal.pone.0169400
19. Alonso A, Lopez FL, Matsushita K et al. Chronic kidney disease is associated with the incidence of atrial fibrillation: the Atherosclerosis Risk in Communities (ARIC) study. Circulation 2011;123:2946–2953. Doi: https://Doi.org/10.1161/CIRCULATIONAHA.111.020982
20. Sandhu RK, Kurth T, Conen D et al. Relation of renal function to risk for incident atrial fibrillation in women. Am J Cardiol 2012; 109:538–542. Doi: https://Doi.org/10.1016/j.amjcard.2011.10.006
21. Watanabe H, Watanabe T, Sasaki S et al. Close bidirectional relationship between chronic kidney disease and atrial fibrillation: the Niigata preventive medicine study. Am Heart J 2009;158:629– 636. Doi: https://Doi.org/10.1016/j.ahj.2009.06.031
22. Horio T, Iwashima Y, Kamide K et al. Chronic kidney disease as an independent risk factor for new-onset atrial fibrillation in hypertensive patients. J Hypertens 2010;28:1738–1744. Doi: https://Doi.org/10.1097/HJH.0b013e32833a7dfe
23. Shang W, Li L, Huang S et al. Chronic kidney disease and the risk of new-onset atrial fibrillation: a meta-analysis of prospective cohort studies. PLoS One 2016;11:e0155581. Doi: https://Doi.org/10.1371/journal.pone.0155581
24. Alonso A, Krijthe BP, Aspelund T et al. Simple risk model predicts incidence of atrial fibrillation in a racially and geographically diverse population: the CHARGE-AF consortium. J Am Heart Assoc 2013;2:e000102. Doi: https://Doi.org/10.1161/JAHA.112.000102
25. Deo R, Katz R, Kestenbaum B et al. Impaired kidney function and atrial fibrillation in elderly subjects. J Card Fail 2010;16:55–60. Doi: https://Doi.org/10.1016/j.cardfail.2009.07.002
26. Liao JN, Chao TF, Liu CJ et al. Incidence and risk factors for newonset atrial fibrillation among patients with end-stage renal disease undergoing renal replacement therapy. Kidney Int 2015;87:1209–1215. Doi: https://Doi.org/10.1038/ki.2014.393
27. Goldstein BA, Arce CM, Hlatky MA et al. Trends in the incidence of atrial fibrillation in older patients initiating dialysis in the United States. Circulation 2012;126:2293–2301. Doi: https:// Doi.org/10.1161/CIRCULATIONAHA.112.099606
28. Winkelmayer WC, Patrick AR, Liu J et al. The increasing prevalence of atrial fibrillation among hemodialysis patients. J Am Soc Nephrol 2011;22:349–357. Doi: https://Doi.org/10.1681/ ASN.2010050459
29. Providência R, Marijon E, Boveda S et al. Meta-analysis of the influence of chronic kidney disease on the risk of thromboembolism among patients with nonvalvular atrial fibrillation. Am J Cardiol 2014;114:646–653. Doi: https://Doi.org/10.1016/j. amjcard.2014.05.048
30. Piccini JP, Stevens SR, Chang Y et al. ROCKET AF Steering Committee and Investigators. Renal dysfunction as a predictor of stroke and systemic embolism in patients with nonvalvular atrial fibrillation: validation of the R(2)CHADS(2) index in the ROCKET AF (Rivaroxaban Once-daily, oral, direct factor Xa inhibition Compared with vitamin K antagonism for prevention of stroke and Embolism Trial in Atrial Fibrillation) and ATRIA (AnTicoagulation and Risk factors In Atrial fibrillation) study cohorts. Circulation 2013;127:224– 232. Doi: https://Doi.org/10.1161/CIRCULATIONAHA.112.107128
31. Olesen JB, Lip GY, Kamper AL et al. Stroke and bleeding in atrial fibrillation with chronic kidney disease. N Engl J Med 2012;367:625–635. Doi: https://Doi.org/10.1056/NEJMoa1105594
32. Go AS, Fang MC, Udaltsova N et al. Impact of proteinuria and glomerular filtration rate on risk of thromboembolism in atrial fibrillation: the anticoagulation and risk factors in atrial fibrillation (ATRIA) study. Circulation 2009;119:1363–1369. Doi: https://Doi. org/10.1161/CIRCULATIONAHA.108.816082
33. Wetmore JB, Ellerbeck EF, Mahnken JD et al. Atrial fibrillation and risk of stroke in dialysis patients. Ann Epidemiol 2013;23:112–118. Doi: https://Doi.org/10.1016/j.annepidem.2012.12.011
34. Conen D, Chae CU, Glynn RJ et al. Risk of death and cardiovascular events in initially healthy women with newonset atrial fibrillation. JAMA 2011;305:2080–2087. Doi: https://Doi. org/10.1001/jama.2011.659
35. Shih CJ, Ou SM, Chao PW et al. Risks of death and stroke in patients undergoing hemodialysis with new-onset atrial fibrillation: a competing-risk analysis of a nationwide cohort. Circulation 2016;133:265–272. Doi: https://Doi.org/10.1161/CIRCULATIONAHA.115.018294
36. Lenihan CR, Montez-Rath ME, Scandling JD et al. Outcomes after kidney transplantation of patients previously diagnosed with atrial fibrillation. Am J Transplant 2013;13:1566–1575. Doi: https://Doi.org/10.1111/ajt.12197
37. Findlay MD, Thomson PC, MacIsaac R et al. Risk factors and outcome of stroke in renal transplant recipients. Clin Transplant 2016; 30: 918–924. Doi: 10.1111/ctr.12765
38. Bansal N, Xie D, Tao K et al. Atrial fibrillation and risk of ESRD in adults with CKD. Clin J Am Soc Nephrol 2016; 11: 1189–1196. Doi: 10.2215/CJN.10921015
39. Bansal N, Fan D, Hsu CY et al. Incident atrial fibrillation and risk of end-stage renal disease in adults with chronic kidney disease. Circulation 2013; 127: 569–574. Doi: 10.1161/CIRCULATIONAHA.112.123992
40. O’Neal WT, Tanner RM, Efird JT et al. Atrial fibrillation and incident end-stage renal disease: the REasons for Geographic And Racial Differences in Stroke (REGARDS) study. Int J Cardiol 2015; 185: 219–223. Doi: 10.1016/j.ijcard.2015.03.104
41. Bansal N, Fan D, Hsu CY et al. Incident atrial fibrillation and risk of death in adults with chronic kidney disease. J Am Heart Assoc 2014; 3: e001303. Doi: 10.1161/JAHA.114.001303
42. Nelson SE, Shroff GR, Li S, Herzog CA. Impact of chronic kidney disease on risk of incident atrial fibrillation and subsequent survival in medicare patients. J Am Heart Assoc 2012; 1: e002097. Doi: 10.1161/JAHA.112.002097
43. Chan PH, Huang D, Yip PS et al. Ischaemic stroke in patients with atrial fibrillation with chronic kidney disease undergoing peritoneal dialysis. Europace 2016; 18: 665–671. Doi: 10.1093/ europace/euv289
44. Chao TF, Liu CJ, Wang KL et al. Incidence and prediction of ischemic stroke among atrial fibrillation patients with end-stage renal disease requiring dialysis. Heart Rhythm 2014; 11: 1752–1759. Doi: 10.1016/j.hrthm.2014.06.021
45. Friberg L, Benson L, Lip GY. Balancing stroke and bleeding risks in patients with atrial fibrillation and renal failure: the Swedish Atrial Fibrillation Cohort study. Eur Heart J 2015; 36: 297–306. Doi: 10.1093/eurheartj/ehu139
46. Roldan V, Marin F, Manzano-Fernandez S et al. Does chronic kidney disease improve the predictive value of the CHADS2 and CHA2DS2-VASc stroke stratification risk scores for atrial fibrillation? Thromb Haemost 2013; 109: 956–960. Doi: 10.1160/TH13-01-005
47. Singer DE, Chang Y, Borowsky LH et al. A new risk scheme to predict ischemic stroke and other thromboembolism in atrial fibrillation: the ATRIA study stroke risk score. J Am Heart Assoc 2013; 2: e000250. Doi: 10.1161/JAHA.113.000250
48. Kerr KF, Wang Z, Janes H et al. Net reclassification indices for evaluating risk prediction instruments: a critical review. Epidemiology 2014; 25: 114–121. Doi: 10.1097/EDE.0000000000000018
49. January CT, Wann LS, Alpert JS et al. American College of Cardiology/American Heart Association Task Force on Practice Guidelines. 2014 AHA/ACC/HRS guideline for the management of patients with atrial fibrillation: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the Heart Rhythm Society. J Am Coll Cardiol 2014; 64: 2246–2276. Doi: 10.1016/j.jacc.2015.09.018
50. Bonde AN, Lip GY, Kamper AL et al. Net clinical benefit of antithrombotic therapy in patients with atrial fibrillation and chronic kidney disease: a nationwide observational cohort study. J Am Coll Cardiol 2014; 64: 2471–2482. Doi: 10.1016/j.jacc.2014.09.051
51. American College of Chest Physicians Antithrombotic Therapy and Prevention of Thrombosis Panel. Antithrombotic therapy and prevention of thrombosis, 9th Ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012; 141(2 Suppl): 1S–70S, e1S–e801S. Doi: 10.1378/ chest.1412S3
52. Kamel H, Okin PM, Elkind MS, Iadecola C. Atrial fibrillation and mechanisms of stroke: time for a new model. Stroke 2016; 47: 895–900. Doi: 10.1161/STROKEAHA.115.012004
53. Connolly SJ, Ezekowitz MD, Yusuf S et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009; 361: 1139–1151. Doi: 10.1056/NEJMoa0905561
54. Patel MR, Mahaffey KW, Garg J et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med 2011; 365: 883–891. Doi: 10.1056/NEJMoa1009638
55. Granger CB, Alexander JH, McMurray JJ et al. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2011; 365: 981–992. Doi: 10.1056/NEJMoa1107039
56. Giugliano RP, Ruff CT, Braunwald E et al. Edoxaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2013; 369:2093–2104. Doi: 10.1056/NEJMoa1310907
57. Hart RG, Pearce LA, Asinger RW, Herzog CA. Warfarin in atrial fibrillation patients with moderate chronic kidney disease. Clin J Am Soc Nephrol 2011; 6: 2599–2604. Doi: 10.2215/ CJN.02400311
58. Hijazi Z, Hohnloser SH, Oldgren J et al. Efficacy and safety of dabigatran compared with warfarin in relation to baseline renal function in patients with atrial fibrillation: a RE-LY (Randomized Evaluation of Long-term Anticoagulation Therapy) trial analysis. Circulation 2014; 129:961–970. Doi: 10.1161/CIRCULATIONAHA.113.003628
59. Fox KA, Piccini JP, Wojdyla D et al. Prevention of stroke and systemic embolism with rivaroxaban compared with warfarin in patients with non-valvular atrial fibrillation and moderate renal impairment. Eur Heart J 2011; 32: 2387–2394. Doi: 10.1093/ eurheartj/ehr342
60. Hohnloser SH, Hijazi Z, Thomas L et al. Efficacy of apixaban when compared with warfarin in relation to renal function in patients with atrial fibrillation: insights from the ARISTOTLE trial. Eur Heart J 2012; 33: 2821–2830. Doi: 10.1093/eurheartj/ehs274
61. Eikelboom JW, Connolly SJ, Gao P et al. Stroke risk and efficacy of apixaban in atrial fibrillation patients with moderate chronic kidney disease. J Stroke Cerebrovasc Dis 2012; 21:429–435. Doi: 10.1016/j.jstrokecerebrovasdis.2012.05.007
62. Bohula EA, Giugliano RP, Ruff CT et al. Impact of renal function on outcomes with edoxaban in the ENGAGE AF-TIMI 48 trial. Circulation 2016; 134:24–36. Doi: 10.1161/CIRCULATIONAHA.116.022361
63. Qamar A, Bhatt DL. Anticoagulation therapy: balancing the risks of stroke and bleeding in CKD. Nat Rev Nephrol 2015; 11:200–202. Doi: 10.1038/nrneph.2015.14
64. Lau YC, Proietti M, Guiducci E et al. Atrial fibrillation and thromboembolism in patients with chronic kidney disease. J Am Coll Cardiol 2016; 68:1452–1464. Doi: 10.1016/j.jacc.2016.06.057
65. Tan J, Liu S, Segal JB et al. Warfarin use and stroke, bleeding and mortality risk in patients with end stage renal disease and atrial fibrillation: a systematic review and meta-analysis. BMC Nephrol 2016; 17:157. Doi: 10.1186/s12882-016-0368-6
66. Hayashi M, Takamatsu I, Kanno Y et al. A case-control study of calciphylaxis in Japanese endstage renal disease patients. Nephrol Dial Transplant 2012; 27:1580–1584. Doi: 10.1093/ndt/ gfr658
67. Carrero JJ, Evans M, Szummer K et al. Warfarin, kidney dysfunction, and outcomes following acute myocardial infarction in patients with atrial fibrillation. JAMA 2014; 311: 919–928. Doi: 10.1001/jama.2014.1334
68. Szummer K, Gasparini A, Eliasson S et al. Time in therapeutic range and outcomes after warfarin initiation in newly diagnosed atrial fibrillation patients with renal dysfunction. J Am Heart Assoc 2017; 6:e004925. Doi: 10.1161/JAHA.116.004925
69. Yang F, Hellyer JA, Than C et al. Warfarin utilisation and anticoagulation control in patients with atrial fibrillation and chronic kidney disease. Heart 2017; 103:818–826. Doi: 10.1136/ heartjnl-2016-309266
70. Winkelmayer WC, Turakhia MP. Warfarin treatment in patients with atrial fibrillation and advanced chronic kidney disease: sins of omission or commission? Jama 2014; 311:913–915. Doi: 10.1001/jamasurg.2014.926
71. Brodsky SV, Nadasdy T, Rovin BH et al. Warfarin-related nephropathy occurs in patients with and without chronic kidney disease and is associated with an increased mortality rate. Kidney Int 2011; 80:181–189. Doi: 10.1038/ki.2011.44
72. Holden RM, Booth SL. Vascular calcification in chronic kidney disease: the role of vitamin K. Nat Clin Pract Nephrol 2007; 3:522–523. Doi: 10.1038/ncpneph0601
73. Kooiman J, van der Hulle T, Maas H et al. Pharmacokinetics and pharmacodynamics of dabigatran 75 mg b.i.d. in patients with severe chronic kidney disease. J Am Coll Cardiol 2016; 67:2442–2444. Doi: 10.1016/j.jacc.2016.03.516
74. Dias C, Moore KT, Murphy J et al. Pharmacokinetics, pharmacodynamics, and safety of single-dose rivaroxaban in chronic hemodialysis. Am J Nephrol 2016; 43:229–236. Doi: 10.1159/000445328
75. De Vriese AS, Caluwe R, Bailleul E et al. Dose-finding study of rivaroxaban in hemodialysis patients. Am J Kidney Dis 2015; 66: 91–98. Doi: 10.1053/j.ajkd.2015.01.022
76. Wang X, Tirucherai G, Marbury TC et al. Pharmacokinetics, pharmacodynamics, and safety of apixaban in subjects with endstage renal disease on hemodialysis. J Clin Pharmacol 2016; 56: 628–636. Doi: 10.1002/jcph.628
77. Mavrakanas TA, Samer CF, Nessim SJ et al. Apixaban pharmacokinetics at steady state in hemodialysis patients. J Am Soc Nephrol 2017; 28: 2241–2248. Doi: 10.1681/ASN.2016090980
78. Matzke GR, Aronoff GR, Atkinson AJ et al. Drug dosing consideration in patients with acute and chronic kidney disease-a clinical update from Kidney Disease: improving Global Outcomes (KDIGO). Kidney Int 2011; 80: 1122–1137. Doi: 10.1038/ ki.2011.322
79. Manzano-Fernández S, Andreu-Cayuelas JM, Marı´n F et al. Comparison of estimated glomerular filtration rate equations for dosing new oral anticoagulants in patients with atrial fibrillation. Rev Esp Cardiol (Engl Ed) 2015; 68: 497–504. Doi: 10.1016/j. rec.2014.06.026
80. Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 clinical practice guideline for the evaluation and management of chronic kidney disease. Kidney Int 2013; 3 (Suppl): 1–150.
81. Chan KE, Edelman ER, Wenger JB et al. Dabigatran and rivaroxaban use in atrial fibrillation patients on hemodialysis. Circulation 2015; 131: 972–979. Doi: 10.1161/CIRCULATIONAHA.114.014113.
82. Winkelmayer WC, Herzog CA, Montez-Rath ME et al. Use of novel oral anticoagulants in patients with end-stage renal disease. Hemodial Int 2015; 19: 150–153. Doi: 10.1111/hdi.12251.
83. Shroff GR. Renal function in patients with atrial fibrillation receiving anticoagulants: the canaries in the coal mine. JAMA Cardiol 2016; 1: 375–376. Doi: 10.1001/jamacardio.2016.1258.
84. Yao X, Shah ND, Sangaralingham LR et al. Non-vitamin K antagonist oral anticoagulant dosing in patients with atrial fibrillation and renal dysfunction. J Am Coll Cardiol 2017; 69: 2779–2790. Doi: 10.1016/j.jacc.2017.03.600
85. Kirchhof P, Breithardt G, Bax J et al. A roadmap to improve the quality of atrial fibrillation management: proceedings from the fifth Atrial Fibrillation Network/European Heart Rhythm Association consensus conference. Europace 2016; 18: 37–50. Doi: 10.1093/ europace/euv304.
86. Bohm M, Ezekowitz MD, Connolly SJ et al. Changes in renal function in patients with atrial fibrillation: an analysis from the RE-LY trial. J Am Coll Cardiol 2015; 65: 2481–2493. Doi: 10.1016/j. jacc.2015.03.577
87. Doherty JU, Gluckman TJ, Hucker WJ et al. 2017 ACC expert consensus decision pathway for periprocedural management of anticoagulation in patients with nonvalvular atrial fibrillation: a Report of the American College of Cardiology Clinical Expert Consensus Document Task Force. J Am Coll Cardiol 2017; 69: 871–898. Doi: 10.1016/j.jacc.2016.11.024
88. Janssen MJ, Huijgens PC, Bouman AA et al. Citrate versus heparin anticoagulation in chronic haemodialysis patients. Nephrol Dial Transplant 1993;8:1228–1233. Doi: -
89. Glund S, Stangier J, van Ryn J et al. Effect of age and renal function on idarucizumab pharmacokinetics and idarucizumabmediated reversal of dabigatran anticoagulant activity in a randomized, double-blind, crossover phase Ib study. Clin Pharmacokinet 2017; 56: 41–54. Doi: 10.1007/s40262-016-0417-0
90. Connolly SJ, Eikelboom J, Joyner C et al. Apixaban in patients with atrial fibrillation. N Engl J Med 2011; 364: 806–817. Doi: 10.1056/NEJMoa1007432.
91. Gibson CM, Mehran R, Bode C et al. Prevention of bleeding in patients with atrial fibrillation undergoing PCI. N Engl J Med 2016; 375: 2423–2434. Doi: 10.1056/NEJMoa1611594.
92. Reddy VY, Doshi SK, Kar S et al. 5-year outcomes after left atrial appendage closure: from the PREVAIL and PROTECT AF trials. J Am Coll Cardiol 2017; 70: 2964–2975. Doi: 10.1016/j. jacc.2017.10.021.
93. Kefer J, Tzikas A, Freixa X et al. Impact of chronic kidney disease on left atrial appendage occlusion for stroke prevention in patients with atrial fibrillation. Int J Cardiol 2016; 207: 335–340. Doi: 10.1016/j.ijcard.2016.01.003.
94. Wyse DG, Waldo AL, DiMarco JP et al. Atrial Fibrillation Follow-up Investigation of Rhythm Management Investigators. A comparison of rate control and rhythm control in patients with atrial fibrillation. N Engl J Med 2002; 347: 1825–1833. Doi: 10.1056/ NEJMoa021328
95. Testa L, Biondi-Zoccai GG, Dello Russo A et al. Rate-control vs. rhythm-control in patients with atrial fibrillation: a meta-analysis. Eur Heart J 2005; 26: 2000–2006. Doi: 10.1093/eurheartj/ehi306
96. Chatterjee S, Sardar P, Lichstein E et al. Pharmacologic rate versus rhythm-control strategies in atrial fibrillation: an updated comprehensive review and meta-analysis. Pacing Clin Electrophysiol 2013; 36: 122–133. Doi: 10.1111/j.1540-8159.2012.03513.x.
97. Wyse DG. Rate control vs rhythm control strategies in atrial fibrillation. Prog Cardiovasc Dis 2005; 48: 125–138. Doi: 10.1016/j. pcad.2005.06.008
98. Verde E, Perez de Prado A, Lopez-Gomez JM et al. Asymptomatic intradialytic supraventricular arrhythmias and adverse outcomes in patients on hemodialysis. Clin J Am Soc Nephrol 2016; 11: 2210–2217. Doi: 10.2215/CJN.04310416
99. Van Gelder IC, Groenveld HF, Crijns HJ et al; RACE II Investigators. Lenient versus strict rate control in patients with atrial fibrillation. N Engl J Med 2010; 362: 1363–1373. Doi: 10.1056/ NEJMoa1001337
100. Williams ES, Thompson VP, Chiswell KE et al. Rate versus rhythm control and outcomes in patients with atrial fibrillation and chronic kidney disease: data from the GUSTO-III Trial. Cardiol J 2013; 20: 439–446. Doi: 10.5603/CJ.2013.0104.
101. Potpara TS, Jokic V, Dagres N et al. Cardiac arrhythmias in patients with chronic kidney disease: implications of renal failure for antiarrhythmic drug therapy. Curr Med Chem 2016; 23: 2070–2083. Doi: –
102. Weir MA, Dixon SN, Fleet JL et al. beta-Blocker dialyzability and mortality in older patients receiving hemodialysis. J Am Soc Nephrol 2015; 26: 987–996. Doi: 10.1681/ASN.2014040324
103. Hoffmann KJ, Regardh CG, Aurell M et al. The effect of impaired renal function on the plasma concentration and urinary excretion of metoprolol metabolites. Clin Pharmacokinet 1980; 5: 181–191. Doi: 10.2165/00003088-198005020-00005
104. https://www.drugbank.ca/drugs/DB00598 (13 February 2018).
105. Daheb K, Lipman ML, Hildgen P, Roy JJ. Artificial neural network modeling for drug dialyzability prediction. J Pharm Pharm Sci 2013; 16: 665–675. Doi: -
106. Frishman WSD. Cardiovascular Pharmacotherapies. Minneapolis, MN: Cardiotext Publisher; 2011
107. Dasgupta A, Montalvo J, Medendorp S et al. Increased complication rates of cardiac rhythm management devices in ESRD patients. Am J Kidney Dis 2007; 49: 656–663. Doi: 10.1053/j. ajkd.2007.02.272
108. Reinecke H, Nabauer M, Gerth A et al. Morbidity and treatment in patients with atrial fibrillation and chronic kidney disease. Kidney Int 2015; 87: 200–209. Doi: 10.1038/ki.2014.195.
109. Schmidt M, Daccarett M, Rittger H et al. Renal dysfunction and atrial fibrillation recurrence following cardioversion. J Cardiovasc Electrophysiol 2011; 22: 1092–1098. Doi: 10.1111/j.1540-8167.2011.02069.x
110. https://www.drugbank.ca/drugs/DB01182 (13 February 2018).
111. Ullal AJ, Than CT, Fan J et al. Amiodarone and risk of death in contemporary patients with atrial fibrillation: findings from the Retrospective Evaluation and Assessment of Therapies in AF study. Am Heart J 2015; 170: 1033–1041. Doi: 10.1016/j.ahj.2015.07.023
112. Ullal AJ, Kaiser DW, Fan J et al. Safety and clinical outcomes of catheter ablation of atrial fibrillation in patients with chronic kidney disease. J Cardiovasc Electrophysiol 2017;28:39–48. Doi:10.1111/jce.13118
113. Li M, Liu T, Luo D, Li G. Systematic review and metaanalysis of chronic kidney disease as predictor of atrial fibrillation recurrence following catheter ablation. Cardiol J 2014;21:89–95 Doi:10.5603/CJ.a2013.0116
114. Yanagisawa S, Inden Y, Kato H et al. Impaired renal function is associated with recurrence after cryoballoon catheter ablation for paroxysmal atrial fibrillation: a potential effect of non-pulmonary vein foci. J Cardiol 2017;69:3–10 Doi: 10.1016/j.jjcc.2016.07.008
115. Takahashi Y, Takahashi A, Kuwahara T, et al. Renal function after catheter ablation of atrial fibrillation. Circulation 2011;124:2380–2387. Doi: 10.1161/CIRCULATION-AHA.111.047266
116. Marrouche NF, Brachmann J, Andresen D, et al; CASTLE-AF Investigators. Catheter ablation for atrial fibrillation with heart failure. N Engl J Med 2018;378:417–427. Doi: 10.1056/ NEJMoa1707855
117. Marrouche NF, Brachmann J. Catheter ablation versus standard conventional treatment in patients with left ventricular dysfunction and atrial fibrillation (CASTLE-AF)—study design. Pacing Clin Electrophysiol 2009; 32:987–994. Doi: 10.1111/j.1540-8159.2009.02428.x
118. Kwon CH, Kim J, Kim MS, et al. Impact of impaired renal function on the incidence of atrial fibrillation following radiofrequency ablation of cavotricuspid isthmusdependent atrial flutter. Korean Circ J 2015;45:473–478. Doi:10.4070/kcj.2015.45.6.473
119. Abed HS, Wittert GA, Leong DP, et al. Effect of weight reduction and cardiometabolic risk factor management on symptom burden and severity in patients with atrial fibrillation: a randomized clinical trial. JAMA 2013;310:2050–2060. Doi: 10.1001/ jama.2013.280521
120. Lakkireddy D, Atkins D, Pillarisetti J, et al. Effect of yoga on arrhythmia burden, anxiety, depression, and quality of life in paroxysmal atrial fibrillation: the YOGA My Heart Study. J Am Coll Cardiol 2013;61:1177–1182. Doi: 10.1016/j.jacc.2012.11.060
121. Gami AS, Pressman G, Caples SM, et al. Association of atrial fibrillation and obstructive sleep apnea. Circulation 2004;110:364–367. Doi: 10.1161/01.CIR.0000136587.68725.8E
122. Li L, Wang ZW, Li J, et al. Efficacy of catheter ablation of atrial fibrillation in patients with obstructive sleep apnoea with and without continuous positive airway pressure treatment: a metaanalysis of observational studies. Europace 2014;16:1309–1314. Doi: 10.1093/europace/euu066
123. Meyring-Wosten A, Zhang H, Ye X et al. Intradialytic hypoxemia and clinical outcomes in patients on hemodialysis. Clin J Am Soc Nephrol 2016;11:616–625 Doi: 10.2215/CJN.08510815
124. Unruh ML, Sanders MH, Redline S, et al. Sleep apnea in patients on conventional thrice-weekly hemodialysis: comparison with matched controls from the Sleep Heart Health Study. J Am Soc Nephrol 2006;17:3503–3509. Doi: 10.1681/ASN.2006060659
125. Tuohy CV, Montez-Rath ME, Turakhia M, et al. Sleep disordered breathing and cardiovascular risk in older patients initiating dialysis in the United States: a retrospective observational study using medicare data. BMC Nephrol 2016;17:16. Doi: 10.1186/ s12882-016-0229-3
126. Charytan DM, Lewis EF, Desai AS, et al. Cause of death in patients with diabetic CKD enrolled in the Trial to Reduce Cardiovascular Events With Aranesp Therapy (TREAT). Am J Kidney Dis 2015;66:429–440. Doi: 10.1053/j.ajkd.2015.02.324
127. Deo R, Sotoodehnia N, Katz R, et al. Cystatin C and sudden cardiac death risk in the elderly. Circ Cardiovasc Qual Outcomes 2010;3:159–164 Doi: 10.1161/CIRCOUTCOMES.109.875369
128. Goldenberg I, Moss AJ, McNitt S, et al. Relations among renal function, risk of sudden cardiac death, and benefit of the implanted cardiac defibrillator in patients with ischemic left ventricular dysfunction. Am J Cardiol 2006;98:485–490. Doi: 10.1016/j. amjcard.2006.03.025
129. Pun PH, Smarz TR, Honeycutt EF, et al. Chronic kidney disease is associated with increased risk of sudden cardiac death among patients with coronary artery disease. Kidney Int 2009;76:652–658 Doi: 10.1038/ki.2009.219
130. Saxon LA, Bristow MR, Boehmer J, et al. Predictors of sudden cardiac death and appropriate shock in the Comparison of Medical Therapy, Pacing, and Defibrillation in Heart Failure (COMPANION) Trial. Circulation 2006;114:2766–2772. Doi: 10.1161/ CIRCULATIONAHA.106.642892
131. Suzuki T, Agarwal SK, Deo R, et al. Kidney function and sudden cardiac death in the community: the Atherosclerosis Risk in Communities (ARIC) Study. Am Heart J 2016;180:46–53. Doi: 10.1016/j.ahj.2016.07.004
132. Bleyer AJ, Hartman J, Brannon PC, et al. Characteristics of sudden death in hemodialysis patients. Kidney Int 2006;69: 2268–2273. Doi: 10.1038/sj.ki.5000446
133. Chan KE, Maddux FW, Tolkoff-Rubin N, et al. Early
134. outcomes among those initiating chronic dialysis in the United States. Clin J Am Soc Nephrol 2011;6:2642–2649. Doi: 10.2215/ CJN.03680411
135. Herzog CA, Asinger RW, Berger AK, et al. Cardiovascular disease in chronic kidney disease. A clinical update from Kidney Disease: improving Global Outcomes (KDIGO). Kidney Int 2011;80: 572–586 Doi: 10.1038/ki.2011.223
136. Herzog CA, Mangrum JM, Passman R. Sudden cardiac death and dialysis patients. Semin Dial 2008;21:300–307. Doi: 10.1111/j.1525-139X.2008.00455.x
137. Robinson BM, Zhang J, Morgenstern H, et al. Worldwide, mortality risk is high soon after initiation of hemodialysis. Kidney Int 2014;85:158–165 Doi: 10.1038/ki.2013.252
138. Weinhandl E, Constantini E, Everson S, et al. Peer kidney care initiative 2014 report: dialysis care and outcomes in the United States. Am J Kidney Dis 2015;65:A6. Doi: 10.1053/j. ajkd.2015.03.021
139. U.S. Renal Data System, 2017 USRDS Annual Data Report: Epidemiology of kidney disease in the United States. Bethesda, MD: National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Diseases, 2017. Doi: https:// Doi.org/10.1053/j.ajkd.2017.01.036
140. Wetmore JB, Gilbertson DT, Liu J, Collins AJ. Improving outcomes in patients receiving dialysis: the peer kidney care initiative. Clin J Am Soc Nephrol 2016;11: 1297–1304. Doi: 10.2215/ CJN.12981215
141. Chugh SS, Reinier K, Teodorescu C et al. Epidemiology of sudden cardiac death: clinical and research implications. Prog Cardiovasc Dis 2008;51:213–228 Doi: 10.1016/j.pcad.2008.06.003
142. Desai AS, McMurray JJ, Packer M, et al. Effect of the angiotensin-receptor-neprilysin inhibitor LCZ696 compared with enalapril on mode of death in heart failure patients. Eur Heart J 2015;36:1990–1997. Doi: 10.1093/eurheartj/ehv186
143. Solomon SD, Zelenkofske S, McMurray JJ, et al. Sudden death in patients with myocardial infarction and left ventricular dysfunction, heart failure, or both. N Engl J Med 2005;352: 2581–2588. Doi: 10.1056/NEJMoa043938
144. Pun PH, Herzog CA, Middleton JP. Improving ascertainment of sudden cardiac death in patients with end stage renal disease. Clin J Am Soc Nephrol 2012;7: 116–122. Doi: 10.2215/ CJN.02820311
145. Wan C, Herzog CA, Zareba W, Szymkiewicz SJ. Sudden cardiac arrest in hemodialysis patients with wearable cardioverter defibrillator. Ann Noninvasive Electrocardiol 2014;19:247–257. Doi: 10.1111/anec.12119
146. Wong MC, Kalman JM, Pedagogos E, et al. Temporal distribution of arrhythmic events in chronic kidney disease: highest incidence in the long interdialytic period. Heart Rhythm 2015;12:2047–2055. Doi: 10.1016/j.hrthm.2015.06.033
147. Pun PH, Lehrich RW, Honeycutt EF, et al. Modifiable risk factors associated with sudden cardiac arrest within hemodialysis clinics. Kidney Int 2011;79:218–227. Doi: 10.1038/ki.2010.315
148. Shastri S, Tangri N, Tighiouart H, et al. Predictors of sudden cardiac death: a competing risk approach in the hemodialysis study. Clin J Am Soc Nephrol 2012;7:123–130 Doi: 10.2215/ CJN.06320611
149. Friedman AN, Yu Z, Tabbey R, Denski et al. Inverse relationship between long-chain n-3 fatty acids and risk of sudden cardiac death in patients starting hemodialysis. Kidney Int 2013;83:1130–1135 Doi: 10.1038/ki.2013.4
150. Kruzan RM, Herzog CA, Wu A et al. Association of NT-proBNP and cTnI with outpatient sudden cardiac death in hemodialysis patients: the Choices for Healthy Outcomes in Caring for ESRD (CHOICE) study. BMC Nephrol 2016; 17:18. https://Doi. org/10.1186/s12882-016-0230-x
151. Sandoval Y, Herzog CA, Love SA et al. Prognostic value of serial changes in high sensitivity cardiac troponin I and T over 3 months using reference change values in hemodialysis patients. Clin Chem 2016; 62: 631–638. https://Doi.org/10.1373/ clinchem.2015.251835
152. Wang AY, Lam CW, Chan IH et al. Sudden cardiac death in end-stage renal disease patients: a 5-year prospective analysis. Hypertension 2010; 56: 210–216. https://Doi.org/10.1161/ HYPERTENSIONAHA.110.151167
153. Winkler K, Wanner C, Drechsler C et al. German Diabetes and Dialysis Study Investigators. Change in N-terminal-pro-B-typenatriuretic-peptide and the risk of sudden death, stroke, myocardial infarction, and all-cause mortality in diabetic dialysis patients. Eur Heart J 2008;29: 2092–2099. https://Doi.org/10.1093/eurheartj/ehn278
154. Katritsis DG, Zareba W, Camm AJ. Nonsustained ventricular tachycardia. J Am Coll Cardiol 2012;60:1993–2004. https://Doi. org/10.1016/j.jacc.2011.12.063
155. Roberts R, Jeffrey C, Carlisle G, Brierley E. Prospective investigation of the incidence of falls, dizziness and syncope in haemodialysis patients. Int Urol Nephrol 2007;39:275–279. https:// Doi.org/10.1007/s11255-006-9088-3
156. Charytan DM, Patrick AR, Liu J et al. Trends in the use and outcomes of implantable cardioverter-defibrillators in patients undergoing dialysis in the United States. Am J Kidney Dis 2011;58:409–417. https://Doi.org/10.1053/j.ajkd.2011.03.026
157. Herzog CA, Li S, Weinhandl ED et al. Survival of dialysis patients after cardiac arrest and the impact of implantable cardioverter defibrillators. Kidney Int 2005;68:818–825. https://Doi. org/10.1111/j.1523-1755.2005.00462.x
158. Nakhoul GN, Schold JD, Arrigain S et al. Implantable cardioverter-defibrillators in patients with CKD: a propensity-matched mortality analysis. Clin J Am Soc Nephrol 2015;10: 1119–1127. https://Doi.org/10.2215/CJN.11121114
159. Mallamaci F, Zoccali C, Tripepi G et al. Diagnostic potential of cardiac natriuretic peptides in dialysis patients. Kidney Int 2001;59: 1559–1566. https://Doi.org/10.1046/j.1523-1755.2001.0590041559.x
160. Sood MM, Pauly RP, Rigatto C, Komenda P. Left ventricular dysfunction in the haemodialysis population. NDT Plus 2008;1:199–205. https://Doi.org/10.1093/ndtplus/sfn074
161. Pun PH, Al-Khatib SM, Han JY et al. Implantable cardioverter-defibrillators for primary prevention of sudden cardiac death in CKD: a meta-analysis of patient-level data from 3 randomized trials. Am J Kidney Dis 2014;64:32–39. https://Doi.org/10.1053/j. ajkd.2013.12.009
162. El-Chami MF, Levy M, Kelli HM et al. Outcome of subcutaneous implantable cardioverter defibrillator implantation in patients with end-stage renal disease on dialysis. J Cardiovasc Electrophysiol 2015;26: 900–904. https://Doi.org/10.1111/jce.12705
163. Fotheringham J, Fogarty DG, El Nahas M et al. The mortality and hospitalization rates associated with the long interdialytic gap in thrice-weekly hemodialysis patients. Kidney Int 2015;88:569–575. https://Doi.org/10.1038/ki.2015.141
164. Brunelli SM, Du Mond C, Oestreicher N et al. Serum potassium and short-term clinical outcomes among hemodialysis patients: impact of the long interdialytic interval. Am J Kidney Dis 2017;70:21–29. https://Doi.org/10.1053/j.ajkd.2016.10.024
165. Rhee CM, Kalantar-Zadeh K. Implications of the long interdialytic gap: a problem of excess accumulation vs. excess removal? Kidney Int 2015;88:442–444. https://Doi.org/10.1038/ ki.2015.193
166. Ribeiro SC, Figueiredo AE, Barretti P, Pecoits-Filho R, de Moraes TP, Aguilera AI. all centers that contributed to BIIs. Low serum potassium levels increase the infectious-caused mortality in peritoneal dialysis patients: a Propensity-Matched Score Study. PLoS One 2015;10:e0127453. https://Doi.org/10.1371/journal. pone.0127453
167. Pitt B, Rossignol P. Potassium lowering agents: recommendations for physician and patient education, treatment reappraisal, and serial monitoring of potassium in patients with chronic hyperkalemia. Pharmacol Res 2017;118:2–4. https://Doi. org/10.1016/j.phrs.2016.07.032
168. Lepage L, Dufour AC, Doiron et al. Randomized clinical trial of sodium polystyrene sulfonate for the treatment of mild hyperkalemia in CKD. Clin J Am Soc Nephrol 2015;10:2136–2142. https://Doi.org/10.2215/CJN.03640415
169. Berlyne GM, Janabi K, Shaw AB, Hocken AG. Treatment of hyperkalemia with a calcium-resin. Lancet 1966;1:169–172. https://Doi.org/10.1016/S0140-6736(66)92460-3
170. Weir MR, Bakris GL, Bushinsky DA et al. Patiromer in patients with kidney disease and hyperkalemia receiving RAAS inhibitors. N Engl J Med 2015;372: 211–221 https://Doi.org/10.1056/ NEJMoa1410853
171. Weir MR, Bakris GL, Gross C et al. Treatment with patiromer decreases aldosterone in patients with chronic kidney disease and hyperkalemia on renin-angiotensin system inhibitors. Kidney Int 2016;90:696–704. https://Doi.org/10.1016/j. kint.2016.04.019
172. ONTARGET Investigators, Yusuf S, Teo KK, Pogue J et al. Telmisartan, ramipril, or both in patients at high risk for vascular events. N Engl J Med 2008;358: 1547–1559. https://Doi. org/10.1056/NEJMoa0801317
173. Parving HH, Brenner BM, McMurray JJ et al. ALTITUDE Investigators. Cardiorenal end points in a trial of aliskiren for type 2 diabetes. N Engl J Med 2012;367:2204–2213. https://Doi. org/10.1056/NEJMoa1208799
174. Fried LF, Emanuele N, Zhang JH et al. VA NEPHRON-D Investigators. Combined angiotensin inhibition for the treatment of diabetic nephropathy. N Engl J Med 2013;369:1892–1903. https:// Doi.org/10.1056/NEJMoa1303154
175. Quach K, Lvtvyn L, Baigent C et al. The safety and efficacy of mineralocorticoid receptor antagonists in patients who require dialysis: a systematic review and meta-analysis. Am J Kidney Dis 2016;68:591–598. https://Doi.org/10.1053/j.ajkd.2016.04.011
176. Weir MR, Kline I, Xie J et al. Effect of canagliflozin on serum electrolytes in patients with type 2 diabetes in relation to estimated glomerular filtration rate (eGFR). Curr Med Res Opin 2014;30:1759–1768. https://Doi.org/10.1185/03007995.2014 .919907
177. Karnik JA, Young BS, Lew NL et al. Cardiac arrest and sudden death in dialysis units. Kidney Int 2001;60: 350–357. https:// Doi.org/10.1046/j.1523-1755.2001.00806.x
178. Jadoul M, Thumma J, Fuller DS et al. Modifiable practices associated with sudden death among hemodialysis patients in the Dialysis Outcomes and Practice Patterns Study. Clin J Am Soc Nephrol 2012;7:765–774. https://Doi.org/10.2215/CJN.08850811
179. Karaboyas A, Zee J, Brunelli SM et al. Dialysate potassium, serum potassium, mortality, and arrhythmia events in hemodialysis: results from the Dialysis Outcomes and Practice Patterns Study (DOPPS). Am J Kidney Dis 2017;69:266–277. https://Doi. org/10.1053/j.ajkd.2016.09.015
180. Heguilen RM, Sciurano C, Bellusci AD et al. The faster potassium-lowering effect of high dialysate bicarbonate concentrations in chronic haemodialysis patients. Nephrol Dial Transplant 2005;20:591–597. https://Doi.org/10.1093/ndt/gfh661
181. Saran R, Bragg-Gresham JL, Levin NW et al. Longer treatment time and slower ultrafiltration in hemodialysis: associations with reduced mortality in the DOPPS. Kidney Int 2006;69:1222– 1228. https://Doi.org/10.1038/sj.ki.5000186
182. Burton JO, Jefferies HJ, Selby NM, McIntyre CW. Hemodialysis-induced repetitive myocardial injury results in global and segmental reduction in systolic cardiac function. Clin J Am Soc Nephrol 2009;4:1925–1931. https://Doi.org/10.2215/ CJN.04470709
183. Cabrera C, Brunelli SM, Rosenbaum D et al. A retrospective, longitudinal study estimating the association between interdialytic weight gain and cardiovascular events and death in hemodialysis patients. BMC Nephrol 2015;16:113. https://Doi. org/10.1186/s12882-015-0110-9
184. Calkins H, Hindricks G, Cappato R et al. 2017 HRS/EHRA/ ECAS/APHRS/SOLAECE expert consensus statement on catheter and surgical ablation of atrial fibrillation. Europace 2018;20:e1. https://Doi.org/10.1093/europace/eux275
Об авторах
Минту П. ТурахияСоединённые Штаты Америки
Петер Дж. Бланкештин
Нидерланды
отделение нефрологии
Хуан-Хесус Карреро
Швеция
отделение медицинской эпидемиологии и биостатистики
Катерин М. Клазе
Канада
отделение Медицины и отделение научных методов исследования в медицине
Райат Део
Соединённые Штаты Америки
секция электрофизиологии, отделение сердечно-сосудистой медицины
Чарльз А. Герцог
Соединённые Штаты Америки
Скотт Е. Каснер
Соединённые Штаты Америки
отделение неврологии
Род С. Пассам
Соединённые Штаты Америки
Роберто Пекуа-Фийо
Бразилия
Холгер Райнеке
Германия
отделение кардиологии и ангиологии
Гаутам Р. Шрофф
Соединённые Штаты Америки
отделение кардиологии
Войцех Зареба
Соединённые Штаты Америки
Майкл Чеунг
Бельгия
Дэвид К. Вилер
Великобритания
Кристоф Ваннер
Германия
Вольфганг К. Винкельмайер
Соединённые Штаты Америки
Рецензия
Для цитирования:
Турахия М.П., Бланкештин П.Д., Карреро Х., Клазе К.М., Део Р., Герцог Ч.А., Каснер С.Е., Пассам Р.С., Пекуа-Фийо Р., Райнеке Х., Шрофф Г.Р., Зареба В., Чеунг М., Вилер Д.К., Ваннер К., Винкельмайер В.К. ХРОНИЧЕСКАЯ БОЛЕЗНЬ ПОЧЕК И АРИТМИИ: ИТОГИ КОНФЕРЕНЦИИ KDIGO ПО СПОРНЫМ ВОПРОСАМ. Нефрология. 2019;23(2):18-40. https://doi.org/10.24884/1561-6274-2019-23-2-18-40
For citation:
Turakhia M.P., Blankestijn P.J., Carrero J., Clase C.M., Deo R., Herzog Ch.A., Kasner S.E., Passman R.S., Pecoits-Filho R., Reinecke H., Shrof G.R., Zareba W., Cheung M., Wheeler D.C., Wanner Ch., Winkelmayer W.C. CHRONIC KIDNEY DISEASE AND ARRHYTHMIAS: CONCLUSIONS FROM A KIDNEY DISEASE: IMPROVING GLOBAL OUTCOMES (KDIGO) CONTROVERSIES CONFERENCE. Nephrology (Saint-Petersburg). 2019;23(2):18-40. (In Russ.) https://doi.org/10.24884/1561-6274-2019-23-2-18-40








































