Перейти к:
К ВОПРОСУ О ПЕРСПЕКТИВАХ ОБНОВЛЕНИЯ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ ПО ГЕМОДИАЛИЗУ
https://doi.org/10.24884/1561-6274-2019-23-2-49-76
Аннотация
За последние годы получено много новых данных относительно тактики и стратегии диализной терапии, которые требуют пересмотра имеющихся клинических рекомендаций. Данный обзор современных критериев адекватности гемодиализа построен в соответствии с работой групп Согласительной конференции KDIGO 2018 года, являющейся основой разработки обновления будущих клинических рекомендаций Международного общества нефрологов. Следует признать, что интенсификация отдельного сеанса диализа достигла предела в части улучшения значимых исходов. Вместе с тем, индивидуальный выбор модальности диализа, условий старта и подготовки к нему, оптимизация скорости ультрафильтрации, выбор состава диализирующего раствора, использование инструментальных методов в коррекции водного баланса позволяют расширить возможности лечения. Сами результаты лечения следует оценивать с пациент-ориентированных позиций. Понятие «целевая эффективность» для пожилых и ослабленных пациентов должно постепенно уступить место понятию «целевая переносимость», при которой адекватный диализ должен обладать минимальными побочными эффектами. В то же время, более частый высокоэффективный диализ может дать преимущества в группе молодых пациентов с высокими метаболическими потребностями. Стоит обратить внимание на диссонанс между оценкой значимости исходов для пациентов и врачей: взаимное понимание целей и желаний приведет к увеличению податливости лечению и удовлетворенности его результатами. Назначение любого лечения (в том числе, диализа) должно, в первую очередь, не вступать в противоречие с императивом «noli nocere!».
Для цитирования:
Румянцев А.Ш., Земченков Г.А., Сабодаш А.Б. К ВОПРОСУ О ПЕРСПЕКТИВАХ ОБНОВЛЕНИЯ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ ПО ГЕМОДИАЛИЗУ. Нефрология. 2019;23(2):49-76. https://doi.org/10.24884/1561-6274-2019-23-2-49-76
For citation:
Rumyantsev A.Sh., Zemchenkov G.A., Sabodash A.B. TO THE QUESTION ABOUT THE PROSPECTIVE FOR THE UPDATES OF CLINICAL GUIDELINES FOR HEMODIALYSIS. Nephrology (Saint-Petersburg). 2019;23(2):49-76. (In Russ.) https://doi.org/10.24884/1561-6274-2019-23-2-49-76
Традиционно появлению нового набора международных рекомендаций KDIGO предшествует Согласительная конференция, которая в отношении заявленной темы прошла 25-28 января 2018 года в Мадриде1. Такие конференции занимаются постановкой задачи и определяют рамки будущих рекомендаций. Несмотря на то, что рабочие материалы остаются только в руках узкой группы участников2, ознакомиться с базовыми положениями и представить себе будущие контуры рекомендаций можно уже сейчас. Мы считаем необходимым представить российскому читателю основные положения, которые обсуждались на Согласительной конференции в четырех рабочих группах.
Неуклонный рост числа диализных пациентов - почти повсеместное явление (рис. 1а), хотя исключения все же есть, и, возможно, это - реализованный эффект нефропротективной стратегии - широко нами пропагандируемой, но далеко не везде широко воплощенной в жизнь (см. рис. 1б). Для всего мира рост составляет 7 % в год, для России - 10 %.
Более того, в развивающихся странах, а в России - еще в большей степени - этот рост обусловлен непропорционально быстрым увеличением доли коморбидных пациентов - в частности за счет увеличения количества пациентов с сахарным диабетом и прогрессированием тяжести сердечно-сосудистой патологии. Так, увеличение числа новых случаев терминальной почечной недостаточности (тПН) у пациентов с сахарным диабетом за 2003-2015 годы почти втрое превышает общее увеличение частоты новых случаев тПН (рис. 2).
С течением времени также происходят общие изменения в демографии, в ожиданиях пациентов (связанных с лечением), а также условий финансирования. Такие изменения не могут остаться незамеченными и ставят перед здравоохранением новые вызовы, вынуждая смещаться в сторону пациент- ориентированного подхода и прорабатывать обновления различных конкретных аспектов помощи.
В области гемодиализа огласительная конференция выделила четыре таких темы, создав, соответственно, четыре рабочие группы по:
- Выбору начальной модальности диализа
- Выбору времени старта и подготовки к старту
- Подготовке диализного доступа
- Оптимальной адекватности диализа и контролю симптомов.
Не может не вызвать удовлетворения тот факт, что недавнее обновление Российских рекомендаций по гемодиализу/гемодиафильтрации, в принципе, идет в русле планируемого апгрейда международных, хотя и наши рекомендации, безусловно, нуждаются в развитии и дельнейшем уточнении, возможно - с некоторым смещением приоритетов.
Активность первой рабочей группы Согласительной конференции была посвящена выбору метода ЗПТ. Её работа заведомо усложнена отсутствием качественных рандомизированных исследований по сравнению результатов лечения при старте с гемо- или перитонеального диализа [1]. В этих условиях опираться (с меньшей мерой доказательности) можно только на сравнения тщательно сопоставленных групп. Например, для коррекции на различия в составе группы 692 пациента, начавших заместительную почечную терапию (ЗПТ) с перитонеальным диализом (ПД) в Норвегии в 2005-2012 гг., были сопоставлены тому же числу начавших с ГД. Как в анализе результатов «по протоколу», так и в анализе по «фактическому лечению» первоначальный выбор модальности не повлиял на риски смерти (ПД vs. ГД: отношение рисков (ОР) 0,87, 95 % ДИ 0,67-1,12 для 2 лет и 0,95, 95 %ДИ 0,77-1,17 для 5 лет). У пациентов моложе 65 лет выбор ПД обеспечил преимущество: ОР 0,39 (0,19-0,81) для 2 лет и 0,49 (0,270,89) для 5 лет соответственно. Выбор ПД не был связан с худшим прогнозом ни в одной из заранее выделенных подгрупп.
Механистический же подход к анализу (в том числе, и с использованием инструмента метаанализа) всегда игнорирует известную предвзятость формирования избранной популяции («survival bias» - см. ниже). В частности, речь идет о том, что коморбидных пациентов, особенно старших возрастных групп, часто стараются как можно дольше «не брать» на ЗПТ. Иногда это происходит потому, что сами больные отказываются в силу разных причин, в том числе и в связи с недостаточной осведомленностью. В таком случае поздний старт диализа является вынужденной мерой, и при формальном статистическом анализе получается, что те, кто «доживают», имеют лучший прогноз.
В то же время, перитонеальный диализ всегда ассоциировался с несколько более ранним стартом и более плановым стартом. Не вызывает сомнения, что в широких эпидемиологических (часто ретроспективных) исследованиях попытки учета тяжести исходной коморбидности остаются формальными, и более коморбидные пациенты «успевают» быть принятыми на ПД, но не доживают до более позднего старта ГД. Это относится как к публикациям прошлого десятилетия, так и к более свежим работам [2, 3]. Сложности соотнесения выживаемости при старте с ПД или ГД усугубляются еще и тем, что структура летальности на разных сроках лечения весьма неоднородна, и эти различия плохо изучены [4], что вообще ставит под сомнение правомерность использования моделей Кокса в оценках рисков (по определению, пропорциональных).
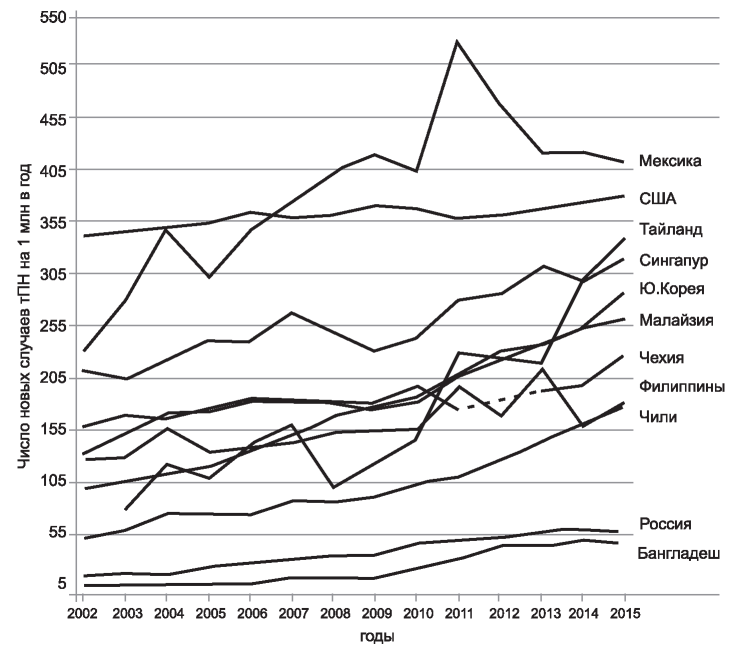
Рис. 1а. Частота новых случаев тПН в странах с увеличением показателя (United States Renal Data System 2018 - Chapter 11: International Comparisons: https://www.usrds.org/2018/view/v2_11.aspx).
Figure 1. The incidence of end stage renal disease in countries with an increase of index (United States Renal Data System 2018 - Chapter 11: International Comparisons: https://www.usrds.org/2018/view/v2_11.aspx).
Рис. 1б. Частота новых случаев тПН в странах без увеличения показателя (United States Renal Data System 2018 - Chapter 11: International Comparisons: https://www.usrds.org/2018/view/v2_11.aspx).
Figure 1. The incidence of end stage renal disease in countries without an increase of index (United States Renal Data System 2018 - Chapter 11: International Comparisons: https://www.usrds.org/2018/view/v2_11.aspx).
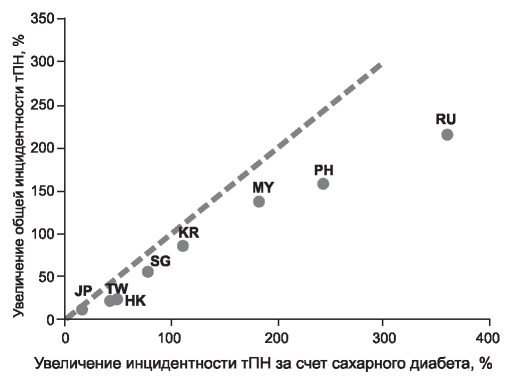
Рис. 2. Соотношение общего увеличения инцидентности тПН и инцидентности тПН за счет сахарного диабета в странах Азии и РФ за период 2003-2016 гг, USRDS 2018 - Chapter 11: International Comparisons.1
JP - Япония, TW - Тайвань, HK - Гонконг, SG - Сингапур, KR - Южная Корея, MY - Малайзия, PH - Филиппины, RU - Россия. Figure 2. Country-level correlation of the percentage change in ESRD incidence with the percentage change in ESRD incidence due to diabetes, from 2003-2016 in Asia and Russia; USRDS 2018 - Chapter 11: International Comparisons1.
Notes: Japan (JP), Taiwan (TW), Hong Kong (HK), Singapore (SG), Rep. of Korea (KR), Malaysia (MY), Philippines (PH), Russia (RU). 1 United States Renal Data System 2018 -Chapter 11: International Comparisons: https://www.usrds.org/2018/view/v2_11.aspx; доступ 29.12.2018
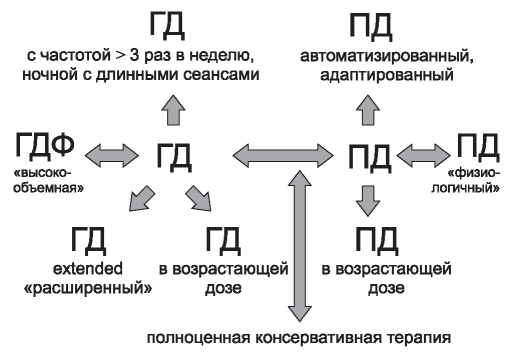
Рис. 3. Современный выбор методов диализа.
Figure 3. Contemporary choice of dialysis modality.
Более того, если ранее мы больше говорили о сравнении ГД и ПД, в том числе, в качестве стартового метода, то сегодня этот выбор трансформировался в целый спектр подходов, открывающих как возможность плавного старта диализа (с шансами на сохранение остаточной функции почек), так и на возможности интенсификации диализных режимов с приданием им более пациент- ориентированных черт (рис. 3).
Интересно, что даже экстренный старт перитонеального диализа не был связан с худшими исходами, чем плановый старт в популяции из более 500 новых пациентов в Тайване в отличие от гемодиализа, по крайней мере - на катетере в качестве начального сосудистого доступа [5].
Анализ французского регистра пациентов на ЗПТ позволяет сделать заключение о том, что девять доступных методик (достаточных, по- видимому, чтобы адаптировать лечение к клиническим характеристикам и возможностям пациентов) распределены по регионам страны неравномерно - вне какого-либо соответствия различиям в популяции пациентов с ХБП или населения в целом. Градиент характеристик пациентов был схожим в линейках от домашнего ГД к ГД в центре и от автоматизированного ПД к ассистируемо- му ПД [6].
Спектр возможного выбора методов увеличила недавно сформулированная концепция «расширенного диализа» (expanded hemodialysis, HDx). При этом применяют диализные мембраны нового типа. Они отличаются узким распределением пор по размерам, что способствует увеличению наклона кривой просеивания. В результате достигается хорошее удаление уремических токсинов с молекулярной массой до 40-50 кДа при практически полном отсутствии потери альбумина (молекулярная масса около 68 кДа) [7]. Получены первые обнадеживающие клинические результаты [8].
Постепенно формулируются критерии, конкретизирующие условия реализации тех или иных возможностей; например, условия для более редкого гемодиализа на старте диализной терапии [9, 10], хотя мы по-прежнему считаем, что оптимальным методом для старта диализа в возрастающей дозе является ПД. С другой стороны - появляются свидетельства тому, что более редкий диализ (двухразовый) может способствовать сохранению остаточной функции почек. В когортном исследовании в крупной диализной сети группа в 351 пациента, начавшая диализ в двухразовом режиме с измеренным почечным клиренсом мочевины >3 мл/мин (4,8 [интерквартильный размах - ИР 3,2^6,7), была сопоставлена с группой в 8086 пациентов, стартовавших в стандартном трехразовом режиме [11]. Пациенты на двухразовом диализе демонстрировали на 16 % меньшее снижение остаточной функции почек в течение первых трех месяцев; различия сохранялись на всем протяжении исследования (15 мес). Летальность в сопоставленных группах при исходном клиренсе выше 3 мл/мин не различалась, хотя при клиренсе ниже 3 мл/мин двухразовый диализ был связан с большим в 1,6 раза риском летальности.
Необеспеченные нужды пациента в переходный период могли бы закрыть специально созданные центры - Transitional dialysis care units - «диализные центры переходного периода», существующие пока в виде планов или пилотных проектов [12].
Создать универсальный алгоритм выбора оптимальной модальности диализа пока не удается, поэтому на практике рассматриваются показатели в каждой особой популяции и ситуации.
Одной из таких быстро растущих популяций являются пожилые пациенты. Углубленный анализ выбора метода ЗПТ среди этих пациентов представлен в обзоре, подготовленном группой Европейской инициативы по наилучшей клинической практике в нефрологии (European Renal Best Practice - ERBP) [13]. Логично предположить, что для таких пациентов оптимальными оказались бы домашние модальности диализа, но общего согласия в этом вопросе нет, и домашние методы диализа развиваются значительно медленнее, чем увеличивается число пожилых пациентов. Диализ в центре остается доминирующим вариантом, несмотря на широкое признание потенциальных преимуществ ПД, включающих отсутствие потребности в сосудистом доступе, постоянную медленную ультрафильтрацию (УФ), меньшее влияние на образ жизни и - в большинстве стран - меньшие затраты. Сравнения методов ГД и ПД в отсутствие рандомизированных контролируемых испытаний основывается на наблюдательных исследованиях, результаты которых противоречивы. Большинство из них, однако, не находят различий в выживаемости во всех группах за исключением пожилых пациентов с сахарным диабетом в сроки более 1-3 лет диализа, у которых результаты ГД лучше. Учитывая особенности данной когорты больных, качество жизни рассматривается как показатель не менее важный, чем выживаемость. По данным мета-анализа (35 работ по 18 шкалам в 9 доменах), различий между ГД и ПД не выявлено [14]. Аналогичные результаты получены и в российской популяции (KDQOL-SF) [15]. В этих условиях выбор метода должен основываться на предпочтениях пациента, сформулированных после всестороннего и непредвзятого информирования. Появляются первые работы, ставящие задачей разработку и оценку вмешательств по привлечению пациентов к совместному принятию решения о первом методе диализа [16].
Мультидисциплинарная команда должна с разных сторон оценить ситуацию, выявить барьеры для проведения домашнего диализа (включая физические, когнитивные, психологические, связанные со зрением, социальные) и попытаться преодолеть их, предоставив адекватную помощь (в том числе, в проведении диализа), обучение и психологическое консультирование [13]. В ходе исследования EPOCH-RRT (Empowering Patients on Choices for RRT в рамках проекта DOPPS - PDOPPS) 614 пациентов на ПД и 1346 пациентов на ГД отвечали на опросник из 39 пунктов. Выяснилось, что больные первой группы чаще получали достаточно информации для понимания различий в модальностях лечения, участвовали в принятии решения о методе диализа и были удовлетворены сделанным выбором. Они также сообщали о более частом вовлечении в процесс близких и родственников. Тем не менее, более 60 % при обеих модальностях не знали о недостатках своих методов [17].
В подготовленном также по инициативе ERBP обзоре 25 исследований в отношении пациентов с сахарным диабетом не было выявлено предпочтительной модальности диализа, по крайней мере, по критерию выживаемости. В связи с этим авторы сделали вывод о необходимости ориентироваться на предпочтения пациента [18].
В анализе общенационального проспективного когортного исследования в Южной Корее преимущество ПД для пациентов с сахарным диабетом продемонстрировано только в группе с удовлетворительным контролем гликемии: при HbA1c <8 % риск смерти на ПД был ниже на 41 % (р=0,03), тогда как при HbA1c >8 % риски смерти при ПД и ГД не различались [19].
Хотя ближайшие исходы трансплантации почки существенно улучшились за последние три десятилетия благодаря современным методам иммуносупрессии, долгосрочные результаты демонстрируют минимальное улучшение [20]. Это расхождение частично относят к расширению критериев для донорства, увеличению возраста пациентов, возвратной нефропатии [21]. Среди других факторов особое внимание уделяется предшествующей модальности диализа. Лишь единичные работы относят лечение ПД к факторам риска. В основном продемонстрированы более быстрое восстановление функции и лучшая долгосрочная выживаемость трансплантированной почки [22-24].
В небольшом, но отличавшемся почти 100 % получением ответов одноцентровом исследовании показано, что достичь уровня 40 % использования ПД с отличными результатами в отношении оценок исходов пациентами вполне возможно. Для этого необходимо структурированное обучение с учетом персональных нужд пациента, адекватная инфраструктура для ПД, преданная достижению результата команда с постоянной поддержкой пациентов. Распространение подобной практики может изменить существующую во многих странах тенденцию к сокращению доли ПД - достойную сожаления как для пациентов, так и для общества в целом [25].
В недавнем обзоре литературы сделан вывод об отсутствии твердых свидетельств преимуществ в выживаемости пациентов при старте с гемо- или ПД - в условиях известных ограничений наблюдательных исследований и отсутствия рандомизированных испытаний. Уже хотя бы поэтому выбор модальности не должен базироваться на выводах о выживаемости, но исходить из индивидуализированного и информированного процесса принятия решения с учетом предпочтений пациента, образа его жизни - с включением в процесс медицинских факторов, различных аспектов доступности ресурсов и наличия необходимой поддержки больных [26].
Связующим тезисом с темой второй рабочей группы - условия старта диализа - является недавно сформулированная официально, но давно существовавшая виртуально идея о диализных центрах «переходного периода». Реализуемая в них программа оптимального перехода (Optimal Transitions Program) предполагает не только собственно старт диализа, но и углубленное ознакомление пациентов с ХБП5 со всеми модальностями диализа, стабилизацию физического состояния, практическое обучение самообслуживанию, выбор вида диализа на основе индивидуальных жизненных мотиваций, целей и окружения. В российских условиях, когда доля чисто амбулаторных диализных центров стремительно растет, и все большая доля из них оказываются оторванными от любых многопрофильных (стационарных) медицинских организаций [27], функционирование диализных центров «переходного периода» на базе последних становится жизненной необходимостью.
В настоящий момент привычные нам значения скорости клубочковой фильтрации для старта ЗПТ в 10 - 5 мл/мин/1,73 м2 (15 мл/мин/1,73 м2 для пациентов с сахарным диабетом) становятся лишь рамками, в пределах которых следует учесть множество факторов (рис. 4).
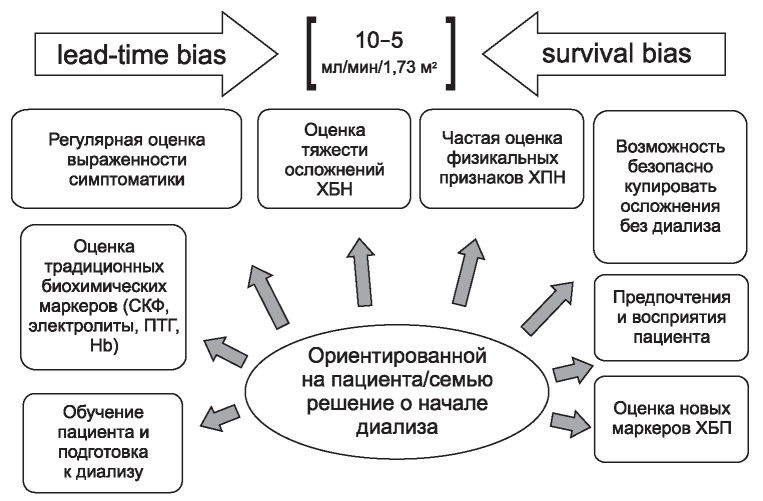
Рис. 4. Условия и основания для принятия решения о старте диализа. lead-time bias - предвзятость преждевременного старта, survival bias - предвзятость искусственного (хотя и непреднамеренного) отбора - за счет пред- диализной выживаемости менее коморбидных пациентов.
Figure 4. Conditions and reason for decision-making for dialysis start.
Note: lead-time bias - bias of premature start, survival bias - bias of artificial (albeit unintended) selection - due to predialysis survival of less comorbid patients.
Оценка относительного вклада этих факторов - предмет актуальных исследований. Пока преимущественно накапливаются лишь данные по фактической практике старта диализа. В странах северной Европы для 446 пациентов принимавшими решение врачами были определены 23 главные причины старта диализа, 63 % из которых были клиническими, 37 % - биохимическими. В 23 % случаев ЗПТ начинали в связи с жизнеугрожающими состояниями. Степень снижения экскреторной функции почек была определена в качестве основной причины только у 19 %, хотя в составе основных и дополнительных причин учитывалась в 69 % случаев: рСКФ на старте составила 7,2±3,4 мл/мин/1,73 м2 (выше - при кахексии, анорексии и отеке легких - 8,2 - 9,8 мл/мин; ниже - при отеках, ацидозе и собственно низкой СКФ - 4,6 - 6,1 мл/мин). Интересно, что врачи- женщины начинали диализ при более высокой СКФ (в среднем, на 0,9 мл/мин) [28].
Развернутая декларация, вводящая понятие переходного периода (transition) от ХБП4 к устоявшемуся плановому диализу, была представлена в 2017 году и в ряде последующих публикаций получила развитие. Переход от «prelude» (пред- диализная помощь) к набору «vintage» (срока лечения диализом) характеризуется самой высокой летальностью (в пересчете на годовую) [29, 30], а также самыми высокими расходами. Именно этот период характеризуется наибольшими пробелами в информации о том, как преодолеть его с наименьшими потерями, индивидуализируя подходы, по крайней мере, к следующим ключевым аспектам [29]:
- наилучшее время перехода к ЗПТ;
- оптимальный метод ЗПТ;
- место его проведения (дома - вспомогательные центры - диализные центры);
- частота (редкий - стандартный - частый);
- влияние преддиализного состояния на результаты последующего лечения диализом (артериальная гипертензия, контроль гликемии, эпизоды ОПП, контроль анемии и минеральных и костных нарушений);
- влияние указанных состояний на процесс принятия решения о выборе диализа или отказе от него в пользу консервативной терапии.
Факторы, влияющие на старт диализа, разнообразны и связаны в большей степени с административными вопросами, чем с клиническими и демографическими особенностями популяции [29]:
- уровень подушевого дохода (по версии Всемирного банка, Россия - в группе стран с высоким доходом);
- доля подушевого дохода, направляемая на здравоохранение [в России - низкая, 3,5 %, в Европе от 4,5 % (Польша) до 10 % (Швеция) от ВВП]3;
- размер оплаты за диализ (в 2016-2018 гг. был установлен федеральным ФОМС и МЗРФ, фактически - корректировался регионами [31], с 2018 г. устанавливается регионами4 и весьма разнообразен), доля частных диализных центров (в России - в 2016 году превысила % и продолжает расти [27]);
- фрагментация системы здравоохранения (в России - разделено по регионам, финансирование зависит от регионального бюджета, федеральный компонент управления ограничен [31]);
- территориальное распределение диализных центров (хотя в России доля населения, проживающая в регионах с обеспеченностью диализам ниже 150 пациентов/млн населения, постоянно снижается и не превышала в 2016 году 14 %, остаются регионы, где 1 диализный центр приходится на 500 000 км2 - сопоставимо с терри- рорией Испании);
- доступность трудовых ресурсов (в России число подготовленных нефрологов быстро растет, но большая часть их проходят первичную переподготовку за 2-3 мес, и только в 2018 году начался существенный прирост числа клинических ординаторов по нефрологии5. Тем не менее, по результатам исследования под эгидой Международного общества нефрологов [32], Россия находится в высшей категории обеспеченности нефрологами (>15 на 1 млн населения - наравне с Восточной и Центральной Европой, незначительно уступая Западной Европе и Северной Америке - 20 и 24 соответственно).
Многие клинико-лабораторные характеристики пациентов за период непосредственно до и после старта диализа претерпевают драматические немонотонные изменения. В частности, это относится к величине артериального давления, массе тела, уровню альбумина, натрия, фосфатов, лейкоцитов [33]. Абсолютные значения этих показателей на преддиализном этапе или их изменения [33-37], а также условия старта [38] и даже наличие депрессии [39] существенным образом влияют на прогноз последующей ЗПТ (табл. 1).
Таблица 1 / Table 1
Клинико-лабораторные характеристики пациентов на преддиализных стадиях ХБП (за период 6-12 мес), значимо связанные с рисками смерти пациентов на диализе (в период 3 мес - 2 года)
The features of predialysis patients (6-12 month before dialysis) associated with mortality after dialysis start (3 month - 2 years)
Параметр в преддиализный период («prelude») | Риски летальности | Срок наблюдения | |
|---|---|---|---|
Вариабельность* Hb в предшествовавшие 6 мес: высший квартиль вариабельности (>9,6 г/л) vs. низшего (<4,6 г/л) (n= 11 872) [35] | 1,10 [1,02-1,19] - общей 1,28 [0,93-1,75] - инфекционной | 1,3 года | |
Средняя щелочная фосфатаза за 6 мес: высший квартиль ЩФ (>111 МЕ/л) vs. низшего (<66 МЕ/л) (n= 17 732) [36] | 1.42 (1,34-1,51) - общей 1.43 (1,09-1,88) - серд.-сосудистой 1,39 (1,09-1,78) - инфекционной | 2 года | |
Колебания АД в течение года перед диализом: высший квартиль колебаний (>20 ммНд) vs. низшего (<12 ммНд) (n= 17 729) [40] | 1,08 (1,01-1,16) - общей 1,41 (1,10-1,80) - инфекционной | 2 года | |
Среднее систолическое АД (в сравнении с 140-149 мм рт. ст.) за предшествующий год (n= 17 729) [37] | <120 120-129 130-139 150-159 >160 | 2,40 (1,96-2,93) 1,99 (1,66-2,40) 1,35 (1,13-1,62) 0,98 (0,78-1,22) (NS) 0,76 (0,57-1,00) | 3 мес |
Средний уровень гликированного Hb в предшествующий год (в сравнении с нормальным уровнем 6-7 %) (n= 17 819) [34] | 7- 8% 8- 9% | 1,19 (1,07-1,32) 1,48 (1,31-1,67) | 1 год |
Начало диализа в стационаре vs. амбулаторно (n= 48 261) [38] | 0-6 мес 0-12 мес | 1,07 (1,01-1,13) 1,05 (1,01-1,10) | 6-12 мес |
Депрессия в преддиализном периода (у 23 % пациентов), (n= 45 076) [39] | 1,06 (1,03-1,09) | 1 год | |
* Вариабельность оценивалась в соответствии с учетом тренда на снижение уровня гемоглобина. |
| ||
Следует отметить, что эти оценки в серии опубликованных работ одной большой группы авторов сделаны на основе наблюдения за переходным периодом - стартом диализа в крупной, но специфичной группе пациентов - ветеранов армии США, получающих лечение (в том числе, диализом) в отдельной медицинской сети, т.е. речь идет о наиболее сохранных и активно наблюдаемых пациентах.
Другим подходом к оценке влияния условий старта диализа на последующие исходы является использование параметров, которые характеризуют состояние пациента непосредственно перед стартом диализа (вместе с его постоянными характеристиками). Построенные на основе этих оценок множественные регрессионные модели предсказывают более или менее краткосрочные результаты лечения. Сами прогнозы имеют ограниченное клиническое применение, но некоторые используемые в них факторы являются модифицируемыми или изменяются прогнозируемым в ходе снижения функции почек образом. Поэтому возникает возможность использовать некоторые предикторы при принятии решения о начале диализа: в случае, если дальнейшее увеличение рисков становится неприемлемо высоким, следует начинать диализ или предварительно скорректировать модифицируемые риски. Следует отметить, что если ряд разработанных шкал прошли не только внутреннюю, но и внешнюю валидацию (см. обзоры в [41, 42]), то предположение о полезности этого инструмента в принятии решения о старте диализа пока не подтверждено в прямых испытаниях. К настоящему времени моделью, прошедшей самое широкое внутреннее и внешнее подтверждение, является модель J. Floege [43], единственной построенной на Российской диализной популяции - модель START [42].
Риски lead-time bias и survival bias
При анализе выживаемости, как критерия своевременности принятия решения о старте диализа, сложно уйти от двух предвзятостей. С одной стороны, потенциально «преждевременное» принятие на диализ искусственно удлиняет продолжительность лечения (за счет начального периода времени, когда диализ, возможно, еще не является необходимым), что приводит к увеличению выживаемости, если рассчитывать ее с временной точки старта диализа («lead-time bias»). C другой стороны - стремление отодвинуть начало диализа к возможно более поздним стадиям тПН приводит к формированию популяции «избранных» пациентов, выживших до падения функции почек, к очень низкому уровню, создавая за счет выбывания умерших на предыдущих этапах более комор- бидных пациентов группу, имеющую более высокие шансы на выживаемость («survival bias»). Разрешить эту дилемму могло бы исследование, в котором пациенты в группу раннего и позднего старта были бы рандомизированы на заведомо преддиализной стадии (до и раннего, и позднего старта). Такое исследование было проведено (IDEAL [44]). В нем продемонстрирована равная выживаемость в группах, однако, требуется отметить, что протокол реализовать не удалось. Пациентов предполагалось рандомизировать в группы раннего (клиренс креатинина 14-10 мл/ мин/1,73 м2) и позднего (7-5 мл/мин/1,73 м2) старта диализа, но фактически в группе позднего старта диализ начали ранее установленного диапазона 76 % (!) пациентов, а в группе раннего старта диализ начали позднее 19 % пациентов. В результате различие в стартовой СКФ (в пересчете по MDRD) составило менее 2 мл/мин/1,73 м2 (9 vs. 7,2 мл/1,73 м2 мин). Это исследование является хорошим примером эффекта двух упомянутых выше предвзятостей (рис. 5): лечение в ранней группе начато раньше (?) на 5 мес, но до старта лечения в поздней группе не дожили 5 % пациентов. Вопрос о том, что весомее, не относится к области статистики, а скорее требует обсуждения для совместного с пациентом принятия решения (см. раздел о контроле симптоматики).
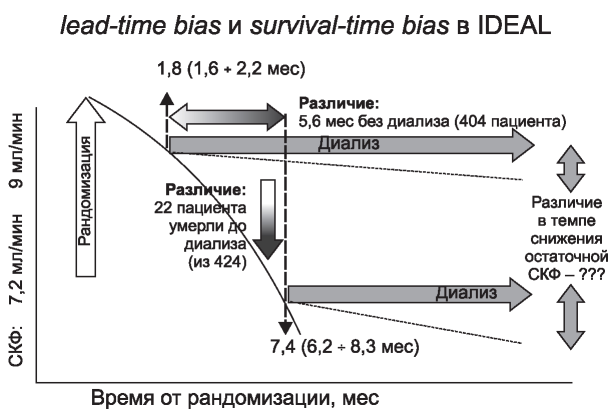
Рис. 5. Иллюстрация предвзятости преждевременного старта (lead-time bias) и предвзятости «естественного» отбора (survival-time bias) в исследовании IDEAL: лечение в ранней группе начато (если судить по одинаковой последующей выживаемости) преждевременно на 5 мес, но до старта лечения в поздней группе не дожили 5 % пациентов. Схема построена по результатам исследования IDEAL [44].
Figure 5. Illustration of premature start bias (lead-time bias) and “natural” selection bias (survival-time bias) in the IDEAL study: treatment in the early group started prematurely (judging by the same subsequent survival) for 5 months, but 5% of patients in the late group did not survive until the dialysis start. The scheme is based on the results of the IDEAL study [44].
Помимо прогнозирования результатов лечения диализом, всё большую актуальность приобретают вопросы определения времени достижения потребности в диализе для пациентов с продвинутыми стадиями ХБП. Они важны как для отдельного пациента (оценка риска осложнений, оценка соотношения пользы и вреда от вмешательств, время обучения пациента по модальностям ЗПТ, время создания диализного доступа), так и для системы здравоохранения (оценка расходов и соотношения цена/эффективность, планирование передачи пациентов от врача общей практики нефрологу или в «клинику низкой СКФ»). В Санкт- Петербурге с 2017 года планирование увеличения потребности в диализных местах ТФ ОМС основывает не только на выживаемости пациентов на диализе, но и на числе пациентов с ХБП С3Б- 4 стадий, находящихся под наблюдением нефрологического центра. Наиболее популярным и подтвержденным (в том числе, в мета-анализе [45]) инструментом для такого прогнозирования является шкала Kidney Failure Risk Equation (KFRE) [46, 47].
Третья рабочая группа обсуждала вопросы диализного доступа. Впечатляющим диссонансом выглядит разница в частоте использования арте- риовенозной фистулы (АВФ) среди всех лечащихся (превалентных) и новых пациентов в России. Занимая безусловное первое в мире место по доле превалентных пациентов с АВФ (более 90 %), в половине случаев мы начинаем диализ с временного сосудистого доступа в связи с необходимостью экстренного старта диализа.
Ключевыми характеристиками сосудистого доступа являются сохранение проходимости и отсутствие осложнений - сердечно-сосудистых и инфекционных. В мета-анализе 59 исследований с почти 12 тыс. пациентов средний срок первичного функционирования фистулы составил 20 мес в широком диапазоне по характеристикам пациентов и месту формирования от 9 до 28 мес [48] при однолетней «выживаемости» в 64 %. Вторичная однолетняя проходимость (в том числе, и после реконструкций) в мета-анализе 65 исследований достигла 80 % при среднем сроке функционирования в 28 мес. В мета-анализе 76 исследований частота инфекционных осложнений оценена в 0,018 на 100 дней функционирования фистулы. Фистулы, созданные до начала диализа, функционировали дольше, чем сформированные после старта диализа. Анализ затруднен разнообразием использованных определений проходимости, созревания, функциональности и утраты фистул, а также связанных с доступом инфекций. В России анализ состояния сосудистого доступа ограничен в основном региональными регистрами, иногда - довольно крупными (например, по Московской области - 3837 операций у 1862 пациентов) [49]. В целом, они демонстрируют сопоставимые результаты с крупными международными регистрами, хотя также используют неодинаковые определения. Одной из задач рекомендаций является унификация определений, что будет способствовать формированию более убедительной доказательной базы. Всесторонний анализ исходов важен ещё и потому, что некоторые исследования ставят под сомнения устоявшееся представление о том, что прогноз для пациента зависит от выбора типа доступа. В исследовании DOPPS (6119 пациентов) риски смерти у пациентов на временном сосудистом доступе были вдвое выше, чем на фистулах, но эта связь ни в какой мере не была опосредована осложнениями сосудистого доступа, поскольку их включение или исключение из модели никак не влияло на величину относительного риска, связанного непосредственно с доступом [50]. Возможно, как более высокая летальность, так и вынужденный выбор центрального венозного катетера в качестве доступа взаимосвязаны с более высокой коморбидностью.
В отличие от проходимости фистул и инфекционных осложнений сердечно-сосудистые осложнения сосудистых доступов остаются недооцененными и мало исследованными. В первую очередь это относится к сердечной недостаточности с сохранной фракцией выброса (HFpEF) [51], а сброс по доступу с резким падением системного сосудистого сопротивления представляется важнейшим механизмом её формирования [52]. Без отлаженной системы инструментальной (возможно, и лабораторной) диагностики контролировать эту проблему невозможно.
Таблица 2 / Table 2
Темп снижения СКФ при разных стадиях ХБП в проспективном наблюдении [55]
The rates of GFR decrease in different CKD stages in prospective study [55]
Стадия ХБП | Число пациентов | Средняя скорость снижения СКФ, (95 % ДИ), мл/мин/1,73 м2 за год |
|---|---|---|
3А | 366 | -1,27 (-1,96 - -0,57)* |
3Б | 879 | -2,64 (-3,14 - -2,15)* |
4 | 959 | -4,83 (-5,31 - -4,36)* |
5 | 241 | -6,28 (-7,24 - -5,33)* |
Примечание. * Отличие от 0, p<0,001; 95 % ДИ - доверительный интервал; темпы снижения оценены в модели линейной регрессии по пяти точкам и более.
По-прежнему остается необходимость заблаговременного формирования сосудистого доступа. Однако в последние годы внимание привлек еще один аспект проблемы. Первоначально сообщения о меньшей скорости снижения СКФ после создания фистулы воспринимались как курьезные, однако подтверждения этой случайной находки продолжают поступать: после создания фистулы/протеза медиана (ИР) темпа снижения СКФ уменьшилась с 18,1 (20,6-15,9) до 8,3 (8,8-7,5) мл/ мин/1,73 м2 (p<0,001), тогда как в группе сравнения у пациентов без фистулы в соответствующий период преддиализной истории темпы снижения СКФ увеличивались по мере приближения к диализу [53]. Обращает, правда, на себя внимание слишком высокая медиана в группе сравнения. Объяснением может быть непреднамеренный «отбор» пациентов: мета-анализ 60 исследований по оценке темпов снижения СКФ [54] количественно подтвердил очевидное различие в двух типах исследований - часть из них базируются на динамически собранных данных у пациентов с ХБП С3-5 (многие из которых умирают до диализа), другая часть - на ретроспективной оценке темпов снижения СКФ в некоторый период, предшествовавший фактическому старту диализа; соответственно, в мета-анализе получены различные медианы для темпов снижения СКФ в двух группах исследований: 2,4 (95 % ДИ: 2,2-2,6) vs. 8,5 (6,8-10,1), различие - 6,0 (4,8-7,2) мл/мин/1,73 м2. В табл. 2 приведены темпы снижения СКФ в проспективном наблюдении Городского нефрологического центра Санкт-Петербурга [55].
Темп и траектория снижения остаточной функции почек может в существенной степени повлиять на избираемую тактику и успех в своевременном формировании сосудистого доступа. В когорте 11 тыс. пациентов, у которых величина рСКФ была ниже 25 мл/мин/1,73 м2 (средняя при включении в группу - 18 мл/мин/1,73 м2), за год последующего наблюдения 25 % начали диализ, но только 39 % из них - со сформированным постоянным доступом. Пожилым пациентам реже формировали доступ, но еще реже они начинали диализ. Если бы всем на старте наблюдения были бы созданы сосудистые доступы, соотношение числа невостребованных к востребованным за двухлетний период у пожилых пациентов (>85 лет) со ставило 5:1, тогда как для молодых (18-44 года) - 0,5:1 [56]. Пожилых пациентов характеризовали более пологие траектории снижения рСКФ и в российской когорте [57]. Среди 1929 пациентов из Канады после создания фистулы 81 % начали диализ с медианой отсрочки в 6 мес, 9 % умерли без диализа через 11 мес, а 10 % остались в преддиа- лизном наблюдении с медианой срока 39 мес. За 3-12 мес до начала диализа фистула была сформирована у 40 % пациентов и по 30 % составили группы с отсрочкой старта диализа менее 3 мес и более 1 года. Пожилые пациенты, женщины и менее коморбидные пациенты характеризовались большими сроками ожидания.
Действующими рекомендациями определены лишь общие рамки сроков заблаговременного создания постоянного сосудистого доступа - за 3-6 мес до предполагаемого старта диализа. Рабочая группа определила следующие факторы, способные повлиять на этот диапазон6:
- индивидуальные факторы, характеризующие пациента (как объект);
- коморбидность и возраст;
- факторы, контролируемые нефрологом;
- исходная экскреторная функция почек;
- траектория её снижения;
- вероятность старта диализа после создания фистулы;
- индивидуальные факторы, характеризующие пациента (как субъект);
- обучение пациента;
- взгляды пациента (оценки перспектив).
В качестве иллюстрации значимости взаимодействия с пациентов можно привести результаты исследования SONG [58], где пациенты и профессионалы одинаково высоко оценили важность функционирования сосудистого доступа и инфекции, но пациенты меньшую значимость придавали синдрому обкрадывания, созреванию фистулы, рискам кровотечения1.
Далее представлены вопросы четвертой Рабочей группы - выделение оптимальных методов оценки адекватности диализа и формулировка целей для этих параметров, а частично - и средств к их достижению.
В идеале пациентом, получающим адекватное лечение диализом, можно было бы назвать физически активного, соблюдающего адекватную диету, стабильно пребывающего в эуволемии человека, у которого поддерживается хорошее качество жизни, а срок ожидаемой жизни не отличается от практически здоровых лиц аналогичного возраста [59]. Некоторые из этих целей неосуществимы в настоящее время в полном объеме. В рамках практических задач рабочая группа сформулировала следующие группы критериев в качестве мер адекватности диализа:
- биохимические индексы;
- водный статус;
- контроль симптомов;
- нутриционный статус.
А также обозначила зону поиска новых физиологических индексов, характеризующих шансы на снижение или исключение риска развития долгосрочных диализных осложнений, регресс которых практически невозможен.
Биохимические индексы
Ранее мы опубликовали детальный обзор построенных на мочевине (или её суррогатах) биохимических индексов, традиционно представляющих адекватность диализа с точки зрения выведения низкомолекулярных уремических токсинов. Точный расчет обеспеченной дозы диализа в классическом исполнении и с учетом меняющегося объёма распределения мочевины предполагает проведение кинетического моделирования мочевины и измерения её концентрации в крови в дополнительных временных точках, что (вместе с усложненным расчётом) сделало такой подход малораспространенным. Вместо него используют упрощенные формулы для оценки обеспеченной дозы диализа [60]. Широко применяется оценка дозы диализа с учтенным вкладом конвекционного транспорта за счет ультрафильтрации по логарифмической формуле Daugirgas - формула (1) обозначается как Daugirgas-II, или D2 [61].
Kt/V = -ln(R - 0,008xt) + (4-3,5xR)xUF/W, (1)
где R - отношение уровней мочевины после и до диализа, t - длительность сеанса в часах, UF - объём ультрафильтрации за сеанс, а W - масса тела.
Коэффициент 0,008 корректировал величину снижения концентрации мочевины за сеанс на фактор генерации мочевины во время сеанса (которая противодействует снижению мочевины и, тем самым, занижает фактически обеспеченную дозу диализа). Для более частого диализа этот коэффициент не соответствует новой ситуации, и в ходе исследования FHN для нескольких схем более частого диализа рассчитаны и подтверждены другие значения (табл. 3).
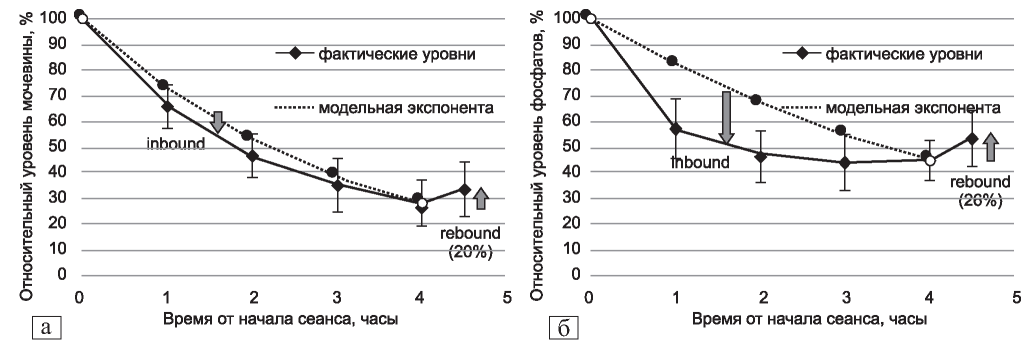
Рис. 6. Динамика уровней мочевины (а) и фосфатов (б) в ходе сеанса гемодиализа.
Figure 6. Dynamics of urea and phosphate levels during a hemodialysis session.
Очень наглядно и доступно на примере аквариума с рыбкой, загрязняющей его продуктами своей жизнедеятельности, модели очищения представлены в пятом переиздании руководства Догирдаса [62]. Упрощенная модель рассматривает тело пациента как единое водное пространство, в котором равномерно распределены растворенные вещества. Реальные модели выведения уремических токсинов построены с учетом наличия, по меньшей мере, двух пулов растворенных веществ - двух объемов распределения. Отправной точкой этой концепции являлся обнаруженный эффект рикошета мочевины (rebound) - быстрого увеличения ее концентрации в крови после окончания сеанса гемодиализа за счет перераспределения из второго пула. На рис. 6 в качестве иллюстрации представлены результаты нашего анализа динамики концентраций мочевины и фосфатов в крови в ходе и после сеанса гемодиализа (полученные у стабильных пациентов контрольных групп в рамках исследований по состоянию сосудистого доступа и коррекции фосфатемии).
Для расчета «сбалансированного» Kt/V с учетом эффекта рикошета мочевины (eKt/V) при прямом сравнении методов расчета с референтным (моделирование мочевины по трем точкам) [63] оптимальным оказался метод, основанный на учете интенсивности диализа K/V [равного отношению (Kt/V)/t после сокращения на t] [64]: eKt/V = spKt/V - 0,6 X (spKt/V)/t + 0,03, где t - длительность сеанса в часах.
Таблица 3 / Table 3
Коэффициенты поправки на генерацию мочевины в ходе сеанса гемодиализа для формулы (1) при различной частоте сеансов
Correction factor for urea generation during dialysis session for formula (1) for different dialysis frequency
Кратность сеансов в неделю | Время после предыдущего диализа, дни | ||
|---|---|---|---|
1 | 2 | 3 | |
3 |
| 0,008 | 0,0060 |
4 | 0,0155 | 0,0090 |
|
5-7 | 0,0175 | 0,0095 |
|
Целевые значения некоторых актуальных клинических рекомендаций представлены в табл. 4. Большинство рекомендаций по адекватности в части дозы диализа не обновляли уже около 10 лет и более. Установленная доза одного сеанса в трехразовом режиме (довольно низкая в сравнении с возможностями современных диализаторов) служит гарантией очевидного недодиализа. Убедительных преимуществ её повышения в наблюдательных исследованиях не получено, а последним рандомизированным испытанием (также не подтвердившим преимуществ дальнейшего повышения дозы) было HEMO Study [65]. В последующем поиски велись в области сравнения высоко- и низкопоточных мембран (MPO Study - выявившее преимущество высокого потока у пациентов с ги- поальбуминемией), а затем - гемодиафильтрации (ГДФ). Преимущество в выживаемости удалось продемонстрировать в первичном анализе только в одном из четырех крупнейших исследований по ГДФ [66], а также в мета-анализе объединенных данных четырех исследований - 2793 пациента [67]: общая летальность на ГДФ была ниже на 14 % (95 % ДИ 1-25 %), сердечно-сосудистая - на 23 % (3-39 %). В каждом из исследований преимущества были получены (а в объединенном анализе были выше) у группы пациентов с более высоким конвекционным объемом. Эти данные послужили для EUDIAL group основанием для определения понятия адекватности ГДФ - 21 л объема замещения. Гемоконцентрация, формирующаяся в выходной части диализатора в результате такой большой ультрафильтрации, может приводить к тромбированию диализатора и неизбежно снижает диффузионный клиренс. Для уменьшения этих рисков вводится ограничение по фильтрационной фракции - отношению ультрафильтрации к кровотоку по контуру - не выше 25 %. Соблюдение обоих условий адекватности ГДФ может потребовать высоких кровотоков и/или удлинения сеансов.
Таблица 4 / Table 4
Целевые показатели адекватности диализа в некоторых клинических рекомендациях (в скобках приведены оригинальные оценки авторов в отношении убедительности и твердости свидетельств)
Target indicators of the dialysis adequacy in some clinical guidelines (the original authors' assessments regarding the strength of recommendation and the quality of the supporting evidence are given in parentheses)
Источник | Критерий | Примечания |
|---|---|---|
Российские национальные рекомендации [68] (2016) | eKt/V - 1,2; = spKt/V - 1,4. stdKt/V > 2,2 (1А) | Продолжительность сеанса при трехразовом режиме - не менее 4 ч, вне зависимости от Kt/V (1А) |
KDOQI Clinical Practice Guideline for Hemodialysis Adequacy: 2015 Update [69] | Целевой spKt/V - 1,4, минимально обеспеченный - 1,2 (2B) | Можно учитывать остаточную функцию почек. Более частый диализ целевой stdKt/V - 2,3 в неделю; минимально обеспеченная доза 2,1 (Not graded) |
Hemodialysis Clinical Practice Guidelines for the Canadian Society of Nephrology [70] 2006 | spKt/V>1,2 (Grade C) | Раздел по частому и длительному диализу обновлен отдельным набором рекомендаций [71] (2013) по «intensive hemodialysis» (Conditional recommendation; very low-quality evidence) |
European Best Practice Guidelines for HD (Part 1) [72], 2002 | eKt/V>1,20 (sp Kt/V «1,4) (Evidence level: B) | В части II (2007) - расширение показаний к большей частоте и продолжительности сеансов, без изменений в отношении Kt/V (Opinion - III) |
Renal Association Clinical Practice Guideline on Haemodialysis (Великобритания, 2009) [73] | eKt/V >1,2 (или spKt/V>1.3) ( Evidence) | Чтобы обеспечить всем, цель - eKt/V >1,3 или ДСМ>70 %; от большей дозы выиграют женщины и пациенты с малым размером тела |
EUDIAL group (ERA-EDTA)1 | Объем замещения на сеансе гемодиафильтрации = 21 л; (конвекционный объем - 24 л, контроль фильтрационной фракции ≤ 25 % от кровотока) | |
Таблица 5 / Table 5
Обеспеченные дозы диализа в России и некоторых странах
The provided dialysis doses in Russia and in some countries
Источник | spKt/V | Скорость УФ, мл/ч/кг | Длительность сеанса, мин |
|---|---|---|---|
Российский регистр [74], 2013 | <1,2 - 10 %; 1,2-1,6 - 59 %; >1,6 - 31 % |
|
|
СПб регистр ЗПТ, 2016 | <1,2 - 3 %; 1,2-1,6 - 61 %; >1,6 - 36 % |
| <210 - 0 % 210-240 - 73 % >240 - 26 % |
DOPPS1, США, декабрь 2017 | <1,2 - 4 %; 1,2-1,6 - 50 %; >1,6 - 45 % 5-95 % 1,21-2,04 | <10 - 74 %; 10-13 - 17 %; >13 - 9 % | <210 - 29 % 210-240 - 41 % >240 - 30 % 5-95 % 180-257 |
DOPPS1, Канада, апрель 2016 | <1,2 - 13 %; 1,2-1,6 - 47 %; >1,6 - 40 % 5-95 % 1,07-2,02 | УФ - медиана - 2,48 % Q1-Q3 - 1,3-3,18 % 5-95 % 0,34-5,72 | <210 - 16 % 210-240 - 59 % >240 - 25 % 5-95 % 180-269 |
DOPPS1, Германия, декабрь 2014 | <1,2 - 11 %; 1,2-1,6 - 47 %; >1,6 - 42 % 5-95 % 1,09-2,09 | УФ - медиана - 2,24 % Q1-Q3 - 1,53-3,6 % 5-95 % -0,07-4,51 | <210 - 2 % 210-240 - 25 % >240 - 73 % 5-95 % 239-314 |
1 DOPPS Practice Monitor: https://www.dopps.org/dpm/ Last Data Update: April 2018 (data through February 2018) доступ 24.01.2019
Авторы рекомендаций по-разному оценивают убедительность и твердость одной и той же базы доказательств. Высокая оценка в Российских рекомендациях - отчасти реакция на сохраняющуюся неприемлемо высокой долю пациентов с Kt/V<1, 2 (табл. 5).
Все это относилось к отдельному сеансу гемодиализа. Сравнение режимов диализа с разной кратностью в неделю требует оценки общей недельной дозы диализа, которую нельзя получить простым суммированием значений каждого сеанса. Для этого была разработана концепция стандартного Kt/V (stdKt/V), определяемого как недельная генерация мочевины, отнесенная к среднему за неделю уровню мочевины перед сеансом и стандартизованная по объёму распределения мочевины. Точный расчет, как и для однопулового Kt/V, требует осуществления кинетического моделирования мочевины, но, как и для spKt/V, сначала F.A. Gotch [75] с последующим уточнением J.K. Leypoldt и соавт. [76] была создана расчётная формула:
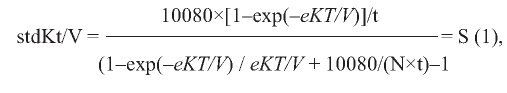
где 10 080 - количество минут в неделе, eKT/V - выровненный KT/V, t - длительность сеанса (в минутах), N - число сеансов в неделю, S - обозначение полученного выражения для использования в дальнейших уточнениях.
Эти уточнения формулы (по J. Daugirdas [77]) связаны с учетом вклада ультрафильтрации в транспорт растворенных веществ через диализную мембрану (первая строка приведенной ниже формулы - 2а), а также остаточного почечного клиренса по мочевине (вторая строка формулы - 2б):
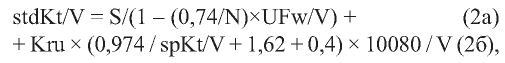
где S - расчет stdKt/V по Gotch- Leypoldt (формула 1), N - число сеансов гемодиализа в неделю, UFw - суммарный объем ультрафильтрации за все сеансы в неделю, V - объём распределения мочевины, Kru - остаточный почечный клиренс по мочевине; за ним следует эмпирический коэффициент, учитывающий уменьшение эффективности остаточной функции почек на фоне проведения диализа.
Доступен широкий набор калькуляторов по адекватности диализа, включая расчет стандартного Kt/V8, калькулятор дозы диализа доступен для скачивания на сайте Российского Диализного общества9.
Несмотря на то, что концепция стандартного Kt/V была разработана в рамках преимущественно виртуального моделирования 15 лет назад, масштабное исследование для клинического подтверждения установленной цели впервые опубликовано совсем недавно [78]. В когорте 109 тыс пациентов stdKt/V<2,1 был связан с большим на 11 % риском смерти ((95 % ДИ 7÷14 %), тогда как превышение величины stdKt/V>2,3 ассоциировалось со снижением риска смерти всего на 3 % (ДИ1÷6 %). При этом такой зависимости не выявлено в группе 2373 пациентов на домашнем гемодиализе. Независимо от модальности увеличение стандартного Kt/V не было связано с клинически значимыми улучшениями метаболического контроля (калий, кальций, фосфаты, бикарбонат).
В упрощенном варианте объемы распределения растворенных веществ ранее сопоставляли с внеклеточной и внутриклеточной жидкостью, поскольку моделирование указывало на то, что «дальний», секвестрированный сектор (compartment) по объему существенно больше «ближнего»; главной мембраной между ними называли клеточную мембрану. Позднее стало ясно, что для мочевины и многих других низкомолекулярных веществ секвестрирование происходит не на уровне клеточной мембраны, а на уровне хорошо или плохо перфузируемых в ходе сеанса органов и тканей. Так называемая модель (неравномерного) регионального кровотока лучше объясняла такие эффекты, как увеличение рикошета при большей ультрафильтрации (которая уменьшает ОЦК и ухудшает перфузию тканей) и уменьшение рикошета при состояниях с высоким сердечным выбросом, а также при физической активности (когда перфузия тканей улучшается) [79]. Зеркальным отражением этого эффекта является эффект инбаунда - когда снижение концентрации вещества в ходе диализа происходит быстрее, чем можно было бы ожидать, исходя из однопуловой модели. Особенно выражен этот эффект, например, для фосфатов, которые в течение первого часа диализа снижаются в 1,5-2 раза иногда до субнормальных значений (из-за очень медленного перемещения из внутриклеточного сектора), а вскоре после сеанса поднимаются практически к исходным величинам (за счет перемещения из мало очищенного внутриклеточного сектора и плохо перфузируемых секторов тела) [80] - рис. 6.
Подобные графики строятся, когда информация о параметрах кинетики мочевины (или фосфатов) получена по нескольким точкам биохимических исследований крови за сеанс (число которых по понятным причинам ограничено). Сегодня в распоряжении клиницистов и исследователей имеются on-line сенсоры, которые отслеживают динамику снижения уровня растворенного вещества в отводимом диализате практически непрерывно. Это позволяет детальнее проследить, что кривая снижения концентрации происходит не по теоретически ожидаемой экспоненте, а по двум (как минимум) наложенным друг на друга экспонентам (рис. 7). Параметры каждой из них, вероятно, отражают скорости перемещения вещества между водными секторами - «дальний» (плохо перфузируемый, внутриклеточный) - «ближний» (внеклеточный - внутрисосудистый) - диализи- рующий раствор [81].
Возможно, такое разделение кривых позволит в ходе последующих исследований соотнести их параметры со значимостью барьеров между водными секторами тела для прохождения растворенных веществ. Там, например, где более значим «ближний» барьер между кровью и диализатом (диализная мембрана) целесообразно увеличивать клиренс диализатора; там, где более существен «дальний» барьер между межклеточной средой и кровью (стенка капилляра) - увеличение клиренса диализатора ничего не сможет добавить, а требуется увеличение времени и/или частоты сеансов. Иллюстрацией второй ситуации могут быть результаты рандомизированного перекрестного исследования, в котором использование двух высокопоточных диализаторов параллельно (кровоток 350 мл/мин, поток диализата 800 мл/мин) не привело ни к большему клиренсу или общему удалению фосфатов за сеанс, ни меньшей преддиализной концентрации фосфатов [82].
Обе существующие в настоящее время on-line методики оценки обеспеченной дозы диализа строятся на суррогатах мочевины - или по ионному диализансу натрия оценивается клиренс диализатора (который затем пересчитывается в Kt/V), или выведение мочевины экстраполируется из выведения мочевой кислоты (оценка которого - в отличие от мочевины - доступна спектрофотометрически). Оба метода с соответствующими эмпирически найденными корректирующими коэффициентами хорошо подтверждены в сравнении с референтными методами [60], хотя ни натрий, ни мочевая кислота не могут считаться полным эквивалентом мочевины. Впрочем, и мочевина используется в оценке дозы диализа несмотря на очевидное несоответствие кинетике других уремических токсинов только благодаря отсутствию лучшей альтернативы.
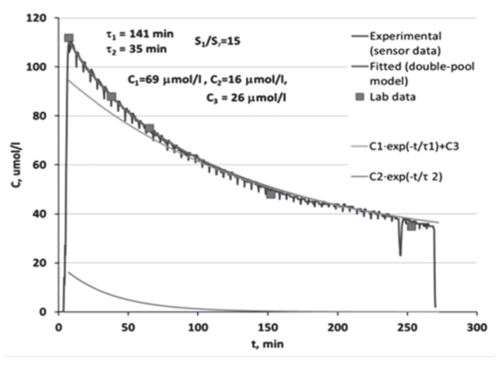
Рис. 7. Построение двух экспонент по фактическому графику снижения спектрофотометрически выявляемой концентрации растворенного вещества в отводимом диализате on-line, собственные данные [81].
Figure 7. Building of two exponents according to the actual reducing the spectrophotometrically detected concentration of a solute in the spent dialysate on-line, the own data [81].
С 2003 года рабочей группой ERA-EDTA (EUTOX) собирается база данных по уремическим токсинам (сегодня в ней - 130 веществ), с доступной информацией о каждом из которых можно познакомиться на сайте рабочей группы10. Из этих веществ половина - низкомолекулярные водорастворимые и по четверти - среднемолекулярные и связанные с белками (большая часть из последних - с молекулярной массой не более 500 дальтон). Только для 75 веществ найдены неблагоприятные ассоциации, чаще других - с сердечно-сосудистой патологией. И никакое из них не заслужило пока статуса кандидата на маркер для оценки дозы диализа. Вероятно, оттого, что на каждое вещество приходится лишь по 1-2 исследования по изучению их концентраций и эффектов. Можно предположить, что едва ли в ближайшем будущем появятся подтвержденные строгими доказательствами маркеры адекватности из области средних, а тем более - крупных молекул. И в рекомендации они, скорее всего, не попадут. Более того, обилие и неопределенный статус кандидатов на важные уремические токсины порождают пессимистические (в отношении дозирования диализа) идеи - «Dialysis cannot be dosed» [83]. Адекватному диализу с этой точки зрения трудно дать определение, поскольку мы не идентифицировали в должной мере токсичные продукты, ответственные за развитие большинства патологических состояний. Соответственно, определить оптимальный режима диализа невозможно, если исходить из цели коррекции уровня уремических токсинов. Современный подход к этому аспекту, состоящий в том, что адекватная
доза диализа устанавливается на основе фракционного удаления мочевины из организма, является лишь компромиссом: в качестве ключевого критерия качества установлен минимальный уровень Kt/V по мочевине, который исключает элементарно неадекватный диализ. Дозирование же диализа на основе одного относительно нетоксичного вещества способно дать очень мало в части улучшения результатов лечения. Различные режимы, которые дают близкий эффект в отношении одного индикаторного вещества, могут существенно различаться в отношении других веществ. Тем самым, концепция дозирования диализа дискредитирует попытки увеличить выведение веществ, отличных от индикаторного. Кроме того, она исходит из постоянной генерации индикаторного вещества (по отношению к размеру тела) и дискредитирует попытки улучшить результаты снижением продукции удаляемых веществ (как, например, генерируемых микробиотой кишечника [84]). На этом пути только идентификация действительно значимых токсичных веществ даст в будущем более твердую основу для назначения режима диализа и, в конечном счете, улучшение исходов лечения [83].
А вот как расставить приоритеты среди более привычных параметров и сбалансировать требования к достижению ключевых показателей, характеризующих адекватный диализ в реальной практике, - прямая функция рекомендаций. Что важнее:
- клиренсы;
- корректность (безопасность) удаления жидкости;
- уменьшение бремени лечебных мероприятий или
- контроль симптоматики (например, слабость, зуд, синдром беспокойных ног и т.д.);
- вероятно, в новых клинических рекомендациях мы получим ответы на эти вопросы. Кажется все же что они не будут универсальными, и для разных популяций пациентов шкала приоритетов будет различной (молодые - пожилые, срок ожидаемой жизни, наличие сопутствующей патологии, предпочтения пациентов и т.д.).
Тем не менее, представляется, что биохимические индексы - старые или новые - останутся в качестве гарантии поддержания очищения на достигнутом к настоящему времени (и, по-видимому, вполне достаточном) уровне, а на первое место выйдут критерии состояния водного обмена.
Водный статус
Впервые граница между более и менее безопасной скоростью удаления жидкости была обозначена в относительно небольшом (287 пациентов), но длительном (5 лет) наблюдении из Ломбардии [85]. Медиана скорости УФ в 12,5 мл/ч/ кг оказалась чувствительным предиктором выживаемости: площадь под кривой при проведении ROC-анализа с этой точкой отсечения составила 0,80 (95 % ДИ 0,66^0,84). К этому же времени относится наблюдение DOPPS [86] с пределом скорости УФ в 10 мл/ч/кг массы тела, превышение которого ассоциировалось с увеличением риска смерти на 9 %. Попутно отметим, что увеличенное время диализа (дольше 4 ч) в этом исследовании было связано с существенно большим снижением риска смерти - на 19 %. Важно подчеркнуть, что влияние длительности сеанча и скорости УФ было независимым в скорректированном (по возрасту, полу, расе, сроку лечения, коморбидности, ИМТ, Kt/V, скорости кровотока, остаточной функции почек, типу сосудистого доступа, а также географическому региону и фазе исследования) анализе.
Повторное рассмотрение материалов давно завершенного исследования HEMO позволил позже подтвердить эти цифры: при коррекции на множество клинически важных параметров в диапазоне увеличения скорости УФ от 10 до 13 мл/ч/кг риски растут быстрее всего. Правда, анализ в большой диализной сети [87] не только подтвердил заявленные границы (превышение порога в 13 мл/ч/ кг связано было с увеличением относительного риска смерти в 1,31 [95 % ДИ 1,28-1,34], превышение порога в 10 мл/ч/кг - 1,22 [95 % ДИ 1,281,34]), но и показал, что каждые дополнительные 2 мл/ч/кг прибавки скорости УФ увеличивают риски смерти уже начиная с диапазона 8-10 мл/ч/кг (+9 % риска): 10-12 мл/ч/кг (+15 %), 12-14 мл/ч/ кг (+23 %). Тем не менее, наиболее значительный прирост отмечен именно с уровня выше 14 мл/ч/ кг (+43 % риска). Большой объем материала позволил продемонстрировать устойчивость этой связи в подгруппах по полу, расе, сроку диализа, индексу массы тела.
Один из недавних анализов результатов в когорте вновь начавших диализ 110 тыс пациентов показал, что нижней границы у этой взаимосвязи нет: в категориальном анализе группы пациентов со скоростью УФ 4-6 мл/ч/кг и менее 4 мл/ч/кг демонстрировали дальнейшее снижение риска общей и сердечно-сосудистой летальности в сравнении с референтной группой с УФ 6-8 мл/ч/кг. При анализе скорости УФ как непрерывной величины, дальнейшее снижение рисков в зоне УФ <7 мл/ч/ кг лишь замедлялось, но не останавливалось до нижней границы шкалы (1 мл/ч/кг) [88].
Существует некоторая угроза при введении жесткого требования не превышать заявленной скорости УФ: при сохранении продолжительности сеанса и ограничении скорости УФ часть пациентов (если не большая часть) могут начать увеличивать массу тела за счет задержки воды [89]. Решением здесь может быть только удлинение общего недельного времени диализа: или за счет продолжительности сеанса, или за счет кратности сеансов в неделю (если не удается ограничить междиализную прибавку массы).
В США уже на протяжении нескольких лет медленно, но неуклонно расширяется программа контроля качества. За невыполнение целевых параметров включаются штрафные санкции. Первыми показателями были уровень гемоглобина и доза диализа, в 2018 году добавлена гиперкаль- циемия; в 2019 году негативно будет оцениваться доля пациентов с УФ выше 13 мл/ч/кг. Плательщик (Centers for Medicare and Medicaid Services), правда, ещё не вполне согласовал свое решение с альянсом общественных профессиональных организаций (Kidney Care Quality Alliance) в тонкостях расчета показателя, но принципиально вопрос решен. Альянс предлагает нарушением рассматривать и продолжительность лечения менее 4 ч.
Отклонение от «сухого веса» в любую сторону связано с безусловным ростом рисков летальности. Тезис не новый, но в ещё одной работе из крупной диализной сети [90] авторы совместили оценки рисков как гипергидратации, так и избыточной дегидратации после сеанса - которые оказались симметричными относительно целевого веса (табл. 6).
Долгий поиск чисто клинических критериев адекватности дегидратации привел к однозначному выводу: метод проб и ошибок в подборе «сухого веса» неадекватен [91] - нам нужны инструментальные методы. И сегодня они доступны. В первую очередь, это биоимпедансные методики - реализованы ли они в варианте биоимпедансной мультичастотной спектроскопии, или в варианте более наглядного векторного анализа [92]. Менее распространенным методом является мониторинг изменения объема циркулирующей крови (по оптически измеряемому гематокриту on-line в диализной магистрали). Впрочем, методы эти прекрасно согласуются и сочетаются. Реализация совместного алгоритма использования двух методик позволила предложить изменить «сухой вес» почти у половины согласившихся принять участие в испытании пациентов [92]. Реализация «рекомендованного» аппаратами изменения сухого веса привела к урежению числа эпизодов как интрадиализной артериальной гипотензии, так и гипертензии. В недавнем систематическом обзоре литературы с мета-анализом из 42 работ (с приемлемым профилем рисков предвзятости) 17 были построены на векторном анализе и фазовом угле, 16 - на индексе гипергидратации (>15 %), 9 - на отношении объемов вне-, внутриклеточной жидкости. Индекс гипергидратации >15 % повышал риск смерти в 2,28 раза; снижение фазового угла на 1° - в 1,74 раза.
Таблица 6 / Table 6
Относительный риски смерти пациентов, завершающих сеанс диализа с весом вне целевого диапазона (таблица составлена по графику из [90])
The relative risk of death for patients completing the dialysis session with a weight outside the target range (table compiled according to data from [90])
Доля сеансов с весом после ГД: | Скорректированное отношение рисков(95 % ДИ) | |
|---|---|---|
На 2 кг ниже целевого | >40 % | 1,28 (1,21-1,54) |
(6,6 % пациентов) | 20-39 % | 1,24 (1,04-1,48) |
| 1-19 % | 1,18 (1,08-1,50) |
Всегда целевой вес | 1,00 | |
На 2 кг выше целевого | 1-19 % | 1,17 (1,06-1,30) |
(14,6 % пациентов) | 20-39 % | 1,30 (1,14-1,49) |
| >40 % | 1,36 (1,21-1,49) |
Крупное детальное исследование (более 38 тыс пациентов) проведено в сети NephroCare (США), в которой рутинной практикой установлено проведение биоимпедансной спектроскопии каждые три месяца. Продемонстрировало раздельное значение перегрузки жидкостью (fluid overload, перегрузка жидкостью, ПЖ) перед и после сеанса, с одной стороны, и междиализной прибавки массы тела (МДП) - с другой. Пациенты в 3-м и 4-м квартиле (Q3 и Q4) ПЖ демонстрировали возрастающий риск смерти, а пациенты в Q1 - самом низшем квартиле МДП - больший риск, чем в Q2. Наибольший риск (2,66) имели пациенты в Q4 по ПЖ до диализа, но в Q1 по МДП - т.е., находящиеся в значительной перегрузке до диализа, но с минимальной междиализной прибавкой (в сравнении с Q2 по обоим показателям). МДП была прямо связана с ПЖ до диализа, но обратно - с ПЖ после диализа. Низкая МДП, связанная с большим риском смерти, возможно, указывает на белково-энергетическую недостаточность, поэтому оптимальным маркером водного статуса может оказаться ПЖ, оцененная после диализа. При этом исторические и современные инициативы по контролю водного баланса на первое место ставят именно междиализную прибавку11. ПЖ не следует приравнивать к МДП, хотя её часто и называли «задержкой жидкости»: МДП - отчасти суррогат нутриционного статуса и только частично отражает риск внеклеточной задержки жидкости [93]. Соотношение рисков смерти, связанных с различными показателями водного статуса, указывает на то, что оптимальной практикой является установление сухого веса по биоимпедансной оценке перегрузки жидкостью (внеклеточной), а не ограничение междиализной прибавки (которого, кроме того, часть пациентов добиваются за счет ухудшения питания, а не уменьшения приема жидкости). Около половины пациентов могут выиграть от понижения целевой массы тела, установленной по данным биоимпедансной оценки перегрузки жидкостью после сеанса гемодиализа [93].
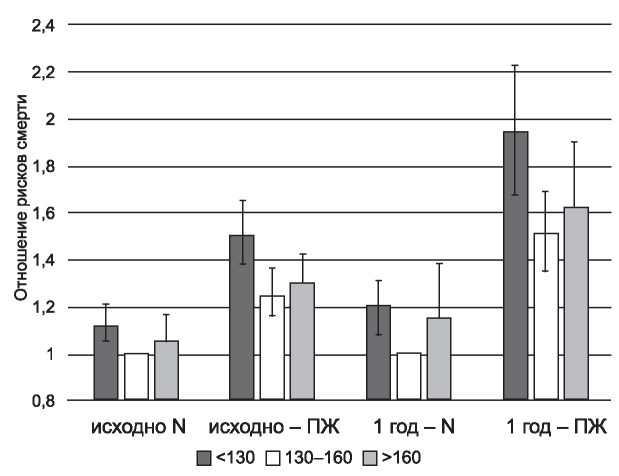
Рис. 8. Отношение рисков гипергидратации, оцененной исходно и кумулятивно за год - в зависимости от категорий АД. N - отсутствие перегрузки жидкостью (<15 %), ПЖ - перегрузка жидкостью (>15 %); диаграмма составлена по данным исследования [94].
Figure 8. Risk ratio of overhydration, assessed at baseline and cumulatively for a year - depending on the categories of blood pressure. N - no fluid overload (<15%), FO - fluid overload (> 15%); the chart is made according to the study data [94].
Преимуществом еще одного анализа на базе крупной диализной сети в Европе [94] стал учет не только исходных данных биоимпедансной спектроскопии у вновь начавших диализ пациентов, но и оценка кумулятивного (за год) влияния перегрузки жидкостью за первый год наблюдения. Риски превышения установленной границы перегрузки (в 15 % от объема внеклеточной жидкости) для годового наблюдения были выше, чем в отношении исходных данных (рис. 8).
Ситуацию с гипергидратацией (а заодно - и с артериальной гипертензией) осложняет практика неуклонного роста уровня натрия в диализирующем растворе, поддерживаемая стремлением избежать гипотоний в коротких сеансах с высокой УФ. Несколько лет назад группа медицинских директоров 14 крупнейших диализных сетей в США выступили с декларацией «Volume first» (по аналогии с «PD first» и «Fistula first») [95]. Хотя авторы и признали, что их выводы базируются почти исключительно на наблюдательных исследованиях, сами выводы экспертов заслуживают безусловного внимания. Барьерами на пути достижения эуволе- мии названы:
- Отсутствие широко принятого и подтвержденного «золотого стандарта» для оценки сухого веса;
- Логистические барьеры для увеличения продолжительности сеансов;
- Вероятность учащения симптомов (артериальная гипотензия, судороги) при дополнительном удалении жидкости;
- Неопределенность в оплате дополнительных сеансов (4-го, 5-го в неделю);
- Несогласие пациентов удлинять время, увеличивать частоту и ограничивать потребление соли;
- Врачебные факторы: ограниченный доступ к оценке водного статуса, консультированию диетологом, несвоевременная коррекция режима диализа.
Принятый консенсусом документ декларирует: статус внеклеточной жидкости должен быть компонентом достаточного диализа. Приближение к нормализации внеклеточного объема следует считать первичной целью диализного лечения, и любой пациент с гипертензией до назначения или усиления антигипертензивной терапии должен пройти программу снижения массы тела и ограничения нагрузки поваренной солью (как в диете, так и на диализе). Для этого надо облегчить доступ к соответствующим технологиям, включив затраты на них в расчеты возмещения за диализное лечение и подтвердить их эффективность в специально спланированных прагматичных, распространимых на всю диализную популяцию исследованиях.
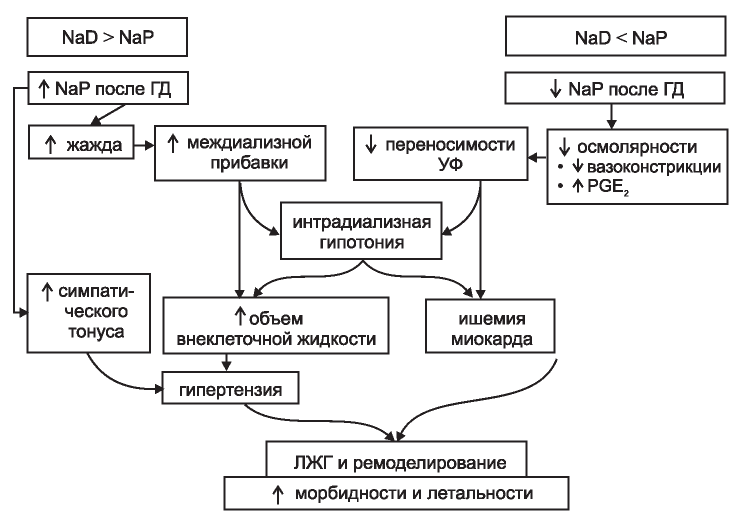
Рис. 9. Клинические последствия отклонения уровня натрия в диа- лизирующем растворе от уровня натрия в крови.
NaD - концентрация натрия в диализате, NaP - концентрация натрия в плазме.
Figure 9. Clinical implications of deviations in the level of sodium in the dialysis solution from the level of sodium in the blood.
Notes: NaD is the concentration of sodium in dialysate, NaP is the concentration of sodium in plasma.
Удаление жидкости должно быть постепенным, в том числе, и с этой точки зрения режим диализа 3 раза в неделю по 4 ч следует считать минимальным, корректируя его индивидуально для поддержания способности достичь эуволемии, учитывая междиализную прибавку массы тела и скорость УФ. В первую очередь, следует рассматривать варианты лечения с более постепенным удалением жидкости.
Когда темп УФ превышает скорость восполнения сосудистого объема, объем циркулирующей крови падает, и развивается явная или скрытая ишемия органов и тканей: появляются участки гипокинезии миокарда («stunning», «оглушение» [96]); ишемия кишечника сопровождается поступлением в кровь бактериальных эндотоксинов (транслокация через ишемизированную кишечную стенку) и усилением системного воспаления [84]; функциональные нарушения и структурные повреждения мозга в результате повторных ишемий приводят к когнитивным расстройствам и развитию депрессии [97]. Специфическими диализными осложнениями интрадиализных артериальных гипотоний являются тромбозы сосудистого доступа, утрата остаточной функции почек и длительное восстановление после сеанса диализа [98].
Мы должны предпринять все усилия, чтобы не нагружать пациента натрием в ходе сеанса. Уровень его в диализирующем растворе следует устанавливать в диапазоне 134-138 ммоль/л (c возможными отклонениями в зависимости от конкретных обстоятельств). Помимо отказа от применения гипертонического раствора соли и нерациональных (если не от всех) схем профилирования натрия, нам следует сформировать практику ориентироваться на «установочную точку натрия» - «set point». «Установочные точки» для каждого конкретного пациента (существующие не только для натрия) характеризуют уровни натрия плазмы, к которым регулировочные системы смещают натриемию после любых случившихся из-за внешнего или внутреннего воздействия отклонений [99]. Известно, что неблагоприятные исходы у гемодиализных пациентов в большей мере связаны с отклонениями от установочной точки уровня натрия в диализирующем растворе, чем собственно с этим уровнем.
В практическом плане можно оценить значение установочной точки для данного пациента как среднее по доступным за последнее время определениям натрия плазмы при исключении из этих значений эпизодов значительной гипергидратации и злоупотребления солью. Учитывая неблагоприятное ремоделирование сердечно-сосудистой системы в результате существенных отклонений уровня натрия диализата от установочной точки в обе стороны, подчеркнем, что оба варианта - хуже (рис. 9). Следует научиться сознательно устанавливать этот уровень в соответствии с оптимальным значением.
Таблица 6 / Table 6
Рутинные показатели наблюдения за нутриционным статусом
Routine indicators for nutritional status monitoring
Показатель | Целевые уровни | За | Против |
|---|---|---|---|
Альбумин | >40 г/л (ниже - при сахарном диабете) | Простой, надежный, дешевый, подтвержденный | Зависит от гидратации, чувствителен к потерям на высокопроницаемых мембранах |
Пре-альбумин | 0,18-0,35 (зависит от лаборатории) | Быстро реагирует на вмешательства: высокая скорость обмена | Дороже альбумина, высокая вариабельность, мало информации для пожилых |
Холестерин | Порог для БЭН <4 ммоль/л |
| Зависим от нескольких факторов |
Стандартизованный белковый эквивалент выведения мочевины - стБВА (n-PNA, n-PCR) | Порог адекватного потребления белков зависит от метода расчета; обычно > 1,2 г/кг/сут | Рассчитывается вместе с Kt/V | Не отделяет катаболизм от потребления; неясен порог для пожилых, установлен в период, когда нормой для здоровых было потребление 1 г/кг/сут, сейчас - 0,8 |
Malnutrition Inflammation Score (MIS) | Простые, надежные, дешевые, подтвержденные; отчасти комплементарны: первый чувствительнее к изменениям нутриционного статуса, второй - способен разделить причины БЭН - недостаточное питание и неадекатный диализ (модифицируемые) или воспаление и атеросклероз (с меньшей вероятностью ответят на модификацию режима диализа) | ||
СГО: Субъективная Глобальная Оценка - Subjective Global Assessment (SGA) | |||
Необходимо еще раз подчеркнуть, что избыточная междиализная прибавка массы тела - в абсолютном большинстве случаев - следствие избытка потребления поваренной соли (или ятро- гения в связи с неадекватным профилированием натрия). В отличие от пациентов без диализа (у которых по выведению натрия с мочой мы можем весьма точно оценить его потребление с пищей), у диализных пациентов это невозможно; поэтому все внимание должно быть сосредоточено на формировании внутреннего сознательного контроля у пациента. Снижение потребления натрия принесет долгосрочные плоды только при поддержании сбалансированной полноценности диеты.
Развитием этих положений прошедшей Согласительной конференции будет следующая - в феврале 2019 г. - по артериальной гипертензии и коррекции водного баланса у пациентов на диализе12.
Интенсивность диализа, равно как и состояние водного обмена, тесно связана с нутриционным статусом. Вероятно, целевые показатели качества гемодиализа придется разделить в зависимости от коморбидности и срока ожидаемой жизни. Для части пациентов критерий эффективности диализа должен уступить первое место критерию переносимости диализа. Пациенты с хорошим нутриционным статусом и низким уровнем по MIS (Malnutrition Inflammation Score) - очевидные кандидаты на интенсификацию диализа (например ГДФ) для получения максимальных долгосрочных преимуществ. Потенциальные потери альбумина через высокопоточную мембрану компенсируются адекватным синтезом в условиях более либеральной диеты. Преимущества высокообъемной ГДФ не очевидны у пожилых пациентов с меньшим сроком ожидаемой жизни (и, соответственно, минимальным риском развития долгосрочных осложнений, например, амилоидо- за). Более «мягкий» ГД может быть лучшим выбором, особенно при наличии остаточной функции почек; эти пациенты часто не могут компенсировать потери альбумина. Пациенты с плохим нутриционным статусом и высоким баллом по шкале «Malnutrition Inflammation Score» (MIS) образуют разнородную популяцию:
- ослабленные пациенты с короткой ожидаемой продолжительностью жизни;
- пациенты с очень большим сроком лечения диализом;
- пациенты с экстренным стартом и потенциально обратимой почечной недостаточностью.
Все они - по разным причинам - демонстрируют плохую переносимость диализа, и этот фактор становится определяющим в выборе интенсивности процедуры.
С точки зрения оценки нутриционного статуса, адекватный диализ можно рассматривать как лечение, обеспечивающее приемлемый стабильный метаболический баланс у пациентов без достаточной функции почек. Наиболее часто рутинно применяемые показатели представлены в табл. 7. Оценки применяемых методов выявления БЭН представлены в недавнем обзоре вместе с результатами обследования 645 российских диализных пациентов [100].
Нутриционный статус может оказать влияние на выбор модальности ГД. Например, высокопоточный (альбумин-теряющий) диализ может препятствовать восстановлению нормального уровня альбумина в крови у вновь принятых на диализ пациентов с исходной БЭН, и рациональным подходом могло бы стать использование вначале низкопоточных диализаторов с последующим переходом на высокопоточные после улучшения нутриционного статуса [101].
Оценка затронутых параметров и результатов лечения во взвешенных соотношениях, возможно, позволит сформулировать новые физиологические индексы адекватности. Например, задачей можно поставить исключение субклинических ге- модинамических нарушений, ведущих к ишемии важных органов, которая в любой момент может из субклинической стать критической (особенно - у коморбидных больных). Само название «новые» имеет отношение только к реальной диализной практике. Эксперты предлагают разный перечень параметров, но большинство из них касаются кардиологических аспектов:
- гипертрофия левого желудочка;
- толщина интимы-медии каротидной артерии;
- вариабельность ритма;
- частота эпизодов желудочковой аритмии (ASN Dialysis Advisory Group [98]);
- нарушение функции продольных волокон при сохраненной фракции выброса;
- диастолическая дисфункция ЛЖ;
- миокардиальный фиброз;
- нарушение функции правого желудочка;
- трактовка повышения биомаркеров, в том числе, тропонина (European Society of Cardiology13).
Учет этих параметров в большей мере будет соответствовать широко принятому тезису о сердечно-сосудистой патологии как основной причине смерти диализных пациентов, особенно в осознании того, что интенсификация стандартного режима диализа для удаление уремических токсинов свои возможности, видимо, исчерпала (см. табл. 4, 5). Особым акцентом на конференции прозвучал тезис о том, что если сердечнососудистая летальность в диализной популяции снизилась за последнее десятилетие в полтора раза, то снижения частоты внезапной кардиальной смерти практически не произошло (как и в Санкт- Петербурге [102]), а летальность от перегрузки объемом возросла вдвое [103]. Соответственно, неудовлетворительным остается контроль артериального давления (<140/90 мм рт. ст.) - меньше 40 % в 2013 г. в России [74] и в 2017 г. в США14, меньше 60 % в 2014 г. в Германии2. Осознанием последних лет стал тезис о необходимости ориентироваться на АД в междиализном интервале (которое прямо связано с выживаемостью [104,105], а не на до- или последиализное (которые с выживаемостью не связаны).
Внезапная сердечная смерть зафиксирована в 40 % случаев летальных исходов по данным USRDS, 201815, до 28 % - в Японии [106] и Европе [107], до 45 % - в Санкт-Петербурге [102]. Обобщая результаты целого ряда исследований, известные стратегии по снижению частоты внезапной сердечной смерти можно представить следующим образом [102, 106, 107] (табл. 8).
Рабочая группа Согласительной конференции определенно настроена включить в понятие адекватного диализа меры по снижению риска внезапной сердечной смерти.
Следующим пунктом, выдвинутым рабочей группой по адекватности диализа, является очень привлекательная, но психологически очень трудно осуществимая идея - диализ через день («every other day»): всегда по нечетным - одна смена, по четным - другая; без учета дней недели, в том числе, и воскресений. Именно отказ от выходного дня в воскресенье и оказывается труднопреодолимым, вызывая сопротивление как со стороны персонала, так и со стороны пациентов. Тем не менее, такие программы в разных странах есть, и они демонстрируют позитивные результаты, иногда недостижимые любой интенсификацией трехразового режима [108]. Наблюдательное исследование по переводу на четырехразовый диализ недавно выполнено в Санкт-Петербурге [109]. На небольшой группе пациентов удалось продемонстрировать несомненные клинические достижения у проблемных пациентов: нормализацию АД, снижение уровня фосфатов, улучшение ин- традиализной гемодинамической стабильности- при отсутствии проблем с сосудистым доступом и без отказов пациентов продолжать режим. Важно также отметить, что воспроизводимые каждые несколько лет работы неизменно демонстрируют, что наивысшие риски неблагоприятных исходов связаны именно с длинным междиализным промежутком [110, 111]. В когорте более 32 тыс пациентов общая летальность в длинный междиализный интервал была на 23 % выше, чем в другие дни, сердечно-сосудистая летальность - на 36 %, а летальность от фатальной аритмии - на 30 % выше [112].
Таблица 7 / Table 7
Меры по снижению риска внезапной сердечной смерти
The strategies for reducing the risk of sudden cardiac death
Фактор риска | Меры предотвращения | Неопределенности |
Накопление и выведение калия | • частая оценка Kp и коррекция Kn; • избегать Kn <2 ммоль/л; • сорбенты Kp | • оптимальный градиент (Kp)/(Kn); • безопасность и эффективность профилирования Kn |
КОС | • избегать низкого уровня бикарбоната в диализирующем растворе; • учет поступления ацетата в ходе сеанса; | • оптимальный уровень бикарбоната в диализирующем растворе; • отказ от концепции «общего буферной емкости» (Bic+Ac) |
Кальций | • избегать Саn <1,25 ммоль/л; • избегать высокого градиента Саn/Cap; • применять витамин D, фосфат-связывающие препараты, кальцимиметики для оптимизации Cap | • оптимальный градиент Саn/Cap; |
Магний | • избегать низкого Mgn • корректировать для магний-теряющих состояний (кишечные потери/диарея, применение ингибиторов протонной помпы, БЭН) | • оптимальный Mgn |
Накопление и выведение воды | • ограничить прием соли и воды; • диуретики при остаточном диурезе; • увеличить время и частоту диализа; • уменьшить градиент Nan/Nap; • избегать интрадиализной гипотонии | • практичные устройства для оценки сухого веса; • оптимальная скорость УФ в разных популяциях пациентов; • значение охлаждения диализирующего раствора |
Проаритмогенные препараты | • исключить использование дигоксина | • поиск эффективных инотропных воздействий |
Препараты, удлиняющие QT интервал | • осторожное применение при быстрых сдвигах Kp, Nap, Cap • исключение предрасполагающих факторов | • поиск критериев оптимального применение антиаритмических препаратов |
KS, NaP, CaP – калий, натрий, кальций в крови; KD, NaD, MgD – калий, натрий, магний в диализирующем растворе
Контроль симптоматики и качество жизни
В следующем разделе будущих рекомендаций предполагается решить вопрос: а на те ли параметры мы ориентируемся, стремясь улучшить нашу помощь пациентам: как оценить симптомы, и как свести симптоматику в более глобальную оценку качества, и как не оставить без внимания различия в потребностях и нуждах различных групп пациентов?
В небольшой работе J. Flythe и соавт. [113] структурировали актуальную симптоматику и оценили влияние персональных, лечебных и внешних факторов на описание симптомов пациентами, которое оказалось весьма вариабельным. Семь аспектов этой проблемы сформулировано в результате тематического анализа интервью:
- «симптомы, порождающие симптомы»: например, слабость после диализа ухудшает течение депрессии, а депрессия утяжеляет восприятие симптомов;
- смирение с тем, что жизнь зависит от машины: утяжеляет восприятие симптомов как непреодолимых;
- ощущение навязчивости диализа: симптомы вмешиваются в семейные и социальные связи;
- принятие адаптивных стратегий преодоления: удается не всем пациентам;
- создание персонального изложения симптомов: не всем пациентам удается внятно описать симптомы, разночтения в трактовке персоналом утяжеляют для пациентов неопределенность восприятия и перспектив;
- осознание утраты контроля: появление страхов, ощущения уязвимости, перенос на себя симптомов соседей;
- осознание ограничений системы оказания диализной помощи: ощущение недостатка внимания со стороны персонала.
В течение последних лет была проведена большая работа по оценке значимости симптомов, синдромов и исходов глазами профессионалов (врачей и организаторов диализной помощи) и с точки зрения пациентов (SONG - HD: Standardized Outcomes in Nephrology-Hemodialysis) [58]. Опрос в широком кругу респондентов велся в три раунда - с постепенным сужением числа параметров на каждом следующем раунде для концентрации внимания респондентов на наиболее типичные варианты ответов. Профессионалами максимальный балл (8-8,5 из 10) присвоен сосудистому доступу, сердечно-сосудистой патологии и летальности. Несравненно ниже профессионалы ставят симптоматику и реабилитацию пациентов. Напротив, пациенты существенно ниже оценивают значение летальности, сердечно-сосудистой патологии и даже сосудистого доступа. Если не считать искусственно переоцененной адекватности диализа, у пациентов наивысшие оценки определены для возможности путешествовать, иметь свободное от диализа время, хорошо чувствовать себя после диализа и активно участвовать в жизни общества. Поэтому вряд ли возможно будет получить поддержку больных, когда предложенная лечебная тактика затрагивает их основные интересы, но не предлагает явной компенсации. В табл. 9 представлены различия в оценках значимости - смещение в сторону интересов пациентов или профессионалов.
Таблица 9 / Table 9
Оценка значимости параметров, характеризующих результаты лечения: различия в балльной оценке пациентами и профессионалами - составлена по диаграммам исследования
SONG-HD Assessment of the significance of parameters characterizing the results of treatment: differences in scoring by patients and by professionals - compiled from the SONG-HD study diagrams
Вопрос | Различия | Параметр |
|---|---|---|
Выше ценят пациенты | на 0,5-1,0 балл | возможность путешествовать; время, свободное от диализа |
на 0,25-0,5 балла | адекватность диализа слабость после сеанса | |
Пациенты и врачи ценят одинаково | анемия мобильность коррекция АД слабость взаимодействие с близкими, друзьями | |
Выше ценят врачи | на 0,25-0,5 балла | боль возможность работать гиперкалиемию инфекция/иммунитет |
на 0,5-1,0 балл | целевой вес сердечно-сосудистая патология депрессия состояние доступа гипотонии госпитализации | |
> 1 балла | летальность | |
Результаты лечения, оцениваемые пациентами (Patient-reported outcomes - PROs), - относительно новый подход к оценке исходов лечения. Они включают в себя симптоматику, качество жизни (связанное со здоровьем) и оценку медицинской помощи - и, по определению, вместе с предпочтениями пациентов занимают центральное место в пациент-ориентированной помощи, могут предоставлять важную диагностическую информацию, влиять на поведение больных (тем самым, оказывая воздействие на основную и сопутствующую патологию), использование ресурсов здравоохранения и выживаемость [98]. Действующая в США система отчетности перед плательщиком (CMMS) за лечение диализом требует проведения оценки качества жизни, удовлетворенности медицинской помощью, оценки болевых ощущений и депрессии. Общая практика развития системы поощрения качества состоит в том, что постепенно изучаемые показатели переходят в категорию оцениваемых (с включением штрафных санкций)16.
Еще одной поднятой рабочей группой темой стал вопрос о иной - поддерживающей пациента помощи - помимо диализа, особенно - у пожилых и ослабленных пациентов. Совсем недавно этим (в частности) вопросам была посвящена специальная представительная конференция - ISN’s 2nd Global Kidney Health Summit: Increasing access to integrated ESKD care, прошедшая 18-20 марта 2018 г. (Working Group 8). Первые результаты конференции представлены в отдельном выпуске Kidney International Supplement17 в феврале 2018 г. в преддверии саммита и позже - более детально [114].
Подробно обсуждались вопросы целостности помощи пациентам, включая минимизацию риска побочных эффектов и осложнений, совместное принятие решений, активную коррекцию симптоматики, налаженную связь, включая планирование дальнейшей помощи, психологическую поддержку, социальную и семейную поддержку, культурные и духовные аспекты помощи. Хоть наиболее детально эти аспекты были рассмотрены для пациентов, находящихся на границе старта диализа или сознательно выбирающих активную полновесную консервативную терапию без диализа, многие наши диализные пациенты заслуживают полноценной поддерживающей помощи и пока ее нечасто получают.
ЗАКЛЮЧЕНИЕ
Складывается впечатление, что интенсификация отдельного сеанса диализа достигла предела в части улучшения значимых исходов. Тем не менее, необходимо продолжать поиск путей учета перемещения растворенных веществ между секторами тела. Целесообразно сфокусироваться на оценке водного баланса и не допускать превышения скорости УФ более 13 мл/кг/ч. При этом необходимо опираться не только на клинические признаки нарушения водного баланса, но и использовать инструментальные методы оценки статуса гидратации. Следует признать 4-часовой диализ 3 раза в неделю минимально допустимым, в том числе, и с этих позиций. Стоит обратить внимание на диссонанс между оценкой значимости исходов для пациентов и врачей: взаимное понимание целей и желаний приведет к увеличению податливости лечению и удовлетворенности его результатами.
Достигнутая эффективность очищения, описываемая классическими маркерами, может оказаться неадекватным результатом для всех пациентов и совсем не быть приоритетом для пожилых и высококо- морбидных пациентов. Назначение любого лечения (в том числе, диализа) должно, в первую очередь, не вступать в противоречие с императивом «noli nocere!». Целевая эффективность в сознании нефрологов постепенно замещается на целевую переносимость, когда «хороший диализ» должен обладать минимальными побочными эффектами. С другой стороны - более частый высокоэффективный диализ может дать преимущества молодым пациентам с высокими метаболическим потребностями.
Конкретными задачами и критериями адекватности диализной помощи в ближайшей перспективе могут стать:
- Обеспечение у всех пациентов минимально установленного клиренса малых молекул (spKt/ V>1,2), stdKt/V>2,1 для неклассических режимов;
- Нормализация объема внеклеточной жидкости (биоимпеданс) и артериального давления (в междиализный день);
- Скорость удаления воды на диализе <10 мл/ч/ кг (ограничение прибавки веса или удлинение общего времени диализа);
- Индивидуализация состава диализирующего раствора (K+, Na+, Ca++, Mg++, Bic);
- Сохранение остаточной функции почек;
- Увеличение клиренса средних молекул (ГДФ с объемом замещения >21 л/сеанс);
- Достижение целевого уровня фосфатемии (<1,78 ммоль/л, в идеале - <1,45 ммоль/л).
Конфликт интересов: Геннадий Земченков и Анастасия Сабодаш являются сотрудниками диализной сети BBraun Avitum Russland Clinics.
Авторы выражают благодарность А.Ю. Земченкову за полезные замечания и редактирование рукописи.
Список литературы
1. Waldum-Grevbo B, Leivestad T, Reisæter AV, Os I. Impact of initial dialysis modality on mortality: a propensity-matched study. BMC Nephrol 2015;16:179. Doi: 10.1186/s12882-015-0175-5
2. Jaar BG, Coresh J, Plantinga LC et al. Comparing the risk for death with peritoneal dialysis and hemodialysis in a national cohort of patients with chronic kidney disease. Ann Intern Med 2005;143(3):174–183
3. Han SS, Park JY, Kang S et al. Dialysis Modality and Mortality in the Elderly: A Meta-Analysis. Clin J Am Soc Nephrol 2015;10(6):983–993. Doi: 10.2215/CJN.05160514
4. Sim JJ, Zhou H, Shi J et al. Disparities in early mortality among chronic kidney disease patients who transition to peritoneal dialysis and hemodialysis with and without catheters. Int Urol Nephrol 2018;50(5):963–971. Doi: 10.1007/s11255-018-1837-6.
5. Li WY, Wang YC, Hwang SJ et al. Comparison of outcomes between emergent-start and planned-start peritoneal dialysis in incident ESRD patients: a prospective observational study. BMC Nephrol 2017;18(1):359. Doi: 10.1186/s12882-017-0764-6.
6. Phirtskhalaishvili T, Bayer F, Edet S et al. Spatial Analysis of Case-Mix and Dialysis Modality Associations. Perit Dial Int 2016;36(3):326–333. Doi: 10.3747/pdi.2015.00003
7. Ronco C. The Rise of Expanded Hemodialysis. Blood Purif 2017;44(2):I–VIII. Doi: 10.1159/000476012
8. Florens N, Juillard L. Expanded haemodialysis: news from the field. Nephrol Dial Transplant 2018 Oct 1;33(suppl_3):iii48– iii52. Doi: 10.1093/ndt/gfy203
9. Андрусев АМ, Земченков АЮ. Режим диализа и остаточная функция почек. Нефрология и диализ 2017;19(4): 522–530 [Andrusev AM, Zemchenkov AY. Dialysis schedule and residual renal function. Nephrology and Dialysis (in Russ) 2017;19(4): 522–530. Doi: 10.28996/1680-4422-2017-4-522-530]
10. Rhee CM, Ghahremani-Ghajar M, Obi Y, Kalantar-Zadeh K. Incremental and infrequent hemodialysis: a new paradigm for both dialysis initiation and conservative management. Panminerva Med 2017; 59(2): 188–196. Doi: 10.23736/S0031-0808.17.03299-2
11. Obi Y, Streja E, Rhee CM et al. Incremental Hemodialysis, Residual Kidney Function, and Mortality Risk in Incident Dialysis Patients: A Cohort Study. Am J Kidney Dis 2016;68(2):256–265. Doi: 10.1053/j.ajkd.2016.01.008
12. Morfín JA, Yang A, Wang E, Schiller B. Transitional dialysis care units: A new approach to increase home dialysis modality uptake and patient outcomes. Semin Dial 2018;31(1):82–87. Doi: 10.1111/sdi.12651
13. Segall L, Nistor I, Van Biesen W et al. Dialysis modality choice in elderly patients with end-stage renal disease: a narrative review of the available evidence. Nephrol Dial Transplant 2017;32(1):41–49. Doi: 10.1093/ndt/gfv411
14. Purnell TS, Auguste P, Crews DC et al. Comparison of life participation activities among adults treated by hemodialysis, peritoneal dialysis, and kidney transplantation: a systematic review. Am J Kidney Dis 2013;62(5):953–973. Doi: 10.1053/j. ajkd.2013.03.022
15. Земченков АЮ, Сапон НГ, Костылева ТГ и др. Оценка качества жизни у пациентов на гемо- и перитонеальном диализе с помощью опросника KDQOL-SF™. Нефрология и диализ 2009;11(2):94–102
16. Finderup J, Jensen JKD, Lomborg K. Developing and pilot testing a shared decision-making intervention for dialysis choice. J Ren Care 2018 Apr 17. Doi: 10.1111/jorc.12241 [Epub ahead of print]
17. Zee J, Zhao J, Subramanian L et al. Perceptions about the dialysis modality decision process among peritoneal dialysis and in-center hemodialysis patients. BMC Nephrol 2018;19(1):298. Doi: 10.1186/s12882-018-1096-x
18. Couchoud C, Bolignano D, Nistor I et al. Dialysis modality choice in diabetic patients with end-stage kidney disease: a systematic review of the available evidence. Nephrol Dial Transplant 2015; 30(2):310–320. Doi: 10.1093/ndt/gfu293
19. Lee MJ, Kwon YE, Park KS et al. Glycemic Control Modifies Difference in Mortality Risk Between Hemodialysis and Peritoneal Dialysis in Incident Dialysis Patients With Diabetes: Results From a Nationwide Prospective Cohort in Korea. Medicine (Baltimore) 2016;95(11):e3118. Doi: 10.1097/MD.0000000000003118
20. Legendre C, Canaud G, Martinez F. Factors influencing long-term outcome after kidney transplantation. Transpl Int 2014;27:19–27.Doi:10.1111/tri.12217
21. Wu DA, Robb ML, Watson CJE et al. Barriers to living donor kidney transplantation in the United Kingdom: a national observational study. Nephrol Dial Transplant 2017;32(5):890–900. Doi:10.1093/ndt/gfx036
22. López-Oliva MO, Rivas B, Pérez-Fernández E et al. Pretransplant peritoneal dialysis relative to hemodialysis improves long-term survival of kidney transplant patients: a single-center observational study. Int Urol Nephrol 2014;46(4):825–832. Doi:10.1007/s11255-013-0521-0
23. Tang M, Li T, Liu H. A comparison of transplant outcomes in peritoneal and hemodialysis patients: a meta-analysis. Blood Purif 2016;42(2):170–176.Doi:10.1159/000446272
24. Lin HT, Liu FC, Lin JR et al. Impact of the pretransplant dialysis modality on kidney transplantation outcomes: a nationwide cohort study. BMJ Open 2018 Jun 4;8(6):e020558. Doi: 10.1136/ bmjopen-2017-020558
25. de Fijter CWH, van Diepen ATN, Amiri F et al. Patientreported outcomes (PROs) argue against the limited use of peritoneal dialysis in end-stage renal disease. Clin Nephrol 2018; 90(2):94–101. Doi: 10.5414/CN109369
26. Trinh E, Chan CT, Perl J et al. Dialysis modality and survival: Done to death. Semin Dial 2018;31(4):315–324. Doi: 10.1111/ sdi.12692
27. Томилина НА, Андрусев АМ, Перегудова НГ и др. Заместительная терапия терминальной хронической почечной недостаточности в Российской Федерации в 2010–2015 гг. Часть первая. Нефрология и диализ 2017;19(4 – Приложение): 1–95. Doi: 10.28996/1680-4422-2017-4suppl-1-95
28. Heaf J, Petersons A, Vernere B et al. Why do physicians prescribe dialysis? A prospective questionnaire study. PLoS One 2017;12(12):e0188309. Doi: 10.1371/journal.pone.0188309
29. Kalantar-Zadeh K, Kovesdy CP, Streja E et al. Transition of care from pre-dialysis prelude to renal replacement therapy: the blueprints of emerging research in advanced chronic kidney disease. Nephrol Dial Transplant 2017;32(suppl_2):ii91–ii98. Doi: 10.1093/ndt/gfw357
30. Земченков АЮ, Вишневский КА, Сабодаш АБ и др. Сроки начала и другие факторы на старте диализа, влияющие на выживаемость: Санкт-Петербургский регистр пациентов на заместительной почечной терапии. Нефрология и диализ 2017;19(2): 255–270. Doi: 10.28996/1680-4422-2017-2-255-270.
31. Земченков АЮ, Андрусев АМ, Виталюева МА. Заместительная почечная терапия в новых нормативных документах на 2017. Нефрология и диализ 2016;18(4):362–373
32. Osman MA, Alrukhaimi M, Ashuntantang GE et al. Global nephrology workforce: gaps and opportunities toward a sustainable kidney care system. Kidney International Supplements 2018; 8(2):52–63. Doi:10.1016/j.kisu.2017.10.009
33. Maddux DW, Usvyat LA, Ketchersid T et al. Clinical parameters before and after the transition to dialysis. Hemodial Int 2018;22(2):235–244. Doi: 10.1111/hdi.12603
34. Rhee CM, Kovesdy CP, Ravel VA et al. Association of Glycemic Status During Progression of CKD With Early Dialysis Mortality in Patients With Diabetes. Diabetes Care 2017;40(8):1050–1057. Doi: 10.2337/dc17-0110
35. Sumida K, Diskin CD, Molnar MZ et al. Pre-End-Stage Renal Disease Hemoglobin Variability Predicts Post-End-Stage Renal Disease Mortality in Patients Transitioning to Dialysis. Am J Nephrol 2017;46(5):397–407. Doi: 10.1159/000484356
36. Sumida K, Molnar MZ, Potukuchi PK et al. Prognostic significance of pre-end-stage renal disease serum alkaline phosphatase for post-end-stage renal disease mortality in late-stage chronic kidney disease patients transitioning to dialysis. Nephrol Dial Transplant 2018;33(2):264–273. Doi: 10.1093/ndt/gfw412
37. Sumida K, Molnar MZ, Potukuchi PK et al. Blood Pressure Before Initiation of Maintenance Dialysis and Subsequent Mortality. Am J Kidney Dis 2017;70(2):207–217. Doi: 10.1053/j. ajkd.2016.12.020
38. Arif FM, Sumida K, Molnar MZ et al. Early Mortality Associated with Inpatient versus Outpatient Hemodialysis Initiation in a Large Cohort of US Veterans with Incident End-Stage Renal Disease. Nephron 2017;137(1):15–22. Doi: 10.1159/000473704
39. Molnar MZ, Streja E, Sumida K et al. Pre-ESRD Depression and Post-ESRD Mortality in Patients with Advanced CKD Transitioning to Dialysis. Clin J Am Soc Nephrol 2017;12(9):1428–1437. Doi: 10.2215/CJN.00570117
40. Sumida K, Molnar MZ, Potukuchi PK. Pre-end-stage renal disease visit-to-visit systolic blood pressure variability and post-end-stage renal disease mortality in incident dialysis patients. J Hypertens 2017;35(9):1816–1824. Doi: 10.1097/ HJH.0000000000001376
41. Ramspek CL, Voskamp PWM, Krediet RT et al. Prediction models for the mortality risk in chronic dialysis patients: a systematic review and independent external validation study. Nephrol Dial Transplant 2016; 31 (suppl_1): i20. Doi: 10.1093/ndt/gfw125.01
42. Земченков АЮ, Герасимчук РП, Сабодаш АБ и др. Определение сроков начала гемодиализа: разработка и подтверждение шкалы START. Вестник трансплантологии и искусственных органов 2018;20(2):47–60
43. Floege J, Gillespie IA, Kronenberg F et al. Development and validation of a predictive mortality risk score from a European hemodialysis cohort. Kidney Int 2015; 87 (5): 996–1008. Doi: 10.1038/ki.2014.419
44. Cooper BA, Branley P, Bulfone L et al. A randomized, controlled trial of early versus late initiation of dialysis. N Engl J Med 2010;363(7):609–619. Doi: 10.1056/NEJMoa1000552
45. Tangri N, Grams ME, Levey AS et al. Multinational Assessment of Accuracy of Equations for Predicting Risk of Kidney Failure: A Meta-analysis. JAMA 2016;315(2):164–174. Doi: 10.1001/ jama.2015.18202
46. Tangri N, Stevens LA, Griffith J et al. A predictive model for progression of chronic kidney disease to kidney failure. JAMA 2011;305(15):1553–1559. Doi: 10.1001/jama.2011.451
47. Земченков АЮ. Использование балльных шкал, предложенных в Клинических рекомендациях European Renal Best Practice для оценки прогноза у пожилых и ослабленных пациентов на поздних стадиях ХБП. Нефрология и диализ 2017;19(1):221–225
48. Bylsma LC, Gage SM, Reichert H et al. Arteriovenous Fistulae for Haemodialysis: A Systematic Review and Meta-analysis of Efficacy and Safety Outcomes. Eur J Vasc Endovasc Surg 2017;54(4):513–522. Doi: 10.1016/j.ejvs.2017.06.024. Epub 2017 Aug 23
49. Ватазин АВ, Зулькарнаев АБ, Фоминых НМ и др. Сосудистый доступ у пациентов на хроническом гемодиализе в Московской области: состояние и перспективы. Альманах клинической медицины 2017;45(7):526–534
50. Ravani P, Quinn R, Oliver M et al. Examining the Association between Hemodialysis Access Type and Mortality: The Role of Access Complications. Clin J Am Soc Nephrol 2017;12(6):955–964. Doi: 10.2215/CJN.12181116
51. Antlanger M, Aschauer S, Kopecky C et al. Heart Failure with Preserved and Reduced Ejection Fraction in Hemodialysis Patients: Prevalence, Disease Prediction and Prognosis. Kidney Blood Press Res 2017;42(1):165–176. Doi: 10.1159/000473868
52. Зелтынь-Абрамов ЕМ, Котенко ОН, Андрусев АМ и др. Сердечная недостаточность с высоким сердечным выбросом у пациентки на программном гемодиализе (Наблюдение из практики и краткий обзор литературы). Нефрология и диализ 2016;18(3):319–327
53. Sumida K, Molnar MZ, Potukuchi PK et al. Association between vascular access creation and deceleration of estimated glomerular filtration rate decline in late-stage chronic kidney disease patients transitioning to end-stage renal disease. Nephrol Dial Transplant 2017;32(8):1330–1337. Doi: 10.1093/ndt/gfw220
54. Janmaat CJ, van Diepen M, van Hagen CC. Decline of kidney function during the pre-dialysis period in chronic kidney disease patients: a systematic review and meta-analysis. Clin Epidemiol 2018;10:613–622. Doi: 10.2147/CLEP.S153367
55. Земченков АЮ, Конакова ИН. Темпы прогрессирования хронической болезни почек по данным Санкт-Петербургского городского регистра ХБП. Нефрология и диализ 2015;17(1):34–51
56. O'Hare AM, Bertenthal D, Walter LC et al. When to refer patients with chronic kidney disease for vascular access surgery: should age be a consideration? Kidney Int 2007;71(6):555–561
57. Земченков АЮ, Конакова ИН, Сабодаш АБ и соавт. Трехлетние траектории снижения расчетной СКФ перед началом диализа по данным городского регистра пациентов с ХБП. Клиническая нефрология 2017; (2):4–11
58. Evangelidis N, Tong A, Manns B et al. Standardized Outcomes in Nephrology–Hemodialysis (SONG-HD) Initiative. Developing a Set of Core Outcomes for Trials in Hemodialysis: An International Delphi Survey. Am J Kidney Dis 2017;70(4):464–475. Doi: 10.1053/j.ajkd.2016.11.029
59. Johnson R, Feehally J, Floege J. Comprehensive Clinical Nephrology, 5th Edition; eBook ISBN: 9780323242875. Saunders; 2014 – 1320 p
60. Земченков ГА, Сабодаш АБ, Казанцева НС и др. Классические и online методы измерения KT/V: сопоставления и надежность. Нефрология и диализ 2015; 17(2):173–184
61. Daugirdas JT. Second generation logarithmic estimates of single-pool variable volume Kt/V: an analysis of error. J Am Soc Nephrol 1993;4(5):1205–1213
62. Daugirdas JD, Blake PB, Todd S. Ing T.S. Handbook of Dialysis, 5th Edition. - LWW/-2014: 900
63. Daugirdas JT, Depner TA Gotch FA et al. Comparison of methods to predict equilibrated Kt/V in the HEMO Pilot Study. Kidney Int 1997;52(5):1395–1405
64. Daugirdas JT, Schneditz D. Overestimation of hemodialysis dose (delta Kt/V) depends on dialysis efficiency (K/V) by regional blood flow and conventional 2-pool urea kinetic analyses. ASAJO J 1995; 41:M719–M724
65. Eknoyan G, Beck GJ, Cheung AK et al. Effect of dialysis dose and membrane flux in maintenance hemodialysis. Hemodialysis (HEMO) Study Group. N Engl J Med 2002;347(25):2010–2009
66. Земченков АЮ, Герасимчук РП, Сабодаш АБ. Гемодиафильтрация: внимание на объем (обзор литературы). Нефрология и диализ 2014; 16(1):128–138
67. Peters SA, Bots ML, Canaud B et al. Haemodiafiltration and mortality in end-stage kidney disease patients: a pooled individual participant data analysis from four randomized controlled trials. Nephrol Dial Transplant 2016;31(6):978–984. Doi: 10.1093/ ndt/gfv349
68. Строков АГ, Гуревич КЯ, Ильин АП и соавт. Лечение пациентов с хронической болезнью почек 5 стадии (ХБП 5) методами гемодиализа и гемодиафильтрации. Клинические рекомендации. Нефрология 2017; 21(3):92–111
69. Daugirdas JT, Depner TA, Inrig J et al. KDOQI Clinical Practice Guideline for Hemodialysis Adequacy: 2015 update. National Kidney Foundation. Am J Kidney Dis 2015;66(5):884–930. Doi: 10.1053/j.ajkd.2015.07.015
70. Jindal K, Chan CT, Deziel C et al. Hemodialysis clinical practice guidelines for the Canadian Society of Nephrology. Canadian Society of Nephrology Committee for Clinical Practice Guidelines. J Am Soc Nephrol 2006;17(3 Suppl 1):S1–27. Doi: 10.1681/ASN.2005121372
71. Nesrallah GE, Mustafa RA, MacRae J et al. Canadian Society of Nephrology guidelines for the management of patients with ESRD treated with intensive hemodialysis. Am J Kidney Dis 2013;62(1):187–198. Doi: 10.1053/j.ajkd.2013.02.351
72. European Best Practice Guidelines for Haemodialysis (Part 1). II.1 Haemodialysis dose quantification: small solutes. Nephrology Dialysis Transplantation 2002; 17(suppl_7):17–21. Doi: 10.1093/ndt/17.suppl_7.17
73. Mactier R, Hoenich N, Breen C. Renal Association Clinical Practice Guideline on haemodialysis. Nephron Clin Pract 2011;118 Suppl 1:c241–86. Doi: 10.1159/000328072
74. Бикбов БТ, Томилина НА. Состав больных и показатели качества лечения на заместительной терапии терминальной хронической почечной недостаточности в Российской Федерации в 1998-2013 гг. Нефрология и Диализ 2016;18(2):98–164
75. Gotch FA. The current place of urea kinetic modelling with respect to different dialysis modalities. Nephrol Dial Transplant 1998;13 Suppl 6:10–14
76. Leypoldt JK, Jaber BL, Zimmerman DL. Predicting treatment dose for novel therapies using urea standard Kt/V. Semin Dial 2004;17(2):142–145
77. Daugirdas JT, Depner TA, Greene T et al. Standard Kt/ Vurea: A method of calculation that includes effects of fluid removal and residual kidney clearance. Kidney Int 2010;77(7):637–644. Doi: 10.1038/ki.2009.525
78. Rivara MB, Ravel V, Streja E et al. Weekly Standard Kt/ Vurea and Clinical Outcomes in Home and In-Center Hemodialysis. Clin J Am Soc Nephrol 2018;13(3):445–455. Doi: 10.2215/ CJN.05680517
79. Schneditz D, Daugirdas JT. Compartment effects in hemodialysis. Semin Dial 2001;14(4):271–277
80. Debowska M, Poleszczuk J, Wojcik-Zaluska A et al. Phosphate Kinetics During Weekly Cycle of Hemodialysis Sessions: Application of Mathematical Modeling. Artif Organs 2015;39(12):1005–1014. Doi: 10.1111/aor.12489
81. Василевский АМ, Герасимчук РП, Земченков АЮ и др. Двухволновой оптико-электронный сенсор для мониторинга концентрации мочевой кислоты в диализной жидкости. Медицинская техника 2015;3:1–3
82. Thompson S, Manns B, Lloyd A et al. Impact of using two dialyzers in parallel on phosphate clearance in hemodialysis patients: a randomized trial. Nephrol Dial Transplant 2017;32(5):855–861. Doi: 10.1093/ndt/gfw085
83. Meyer TW, Sirich TL, Hostetter TH. Dialysis cannot be dosed. Semin Dial 2011;24(5):471–479. Doi: 10.1111/j.1525-139X.2011.00979.x
84. McIntyre CW, Harrison LE, Eldehni MT et al. Circulating endotoxemia: a novel factor in systemic inflammation and cardiovascular disease in chronic kidney disease. Clin J Am Soc Nephrol 2011;6(1):133–141. Doi: 10.2215/CJN.04610510
85. Movilli E, Gaggia P, Zubani R et al. Association between high ultrafiltration rates and mortality in uraemic patients on regular haemodialysis. A 5-year prospective observational multicentre study. Nephrol Dial Transplant 2007;22(12):3547–3552
86. Saran R, Bragg-Gresham JL, Levin NW et al. Longer treatment time and slower ultrafiltration in hemodialysis: associations with reduced mortality in the DOPPS. Kidney Int 2006;69(7):1222–1228
87. Assimon MM, Wenger JB, Wang L, Flythe JE. Ultrafiltration Rate and Mortality in Maintenance Hemodialysis Patients. Am J Kidney Dis 2016;68(6):911–922. Doi: 10.1053/j. ajkd.2016.06.020
88. Kim TW, Chang TI, Kim TH et al. Association of Ultrafiltration Rate with Mortality in Incident Hemodialysis Patients. Nephron 2018;139(1):13–22. Doi: 10.1159/000486323
89. Flythe JE, Assimon MM, Overman RA. Target weight achievement and ultrafiltration rate thresholds: potential patient implications. BMC Nephrol 2017;18(1):185. Doi: 10.1186/ s12882-017-0595-5
90. Flythe JE, Kshirsagar AV, Falk RJ, Brunelli SM. Associations of posthemodialysis weights above and below target weight with all-cause and cardiovascular mortality. Clin J Am Soc Nephrol 2015;10(5):808–816. Doi: 10.2215/CJN.10201014
91. Davies SJ, Davenport A. The role of bioimpedance and biomarkers in helping to aid clinical decision-making of volume assessments in dialysis patients. Kidney Int 2014;86(3):489–496. Doi: 10.1038/ki.2014.207
92. Вишневский КА, Герасимчук РП, Земченков АЮ. Коррекция «сухого веса» у больных, получающих лечение программным гемодиализом по результатам векторного анализа биоимпеданса. Нефрология 2014;18(2):61–71
93. Hecking M, Karaboyas A, Antlanger M et al. Significance of interdialytic weight gain versus chronic volume overload: consensus opinion. Am J Nephrol 2013;38(1):78–90. Doi: 10.1159/000353104
94. Zoccali C, Moissl U, Chazot C et al. Chronic Fluid Overload and Mortality in ESRD. J Am Soc Nephrol 2017;28(8):2491– 2497. Doi: 10.1681/ASN.2016121341
95. Weiner DE, Brunelli SM, Hunt A et al. Improving clinical outcomes among hemodialysis patients: a proposal for a "volume first" approach from the chief medical officers of US dialysis providers. Am J Kidney Dis 2014;64(5):685–695. Doi: 10.1053/j. ajkd.2014.07.003
96. Burton JO, Jefferies HJ, Selby NM, McIntyre CW. Hemodialysis-induced repetitive myocardial injury results in global and segmental reduction in systolic cardiac function. Clin J Am Soc Nephrol 2009;4(12):1925–1931. Doi: 10.2215/CJN.04470709
97. McIntyre CW, Goldsmith DJ. Ischemic brain injury in hemodialysis patients: which is more dangerous, hypertension or intradialytic hypotension? Kidney Int 2015;87(6):1109–1115. Doi: 10.1038/ki.2015.62
98. Perl J, Dember LM, Bargman JM et al. The Use of a Multidimensional Measure of Dialysis Adequacy-Moving beyond Small Solute Kinetics. Clin J Am Soc Nephrol 2017;12(5):839–847. Doi: 10.2215/CJN.08460816
99. Hanafusa N, Tsuchiya K, Nitta K et al. Dialysate sodium concentration: The forgotten salt shaker. Semin Dial 2018;31(6):563–568. Doi: 10.1111/sdi.12749
100. Яковенко АА, Румянцев АШ. Распространенность белково-энергетической недостаточности у пациентов, получающих лечение программным гемодиализом. Нефрология и Диализ 2019;21(1)
101. Piccoli GB, Nielsen L, Gendrot L et al. Prescribing Hemodialysis or Hemodiafiltration: When One Size Does Not Fit All the Proposal of a Personalized Approach Based on Comorbidity and Nutritional Status. J Clin Med 2018;7(10). pii: E331. Doi: 10.3390/jcm7100331
102. Сабодаш АБ, Салихова КА, Земченков ГА и др. Внезапная смерть и интервал QTc у пациентов на гемодиализе. Нефрология и диализ 2016;18(4):394–403
103. Wetmore JB, Li S, Molony JT et al. Insights from the 2016 Peer Kidney Care Initiative Report: Still a Ways to Go to Improve Care for Dialysis Patients. Am J Kidney Dis 2018;71(1):123–132. Doi: 10.1053/j.ajkd.2017.08.023
104. Georgianos PI, Agarwal R. Blood pressure in hemodialysis: targets? Curr Opin Nephrol Hypertens 2017;26(6):523–529. Doi: 10.1097/MNH.0000000000000359
105. Сабодаш АБ, Салихова КА, Земченков ГА и др. Динамика артериальной гипертензии и выживаемость у пациентов на гемодиализе. Нефрология и диализ 2016; 18(4): 416–430
106. Joki N, Tokumoto M, Takahashi N, Nishimura M. Current Perspectives on Sudden Cardiac Death in Hemodialysis Patients. Contrib Nephrol 2018;196:5–12. Doi: 10.1159/000485690
107. Vázquez E, Sánchez-Perales C, García-García F et al. Sudden death in incident dialysis patients. Am J Nephrol 2014;39(4):331–336. Doi: 10.1159/000360547
108. Maduell F, Arias M, Durán CE et al. Nocturnal, everyother-day, online haemodiafiltration: an effective therapeutic alternative. Nephrol Dial Transplant 2012;27(4):1619–1631. Doi: 10.1093/ndt/gfr491
109. Земченков АЮ, Герасимчук РП. Результаты перевода пациентов на четырехразовый гемодиализ. Нефрология и диализ 2019;21(1)
110. Loutradis C, Sarafidis PA, Papadopoulos CE et al. The Ebb and Flow of Echocardiographic Cardiac Function Parameters in Relationship to Hemodialysis Treatment in Patients with ESRD. J Am Soc Nephrol 2018;29(5):1372–1381. Doi: 10.1681/ ASN.2017101102
111. Georgianos PI, Sarafidis PA. Pro: Should we move to more frequent haemodialysis schedules? Nephrol Dial Transplant 2015;30(1):18–22. Doi: 10.1093/ndt/gfu381
112. Foley RN, Gilbertson DT, Murray T, Collins AJ. Long interdialytic interval and mortality among patients receiving hemodialysis. N Engl J Med 2011;365(12):1099–1107. Doi: 10.1056/NEJMoa1103313
113. Flythe JE, Dorough A, Narendra JH et al. Perspectives on symptom experiences and symptom reporting among individuals on hemodialysis. Nephrol Dial Transplant 2018;33(10):1842– 1852. Doi: 10.1093/ndt/gfy069
114. Caskey F, Van Biesen W, Andreoli S et al. Integrated care for end stage kidney disease. The role of supportive care. Kidney International Supplements 2019; 9(2):
Об авторах
А. Ш. РумянцевРоссия
Проф., д-р мед наук, Санкт-Петербургский государственный университет, кафедра факультетской терапии
Г. А. Земченков
Россия
ББраун Авиум Руссланд Клиникс
А. Б. Сабодаш
Россия
Доц., канд. мед. наук, Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова, кафедра нефрологии и диализа
Рецензия
Для цитирования:
Румянцев А.Ш., Земченков Г.А., Сабодаш А.Б. К ВОПРОСУ О ПЕРСПЕКТИВАХ ОБНОВЛЕНИЯ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ ПО ГЕМОДИАЛИЗУ. Нефрология. 2019;23(2):49-76. https://doi.org/10.24884/1561-6274-2019-23-2-49-76
For citation:
Rumyantsev A.Sh., Zemchenkov G.A., Sabodash A.B. TO THE QUESTION ABOUT THE PROSPECTIVE FOR THE UPDATES OF CLINICAL GUIDELINES FOR HEMODIALYSIS. Nephrology (Saint-Petersburg). 2019;23(2):49-76. (In Russ.) https://doi.org/10.24884/1561-6274-2019-23-2-49-76








































