Перейти к:
Миостатин при белково-энергетической недостаточности у пациентов на гемодиализе
https://doi.org/10.24884/1561-6274-2019-23-3-36-41
Аннотация
Цель: оценка влияния миостатина (MSTN) на развитие клинико-лабораторных проявлений нарушения белкового обмена у пациентов, получающих гемодиализ.
Пациенты и методы: было обследовано 80 больных с ХБП С5Д стадии (47 мужского и 33 женского пола), получающих терапию программным гемодиализом. У всех пациентов проводился тщательный сбор клинико-анамнестических данных, лабораторный мониторинг с определением уровня MSTN в крови методом иммуноферментного анализа, динамометрическое и биоимпедансометрическое исследование. Статистический анализ осуществляли с помощью программ «STATISTICA 10.0» («StatSoft Inc.», США) и «Microsoft Office Excel 2010» («Microsoft Corp.», США).
Результаты: при проведении регрессионного анализа не было выявлено статистически значимой связи уровня MSTN с показателями белково-энергетической недостаточности (БЭН), альбумином, β2-микроглобулином, СРБ, ферритином крови. Ни прием различных лекарственных средств (за исключением кетоа-минокислот), ни наличие сопутствующей патологии в анамнезе не изменяли уровень MSTN. В то же время, была выявлена зависимость локального увеличения толщины кожных складок с исследуемым маркером, повышение которого ассоциировано с прогрессирующим снижением мышечной силы.
Заключение: в результате проведенного исследования была оценена взаимосвязь сывороточной концентрации MSTN с клинико-лабораторными проявлениями БЭН. Полученные данные характеризуют вклад MSTN в процесс мышечной деградации белка, что может стать мишенью для таргетного терапевтического воздействия и требует дальнейшего изучения.
Ключевые слова
Для цитирования:
Кузярова А.С., Гасанов М.З., Батюшин М.М., Голубева О.В. Миостатин при белково-энергетической недостаточности у пациентов на гемодиализе. Нефрология. 2019;23(3):36-41. https://doi.org/10.24884/1561-6274-2019-23-3-36-41
For citation:
Kuzyarova A.S., Gasanov M.Z., Batyushin M.M., Golubeva O.V. Myostatin in protein-energy wasting in patients on hemodialysis. Nephrology (Saint-Petersburg). 2019;23(3):36-41. (In Russ.) https://doi.org/10.24884/1561-6274-2019-23-3-36-41
ВВЕДЕНИЕ
На сегодняшний день основными методами заместительной почечной терапии (ЗПТ) являются гемодиализ (ГД) и перитонеальный диализ (ПД), лечением которыми обеспечиваются более 80 % пациентов с терминальной стадией почечной недостаточности (тПН) во всем мире. По данным отчета Российского Национального регистра (декабрь 2015), в России ЗПТ получали 44 136 больных с хронической болезнью почек (ХБП) 5Д стадии, среди которых доля ГД составила около 93 % [1]. Продолжительность ж изни и заболеваемость почечных больных зависят не столько от выбора модальности диализной программы, обусловленной различными, в том числе, социальноэкономическими причинами, но в большой степени от наличия сопутствующей патологии, влияющей на течение основного заболевания и резко ухудшающей его прогноз [2]. Важнейший вклад в структуру смертности обсуждаемой когорты пациентов вносит нарушение нутритивного статуса. Оно сопровождается развитием белковоэнергетической недостаточности (БЭН), тяжелые стадии которой характеризуются развитием уремической саркопении. Проявления БЭН встречаются у 20-70 % гемодиализных пациентов, а также у 18-56 % больных на ПД. Чаще наблюдается легкая и среднетяжелая стадия БЭН и гораздо реже - выраженные нарушения [3]. Этиология развития саркопении носит многофакторный характер и может быть обусловлена нарушением роста новых мышечных волокон, подавлением синтеза или стимуляцией деградации белка [4]. Если раньше ведущая роль отводилась снижению поступления белка в организм, то сегодня достоверно известно, что увеличение потребления белка не может в значительной степени снизить его ХБП-индуцированную потерю, если не будет заблокирован катаболический контур. В настоящее время не существует надежных способов борьбы с мышечным истощением, вызванным ХБП, но были обнаружены механизмы, которые контролируют оборот клеточного белка, что в будущем позволит разработать терапевтические стратегии для уменьшения явлений саркопении. Основной причиной потери мышечной массы является нарушение передачи сигналов ЮРН/РВК/АкРпути, ведущая роль в котором отводится гиперэкспрессии миостатина (МSTN). Осложнения, связанные с уремией, такие как системное воспаление, прогрессирующая анемия, ацидоз, гормональные нарушения в метаболизме витамина D3 и гиперин- сулинемия являются инициальными факторами для повышения МSTN, приводящего к активации протеолиза через убиквитин-протеосомную систему [5]. Миостатин - член семейства трансформирующего фактора роста-β (TGF-β), является отрицательным регулятором роста и развития мышц (рисунок). Связываясь с активиновыми рецепторами IIB типа, он через Smad 2/ Smad 3-сигнальные пути ингибирует фосфорилирование АКТ, тем самым увеличивает уровни активного FoxO1, приводя к экспрессии генов, связанных с атрофией [6]. Он также блокирует экспрессию фактора MyoD, который усиливает миогенез. Таким образом, МSTN играет двойную роль, участвуя как в усилении деградации белка, так и в подавлении пролиферации и дифференцировки миоцитов [7].
Еще одним механизмом развития уремической саркопении является нарушение репарации и синтеза новых мышечных волокон, индуцированных клетками-спутниками (клетки-предшественники мышц) [8, 9]. Эти клетки, находясь под базальной пластинкой, покрывающей миофибриллы, пребывают в покое. При снижении мышечной массы клетки-сателлиты начинают экспрессировать транскрипционные факторы MyoD и миогенин [10]. Затем путем мезенхимально-эпителиальной трансформации дифференцируются в миоциты и образуют новые мышечные волокна [11,12]. В исследовании M. Sharma, C. McFarlane и др. было установлено ингибирующее влияние проявлений уремии (системное воспаление, дефицит сигнала IGF-1 и др.) на сателлитные клетки [8]. Таким образом, своевременное определение стадии БЭН у пациентов, получающих ЗПТ программным гемодиализом, имеет важное прогностическое значение.
Целью исследования явилась оценка роли мио- статина в процессе катаболизма белка у пациентов на гемодиализе.
ПАЦИЕНТЫ И МЕТОДЫ
Было обследовано 80 больных с ХБП 5Д стадии (47 мужского и 33 женского пола), получающих терапию программным гемодиализом. Средний возраст составил 51,7±11,6 года, длительность диализа - 33,5 (0,5; 236) мес. У всех участников исследования был проведен тщательный сбор анамнестических данных, учитывающих индивидуальные особенности течения и прогрессирования ХБП, наличие сопутствующей патологии, проводимую лекарственную терапию. Потребление питательных веществ и калорийность определяли по результатам заполнения индивидуальных 3-дневных пищевых дневников. Оценивали антропометрические данные, включающие измерение роста и массы тела с целью расчета ИМТ и процента отклонения от идеальной массы тела; измеряли толщину кожной складки над бицепсом, трицепсом, в подвздошной области, над лопаткой для подсчета процентного содержания жировой ткани. Стадию БЭН оценивали с использованием комплексной методики в модификации G.L. Bilbrey и T.L.Cohen [3]. Уровень MSTN определяли в сыворотке крови методом полуоткрытого иммуноферментного анализа с использованием набора «Myostatin ELISA Kit» (США). Сопутствующий лабораторный мониторинг включал в себя общий и биохимический анализы крови с оценкой показателей феррокинетики, уровней креатинина, мочевины, СРБ, р2-микроглобулина, паратиреоидного гормона и др. Функциональное состояние мышечной ткани определяли при помощи кистевой динамометрии. Методом биоимпедансоме- трии оценивали показатели компонентного состава тела.
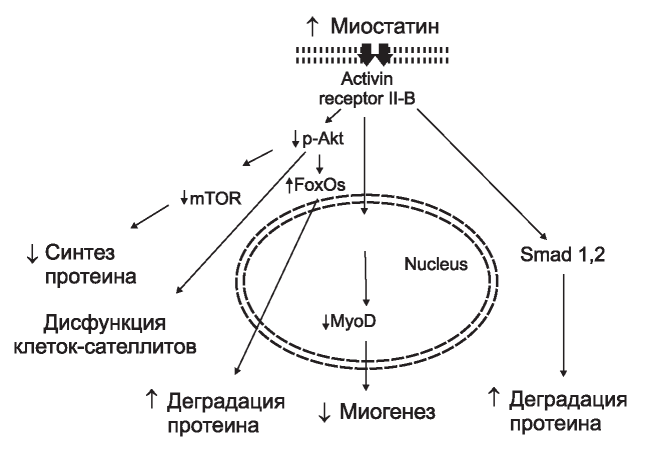
Рисунок. Схема патогенетических эффектов миостатина. Akt - протеин киназа β, mTOR - белок-мишень рапамицина млекопитающих, Myostatin - миостатин, Activin receptor ΙΙβ - активиновый рецептор ΙΙβ типа, FoxOs, Smad 1,2 - транскрипционные факторы, MyoD - фактор миогенеза.
Figure 1. Diagram of the pathogenetic effects of the myostatin. Akt - protein kinase β, mTOR - mammalian target rapamycin protein, FoxOs - forkhead box protein, Smad 1,2 - transcription factors, MyoD - the factor of myogenesis.
Статистический анализ данных проводился с помощью пакета прикладных программ «Microsoft Office» («Microsoft Corporation», США) и «Statistica-10.0» («StatSoft Inc.», США). При нормальном распределении признака в группе при сравнении независимых выборок применяли критерий Стьюдента, а при отличии от нормального - критерии Манна-Уитни, χ2, тест Брауна-Форсайта. Корреляционный анализ при нормальном распределении выборки осуществлялся с помощью коэффициента Пирсона, при ненормальном - коэффициента Спирмена. Также проводился линейный регрессионный одно- и многофакторный анализ. При сравнении двух независимых выборок применяли методы дисперсионного анализа: анализ ANOVA с проведением теста Левене и Брауна-Форсайта при нормальном распределении и по критерию Краскела-Уоллиса при распределении, отличном от нормального. Нулевую статистическую гипотезу об отсутствии различий и связей отвергали при p<0,05.
РЕЗУЛЬТАТЫ
Респонденты были разделены на две подгруппы в зависимости от уровня MSTN, медиана которого составила 8,47±1,27 нг/мл, колеблясь от 5,39 до 12,80 нг/мл. В исследуемой группе частота встречаемости БЭН составила 90 % случаев (72 человека). Большая часть БЭН относилась к легкой - 61,25 % и среднетяжелой стадии - 27,5 %, лишь у 1 пациента отмечались выраженные проявления белково-энергетической недостаточности. Несмотря на высокую частоту встречаемости не было получено корреляционных взаимоотношений между стадией БЭН, ее биоимпедансометрическими характеристиками и миостатином ни в количественном, ни в качественном соотношении признаков, что может свидетельствовать о более выраженном влиянии на экспрессию в крови изучаемого катаболического маркера наличия более тяжелых форм нарушений нутритивного статуса, встречающихся в изучаемой выборке не так часто.
Несмотря на то, что самостоятельная связь между БЭН и миостатином не определялась, повышение уровня MSTN >8,49 нг/мл на 20 % ассоциировалось со снижением мышечной силы, по данным динамометрии, на 12 %, в случае повышения на 75 % вероятность развития слабости мышц достигала 22 % ( р=0,04).
Клинические проявления уремической интоксикации не имели достоверной связи с уровнем МSTN (кожный зуд - r = -0,11, боли в костях - r = 0,06, миалгии - r = -0,04, судороги - r = -0,12), что определяет низкую диагностическую значимость данных признаков в оценке катаболическо- го вектора мышечного метаболизма. Среди всего спектра оцененных лечебных мероприятий ассоциацию с высокой концентрацией MSTN в крови показало применение кетоаналогов аминокислот (таблица). Это может быть объяснено использованием кетокислот с целью терапевтической коррекции признаков БЭН, ассоциированной с выраженными катаболическими процессами, характеризующимися, в том числе, высоким уровнем миостатина.
Таблица / Table
Статистически значимые результаты логистического регрессионного анализа влияния клинических признаков на вероятность повышения миостатина
Statistically significant results of a logistic regression analysis of the influence of clinical signs on the likelihood of increasing myostatin
Показатель и уравнения регрессии* | Constanta B0 | Estimate | ОШ | χ2 | df | p |
|---|---|---|---|---|---|---|
Толщина складки над бицепсом, мм | -2,58 | 0,90 | 2,47 | 5,3 | 1 | 0,02 |
Толщина складки в подвздошной области, мм | -1,63 | 0,40 | 1,49 | 4,3 | 1 | 0,039 |
Длительный прием кетоаналогов аминокислот | -0,35 | 1,33 | 3,78 | 6,45 | 1 | 0,01 |
В то же время, лечение другими исследуемыми препаратами: ингибиторами АПФ, АРА II, β-блокаторами, антагонистами кальциевых каналов, диуретиками, антипаратиреоидными, фос- фатсвязывающими медикаментозными средствами не влияет на белково-энергетический статус пациентов. Проведенный регрессионный анализ также не выявил изменения уровня миостатина в зависимости от наличия сопутствующей патологии (р>0,05). При распределении по двум подгруппам в зависимости от медианы миостатина уровень исследуемого фактора не имел статистически значимой корреляционной связи с уровнем альбумина крови и показателями феррокинетики. Несмотря на имеющиеся литературные данные об индуцирующем влиянии системного воспаления на экспрессию миостатина, нами подобной зависимости выявлено не было. Повышение концентрации β2-микроглобулина и С-реактивного белка не влияло на уровень MSTN крови (р = 0,98 и р = 0,07). Проведение логистического регрессионного анализа позволило обнаружить влияние антропометрических данных на повышение миостатина. Так, в подгруппе MSTN > 8,49 нг/мл толщину складки над бицепсом более 4 мм выявляли в 72 % случаев, и у более 83 % обследованных увеличение кожной складки в подвздошной области составляло более 8 мм (см. таблицу).
ОБСУЖДЕНИЕ
БЭН, индуцированная ХБП, нарушает метаболизм мышечных белков, вызывая гипотрофию и гипоплазию скелетной мускулатуры [8]. При тяжелых стадиях она клинически проявляется уремической саркопенией, важную роль в развитии которой играет миостатин. В проведенном нами исследовании не было выявлено самостоятельной статистически значимой связи МSTN с БЭН, однако была обнаружена отрицательная регрессионная зависимость с таким клиническим проявлением саркопении, как снижение мышечной силы, что можно объяснить недостаточной чувствительностью данного метода определения степени БЭН. Несмотря на то, что методика по G.L. Bilbrey и T.L. Cohen на сегодняшний день является одним из наиболее универсальных и комплексных способов оценки пищевого статуса у пациентов на гемодиализе, она не в полной мере учитывает клинические проявления мышечного истощения у данной когорты пациентов и требует дальнейшего усовершенствования. Выявленное влияние повышения уровня миостатина на степень мышечной гипотрофии, скорее всего, реализуется опосредованно через активацию протеолиза, нарушение синтеза мышечного волокна, а также снижение репаративного потенциала клеток-предшественников. Последний факт подтверждается работой J. Dong и соавт., в которой было детально изучено индуцирующее влияние миостатина в условиях ХБП на дифференцировку сателлитных клеток по фиброгенному пути, приводящую к избирательным структурным изменениям и значительному мышечному истощению при наличии нормальной физиологии скелетных мышц [10]. Тот факт, что ХБП является состоянием постоянного воспалительного процесса, давно известен и подтверждается многочисленными исследованиями [13, 14]. Однако нами не было выявлено изменения показателей системного воспаления ф2-микроглобулин, СРБ, ферритин), а также показателей феррокинетики и альбумина в зависимости от концентрации исследуемого маркера, что может быть связано с системным влиянием данных факторов, наличием сопутствующей патологии, параметрами и продолжительностью диализа. В то же время, изменение толщины кожных складок над бицепсом и в подвздошной области, соотносящееся с повышением уровня MSTN, свидетельствует о вкладе миостатина в адипогенез, развитие инсулинорезистентности и, следовательно, индукции оксидативного стресса, приводящего к нарушению мышечного гомеостаза [15].
ЗАКЛЮЧЕНИЕ
В исследовании выявлено влияние повышенного уровня миостатина на параметры снижения мышечной силы, что может быть связано с процессами фиброадипогенеза в мышечном волокне. В свою очередь прогрессирующее снижение силы сокращения является клиническим проявлением белково-энергетической недостаточности, нарастающей прогрессивно почечной дисфункции. Не было выявлено связи белков системного воспаления, параметров феррокинетики, концентрации альбумина с MSTN, что делает неактуальным определение данных биохимических показателей при оценке БЭН. В фармакологическом анамнезе статистически значимая связь была обнаружена при использовании кетоаналогов аминокислот - со снижением прогрессирования почечной дисфункции. В отношении других лекарственных препаратов связь была недостоверна. Вклад сопутствующей патологии в изменение сывороточной концентрации миостатина также не показал достоверного результата. Таким образом, миостатин оказывал влияние на мышечную силу пациентов, получавших лечение гемодиализом. Однако дальнейшего изучения требуют межмоле- кулярные взаимодействия миостатина в катаболи- ческом каскаде с целью комплексной оценки его роли в этом процессе.
Список литературы
1. Томилина НА, Андрусев АМ, Перегудова НГ, Шинкарев МБ. Заместительная терапия терминальной хронической почечной недостаточности в Российской Федерации в 2010-2015 гг Отчет по данным Общероссийского Регистра заместительной почечной терапии Российского диализного общества, Часть первая. Нефрология и диализ 2017; приложение к Т. 19 (4): 1-95 Doi: 10.28996/1680-4422-2017-4suppl-1-95
2. Агранович НВ, Кнышова СА, Батюшин ММ, Байда АП. Хроническая болезнь почек в амбулаторно-поликлинической практике. Диагностика, лечение, профилактика, медикосоциальная экспертиза, Ставрополь, СтавГМУ, 2014; 57
3. Ветчинникова ОН, Пичугина ИС. Белково-энергетическая недостаточность у пациентов с хронической болезнью почек на диализной терапии, МОНИКИ 1775, М., 2015; 3-5
4. Xiaonan HW, William EM. Mechanisms of muscle wasting in chronic kidney disease. Nat Rev Nephrol 2014; 10 (9): 504-516. Doi:10.1038/nrneph.2014.112
5. Смирнов АВ, Голубев РВ, Коростелева НЮ и др. Снижение физической работоспособности у больных, получающих заместительную почечную терапию: фокус на сарко-пению. Нефрология 2017; 21(4): 9-29
6. Willem MH. Hoogaars, Richard T. Jaspers. Past, Present, and Future Perspective of Targeting Myostatin and Related Signaling Pathways to Counteract Muscle Atrophy. In: Xiao J et al. Muscle Atrophy. Advances in Experimental Medicine and Biology 2018, Springer, Singapore; 153-206
7. Гасанов МЗ. Молекулярные аспекты патогенеза сарко-пении у пациентов с хронической болезнью почек: интегративная роль mTOR. Нефрология 2018; 22(5): 9-16
8. Sharma M, McFarlane C, Kambadur R et al. Myostatin: expanding horizons. IUBMB Life 2015; 67(8): 589-600. Doi:10.1002/iub.1392
9. Liping Z, Xiaonan HW, Huiling W et al. Satellite cell dysfunction and impaired IGF-1 signaling cause CKD-induced muscle atrophy. J Am Soc Nephrol 2010; 21(3): 419-427. Doi: 10.1681/ASN.2009060571
10. Jiangling D, Yanjun D, Zihong C et al. The pathway to muscle fibrosis depends on myostatin stimulating the differentiation of fibro/adipogenic progenitor cells in chronic kidney disease. Kidney Int 2017; 91(1): 119-128. Doi: 10.1016/j.kint.2016.07.029
11. Anat J. The origin, molecular regulation and therapeutic potential of myogenic stem cell populations. Journal of anatomy 2009; 215(5): 477-497. Doi: 10.1111/j.1469-7580.2009.01138.x
12. Lee EJ, Jan AT, Baig MH et al. Fibromodulin: a master regulator of myostatin controlling progression of satellite cells through a myogenic program. The FASEB Journal 2016; 30(8): 2708-2719. Doi: 10.1096/fj.201500133R
13. Cheema B, Abas H, Smith B et al. Investigation of skeletal muscle quantity and quality in end-stage renal disease. Nephrology 2010; 15(4): 454-463. Doi: 10.1111/j.1440-1797.2009.01261.x
14. Raj DSC, Sun Y, Tzamaloukas AH. Hypercatabolism in dialysis patients. Current Opinion in Nephrology and Hypertension 2008; 17(6): 589-594. Doi: 10.1097/MNH.0b013e32830d5bfa
15. Bing D, Feng Z, Jianghui W et al. The function of myostatin in the regulation of fat mass in mammals. Nutr Metab 2017; 14(29). Doi: 10.1186/s12986-017-0179-1
Об авторах
А. С. КузяроваРоссия
Кузярова Ангелина Сергеевна - кафедра внутренних болезней № 2, клинический ординатор.
344022, Ростов-на-Дону, пер. Нахичеванский, д. 29., тел.: +7 904-508-4637
М. З. Гасанов
Россия
Гасанов Митхат Зульфугар-оглы - кандидат медицинских наук, доцент, кафедра внутренних болезней № 1.
344022, Ростов-на-Дону, пер. Нахичеванский, д. 29, тел.: +7 988-947-37-50
М. М. Батюшин
Россия
Батюшин Михаил Михайлович - доктор медицинских наук, профессор, кафедра внутренних болезней № 2.
344022, Ростов-на-Дону, пер. Нахичеванский, д.29, тел.: +7 918-501-88-01
О. В. Голубева
Россия
Голубева Оксана Владимировна - главный врач.
344029, Ростов-на-Дону, ул. 1-й Конной Армии, д. 33, тел.: +7 918-854-09-60
Рецензия
Для цитирования:
Кузярова А.С., Гасанов М.З., Батюшин М.М., Голубева О.В. Миостатин при белково-энергетической недостаточности у пациентов на гемодиализе. Нефрология. 2019;23(3):36-41. https://doi.org/10.24884/1561-6274-2019-23-3-36-41
For citation:
Kuzyarova A.S., Gasanov M.Z., Batyushin M.M., Golubeva O.V. Myostatin in protein-energy wasting in patients on hemodialysis. Nephrology (Saint-Petersburg). 2019;23(3):36-41. (In Russ.) https://doi.org/10.24884/1561-6274-2019-23-3-36-41
JATS XML









































