Перейти к:
Изменение реактивности сосудов крыс с экспериментальным уменьшением массы функционирующих нефронов
https://doi.org/10.24884/1561-6274-2019-23-4-88-95
Аннотация
Цель: оценить изменения эндотелийзависимой регуляции тонуса кровеносных сосудов (аорты и верхней брыжеечной артерии) у крыс через 4 месяца после удаления 5/6 почечной ткани.
Материал и методы. Модель ХБП создавали резекцией 5/6 массы почечной ткани. В экспериментальную группу вошли животные (n=12), подвергнутые нефрэкто-мии (НЭ). Контрольную группу составили ложнооперированные (ЛО) крысы (n=10). Исследования реактивности сосудов проводили на кольцевых сегментах длиной 2 мм, которые вырезали из аорты и верхней брыжеечной артерии (ВБА). Всего было подготовлено 23 сегмента аорты и 17 сегментов ВБА от крыс после НЭ и 18 сегментов аорты и 15 сегментов ВБА от контрольных животных. Для измерения силы сокращений препаратов использовали датчик FORT-10 (WPI, USA). Оценивали амплитуду ответов сосудов, предварительно сокращенных фенилэфрином (1 *10-5 М ), на ацетилхолин (АХ, 1 *10-6 М), а также реакцию на АХ в условиях предварительного воздействия ТЭА (1 x10-3 М) и L-NAME (1 x10-4 М).
Результаты. Через 4 месяца после резекции части почечной ткани у крыс развивались артериальная гипертензия - АД в группе НЭ крыс было выше (165, 0±9,8 мм рт.ст) по сравнению с ЛО (127,2±9,7 мм рт. ст., р<0,001), и ремоделирование миокарда (ИММЛЖ у НЭ крыс составлял 2,72±0,11 мг/г по сравнению с 2,35±0,09 мг/ в ЛО группе, р<0,001). НЭ также приводила к уменьшению дилатация фрагментов аорты и ВБА на АХ по сравнению с ЛО животными. В условиях блокады синтеза NO ингибитором NO- синтазы - L-NAME реакция на АХ также была ниже у крыс с НЭ. Предварительная блокада Ca2+-активируемых К+-каналов большой проводимости введением ТЭА приводила к снижению вазодилатации, вызванной АХ, у НЭ крыс по сравнению с ЛО группой.
Заключение. Резекция 5/6 массы ткани почек у крыс вызывает снижение реактивности сосудов на АХ. Дисрегуляция тонуса сосудов связана с нарушением продукции/биодоступности NO, синтезируемого эндотелием и ингибированием механизма эндотелиальной гиперполяризации.
Ключевые слова
Для цитирования:
Иванова Г.Т., Лобов Г.И., Береснева О.Н., Парастаева М.М. Изменение реактивности сосудов крыс с экспериментальным уменьшением массы функционирующих нефронов. Нефрология. 2019;23(4):88-95. https://doi.org/10.24884/1561-6274-2019-23-4-88-95
For citation:
Ivanova G.T., Lobov G.I., Beresneva O.N., Parastaeva M.M. Changes in the reactivity of vessels of rats with an experimental decrease in the mass of functioning nephrons. Nephrology (Saint-Petersburg). 2019;23(4):88-95. (In Russ.) https://doi.org/10.24884/1561-6274-2019-23-4-88-95
ВВЕДЕНИЕ
В настоящее время известно, что сердечнососудистая система и почки являются настолько функционально связанными, что принято говорить о существовании кардиоренального континуума [1], частными проявлениями которого могут считаться кардиоренальные синдромы [2]. У пациентов с патологией почек (хроническая болезнь почек - ХБП) отмечается повышенный риск кардиоваскулярной заболеваемости и смертности [1, 3, 4, 5]. При этом ХБП рассматривается в качестве независимого фактора риска сердечнососудистых осложнений даже при умеренном снижении массы действующих нефронов (ранние стадии ХБП) [4, 5]. Среди больных ХБП риск сердечно-сосудистой смертности в 10-100 раз больше, чем у здоровых лиц [3].
При этом коронарная патология (коронарная болезнь сердца - КБС) является одной из основных причин смерти у пациентов с ХБП, а выживаемость больных с хронической почечной дисфункцией, подвергшихся коронарной реваскуляризации, хуже, чем при отсутствии повреждений почек. Частота и тяжесть обструктивных вариантов КБС нарастают по мере снижения скорости клубочковой фильтрации (СКФ). КБС при ХБП характеризуется диффузным вовлечением многих сосудов и их кальцификацией [6, 7].
Показано, что при ХБП риск смерти от сердечнососудистых осложнений увеличивается вследствие ускоренного развития атеросклероза, повышенной жесткости артерий и дисфункции эндотелия. Padberg и соавт. также выявили, что ХБП связана с повреждением эндотелиального гликокаликса (ЭГ), которое выражается в уменьшении толщины ЭГ и повышением в крови содержания продуктов распада ЭГ [8]. В свою очередь артериальная гипертензия (АГ) и гипертрофия левого желудочка у пациентов с ХБП считаются важными факторами кардиоваскулярного риска [9, 10]. Однако традиционные факторы сердечно-сосудистого риска, такие как АГ, гиперлипидемия и сахарный диабет, не полностью объясняют высокие кардиоваскулярную заболеваемость и смертность в условиях уменьшения количества функционирующих нефронов [11, 12]. Несмотря на то, что существует четкая обратно пропорциональная зависимость между снижением скорости клубочковой фильтрации (СКФ) и сердечно-сосудистой заболеваемостью, механизмы, которые приводят к росту летальных случаев от сердечно-сосудистых осложнений при дисфункции почек, остаются недостаточно изученными [12]. До сих пор нет единого мнения и о механизмах регуляции сосудистого тонуса при ХБП. Ответы на эти вопросы необходимы как для выработки адекватных методов коррекции сердечно-сосудистых осложнений при нарушении функции почек, так и для подбора превентивных мер, позволяющих предупредить или снизить негативное влияние почечной патологии на миокард и сосуды.
Более ясную картину может дать использование различных экспериментальных моделей, в том числе основанных на уменьшении массы функционирующей паренхимы почек. Однако большинство исследований состояния сердца и сосудов на таких моделях выполнено через сравнительно короткие сроки после индукции почечной недостаточности (2 мес. или менее). В связи этим мы сочли целесообразным оценить изменения эндотелийзависимой регуляции тонуса кровеносных сосудов (аорты и верхней брыжеечной артерии) у крыс через 4 мес после удаления 5/6 почечной ткани (5/6 НЭ), учитывая, что данный срок продолжительности жизни крысы эквивалентен 10-12 годам продолжительности жизни человека.
МАТЕРИАЛЫ И МЕТОДЫ
Эксперименты проведены на 22 крысах, самцах стока Wistar (масса 200-250 г) из биоколлекции лабораторных животных Института физиологии им. И.П. Павлова РАН. Исследование было одобрено этическим комитетом Института физиологии им. И.П. Павлова РАН. Животные содержались в условиях вивария, получали стандартный пищевой рацион и питьевую воду ad libitum.
Крысы были разделены на две группы. В первую группу вошли животные (n=12), подвергнутые резекции 5/6 массы ткани почек (НЭ). Вторую (контрольную) группу составили ложноопериро- ванные (ЛО) крысы (n=10).
Экспериментальную модель ХБП создавали за счет резекции 5/6 массы почечной ткани. Операцию проводили под наркозом в два этапа с интервалом в одну неделю. В качестве наркоза (внутримышечное введение) использовали ксилазин (0,05 мл) в сочетании с тилетамин/золазепамом (0,3 мл). На первом этапе удаляли 2/3 массы левой почки. На втором - полностью удаляли контрлатеральную правую почку. Для доступа к почкам использовали заднепоясничный разрез. С целью сохранения надпочечников почки перед резекцией декапсули- ровали. Контрольным животным «ложную» операцию также выполняли в два этапа с интервалом в одну неделю: операционную рану почки извлекали на 4-5 минут и без нефрэктомии помещали обратно. Такая модель до настоящего времени является «золотым стандартом» для изучения самых разных аспектов хронической болезни почек (ХБП) [1317]. После поэтапной резекции почечной ткани дальнейшее длительное существование организма в условиях резкого сокращения массы действующих нефронов сопровождается развитием гемодинамических, метаболических и иммунных сдвигов (системная и гломерулярная гипертензия, нарушения липидного обмена или кальций-фосфорного гомеостаза, хроническое воспаление и т.д.), почти идентичных появляющимся при прогрессировании ХБП у человека. В силу всего изложенного выше мы сочли модель 5/6 НЭ полностью соответствующей целям нашего исследования.
Срок наблюдения после оперативного вмешательства составлял 16 недель. По истечению этого срока у бодрствующих крыс проводили измерение систолического артериального давления (АД) манжеточным методом на хвосте, используя электроманометр фирмы ELEMA (Швеция), а также определяли частоту сердечных сокращений (ЧСС) за 1 минуту. Для каждой крысы выполняли 4-5 замеров АД и рассчитывали среднее значение трех последних измерений.
Эвтаназию животных осуществляли посредством декапитации, во время которой отбирались образцы крови для последующего анализа. В сыворотке крови определяли уровень мочевины (ммоль/л) на автоанализаторе «Cobas E Mira».
После декапитации у крыс иссекали грудную аорту и верхнюю брыжеечную артерию (ВБА) и помещали в охлажденный до +2 - +4 оС физиологический раствор, в котором они хранились до момента исследования. Исследования проводили на сегментах сосудов длиной 2 мм, которые вырезали из аорты и ВБА, предварительно очищенных от жира и соединительной ткани.
Всего было подготовлено 23 сегмента аорты и 17 сегментов ВБА от крыс с нефрэктомией и 18 сегментов аорты и 15 сегментов ВБА от контрольных животных. Подготовленные сосудистые препараты помещали в термостатируемую (+37,0±0,1оС) камеру миографа с проточным физиологическим солевым раствором следующего состава (ммоль/л): NaCl - 120,4; KCl - 5,9; CaCl2 - 2,5; MgCl2 - 1,2; NaH2PO4 - 1,2; NaHCO3 - 15,5; глюкоза - 11,5. Физиологический раствор сатурировали газовой смесью, состоящей из 95 % О2 и 5 % СО2. Для измерения силы сокращений препаратов использовали датчик FORT-10 (WPI, USA). Препараты подвергали исходному натяжению, соответствующему трансмуральному давлению 90 мм рт. ст. и после 30-минутной стабилизации регистрировали параметры их сократительной активности. Подробно методика эксперимента описана ранее [18].
В исследовании использовали: ацетилхолин (Acetylcholine chloride, Sigma-Aldrich) 1×10–10 – 1×10-4 М; L-NAME (Nω-Nitro-L-arginine methyl ester hydrochloride, ICN Biomedicals) 1×10–4 М; тетраэтиламмоний (Tetraethylammonium chloride, Sigma-Aldrich), 1×10–3 М; фенилэфрин (Phenylephrine, Sigma-Aldrich), 1×10–6 М.
После выведения из эксперимента у крыс также выделяли и взвешивали сердце. По результатам измерений рассчитывали индекс массы миокарда левого желудочка (ИММЛЖ), равный отношению: масса миокарда левого желудочка/ масса животного (мг/г).
Статистическую обработку полученных результатов проводили с помощью программы «StatSoft STATISTICA 6.1.478». Поскольку полученные данные имели нормальное распределение, они представлены в виде средних значений со стандартной ошибкой средней (M±SE). Для установления достоверности различий использовали t-критерий Стьюдента. Различия считали статистически значимыми при p<0,05.
Исследования проведены в соответствии с Национальным стандартом Российской федерации ГОСТ 3-53434-2009 «Принципы надлежащей лабораторной практики», Приказом Министерства здравоохранения и социального развития РФ от 23 августа 2010 г. № 708н «Об утверждении Правил лабораторной практики» при одобрении Этическим комитетом Института физиологии им. Павлова РАН.
РЕЗУЛЬТАТЫ
НЭ у крыс приводила к прогрессивному нарастанию азотемии. Так, через 4 месяца после резекции почечной ткани содержание мочевины в сыворотке крови у крыс увеличивалось в среднем до 20,1±2,6 ммоль/л по сравнению с контрольными животными (4,9±0,6 ммоль/л, р <0,001). Уменьшение массы функционирующих нефронов у крыс сопровождалась развитием гипертензии: прирост систолического АД составлял в среднем 30 % от исходного уровня, достигая 165, 0±9,8 мм рт. ст. (по сравнению с 127,2±9,7 мм рт. ст. в группе ЛО животных, р <0,01). Однако при этом значимые различия частоты сердечных сокращений у крыс с НЭ (415±33 уд/мин) и животных ЛО группы (380±19 уд/мин, р>0,05) отсутствовали. В то же время ИММЛЖ у крыс через 4 месяца после НЭ был значительно выше, чем в ЛО группе (в среднем 2,72±0,11 мг/г и 2,35±0,09 мг/г соответственно, р<0.001). Таким образом, НЭ приводила к нарушениям функционирования сердечно-сосудистой системы, выраженным в развитии вторичной ре- нальной артериальной гипертензии и активизации процессов ремоделирования миокарда.
Для оценки реактивности сосудов измерение исходного тонуса сосудистых сегментов начинали с 30-й минуты эксперимента, когда наступала его стабилизация после размещения фрагмента сосуда в камере установки. Сегменты аорты и верхней брыжеечной артерии НЭ животных в стандартных условиях демонстрировали более высокий уровень тонического напряжения по сравнению с препаратами, полученными от контрольных крыс. В наших исследованиях исходный тонус интакт- ных (с сохраненным эндотелиальным слоем) сегментов аорт в ЛО группе составил 262±24 мг, ВБА - 233±20 мг. Уменьшение количества функционирующих нефронов на данных сроках наблюдения приводило к увеличению исходного тонуса как аорты, так и ВБА (рис.1).
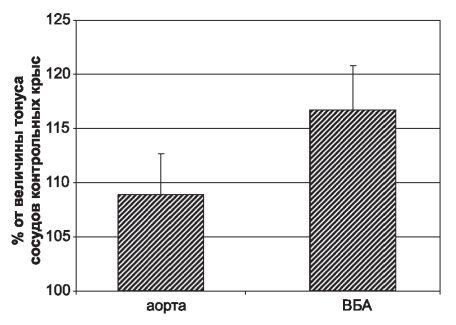
Рис. 1. Величина тонуса сегментов аорты и верхней брыжеечной артерии крыс после нефрэктомии, выраженная в процентах от исходного тонуса контрольных животных.
Figure 1. The magnitude of the tone of the segments of the aorta and superior mesenteric artery of rats after nephrectomy, expressed as a percentage of the initial tone of the control animals.
Для изучения механизмов регуляции тонуса сосудов у животных, подвергнутых резекции почечной ткани, использовали оценку степени вазодила- тации исследуемых фрагментов сосудов при введении в омывающий раствор ацетилхолина (АХ). В предыдущих работах было показано, что реакция аорты и брыжеечной артерии на АХ при исходном тонусе имеет небольшую амплитуду (18). Поэтому исследования принято проводить в условиях предварительной констрикции сосудов, воздействуя на них до начала тестирования фенилэфрином. Добавление в физиологический раствор фенилэфрина в концентрации 1x10-6 М приводило к сокращению ГМК сосудов, о котором судили по повышению уровня тонического напряжения сосудистого фрагмента. Последующую оценку вазодилататорного действия АХ проводили только после стабилизации тонуса фрагментов сосудов на новом уровне.
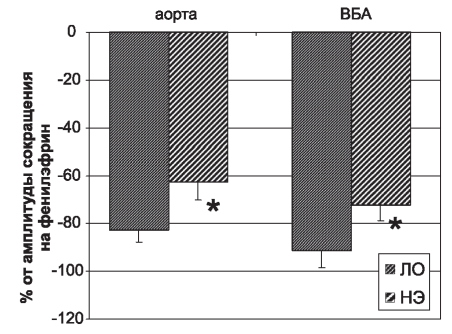
Рис. 2. Влияние ацетилхолина (1χ10-6 М) на тонус аорты и верхней брыжеечной артерии, предварительно сокращенных фенилэфрином (1χ10-5 М), у крыс после нефрэктомии (НЭ) и контрольных крыс (ЛО). * - p<0,001.
Figure 2. Effect of acetylcholine (1χ10-6 M) on the tone of the aorta and superior mesenteric artery, previously contracted with phenylephrine (1χ10-5 M), in rats after nephrectomy (NE) and control rats (LO). * - p <0,001.
Введение в раствор АХ в концентрации 1x10-6 М приводило к выраженной вазодилатации фрагмента аорты крыс обеих групп (рис. 2). Однако вызванная АХ дилатация аорты крыс, подвергнутых НЭ, оказалась меньшей, чем у контрольных ЛО животных. Таким образом, уменьшение массы функционирующих нефронов приводило к значимому снижению ответной реакции сегмента аорты на воздействие АХ.
Аналогичная закономерность наблюдалась и в исследовании действия АХ на верхнюю брыжеечную артерию (рис. 2). Следует отметить, что реакция на АХ сегментов ВБА, выраженная в процентах от амплитуды их сокращения на фенилэфрин, была большей, чем ответ аорты, как у крыс с НЭ, так и у ЛО животных.
Для уточнения механизмов влияния НЭ на эндотелийзависимую регуляцию тонуса сосудов, в частности, определения роли NO, в физиологический раствор сначала вводили ингибитор синтазы NO - L-NAME, а затем фенилэфрин и АХ. В таких условиях АХ также оказывал вазодилататорное действие на аорту и ВБА, однако выраженность дилатации была меньше, чем в исследовании с сохранением синтеза NO (рис. 3). Следует отметить, что в исследованиях этой серии снижение вызванной АХ вазодилатации как аорты, так и ВБА у крыс с НЭ было менее выражено, чем у контрольных ЛО животных. В то же время снижение ответа сосудов животных, подвергнутых резекции части почечной паренхимы на введение АХ в раствор, было большим у фрагментов аорты (в 1,9 раза по сравнению с ЛО группой), чем у ВБА (1,4 раза). Таким образом, уменьшение ответа сосудистых фрагментов крыс с НЭ на АХ при ингибировании синтеза NO по сравнению с ЛО группой указывает на нарушение продукции NO эндотелием сосудов животных данной экспериментальной группы.
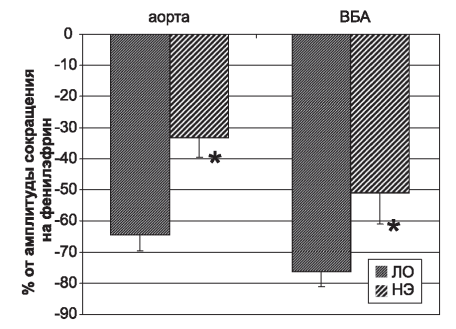
Рис. 3. Влияние ацетилхолина (1 χ10-6 М) на тонус фрагментов аорты и ВБА после блокады синтеза NO (L-NAME, неселективный ингибитор синтазы оксида азота, 1 χ 10-4 М), сокращенных фенилэфрином (1 χ10-5 М), у крыс после нефрэктомии (НЭ) и контрольных крыс (ЛО). * - p<0,001.
Figure 3. Effect of acetylcholine (1χ10-6 M) on the tone of aortic fragments and BWA after blockade of NO synthesis (L-NAME, non-selective inhibitor of nitric oxide synthase, 1χ10-4 M), reduced by phenylephrine (1χ10-5 M), in rats after nephrectomy (NE) and control rats (LO). * - p <0,001.
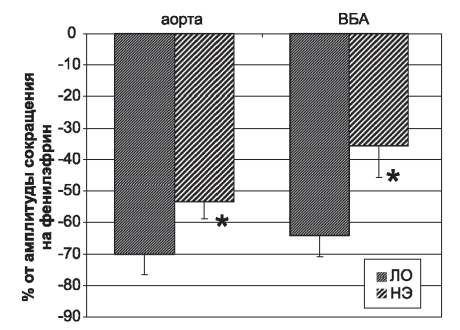
Рис. 4. Влияние ацетилхолина (1 χ 10-6 М) на тонус фрагментов аорты и ВБА предварительно сокращенных фенилэфрином (1 χ 10-5 М, в условиях блокады Ca2+-активируемых К+-каналов большой проводимости (ТЭА, 1 χ 10-6 М) у крыс после нефрэктомии (НЭ) и контрольных крыс (ЛО). * - p<0,001.
Figure 4. Effect of acetylcholine (1 χ10-6 M) on the tone of aortic and BWA fragments previously reduced by phenylephrine (1 χ 10-5 M, under conditions of blockade of Ca2 + -activated K + channels of high conductivity (TEA, 1 χ 10-6 M) in rats after nephrectomy (NE) and control rats (LO). * - p <0,001.
Для уточнения роли эндотелиальной гиперполяризации в реакции сосудов на АХ при развитии уремии использовали блокаду Са2+-активируемых К+-каналов большой проводимости введением в раствор ТЭА (1×10–6 М). В этих условиях АХ вызывал вазодилатацию предварительно сокращенных фенилэфрином сосудов (рис. 4) как в группе животных после НЭ, так и у контрольных крыс. Однако величина ответа была различной. У крыс, подвергнутых уменьшению количества функционирующих нефронов, регистрировалось значимое снижение вазодилататорного ответа сосудов (по сравнению с ЛО животными), более выраженное у фрагментов ВБА, чем аорты. Таким образом, наше исследование показало участие механизмов, связанных с гиперполяризацией мембраны, в регуляции ответа сосудов крыс на АХ. Нарастание азотемии приводит к снижению роли гиперполяризации мембраны в процессах вазодилятации сосудов, предварительно сокращенных фенилэфрином, в ответ на воздействие АХ.
Таким образом, экспериментальное уменьшение количества функционирующих нефронов на длительных сроках наблюдения (4 месяца после НЭ) приводит к снижению вызванной АХ релаксации фрагментов аорты и ВБА, предварительно сокращенных фенилэфрином. Выявлено также снижение роли NO и гиперполяризации мембраны в процессах вазорелаксации у крыс после НЭ.
ОБСУЖДЕНИЕ
Согласно полученным в настоящем исследовании данным, сокращение массы паренхимы почек у экспериментальных животных приводит к развитию закономерных функциональных и метаболических проявлений ХБП. Так, через 4 месяца после НЭ у крыс происходит нарастание уровня мочевины крови. Азотемия сопровождается ростом артериального давления и массы миокарда. Это указывает на негативное влияние ХБП на сердечнососудистую систему. Патологическое влияние НЭ на функционирование сосудов подтверждается также результатами наших экспериментов, выполненных на фрагментах аорты и ВБА, которые показали снижение регуляторных возможностей исследуемых сосудов после уменьшения количества функционирующих нефронов. Механизмы такого влияния до настоящего времени изучены недостаточно. Исследование показало, что после НЭ повышается исходный тонус сосудов. Его рост сопровождается нарушением процессов регуляции функции ГМК сосудов, выражающемся в снижении величины реакции на действие биологических активных веществ, в частности АХ. Выявленное уменьшение амплитуды вазодилатации на добавление в раствор АХ указывает на снижение реактивности сосудов, что препятствует реализации полноценного ответа, характерного для сосудов контрольных животных. Однако механизмы такого влияния требуют уточнения.
Существует множество путей, посредством которых возможна тонкая настройка тонуса сосудов в ответ на изменение состояния организма. Известно, что тонус сосудов регулируется импульсами, приходящими по нервным волокнам, модулируется балансом гормонов в крови и чувствительностью рецепторов к ним. Этот органный уровень регуляции кровообращения, несомненно, значим, однако не менее важным является путь, позволяющий менять характеристики локального кровотока в сосудах различного калибра. Он связан с функционированием эндотелиальных клеток, выстилающих внутреннюю поверхность сосуда [19, 20].
В настоящее время эндотелиальная дисфункция рассматривается в качестве одного из основных патогенетических факторов, приводящих к развитию сердечно-сосудистых нарушений при прогрессировании патологии почек. Во многих клинических и экспериментальных исследованиях выявлено нарушение эндотелийзависимой регуляции тонуса сосудов как у больных ХБП [21-24], так и у экспериментальных животных [25-27]. Однако конкретные механизмы развития эндотелиальной дисфункции при почечной патологии требуют дальнейшего изучения.
Для оценки состояния эндотелиальной регуляции сосудов крыс мы использовали сравнение величины ответа сосудистого фрагмента на воздействие вазоактивных агентов. Основным тестирующим веществом был выбран АХ, являющийся мощным вазодилататором, стимулирующим выработку NO через активацию М-холинорецепторов [28-31]. Наши исследования на сосудах in vitro показали, что нефрэктомия приводит к значительному снижению реактивности фрагментов как аорты, так и ВБА в ответ на введение АХ, что указывает на снижение регуляторных возможностей сосудистой системы. Для уточнения механизмов, участвующих в данном процессе, мы провели эксперименты с блокированием отдельных звеньев регуляторной цепочки.
Важным звеном регуляции тонуса сосудов считают механизмы, связанные с синтезом NO [32-34]. Мы предположили, что нефрэктомия будет приводить к нарушению связанных с продукцией NO путей регуляции сосудистого тонуса. Предположение основывалось также на наших предыдущих экспериментах, показавших снижение уровня NO в сыворотке крови спонтанно-гипертензивных крыс, подвергнутых резекции части почечной ткани [35]. Для уточнения NO- зависимых механизмов влияния НЭ непосредственно на эндотелийзависимую регуляцию тонуса сосудов мы провели тестирование фрагментов сосудов с использованием предварительного ингибирования синтазы NO введением L-NAME. Выявленное в настоящем исследовании снижение вазодилататорного ответа сосудов на АХ в условиях ингибирования синтеза NO у крыс после нефрэктомии (по сравнению с контрольными животными) указывает на повреждение связанных с продукцией NO путей модуляции сосудистого тонуса. Механизм подобных изменений до сих пор не ясен [34]. Характер сосудодвигательного ответа может быть обусловлен множеством факторов и, в частности, снижением синтеза NO [36, 37] и уменьшением его биодоступности [25, 38, 39].
Один из путей регуляции тонуса сосудов связывают с развитием гиперполяризации мембраны эндотелия [40, 41]. В этой регуляторной цепочке основная роль отводится эндотелиальным Ca2+- активируемым К+-каналам с различной скоростью проводимости, посредством которых обеспечивается распределение ионов К+ в клетках эндотелия [42-44]. Полагают, что гиперполяризация эндотелия может напрямую распространяться через щелевые соединения в ГМК [42, 45] или посредством оттока K+ из эндотелия через эндотелиальные Ca2+- активированные К+-каналы приводить к гиперполяризации ГМК и, следовательно, к вазодилатации [45]. Блокада одного из этих механизмов модуляции величины вазодилатации позволяет оценить их вклад в общую картину вазомоторного ответа сосуда на внешнее воздействие. Наши исследования показали, что в условиях блокады Са2+-активируемых К+-каналов большой проводимости (введением ТЭА) амплитуда ответа на АХ значимо снижалась как у НЭ, так и у контрольных животных, что подтверждает участие этого механизма в ответных реакциях сосудов на АХ. Однако НЭ сопровождалась уменьшением степени дилатации сосудистых сегментов на воздействие АХ при предварительной обработке их ТЭА. Следовательно, удаление 5/6 массы почек приводит к нарушению связанных с гиперполяризацией мембраны эндотелиальных клеток путей регуляции тонуса сосудов.
Результаты наших исследований согласуются с имеющимися в литературе данными о снижении вазодилатирующей способности сосудов животных, подвергнутых уменьшению количества функционирующих нефронов [27, 46]. Механизмы выявленных нарушений полностью не ясны, поскольку, с одной стороны, эндотелиальная регуляция тонуса сосудов является мультифакторным процессом, а с другой - развитие ХБП приводит к дисбалансу различных вазоактивных метаболитов, влияющих на функцию сосудов [21, 25, 46, 47].
ЗАКЛЮЧЕНИЕ
Таким образом, проведенные исследования показали, что резекция 5/6 массы ткани почек у крыс вызывает снижение реактивности сосудов, связанное как с нарушением NO-зависимых путей, так и понижением уровня гиперполяризации клеток эндотелия. Такое снижение реактивности может приводить к дизрегуляции сосудистого тонуса, повышению сосудистого сопротивления, росту артериального давления, неадекватному ответу сосудов на воздействия биологически активных агентов и, таким образом, запускать патогенетические механизмы развития осложнений сердечно-сосудистой системы при ХПБ. Важность решения проблемы предупреждения и коррекции нарушений сосудистой системы при развитии почечной патологии требует дальнейшего более детального изучения.
Работа поддержана Грантом РФФИ 19-015-0047.
Работа выполнена с использованием животных из биоколлекции ИФ РАН.
Список литературы
1. Смирнов АВ, Добронравов ВА, Каюков ИГ Кардиоренальный континуум: патогенетические основы превентивной нефрологии. Нефрология 2005; 9(3): 7-15
2. Di Lullo L, Bellasi A, Barbera V et al. Pathophysiology of the cardio-renal syndromes types 1-5: An uptodate. Indian Heart J 2017; 69(2): 255-265. Doi: 10.1016/j.ihj.2017.01.005
3. Foley RN, Parfrey PS. Cardiac disease in chronic uremia: clinical outcome and risk factors. Adv Renal Replace Ther 1997; 4: 234-248
4. Go AS, Chertow GM, Fan D et al. Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization. N Engl J Med 2004; 351: 1296-1305. Doi: 10.1056/NEJMoa041031
5. Ninomiya T, Kiyohara X Kubo M et al. Chronic kidney disease and cardiovascular disease in a general Japanese population: the Hisayama Study. Kidney Int 2005; 68 (1): 228-236
6. Afsar B, Turkmen K, Covic A, Kanbay M. An update on coronary artery disease and chronic kidney disease. Int J Nephrol 2014; 76(7): 424. Doi: 10.1155/2014/767424
7. Choi HX Park HC, Ha SK. How do We manage coronary artery disease in patients with CKD and ESRD? Electrolyte Blood Press 2014; 12 (2): 41-54. Doi: 10.5049/EBP.2014.12.2.41
8. Padberg JS, Wiesinger A, di Marco GS. et al. Damage of the endothelial glycocalyx in chronic kidney disease. Atherosclerosis 2014; 234(2): 335-343. Doi: 10.1016/j.atherosclerosis.2014.03.016
9. Foley RN, Wang C, Collins AJ. Cardiovascular risk factor profiles and kidney function stage in the US general population: the NHANES III study. Mayo Clin Proc 2005; 80(10): 1270-1277. Doi: 10.4065/80.10.1270
10. Baber U, Gutierrez OM, Levitan EB et al. Risk for recurrent coronary heart disease and all-cause mortality among individuals with chronic kidney disease compared with diabetes mellitus, metabolic syndrome, and cigarette smokers. Am Heart J 2013; 166(2): 373-380.e2. Doi: 10.1016/j.ahj
11. Jimbo R, Shimosawa T Cardiovascular risk factors and chronic kidney disease-FGF23: a key molecule in the cardiovascular disease. Int J Hypertens 2014; 182: 82-98. Doi: 10.1155/2014/381082
12. Mancia G, Fagard R, Zanchetti A. Reply to blood pressure target in chronic kidney disease. J Hypertens 2013; 31(11): 2321-2322. Doi: 10.1097/HJH.0b013e328365a00a
13. Карабаева АЖ, Есаян АМ, Каюков ИГ и др. Влияние спи-ронолактона на гипертрофию миокарда левого желудочка у крыс Вистар с экспериментальной уремией. Бюлл экспериментальной биологии и медицины 2008; 145(6): 659-662
14. Каюков ИГ, Береснева ОН, Парастаева ММ и др. Влияние возраста и сокращения массы действующих нефронов на состояние миокарда и коронарного русла у молодых крыс. Регионарное кровообращение и микроциркуляция 2015; 14(4): 66-73
15. Maquigussa E, Paterno JC, de Oliveira Pokorny Gh et al. Klotho and PPAR gamma activation mediate the renoprotective effect of losartan in the 5/6 nephrectomy model. Front Physiol 2018; 9: 1033. Doi: 10.3389/fphys.2018.01033
16. Shobeiri N, Adams MA, Holden RM. Vascular calcification in animal models of CKD: A review. Am J Nephrol 2010; 31(6): 471-481. Doi: 10.1159/000299794
17. Claramunt D, Gil-Pefia H, Fuente R et al. Animal models of pediatric chronic kidney disease. Is adenine intake an appropriate model? Nefrologia 2015; 35(6): 517-522. Doi: 10.1016/j.nefro.2015.08.004
18. Лобов ГИ, Васина ЕЮ, Малахова ЗЛ, Власов ТД. Роль различных эндотелиальных вазодилататоров в регуляции тонуса артерий у крыс. Росс физиолжурн им ИМ Сеченова 2018; 104 (3): 327-337
19. Kang KT Endothelium-derived relaxing factors of small resistance arteries in hypertension. Toxicol Res 2014; 30(3): 141-148. Doi: 10.5487/TR.2014.30.3.141
20. Scotland RS, Madhani M, Chauhan S, Moncada S et al. Investigation of vascular responses in endothelial nitric oxide synthase/cyclooxygenase-1 double-knockout mice: key role for endothelium-derived hyperpolarizing factor in the regulation of blood pressure in vivo. Circulation 2005; 111(6): 796-803. Doi: 10.1161/01.CIR.0000155238.70797.4E
21. Huang MJ, Wei RB, Zhao J et al. Albuminuria and endothelial dysfunction in patients with non-diabetic chronic kidney disease. Med Sci Monit 2017; 23: 4447-4453. Doi: 10.12659/MSM.903660
22. Fujii H, Kono K, Nishi S. Characteristics of coronary artery disease in chronic kidney disease. Clin Exp Nephrol 2019; Doi: 10.1007/s10157-019-01718-5
23. Widlansky ME, Gokce N, Keaney JF, Vita JA. The clinical implications of endothelial dysfunction. Journal of the American College of Cardiology 2003; 42(7): 1149-1160 Doi:10.1016/S0735-1097(03)00994-X
24. Smiljic S. The clinical significance of endocardial endothelial dysfunction. Medicina 2017; 53(5): 295-302. Doi: 10.1016/j.medici.2017.08.003
25. Martens CR, Kuczmarski JM, Lennon-Edwards S, Edwards DG. Impaired L-arginine uptake but not arginase contributes to endothelial dysfunction in rats with chronic kidney disease. J Cardiovasc Pharmacol 2014; 63(1): 40-48. Doi: 10.1097/FJC.0000000000000022
26. Li T, Gua C, Wu B, Chen Y Increased circulating trimethyl-amine N-oxide contributes to endothelial dysfunction in a rat model of chronic kidney disease. Biochem Biophys Res Commun 2018; 495(2): 2071-2077. Doi: 10.1016/j.bbrc.2017.12.069
27. Zanetti M, Gortan Cappellari G, Barbetta D et al. Omega 3 polyunsaturated fatty acids improve endothelial dysfunction in chronic renal failure: role of eNOS activation and of oxidative stress. Nutrients 2017; 9(8): E895. Doi: 10.3390/nu9080895
28. Панина И Ю, Румянцев АШ, Меншутина МА и др. Особенности функций эндотелия при хронической болезни почек. Обзор литературы и собственные данные. Нефрология 2007; 11(4): 28-46
29. Zoccali C, Mallamaci F, Tripepi G. Traditional and emerging cardiovascular risk factors in end-stage renal disease. Kidney Int 2003; 85: S105-S110. Doi: 10.1046/j.1523-1755.63.s85.25.x
30. Furchgott RF, Zawadzki JV. The obligatory role of endothelial cells in the relaxation of arterial smooth muscle by acetylcholine. Nature 1980; 288: 373-376
31. Boulanger CM, Morrison KJ, Vanhoutte PM . Mediation by M3-muscarinic receptors of both endothelium-dependent contraction and relaxation to acetylcholine in the aorta of the spontaneously hypertensive rat. Br J Pharmacol 1994; 112: 519-524
32. Toda N, Ayajiki K, Okamura . Neurogenic and endothelial nitric oxide regulates blood circulation in lingual and other oral tissues. J Cardiovasc Pharmacol 2012; 60: 100-108. Doi: 10.1097/FJC.0b013e318252452a
33. Michel T, Vanhoutte PM. Cellular signalling and NO production. PflugersArch 2010; 459: 807-816
34. Vanhoutte PM , Shimokawa H, Feletou M, Tang EHC. Endothelial dysfunction and vascular disease - a 30th anniversary update. Acta Physiol2017; 219: 22-96. https://Doi.org/10.1111/apha.12646
35. Береснева ОН, Парастаева ММ, Иванова ГТ и др. Оценка кардиопротективного действия малобелковой соевой диеты и уровень неорганических анионов сыворотки крови у спонтанногипертензивных крыс с нефрэктомией Нефрология 2007; 11(3): 70-76
36. Puzserova A, Bernatova I. Blood pressure regulation in stress: focus on nitric oxide-dependent mechanisms. Physiol Res 2016; 65 (Suppl. 3): S309-S342
37. Yamamizu K, Shinozaki K, Ayajiki K, et al. Oral administration of both tetrahydrobiopterin and L-arginine prevents endothelial dysfunctionin rats with chronic renal failure. J Cardiovasc Pharmacol 2007; 49(3): 131-139. Doi: 10.1097/FJC.0b013e31802f9923
38. Xu YC, Leung SW, Leung GP, Man RY Kaempferol enhances endothelium-dependent relaxation in the porcine coronary artery through activation of large-conductance Ca(2+) activated K(+) channels. Br J Pharmacol 2015; 172: 3003-3014. Doi: 10.1111/bph.13108
39. Jang HJ, Ridgeway SD, Kim JA. Effects of the green tea polyphenol epigallocatechin-3-gallate on high-fat diet-induced insulin resistance and endothelial dysfunction. Am J Physiol Endocrinol Metab 2013; 305: E1444-E1451
40. Feletou M, Vanhoutt PM. . Endothelium-dependent hyperpolarization: no longer an f-word! J Cardiovasc Pharmacol 2013; 61: 91-92. Doi: 10.1097/FJC.0b013e31828197bc
41. Shimokawa H. Williams Harvey Lecture: importance of coronary vasomotion abnormalities-from bench to bedside. Eur Heart 2014; J 35: 3180-3193. Doi: 10.1093/eurheartj/ehu427
42. Busse R, Edwards M, Feletou M et al. EDHF: Bringing the concepts together. Trends PharmacolSci 2002; 23: 374-380
43. Eichler I, Wibawa J, Grgic I et al. Selective blockade of endothelial Ca2+-activated small- and intermediate-conductance K+-channels suppresses EDHF-mediated vasodilation. Br J Pharmacol 2003; 138: 594-601 https://Doi.org/10.1038/sj.bjp.0705075
44. Edwards G, Dora KA, Gardener MJ, et al. K+ is an endothelium-derived hyperpolarizing factor in rat arteries. Nature 1998; 396: 269-272 https://Doi.org/10.1038/24388
45. Griffith TM, Chaytor AT, Taylo HJ, et al. cAMP facilitates EDHF-type relaxations in conduit arteries by enhancing electronic conduction via gap junctions. Proc Natl Acad Sci USA 2002; 99: 6392-6397 https://Doi.org/10.1073/pnas.092089799
46. Kohler R, Eichler I, Schonfelder H et al. Impaired EDHF-mediated vasodilation and function of endothelial Ca-activated K channels in uremic rats. Kidney Int 2005; 67(6): 2280-2287. Doi: 10.1111/j.1523-1755.2005.00331.x
47. Li T, Gua C, Wu B, Chen Y Increased circulating trimethyl-amine N-oxide contributes to endothelial dysfunction in a rat model of chronic kidney disease. Biochem Biophys Res Commun 2018; 495(2): 2071-2077. Doi: 10.1016/j.bbrc.2017.12.069
Об авторах
Г. Т. ИвановаРоссия
Иванова Галина Тажимовна - кандидат биологических наук, лаборатория физиологии сердечно-сосудистой и лимфатической систем, старший научный сотрудник.
199034, Санкт-Петербург, наб. Макарова, д. 6, Тел.: 8 (812) 328-07-01
Г. И. Лобов
Россия
Лобов Геннадий Иванович - докор медицинских наук, профессор, лаборатория физиологии сердечно-сосудистой и лимфатической систем, заведующий лабораторией.
199034, Санкт-Петербург, наб. Макарова, д. 6, Тел.: +7 921 743-06-08
О. Н. Береснева
Россия
Береснева Ольга Николаевна - кандидат биологических наук, старший научный сотрудник
197022, Санкт-Петербург, ул. Л. Толстого, д. 17, корп. 54, Тел.: (812) 346-39-26
М. М. Парастаева
Россия
Парастаева Марина Магрезовна - кандидат биологических наук, лаборатория клинической физиологии почек, старший научный сотрудник.
197022, Санкт-Петербург, ул. Л. Толстого, д. 17, корп. 54, Тел.: (812) 346-39-26
Рецензия
Для цитирования:
Иванова Г.Т., Лобов Г.И., Береснева О.Н., Парастаева М.М. Изменение реактивности сосудов крыс с экспериментальным уменьшением массы функционирующих нефронов. Нефрология. 2019;23(4):88-95. https://doi.org/10.24884/1561-6274-2019-23-4-88-95
For citation:
Ivanova G.T., Lobov G.I., Beresneva O.N., Parastaeva M.M. Changes in the reactivity of vessels of rats with an experimental decrease in the mass of functioning nephrons. Nephrology (Saint-Petersburg). 2019;23(4):88-95. (In Russ.) https://doi.org/10.24884/1561-6274-2019-23-4-88-95









































