Перейти к:
Эффективность метилэтилпиридинола при лечении нефропатии у больных с сахарным диабетом 1-го типа
Аннотация
Для цитирования:
Крутиков Е.С., Житова В.А. Эффективность метилэтилпиридинола при лечении нефропатии у больных с сахарным диабетом 1-го типа. Нефрология. 2016;20(5):24-29.
For citation:
Krutikov E.S., Zhitova V.A. The effectiveness of methylethylpiridinol in the treatment of nephropathy in patients with diabetes mellitus type I. Nephrology (Saint-Petersburg). 2016;20(5):24-29. (In Russ.)
ВВЕДЕНИЕ
Длительное течение сахарного диабета (СД) при наличии выраженной гипергликемии и отсутствии компенсирующих факторов способствует развитию диабетической нефропатии (ДН), проявляющейся повреждением сосудов клубочков, нарушением в них кровообращения, альбуминурией, а затем протеинурией с исходом в нефросклероз.
В патогенезе ДН решающее значение имеют следующие патогенетические факторы. Гипергликемия приводит к активации протеинкиназы С, которая усиливает процессы пролиферации клеток, образование различных цитокинов, тканевых факторов роста. При этом нарушается синтез, повреждается эндотелий, протеингликанов на базальных мембранах сосудов клубочков [1-3]. Снижение секреции эндотелиального релаксирующего фактора и других факторов, регулирующих тонус почечных сосудов, приводит к внутриклубочковой гипертензии. Длительное прессорное воздействие внутри капилляров клубочков сопровождается постепенным повреждением сосудистых и паренхиматозных внутрипочечных структур с повышением проницаемости базальных мембран для белков и липидов. Белки средней молекулярной массы попадают в мочу и вместе с липидами откладываются в межкапиллярных пространствах. Развиваются процессы склерозирования клубочков, атрофируются почечные канальцы [4]. При нарушении азотистого обмена с развитием диабетической диспротеинемии (повышение в сыворотке крови относительного содержания α2-глобулинов, гаптоглобинов, С-реактивного белка и фибриногена) на фоне увеличенной проницаемости сосудов создаются условия для инфильтрации субэндотелиального пространства грубодисперсными белками. Все вышеперечисленные факторы вызывают нарушения внутрипочечной гемодинамики (в том числе избыточное тромбообразование), усугубляющие склеротические изменения в почках [5, 6].
Таким образом, для профилактики и лечения ДН в первую очередь необходимо нормализовать уровень глюкозы в крови и в дальнейшем эффективно контролировать его. Необходимо стабилизировать центральное и внутриклубочковое артериальное давление. На ранних этапах это способствует снижению гиперфильтрации, а в дальнейшем - снижению протеинурии и замедлению склерозирования почек.
Немаловажным остается и воздействие на реологические свойства крови (процессы коагуляции и тромбообразования). Для этого успешно применяются ангиопротекторы, антикоагулянты и антиагреганты, такие как гепарин и его производные, ацетилсалициловая кислота, пентоксифиллин, клопидогрель, сулодексид и др. [7, 8] Однако, ввиду большого количества побочных действий одних и высокой стоимости других, длительное применение данных препаратов не всегда возможно. В этой связи возникает актуальность поиска новых средств, воздействующих на почечную гемодинамику, которые можно использовать для лечения и профилактики ДН.
В подобной ситуации особый интерес представляет отечественный препарат «Метилэтилпиридинол», обладающий антиагрегантным, фибринолитическим, ангиопротекторным и антиоксидантным свойствами. Метилэтилпиридинол успешно применяют при лечения диабетической ретинопатии (в том числе при микротромбозах сосудов сетчатки), а также в комплексной терапии нарушений мозгового кровообращения. Целью настоящего исследования явилась оценка эффективности нефропротекторных свойств метилэтилпиридинола у больных с СД I типа.
ПАЦИЕНТЫ И МЕТОДЫ
Нами в условиях терапевтического стационара ГБУЗ РК «Симферопольская городская клиническая больница №7» было обследовано 34 больных с СД I типа. Средний возраст пациентов составил 34±4,7 года. В исследовании принимали участие 18 (52,9%) мужчин и 16 (47,1%) женщин.
Все пациенты находились в состоянии субкомпенсации по основному заболеванию и имели признаки ДН, которая была диагностирована на основании длительного (более 3 мес) снижения СКФ и/или высокого уровня альбуминурии. Средний уровень креатинина в сыворотке крови составил 186,7±21,3 мкмоль/л.
Артериальная гипертензия (АГ) диагностирована у 11 (32.4%), диабетическая ретинопатия (непролиферативная) - у 27 (79,4%), диабетическая полинейропатия - у 8 (23,5%) больных.
Всем пациентам проводили комплексное обследование и лечение (инсулин, статины, ингибиторы АПФ/блокаторы рецепторов к ангиотензину II) согласно принятым протоколам.
Критериями исключения из исследования явились: неконтролируемая АГ, тяжелые нарушения сердечного ритма, хроническая болезнь почек (ХБП) С3б стадии и выше, хроническая артериальная недостаточность (ХАН) Пб стадии и выше, хроническая сердечная недостаточность (ХСН) Пб стадии и выше, острое нарушения мозгового кровообращения (ОНМК) и/или инфаркт миокарда (ИМ) в анамнезе, пролиферативная ретинопатия.
Всем больным проводили лечение метилэтилпиридинолом («Кардиоксипин», ОАО «Биосинтез») в дозировке 600 мг внутривенно капельно на изотоническом растворе хлорида натрия, курсом 12 инъекций.
До и после курса лечения определяли следующие показатели: уровень альбуминурии (АУ) методом ИФА, активность фактора Виллебранда (vWF) по J. Hiadovec (1978), адгезивная (модифицированным методом оценки ретенции тромбоцитов на стеклянных шариках) и агрегационная способность тромбоцитов (методом индукции с АДФ). Расчет скорости клубочковой фильтрации (СКФ) проводили по формуле CKD-EPI. С помощью допплерографии исследовали показатели почечного кровотока на уровне сегментарных и долевых артерий на аппарате «Toshiba APLIO XG» (SSA-790A).
Контрольная группа состояла из 20 практически здоровых людей, сопоставимых по полу и возрасту.
Статистический анализ результатов исследования проводили с использованием пакетов прикладных статистических программ «PlanMaker Professional 2012», «Statistica 8.0 for Windows», США. Данные представлены при нормальном распределении в виде среднего арифметического ± стандартное отклонение (M±SD), при асимметричном - в виде медиана и интерквартильный размах (Ме, 25% квартиль; 75 квартиль). Для сравнения количественных данных использовали U-тест Манна-Уитни или t-критерий Стьюдента. Для сравнения качественных данных применялся точный критерий Фишера. Оценку силы связи между количественными признаками проводили с помощью рангового коэффициента корреляции (Rs) Спирмена. Нулевую статистическую гипотезу об отсутствии различий и связей отвергали при p<0,05.
РЕЗУЛЬТАТЫ
При обследовании до начала лечения у 91,2% больных с СД средний уровень АУ составил 186,4±21,2 мг/сут. В группе контроля экскреция альбумина с мочой была значимо ниже: 14,6±1,7 мг/сут, р=0,001.
Исследование активности vWF также выявило статистически значимое повышение данного показателя среди больных: 172 [158; 184]% против 85 [78; 91]% в контрольной группе (р=0,006).
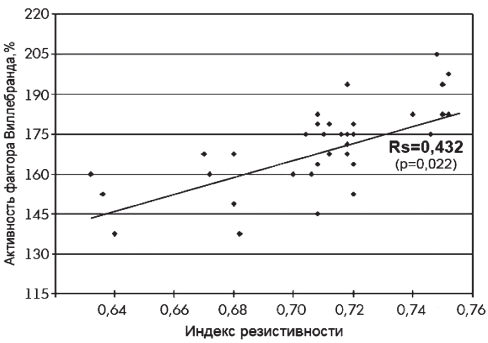
Рис. 1. Взаимосвязь между активностью фактора Виллебранда и индексом резистивности у больных с СД I типа.
Функциональная активность тромбоцитов у пациентов с СД была выше, чем в контроле. Это подтверждалось повышением адгезии до 57,8±3,8% (р=0,024) и агрегации до 85,0±4,6% (р=0,020) тромбоцитов. В контроле данные показатели составили 33,9±2,1 и 70,0±3,8% соответственно.
При расчете СКФ по формуле CKD-EPI у больных: в 30,3% случаев определяли нормальные показатели, у 60,6% больных выявлено снижение СКФ, а у 9,1% диагностировали гиперфильтрацию. При допплерографии сосудов почек было отмечено снижение пиковой скорости кровотока (р=0,023 в сравнении с контролем) и конечнодиастолической (р=0,020) в сегментарной почечной артерии справа (таблица). Индекс резистивности при этом был на 6% выше в сравнении с контролем (р=0,046).
Нами была выявлена прямая корреляционная взаимосвязь между активностью vWF и индексом резистивности сегментарных почечных артерий на уровне Rs=0,432 (р=0,022) (рис. 1).
После курса внутривенного лечения метилэтилпиридинолом у больных с СД I типа отмечалась положительная динамика. Так, по сравнению с показателями до лечения уменьшились активность vWF до 138 [116; 157]% (р=0,023) (рис. 2), адгезия тромбоцитов до 37,2 [33,4; 41,1]% (р=0,002) (рис. 3). Отмечалось также снижение агрегационной способности тромбоцитов до 56 [51; 60]% (р=0,004) (рис. 4). Показатели адгезии и агрегации тромбоцитов после курса лечения были практически идентичны значениям в контрольной группе.
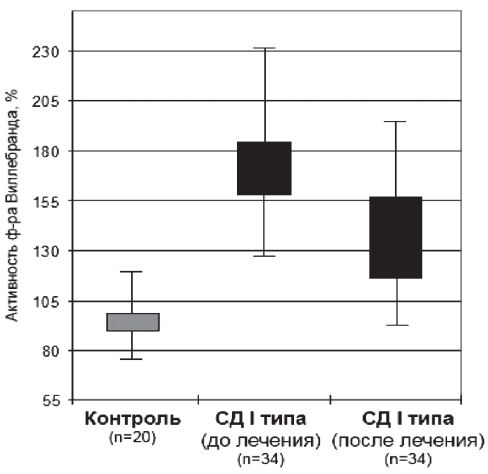
Рис. 2. Активность фактора Виллебранда до и после лечения.
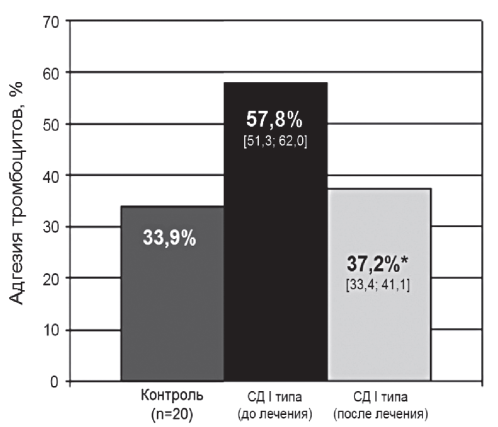
Рис. 3. Адгезия тромбоцитов до и после лечения.
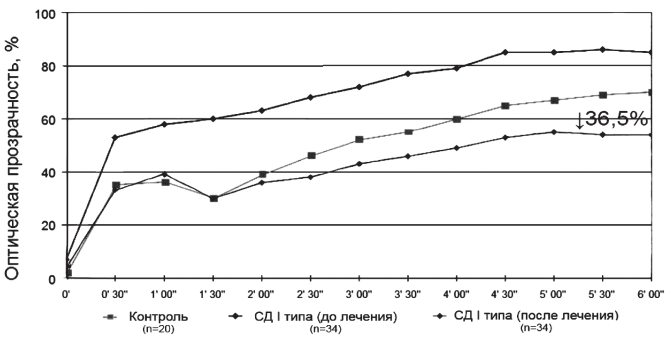
Рис. 4. Агрегационная способность тромбоцитов до и после лечения
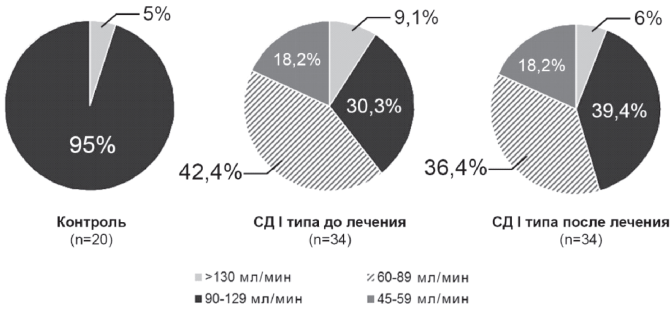
Рис. 5. СКФ до и после лечения.
Терапия метилэтилпиридинолом оказала положительное влияние на нормализацию СКФ (рис. 5). Увеличилось количество больных с показателями СКФ 90-129 мл/мин с 30,3 до 39,4% (р=0,016). При этом уменьшилась доля пациентов со значениями СКФ менее 89 мл/мин, также и с гиперфильтрацией. При этом следует отметить, что уровень альбуминурии у больных после терапии имел лишь тенденцию к снижению.
Исследование почечных сосудов у больных после курса лечения показало повышение пиковой и конечно-диастолической скоростей в сегментарных почечных артериях справа (см. таблицу). Индекс резистивности при этом остался без изменений, что скорее всего было связано с короткой продолжительностью курса лечения метилэтилпиридинолом.
ОБСУЖДЕНИЕ
У больных с СД I типа отмечалось нарушение функциональных свойств тромбоцитов в виде усиленной адгезии и агрегации. Данные изменения могут иметь несколько причин. Во-первых, в условиях хронической гипергликемии происходит гликирование поверхностных белков тромбоцитов, в результате чего повышается активность проагрегантных белков - протеинкиназы С и PAR-I. Во-вторых, в условиях дефицита инсулина уменьшается экспрессия рецептора простациклина. При этом нарушается равновесие между простациклином (ингибитором агрегации) и тромбоксаном (стимулятором агрегации) в пользу последнего [9, 10]. И в третьих, эндотелиальная дисфункция, имеющая место уже на ранних стадиях СД, также усиливает прокоагулянтную активность сыворотки крови и активирует тромбоциты. Нарушение тромбоцитарного звена гемостаза является одним из ведущих факторов развития диабетической микроангиопатии, в том числе и нефропатии. Это продемонстрировали наши исследования по имеющейся взаимосвязи между активностью vWF и индексом резистивности почечных артерий на основе данных допплеровского исследования.
Лечение метилэтилпиридинолом приводило к снижению функциональной активности тромбоцитов: уменьшению их адгезивных и агрегационных свойств. Снижение активности vWF после курса терапии свидетельствовало о положительном влиянии метилэтилпиридинола не только на тромбоциты, но и на дисфункцию эндотелия. Данные изменения, возможно, приводили к улучшению показателей почечного кровотока. У многих больных после комплексной терапии, включавшей метилэтилпиридинол, СКФ нормализовалась. Это, вероятно, связано с нормализацией реологических свойств крови (уменьшение ее вязкости) и улучшением микроциркуляции в почечных сосудах. Отсутствие динамики мы объясняем небольшим периодом наблюдения.
Таблица
Результаты допплерографии сосудов почек на уровне сегментарных артерий до и после лечения
Показатель | Контроль (n=20) | СД I типа до лечения (n=34) | СД I типа после лечения (n=34) |
|---|---|---|---|
Пиковая скорость, см/с | 108 [98; 115] | 63 [57; 70]* | 68 [62; 73]** |
Конечно-диастолическая скорость, см/с | 36 [32; 39] | 24 [20; 28]* | 26 [23; 29]** |
Индекс резистивности | 0,67 [0,64; 0,70] | 0,71 [0,68; 0,74]* | 0,70 [0,69; 0,74] |
* р<0,05 статистически значимое различие с контрольной группой; ** р<0,05 статистически значимое различие с показателями до лечения.
Таким образом, метилэтилпиридинол, который уже применяется в качестве ангиопротектора при лечении диабетической ретинопатии, можно также рекомендовать и для комплексного лечения диабетической нефропатии. Обладая ангиопротек- торным, антиагрегантным, фибринолитическим и антиоксидантным свойствами, метилэтилпириди- нол способен не только затормозить повреждение сосудов, но и улучшить показатели функции почек у больных с СД I типа.
ЗАКЛЮЧЕНИЕ
У пациентов с СД I типа отмечалось повышение функциональной активности тромбоцитов (увеличение их адгезии и агрегации), развитие эндотелиальной дисфункции (усиление активности фактором Виллебранда) на фоне снижения почечного кровотока. При этом была выявлена корреляционная взаимосвязь между фактором Виллебранда и индексом резистивности сегментарной почечной артерии по данным допплеровского исследования сосудов почек. Терапия метилэтилпиридинолом приводила к нормализации функции тромбоцитов (адгезии и агрегации тромбоцитов) и снижению эндотелиальной дисфункции (активности фактора Виллебранда), а также улучшению скоростных показателей кровотока в сегментарной почечной артерии. Улучшение показателей функции тромбоцитов, состояния эндотелия и нормализации СКФ у больных с СД I типа дает возможность рассматривать метилэтилпиридинол в качестве нефропротектора в комплексном лечении ДН.
Список литературы
1. van den Oever IAM, Raterman HG, Nurmohamed MT et al. Endothelial Dysfunction, Inflammation, and Apoptosis in Diabetes Mellitus. Mediators of Inflammation 2010;ID 792393. doi:10.1155/2010/792393
2. Смирнов АВ, Добронравов ВА, Кисина АА и др. Клинические рекомендации по диагностике и лечению диабетической нефропатии. Нефрология 2015; 19(1): 67-77
3. Бобкова ИН, Шестакова МВ, Щукина АА. Диабетическая нефропатия - фокус на повреждение подоцитов. Нефрология 2015;19(2):33-44
4. Ozougwu JC, Obimba KC, Belonwu CD, Unakalamba CB. The pathogenesis and pathophysiology of type 1 and type
5. diabetes mellitus. J Physiol Pathophysiol 2013; 4(4):46-57. doi:10.5897/JPAP2013.0001
6. Kyrgios I, Maggana I, Giza S et al. Suboptimal glycaemic control enhances the risk of impaired prothrombotic state in youths with type 1 diabetes mellitus. Diabetes & Vascular Disease Research 2014;11(3):208-216
7. Nazratuna N, Mahmooda AA, Kuppusamya UR et al. Diabetes mellitus exacerbates advanced glycation end product accumulation in the veins of end-stage renal failure patients. Vascular Medicine 2006;11:245-250
8. Ferreiro JL, Gomez-Hospital JA, Dominick J. Angiolillo Platelet abnormalities in diabetes mellitus. Diabetes & Vascular Disease Research 2010;7(4):251-259. doi:10.1177/1479164110383994
9. Hall HM, Banerjee S, McGuire DK. Variability of clopidogrel response in patients with type 2 diabetes mellitus. Diabetes & Vascular Disease Research 2011;8(4):245-253
10. Бондаренко ИЗ, Ширшина ИА. Механизмы тромбообразования, ассоциированные с сахарным диабетом: что определяет прогноз интервенционного вмешательства? Сахарный диабет 2013; (3):58-63. doi:http://dx.doi. org/10.14341/2072-0351-95
Об авторах
Е. С. КрутиковРоссия
В. А. Житова
Россия
Рецензия
Для цитирования:
Крутиков Е.С., Житова В.А. Эффективность метилэтилпиридинола при лечении нефропатии у больных с сахарным диабетом 1-го типа. Нефрология. 2016;20(5):24-29.
For citation:
Krutikov E.S., Zhitova V.A. The effectiveness of methylethylpiridinol in the treatment of nephropathy in patients with diabetes mellitus type I. Nephrology (Saint-Petersburg). 2016;20(5):24-29. (In Russ.)
JATS XML








































