Перейти к:
Прогнозирование ремоделирования ткани почек с учетом структурных изменений почечных артерий малого диаметра
Аннотация
Для цитирования:
Левицкая Е.С., Батюшин М.М., Пасечник Д.Г., Антипова Н.В. Прогнозирование ремоделирования ткани почек с учетом структурных изменений почечных артерий малого диаметра. Нефрология. 2016;20(5):55-61.
For citation:
Levitskaya E.S., Batiushin M.M., Pasechnik D.G., Antipova N.V. Prediction of kidney tissue remodeling in view of small small diameter renal arteries structural changes. Nephrology (Saint-Petersburg). 2016;20(5):55-61. (In Russ.)
ВВЕДЕНИЕ
Гломерулонефриты занимают одно из ведущих мест в структуре первичной патологии почек [1]. Хронические гломерулонефриты (ХГН) отличаются необратимым прогрессированием патологического процесса, приводящего к развитию терминальной почечной недостаточности, значительно ухудшающей качество жизни пациентов, сопровождающейся дисфункцией многих органов и обуславливающей высокий риск смерти [2].
На современном этапе развития медицины известны некоторые клинико-лабораторные, инструментальные и морфологические предикторы тяжести течения патологического процесса, выраженности нарушения функции почек, на основании которых возможна стратификация риска осложнений и выбор оптимальной тактики лечения пациентов. «Золотым стандартом» диагностики патологии нефрона является морфологический анализ биоптата почки, позволяющий определить не только характер, но и выраженность поражения клубочков. Однако оценка состояния сосудов почек не всегда отражается морфологами, что зачастую приводит к недооценке роли сосудистого фактора в развитии и прогрессии заболеваний почек.
В 1999 г. M. Mulvany была предложена классификация 6 типов структурной перестройки сосудистой стенки [3]. Градация изменения структуры артерий основана на трех вариантах согласно изменению толщины сосудистой стенки (гипо- трофный, гипертрофный и эвтрофный), а также уменьшению (ремоделирование внутрь - «inward») или увеличению просвета сосуда (ремоделирование наружу - «outward»). Таким образом, под ремоделированием артерий понимают изменение структуры как самой сосудистой стенки, так и просвета сосуда адаптивного или дезадаптивного характера.
Структурная перестройка сосудистой стенки играет важную роль в инициации и прогрессировании патологических процессов, приводящих к недостаточности функции почек [4]. Прежде всего, почки являются органами с наиболее выраженной васкуляризацией, они участвуют в локальной и системной регуляции артериального артериального давления. Вовлечение в патологический процесс сосудистой стенки, независимо от первичности поражения, приводит к повреждению ткани почек и усугублению тяжести течения заболевания. Наиболее изучена роль изменений в почечной артерии и ее крупных ветвях в прогрессировании хронической болезни почек.
Целью исследования явилась оценка взаимосвязи ремоделирования ткани почек и артерий малого диаметра у пациентов с различными формами гломерулопатий.
Таблица 1
Клиническая характеристика исследуемой группы пациентов
Критерий | Среднее значение |
|---|---|
Наличие АГ, абс. (%) | 23 (76,7) |
Наличие I степени АГ, абс. (%) | 0 |
Наличие II степени АГ, абс. (%) | 15 (65) |
Наличие III степени АГ, абс. (%) | 8 (35) |
САД при включении в исследование, мм рт. ст. | 140,2±4,5 |
ДАД при включении в исследование, мм рт. ст. | 89,3±2,9 |
Креатинин, мкмоль/л | 188,7±58,1 |
Мочевина, мкмоль/л | 10,7±1,9 |
СКФ, мл/мин/1,73 м2 | 52,2±3,8 |
ХБП 1 стадии, абс. (%) | 6 (20,0) |
ХБП 2 стадии, абс. (%) | 5 (16,7) |
ХБП 3 стадии, абс. (%) | 10 (33,3) |
ХБП 4 стадии, абс. (%) | 6 (20,0) |
ХБП 5 стадии, абс. (%) | 3 (10,0) |
Протеинурия, г/л | 2,91 |
Наличие гипергидратации мягких тканей, абс. (%) | 16 (53,3) |
Примечание. АГ - артериальная гипертензия, САД - систолическое артериальное давление, ДАД - диастолическое артериальное давление, СКФ - скорость клубочковой фильтрации, ХБП - хроническая болезнь почек.
ПАЦИЕНТЫ И МЕТОДЫ
В исследовании приняли участие 30 пациентов с наличием первичных заболеваний почек и показаниями к выполнению нефробиопсии. Среди них было 15 мужчин и 15 женщин, средний возраст 39,8±2,33 года.
Для достижения поставленной цели исследования осуществляли оценку клинического статуса пациентов. Учитывали наличие и уровень артериальной гипертензии (АГ), концентрацию креатинина и мочевины в плазме крови, величину скорости клубочковой фильтрации (СКФ) и протеинурии, стадию хронической болезни почек (ХБП), наличие гипергидратации тканей. Величину СКФ рассчитывали по формуле CKD-EPI. Хроническую болезнь почек (ХБП) ранжировали согласно общепринятой классификации (K/DOQI, 2002). Клиническая характеристика пациентов представлена в табл. 1.
Таблица 2
Ранги ТИФ и ТИВ в соответствии их распространенностью и тяжестью ремоделирования почечной ткани в исследуемой группе пациентов
Ранги | ТИФ | Частота встречаемости, абс. (%) | ТИВ | Частота встречаемости, абс. (%) |
|---|---|---|---|---|
0 | Нет | 0 | Нет | 18 (60) |
1 | Слабый - утолщение и гиалиноз базальных мембран канальцев на большем увеличении | 11 (36,7) | Слабое, единичные лимфоидные агрегаты | 8 (44,5) |
2 | Умеренный - канальцы разделены фиброзными прослойками, видимыми на малом увеличении | 11 (36,7) | Умеренное с наличием от 3 лимфоидных агрегатов и более | 10 (55,5) |
3 | Выраженный - выраженная атрофия канальцев, фиброз/гиалиноз | 8 (26,6) | Выраженное воспаление, диффузный характер инфильтрации | 0 |
Примечание. ТИФ - тубулоинтерстициальный фиброз, ТИВ - тубулоинтерстициальное воспаление.
Всем пациентам была проведена биопсия почек с определением структурных изменений ткани почек и морфологического варианта гломерулонефрита. Наиболее распространенной патологией явлись фокально-сегментарный гломерулосклероз (ФСГС) (56,7% пациентов) и IgA-нефропатия (33,3% пациентов), болезнь минимальных изменений и люпус-нефрит были выявлены в 6,7% случаев, ANCA-ассоциированный гломерулонефрит и мембранозно-пролиферативный гломеролонефрит I и III типов - в 3,3% случаев, мембранозная нефропатия - у 10,0% пациентов. При морфологическом исследовании нефробиоптата учитывали признаки, характеризующие повреждение подоцитов (гипертрофия клеток, исчезновение малых отростков, микровиллезная трансформация), развитие фокального сегментарного гломеруло склероза (утолщение базальных мембран капилляров клубочка, адгезия капиллярных петель между собой и париетальным листком капсулы Боумена, гиалиноз), наличие фиброзных и фиброзно-клеточных полулуний, перигломерулярного фиброза и гиалиноза, глобального гломерулосклероза, а также признаки ремоделирования почечной ткани, такие как тубулоинтерстициальный фиброз (ТИФ), воспаление (ТИВ), атрофия канальцев. Степень выраженности ТИФ и ТИВ оценивали соответственно объему поражения почечной ткани. В табл. 2 приведены ранг и распространенность почечного ремоделирования.
Как видно из представленной таблицы, ТИФ в различной степени выраженности был выявлен у всех исследуемых пациентов, тогда как ТИВ - у 60% больных.
Согласно протоколу исследования, в биопсийном материале был выполнен морфометрический анализ междольковых артерий, отобранных случайным образом. Оценивали размеры внутреннего и внешнего диаметров артерии, толщину сосудистой стенки, интимы, медии, отклонение от нормальных значений внутреннего диаметра междольковой артерии. Толщину стенки междольковой артерии рассчитывали как разницу между внешним и внутренним диаметром. Морфометрия проводилась с использованием цифрового микроскопа «Leica DMD108». Пример анализа параметров, оценивающих структурную перестройку междольковой артерии, приведен на рис. 1.
Отклонения от нормативных значений внутреннего диаметра артерии оценивали с учетом возраста пациента [5]. Нормальное значение внутреннего диаметра междольковой артерии в юношеском возрасте (юноши - 17-21 год, девушки - 16-20 лет) составляет 87,6±4,5 мкм, в 1-м зрелом возрасте (мужчины - 22-35 лет, женщины - 21-35 лет) - 105,6±2,1 мкм, во 2-м зрелом возрасте (мужчины - 36-60 лет, женщины - 36-55 лет) - 112,7±1,0 мкм, в пожилом возрасте (мужчины - 61-74 года, женщины - 56-74 года) - 110,0±1,2 мкм [5]. Показатели, характеризующие структуру междольковых артерий, полученные при анализе биопсийного материала в изучаемой группе пациентов, представлены в табл. 3.
Статистический анализ данных проводили с помощью пакета прикладных статистических программ «Statistica 8,0» («Stat Soft», США). Данные представлены в виде средняя арифметическая±ошибка средней. Для попарного сравнения независимых групп использовали t-критерий Стьюдента. Для оценки силы связи между изучаемыми переменными вычисляли коэффициент корреляции Пирсона. Оценку отдаленной выживаемости проводили с использованием метода Каплана-Мейера. Нулевую статистическую гипотезу об отсутствии различий и связей отвергали при p<0,05.
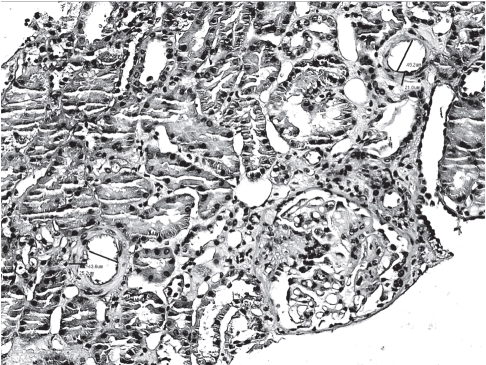
Рис.1. Анализ структуры междольковой артерии в нефробиоптате.
Таблица 3
Характеристика структурных показателей междольковых артерии в группе исследуемых пациентов
Критерий | Среднее значение |
|---|---|
Внутренний диаметр, мкм | 44,7±3,3 |
Внешний диаметр, мкм | 78,7±4,2 |
Толщина стенки, мкм | 33,97±2,4 |
Толщина интимы, мкм | 7,04±1,5 |
Толщина медии, мкм | 29,9±1,9 |
Отклонение от нормы внутреннего диаметра, мкм | -64,1±3,3 |
Наличие фиброза, абс. (%) | 25 (83,3) |
Наличие фиброэластоза, абс. (%) | 2 (6,7) |
Наличие гиалиноза, абс. (%) | 15 (50,0) |
Таблица 4
Результаты однофакторного логистического анализа
Показатель | Отношение шансов (доверительный интервал) | Статистическая значимость (х2-критерий, р) |
|---|---|---|
Наличие утолщения стенки междольковой артерии | 0,765 (0,673-0,857) | Х2-критерий = 4,75, р = 0,03 |
Наличие сращения капиллярных петель | 0,9 (0,76-1,04) | Х2-критерий = 5,49, р = 0,02 |
Наличие облитерации капиллярных петель | 0,13 (0,12-0,0,14) | Х2-критерий = 8,76, р = 0,003 |
Таблица 5
Влияние толщины стенки междольковой артерии на вероятность развития признаков ФСГС
Вероятность риска | Толщина стенки междольковой артерии, мкм | |||
|---|---|---|---|---|
20 | 40 | 60 | 80 | |
Утолщение стенок капилляров | 28,1 | 61,3 | 86,5 | 96,3 |
Сращение капиллярных петель | 1,3 | 10,8 | 52,2 | 90,8 |
Облитерация капиллярных петель | 0,9 | 12,6 | 70,3 | 97,5 |
РЕЗУЛЬТАТЫ
Статистический анализ полученных данных позволил установить прямую корреляционную зависимость высокой силы между утолщением интимы междольковой артерии и максимальным систолическим (САД) артериальным давлением (г = 0,7, р<0,001 ). Необходимо обратить внимание на то, что при максимальном САД менее 130 мм рт. ст. корреляционная взаимосвязь с толщиной интимы междольковой артерии отсутствовала (рис. 2).
При корреляционном анализе толщины интимы междольковой артерии и максимального уровня диастолического артериального давления получены данные с тенденцией к достоверности (г = 0,4, р=0,06).
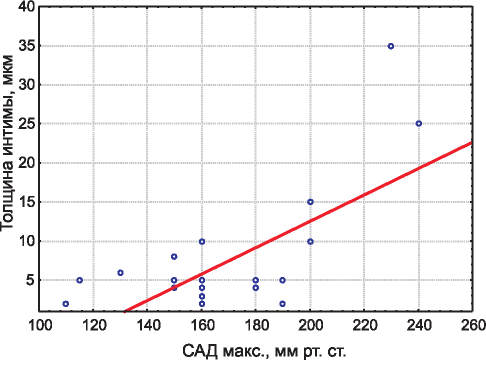
Рис. 2. Корреляционная зависимость толщины интимы меж- дольковой артерии и максимального уровня САД.
При анализе толщины сосудистой стенки были выявлены ряд взаимосвязей. Получена прямая корреляционная зависимость слабой силы с уровнем САД, измеренном при включении пациентов в исследование (г = 0,38, р=0,04), а также максимальной величиной САД (г = 0,4, р - 0,03).
Показатели САД при включении пациентов в исследование, а также максимальных значений САД и толщины сосудистой стенки подчинялись закону нормального распределения, что позволило использовать однофакторный линейный регрессионный анализ. Полученные математические модели позволяют рассчитать толщину стенки междольковой артерии в зависимости от величины АД.
Толщина стенки артерии = 5,16+0,21*САД (мм рт. ст.), р=0,04.
Толщина стенки артерии = 5,97+0,17*САД макс. (мм рт. ст.), р=0,03.
где САД макс. - максимальный уровень САД.
При проведении корреляционного анализа была установлена прямо пропорциональная корреляционная взаимосвязь слабой силы между толщиной стенки междольковой артерии и выраженностью ТИВ (г = 0,43, р=0,02). Так, при отсутствии ТИВ толщина стенки артерии находится в диапазоне от 27,3 до 34,4 мкм, при наличии ТИВ 1-го ранга - от 34,4 до 41,6 мкм, а при ТИВ 2-го ранга - более 41,6 мкм (в ряде случаев достигала 48,6 мкм).
При проведении корреляционного анализа между толщиной сосудистой стенки и выраженностью фиброзирования почечной ткани статистически значимых взаимосвязей выявлено не было. Однако по результатам логистического регрессионного анализа отсутствие увеличения толщины стенки артерии ассоциировалось со снижением риска развития фокального сегментарного гломерулосклероза, таких как утолщение стенки капилляров, сращение и облитерация капиллярных петель. Показатели однофакторного логистического анализа представлены в табл. 4.
На основании полученных уравнений логистической регрессии, сформирована таблица стратификации риска развития ФСГС в зависимости от толщины стенки междольковой артерии (табл. 5).
Анализируя полученные данные, можно отметить, что величина стенки междольковой артерии, превышающая 40 мкм, характеризуется значительным увеличением риска развития сегментарного гломерулосклероза вне зависимости от первичной причины гломерулопатии.
С помощью логистического регрессионного анализа установлена зависимость уменьшения просвета междольковой артерии и признаков склерозирования клубочков. Так, уменьшение внутреннего диаметра артериальной стенки потенцирует вероятность формирования фиброзно-клеточных полулуний (х2-критерий = 4,32, р= 0,04) (рис. 3).
Статистически значимой взаимозависимости ремоделирования стенки междольковой артерии и клинико-лабораторных показателей повреждения почек (протеинурия, эритроцитурия, концентрация креатинина и мочевины в плазме крови, величина СКФ) выявить не удалось.
ОБСУЖДЕНИЕ
Изучение состояния артерий малого диаметра и определение их прогностической значимости в развитии почечной недостаточности является высокоактуальным. Особенности строения сосудистого русла почек до настоящего времени являются предметом для исследований и разработки теории их функционирования. Согласно модели рассеивания энергии, деление почечных артерий на более мелкие сосуды необходимо для адекватной перфузии органа с формированием оптимального давления и напряжения сосудистой стенки [6]. Нарушение иерархии почечного сосудистого русла, обусловленное различными причинами, прежде всего ремоделированием стенки сосудов с нарушением нормальных параметров гемодинамики, неизбежно приводит к повреждению почечной ткани. Патологическое изменение артерий мелкого диаметра вызывает особый интерес, так как это структуры не только наиболее доступные для морфометрии при биопсии почек, но и активно влияющие на состояние нефрона.
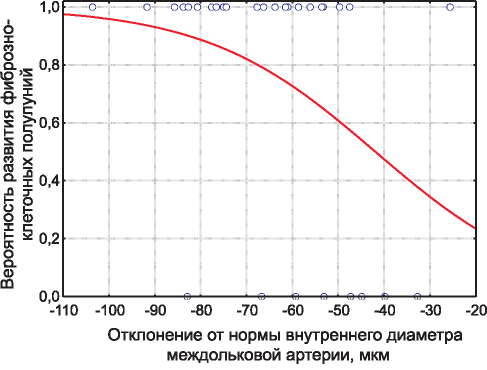
Рис. 3. Вероятность формирования фиброзно-клеточных полулуний с учетом уменьшения просвета междольковой артерии.
Артерии мелкого калибра принимают непосредственное участие в этапах структурной перестройки почечной ткани, выступая инициатором или мишенью в каскаде патогенетических реакций повреждения почек. Известны данные о роли повышения периферического почечного сопротивления при ремоделировании артерий менее 0,3 мм в диаметре на фоне нормального или незначительно повышенного уровня системного АД с последующим вовлечением в патологический процесс почечной паренхимы [7]. В исследовании К. Hanamura и соавт. проводилось определение индекса резистивности почечных артерий и его связи с морфологической перестройкой почечной ткани [8]. Авторами был сделан вывод о том, что изменения в артериях малого диаметра могут привести к снижению перфузии клубочка независимо от тяжести гломерулярного поражения. С другой стороны - при ХБП у пациентов с гипертонической болезнью высокое давление в афферентной артерии вносит непосредственный вклад в изменение структуры артерий малого диаметра [7, 9].
Полученные нами данные позволили продемонстрировать взаимосвязь между уровнем АД и толщиной стенки междольковой артерии, а также - интимы сосуда. Важно отметить, что гипертрофия стенки междольковой артерии приобретает особое значение при превышении величины АД выше целевого уровня.
Обращает на себя внимание то, что дезадаптивное ремоделирование междольковой артерии проявляется уменьшением внутреннего диаметра сосуда и увеличением толщины артериальной стенки [10].
Артерии мелкого диаметра непосредственно определяют характер перфузии органа, но, в свою очередь, могут подвергаться ремоделированию в ответ на структурную перестройку ткани почек [11]. Так, при наличии тубулоинтерстициального компонента полноценность и эффективность кровоснабжения значительно снижается вследствие локального повышения давления и развития ишемии доставки. Данные изменения влекут за собой патологическое ремоделирование сосудистого русла адаптивного, а в последующем дезадаптивного характера. Прогрессирование изменений приобретает характер «порочного круга» с неуклонным прогрессированием дисфункции почек.
Наличие повреждающих факторов, таких как метаболические агенты, оксидативный стресс, компонент гемодинамического сдвига, приводят к нарушению контроля вазоактивных веществ сосудистой стенки артерий малого диаметра [12], их повреждению и, как следствие, нарушению перфузии ткани почки. На фоне продолжающегося влияния факторов агрессии данные механизмы потенцируют друг друга, что активирует процессы органного и тканевого ремоделирования. Полученные нами данные также подтверждают влияние ремоделирования сосудистой стенки на формирование гломерулосклероза. Так, с увеличением толщины стенки междольковой артерии возрастает риск утолщения стенок капилляров, сращения и облитерации капиллярных петель.
Важно отметить, что тканевое и сосудистое ремоделирование должно рассматриваться как взаимосвязанный процесс, лежащий в основе прогрессирования заболеваний почек. Качественная и количественная оценка изменений структуры сосудов почек при исследовании биоптатов может дать важную прогностическую информацию для стратификации степени риска и коррекции нефропротективной терапии.
ЗАКЛЮЧЕНИЕ
В результате проведенного исследования установлена взаимосвязь ремоделирования ткани почки и структурной перестройки междольковых ветвей почечной артерии. Продемонстрирована прямая корреляционная взаимосвязь между величиной артериального давления, выраженностью ТИВ и структурной перестройкой сосудистой стенки междольковой артерии. Уменьшение просвета междольковой артерии выявлено на всех этапах развития гломерулосклероза (утолщение стенок капилляров клубочка, адгезия капиллярных петель, формирование фиброзно-клеточных полулуний). Фиброз стенки междольковой артерии повышает вероятность развития гломерулосклероза. Установлен эвтрофный тип ремоделирования междольковой артерии, характеризующийся уменьшением внешнего диаметра и просвета сосуда, а также увеличением толщины стенки.
Список литературы
1. United States Renal Data System, 2014 annual data report: An overview of the epidemiology of kidney disease in the United States. National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Diseases, Bethesda, MD, 2014
2. Агранович НВ. Обоснование и эффективность профилактики и лечения больных с хронической болезнью почек в амбулаторно-поликлинических условиях. Нефрология 2013; 17(5): 43-48
3. MJ Mulvany. «Vascular remodelling of resistance vessels: can we define this?» Cardiovascular Research. 1999;1(41):9-13
4. Левицкая ЕС, Батюшин ММ, Пасечник ДГ, Асрумян ЭГ. Ремоделирование почечных артерий - инициатор и мишень кардио-ренального континуума. Кардиоваскулярная терапия и профилактика 2015; 14(1): 90-96
5. Каплунова ОА. Кровеносные сосуды почек. Наука-Спектр, Ростов н/Д, 2008;73-81
6. Painter PR, Edйn P, Bengtsson H-U. Pulsatile blood flow, shear force, energy dissipation and Murray’s Law. Theoretical Biology and Medical Modelling 2006; 3:31
7. Tracy RE. Renal Vasculature in Essential Hypertension: A Review of Some Contrarian Evidence. Contrib Nephrol Basel Karger 2011; 169: 327-336
8. Hanamura K, Tojo A, Kinugasa S et al. The Resistive Index Is a Marker of Renal Function, Pathology, Prognosis, and Responsiveness to Steroid Therapy in Chronic Kidney Disease Patients. International Journal of Nephrology 2012, Article ID 139565, 9 pages
9. Pessina AC. Target organs of individuals with diabetes caught between arterial stiffness and damage to the microcirculation. J Hypertens Suppl 2007;25:S13-S18
10. Levy BI, Schiffrin EL, Mourad JJ et al. Impaired tissue perfusion: a pathology common to hypertension, obesity, and diabetes mellitus. Circulation 2008;118:968-976
11. Chade AR. Renal Vascular Structure and Rarefaction. Compr Physiol 2013; 3(2): 817-831
12. Mayer G. Capillary rarefaction, hypoxia, VEGF and angiogenesis in chronic renal disease. Nephrol Dial Transplant 2011;26:1132-1137
Об авторах
Е. С. ЛевицкаяРоссия
М. М. Батюшин
Россия
Д. Г. Пасечник
Россия
Н. В. Антипова
Россия
Рецензия
Для цитирования:
Левицкая Е.С., Батюшин М.М., Пасечник Д.Г., Антипова Н.В. Прогнозирование ремоделирования ткани почек с учетом структурных изменений почечных артерий малого диаметра. Нефрология. 2016;20(5):55-61.
For citation:
Levitskaya E.S., Batiushin M.M., Pasechnik D.G., Antipova N.V. Prediction of kidney tissue remodeling in view of small small diameter renal arteries structural changes. Nephrology (Saint-Petersburg). 2016;20(5):55-61. (In Russ.)








































