Перейти к:
Артериальная гипертензия и потребление соли: вклад в ремоделирование сердца
Аннотация
Для цитирования:
Парастаева М.М., Береснева О.Н., Иванова Г.Т., Швед Н.В., Кучер А.Г., Зубина И.М., Каюков И.Г. Артериальная гипертензия и потребление соли: вклад в ремоделирование сердца. Нефрология. 2016;20(5):97-105.
For citation:
Parastaeva M.M., Beresneva O.N., Ivanova G.T., Shwed N.V., Kucher A.G., Zubina I.M., Kayukov I.G. Arterial hypertension and salt intake: contribution to cardiac remodeling. Nephrology (Saint-Petersburg). 2016;20(5):97-105. (In Russ.)
ВВЕДЕНИЕ
Общепринятая точка зрения предполагает, что высокое потребление поваренной соли (>2,0 г/сут) ответственно за одну из каждой десяти смертей от кардиоваскулярных заболеваний в мире [1]. При этом выявляется логарифмически-линейная зависимость между потреблением натрия и величинами артериального давления (АД), тогда как гипертензия рассматривается в качестве важнейшего фактора кардиоваскулярного риска [2, 3]. Отсюда следует, что уменьшение поступления натрия с пищей должно снижать уровень АД и сердечно-сосудистую летальность [4]. Тем не менее, во многих исследованиях последних лет однозначных доказательств справедливости данного положения не получено [2, 5, 6]. Более того, результаты ряда обширных метаанализов наводят на мысль о том, что зависимость между потреблением натрия и общей смертностью носит J- или U-образный характер. Риск фатального исхода существенно возрастает при ежесуточном поступлении натрия с рационом <3,0 г (<7,5 г поваренной соли) или >6,0 г (>15,0 г соли) [7]. Также показано, что радикальное ограничение натрия в рационе может приводить к целому ряду негативных последствий [8].
Невозможно отрицать, что высокое потребление натрия способно оказывать повреждающее воздействие на сердечно-сосудистую систему. Традиционно считалось, что увеличение потребления соли способствует задержке воды и экспансии объема внеклеточной жидкости, что содействует развитию АГ по объемзависимому пути и последующему ремоделированию сердца и сосудов. Тем не менее, результаты ряда исследований наводят на мысль, что существующие представления о механизмах негативного воздействия высокого содержания хлорида натрия на кардиоваскулярную систему могут существенно измениться. Кратко их можно сформулировать в терминах прямой «токсичности» хлорида натрия в отношении некоторых органов и тканей. Такой «токсический» эффект NaCl в конечном итоге приводит к ремоделированию компонентов микроциркуляторного русла. Механизм реализуется за счет активации различных пролиферативных, профибротических и провоспалительных цитокинов, сигнальные пути которых в той или иной мере ассоциированы или контролируются изменениями экспрессии ряда нуклеарных факторов транскрипции. При этом нарастание резистив- ности мелких сосудов кожи может стать одной из причин, способствующих росту АД, вне зависимости от экспансии объема [9, 10]. Тем не менее, многие вопросы о конкретных путях воздействия высокого потребления хлорида натрия на состояние гемодинамики и ремоделирование сердца остаются открытыми, поскольку противоречивы представления не только о механизмах развития данного состояния, но даже об его определении и критериях [9,11].
В связи с этим мы провели исследование, целью которого стало изучение влияния рационов питания с разным содержанием хлорида натрия на уровень артериального давления (АД), процессы ремоделирования миокарда, параметры гомеостаза натрия у спонтанно-гипертензивных крыс.
МАТЕРИАЛ И МЕТОДЫ
Работа выполнена на взрослых спонтанно- гипертензивных самцах крыс линии SHR (питомник «Колтуши» Российской академии наук). Исследовано две группы лабораторных животных. Первая включала 24 интактные крысы, получавшие стандартный пищевой рацион (0,34 % NaCl) в течение 2 мес. Вторая состояла из 25 животных, получавших в течение того же срока рацион с высоким (8,0 %) содержанием NaCl. По содержанию белков, жиров и углеводов диеты были идентичными. Доступ к воде был свободным.
За сутки до окончания эксперимента у бодрствующих крыс осуществляли измерение системного АД манжеточным методом. Подробное описание методики представлено в ранее опубликованных материалах [12, 13]. В индивидуальных метаболических камерах в течение суток у крыс осуществляли сбор мочи и фиксировали суточный диурез. В моче определяли содержание натрия. Животных выводили из эксперимента декапитацией под легким эфирным наркозом и осуществляли забор крови для последующего определения содержания сывороточного натрия. Рассчитывали индекс массы миокарда (ИММ, отношение массы сердца к массе животного, мг/г) и массы миокарда левого желудочка (ИММЛЖ, отношение массы левого желудочка к массе животного, мг/г).
Морфологические исследования. Для патогистологического исследования фрагменты миокарда каждого животного фиксировались незамедлительно после получения образцов ткани в 4% забуференном PBS растворе ПФА, рН 7,4, в течение 24 ч, при комнатной температуре. После стандартной обработки тканевых фрагментов (обезвоживание и пропитка) из парафиновых блоков были приготовлены серийные срезы толщиной 4-5 мкм. Препараты окрашивались реактивом гематоксилин/эозином и пикрофуксином по Ван- Гизону. Изучение патоморфологических изменений проводилось светооптически.
Для статистического анализа использовали пакет прикладных статистических программ «Statistica v6.0» («StatSoft Inc», США) Результаты представлены в виде медиана [интерквартильный размах]. Для попарного сравнения независимых групп определяли критерий Манна-Уитни.
Исследования выполняли в соответствии с требованиями этического комитета ГБОУ ВПО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России.
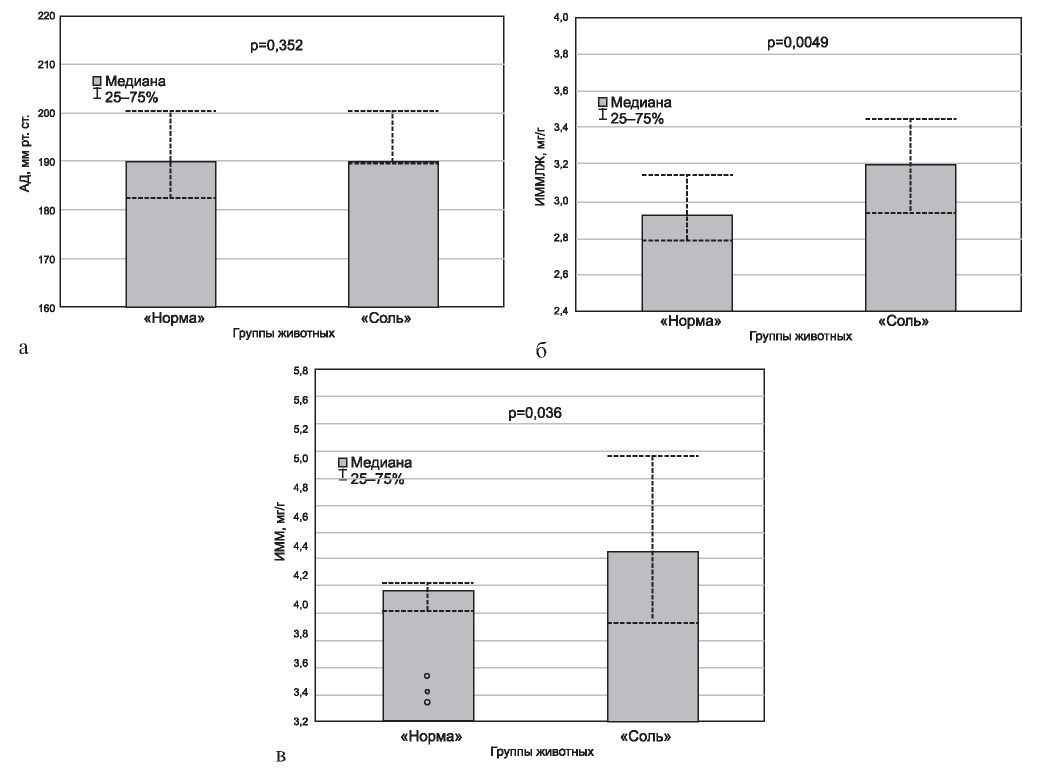
Рис. 1. Уровень артериального давления (а), индекс массы миокарда левого желудочка (б) и индекс массы миокарда (в) у крыс линии SHR, получавших рацион с нормальным («норма») или высоким («соль») содержанием NaCl.
РЕЗУЛЬТАТЫ
Результаты нашего исследования показали, что уровень АД у крыс, получавших в течение 2 мес рацион с высоким содержанием NaCl, существенно не отличается от показателя у животных, находящихся аналогичное время на диете с нормальным содержанием поваренной соли (рис. 1, а). В то же время, ИММ и ИММЛЖ у крыс первой экспериментальной группы были значимо больше (см. рис. 1, б, в).
Концентрация натрия в сыворотке крови была выше у животных, получавших рацион с нормальным содержанием NaCl (рис. 2, а), а концентрация натрия в моче (см. рис. 2, б), диурез (см. рис. 2, в) и суточная экскреция натрия с мочой (см. рис. 2, г) были значимо выше в группе крыс, получавших диету с высоким содержанием поваренной соли.
Морфологическое исследование выявило у взрослых спонтанно-гипертензивных крыс, получавших диету с нормальным содержанием хлорида натрия, утолщение кардиомиоцитов, разволокнение мышечных волокон и появление отдельных участков гомогенизации цитоплазмы (рис. 3).
У животных получавших рацион с высоким содержанием поваренной соли, отмечалось нарастание степени выраженности гипертрофии волокон кардиомиоцитов, выявлялось небольшое количество двуядерных кардиомиоцитов (рис. 4).
Кроме того, в миокарде крыс данной экспериментальной группы наблюдались умеренные пе- риваскулярный фиброз и гипертрофия гладкомышечных клеток стенок сосудов (рис. 5).
ОБСУЖДЕНИЕ
Результаты исследования лабораторных животных, находившихся на рационах со стандартным содержанием белка и высоким или обычным содержанием хлорида натрия, оказались интересными. Мы не обнаружили существенного усугубления гипертензии у спонтанно-гипертензивных крыс, находящихся на высокосолевом рационе в течение 2 мес эксперимента по сравнению с контрольной группой, что, в принципе, согласуется с результатами некоторых исследований у людей [14, 15].
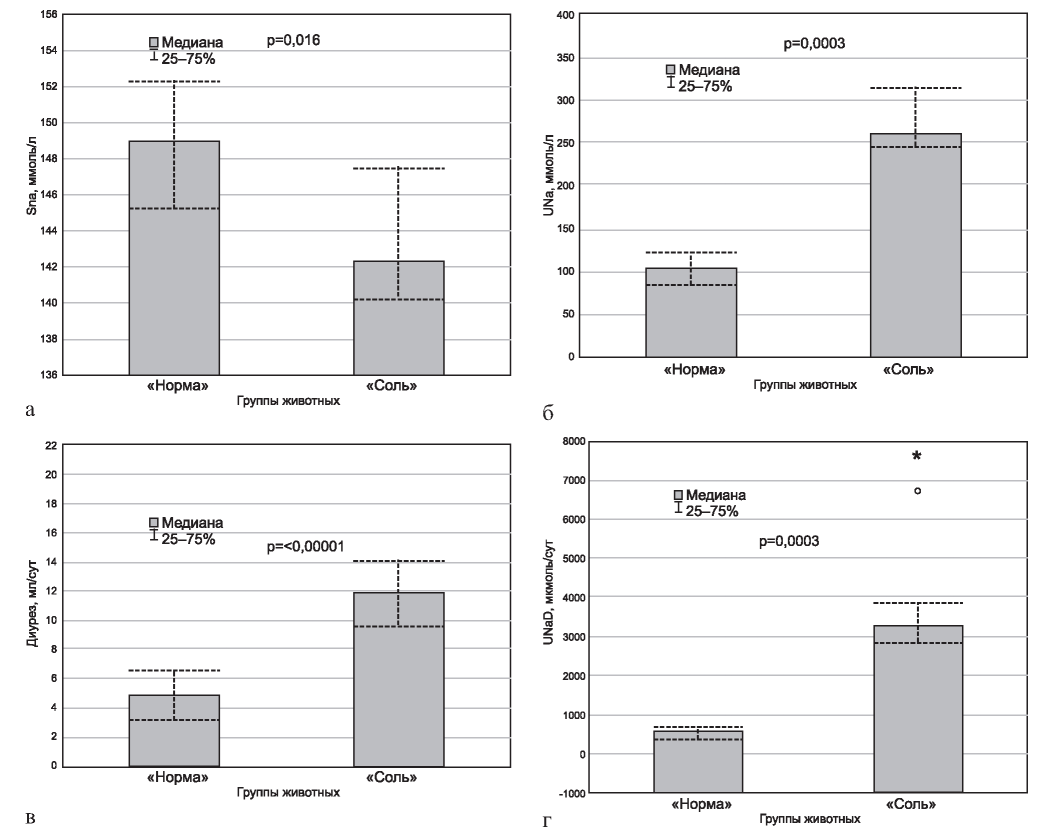
Рис. 2. Концентрация натрия в сыворотке крови (а; SNa), моче (б; UNa), диурез (в) и суточная экскреция натрия с мочой (г; UNaD). Остальные обозначения - см. рис. 1.
Возможно, крысы линии SHR обладают высокой способностью к выведению избытка NaCl, и за время эксперимента у них, скорее всего, не происходит существенной экспансии объема крови, которая могла бы послужить одной из причин роста АД. При этом в данной ситуации у «высокосолевых» животных, по-видимому, формируются элементы солевого осмотического диуреза, одним из последствий которого является снижение концентрации натрия в сыворотке крови.
Не включался в данной ситуации и один из других потенциальных механизмов роста АД, ассоциированный с высоким потреблением хлорида натрия (рост периферического сосудистого сопротивления, связанный с ремоделированием лимфокапиллярной сети, прежде всего кожи).
Возможно, нарастание интерстициальной тоничности побуждает инфильтрирующие макрофаги к экспрессии TonEBP - фактора транскрипции, который повышает продукцию сосудистого эндотелиального фактора роста C (VEGF-C). При высоком потреблении соли также может происходить активация эндотелиальной формы NO-синтазы (NOS3), которая частично опосредуется трансформирующим фактором роста бета (TGF-β). Данный механизм рассматривается как компенсаторный, цель его - создать дополнительный резервуар для депонирования ионов натрия [9, 10]. Такое депонирование, наряду с отмеченным выше нарастанием экскреции натрия, скорее всего, оказываются достаточными для предотвращения увеличения эффективного объема внеклеточной жидкости и. таким образом, создания препятствия росту АД.
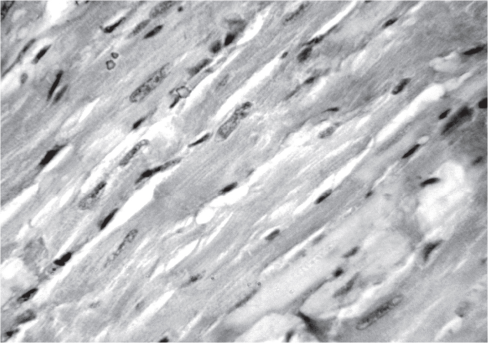
Рис. 3. Состояние кардиомиоцитов у крыс линии SHR, получавших рацион с нормальным содержанием NaCl. Окраска гематоксилином и эозином. Ув. 400.
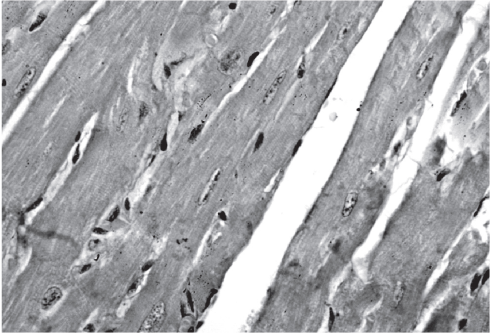
Рис. 4. Состояние кардиомиоцитов у крыс линии SHR, получавших рацион с высоким содержанием NaCl. Окраска пикрофуксином по Ван-Гизону. Ув. 400.
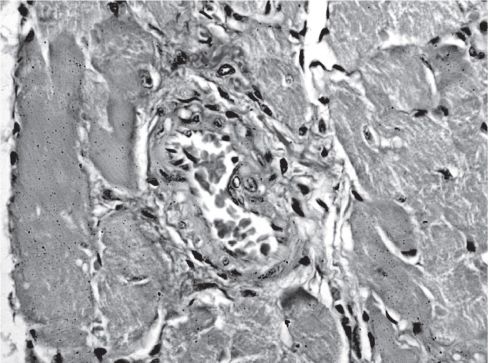
Рис. 5. Изменения сосудов миокарда крыс, получавших рацион с высоким содержанием NaCl. Окраска пикрофуксином по Ван-Гизону. Ув. 400.
Кроме того, активация NOS3 способствует генерации оксида азота, что также, возможно, противодействует усугублению гипертензии [9, 10].
Можно предположить, что эти и другие компенсаторные механизмы у исследованных нами лабораторных животных действуют достаточно надежно, что и препятствует повышению у них АД, несмотря на длительное потребление значительного количества NaCl. При этом результаты морфологических методов дают основания полагать, что в миокарде крыс, потреблявших рацион с 8% содержанием хлорида натрия, имеются отчетливые проявления гипертрофии и, возможно, гиперплазии кардиомиоцитов.
Не исключено, что при этом ремоделированию подвергаются и мелкие сосуды миокарда, что может в дальнейшем усугублять поражение сердца.
Результаты данного исследования и литературные сведения наводят на мысль о том, что высокое потребление соли может оказывать прямое негемодинамическое воздействие на миокард, независящее от влияния на уровень АД [16]. Возможно, как показало наше предыдущее исследование, проведенное на нормотензивных крысах Wistar, негативное воздействие на сердечно-сосудистую систему высокосолевых рационов частично реализуется через активацию NFkB - ассоциированных сигнальных путей [12]. Не исключено, что не всем больным с АГ необходимо жестко ограничивать потребление соли.
ЗАКЛЮЧЕНИЕ
Полученные нами данные дают основания предполагать, что содержание крыс линии SHR на рационе с высоким содержанием хлорида натрия приводит к своеобразному профилю ремоделирования миокарда, который не определяется исключительно нарастанием артериального давления. Это требует разработки новых подходов к коррекции и профилактике подобных изменений.
Список литературы
1. Mozaffarian D, Fahimi S, Singh GM et al. Global sodium consumption and death from cardiovascular causes. N Engl J Med 2014; 371(7): 624-634
2. Mancia G, Fagard R, Narkiewicz K et al. 2013 ESH/ESC guidelines for the management of arterial hypertension: the Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). Eur Heart J 2013; 34(28): 2159-2219
3. Drenjancevic-Peric I, Jelakovic B, Lombard JH et al. High-salt diet and hypertension: focus on the renin-angiotensin system. Kidney Blood Press Res 2011; 34(1): 1-11
4. Klaus D, Hoyer J, Middeke M. Salt restriction for the prevention of cardiovascular disease. Dtsch Arztebl Int 2010; 107(26): 457-462
5. Graudal NA, Hubeck-Graudal T Jürgens G. Reduced dietary sodium intake increases heart rate. A meta-analysis of 63 randomized controlled trials including 72 study populations. Front Physiol 2016;7:111. doi: 10.3389/fphys.2016.00111
6. Adler AJ, Taylor F, Martin N et al. Reduced dietary salt for the prevention of cardiovascular disease. Cochrane Database Syst Rev 2014; 12: CD009217. doi: 10.1002/14651858.CD009217
7. Drüeke TB. Salt and health: time to revisit the recommendations. Kidney Int 2016; 89(2): 259-260
8. Ritz E, Mehls O. Salt restriction in kidney disease - a missed therapeutic opportunity? Pediatr Nephrol 2009; 24(1): 9-17
9. Kanbay M, Chen Y Solak P, Sanders PW. Mechanisms and consequences of salt sensitivity and dietary salt intake. Curr Opin Nephrol Hypertens 2011; 20(1): 37-43
10. Pase MP, Grima NA, Sarris J. The effects of dietary and nutrient interventions on arterial stiffness: a systematic review. Am J Clin Nutr 2011; 93(2): 446-454
11. Mohan S, Campbell NR. Salt and high blood pressure. Clin Sci (Lond) 2009; 117(1): 1-11
12. Береснева ОН, Парастаева ММ, Иванова ГТ и др. Изменения сердечно-сосудистой системы у крыс, сопряженные с высоким потреблением хлорида натрия. Артериальная гипертензия 2014; 20(1): 64-70
13. Каюков ИГ, Береснева ОН, Парастаева ММидр. Влияние возраста и сокращения массы действующих нефронов на состояние миокарда и коронарного русла у молодых крыс. Регионарное кровообращение и микроциркуляция 2015; 14(4): 66-73
14. Cavka A, Jukic I, Ali M et al. Short-term high salt intake reduces brachial artery and microvascular function in the absence of changes in blood pressure. J Hypertens 2016; 34(4):676-684
15. Cavka A, Cosic A, Jukic I et al. The role of cyclo-oxygenase-1 in high-salt diet-induced microvascular dysfunction in humans. J Physiol 2015;593(24):5313-5324
16. Graudal NA, Hubeck-Graudal T, Jurgens G. Effects of low sodium diet versus high sodium diet on blood pressure, renin, aldosterone, catecholamines, cholesterol, and triglyceride. Cochrane Database Syst Rev 2011; 9(11): CD004022. doi: 10.1002/14651858
Об авторах
М. М. ПарастаеваРоссия
О. Н. Береснева
Россия
Г. Т. Иванова
Россия
Н. В. Швед
Россия
А. Г. Кучер
Россия
И. М. Зубина
Россия
И. Г. Каюков
Россия
Рецензия
Для цитирования:
Парастаева М.М., Береснева О.Н., Иванова Г.Т., Швед Н.В., Кучер А.Г., Зубина И.М., Каюков И.Г. Артериальная гипертензия и потребление соли: вклад в ремоделирование сердца. Нефрология. 2016;20(5):97-105.
For citation:
Parastaeva M.M., Beresneva O.N., Ivanova G.T., Shwed N.V., Kucher A.G., Zubina I.M., Kayukov I.G. Arterial hypertension and salt intake: contribution to cardiac remodeling. Nephrology (Saint-Petersburg). 2016;20(5):97-105. (In Russ.)








































