Перейти к:
ВЛИЯНИЕ ТЕПЛОВОЙ ИШЕМИИ-РЕПЕРФУЗИИ НА ЭКСПРЕССИЮ АПОПТОЗ-РЕГУЛИРУЮЩИХ ГЕНОВ В ПОЧЕЧНОЙ ТКАНИ БОЛЬНЫХ С ПОЧЕЧНО-КЛЕТОЧНЫМ РАКОМ
https://doi.org/10.24884/1561-6274-2017-21-1-80-86
Аннотация
Расширение представлений о молекулярных механизмах повреждающего действия тепловой ишемии с реперфузией на почечную ткань больных раком почки имеет значительные перспективы для новых терапевтических подходов, направленных на повышение качества лечения. ЦЕЛЬ: изучение изменения экспрессии апоптоз-регулирующих генов MDM 2, BAX, CASP7, CASP3, CASP8, CASP9, BCL2, CASP8/FADD, p53, APAF1, AIFM1, ICAD и XIAP в почечной ткани больных с почечно-клеточным раком, подвергнутой действию ишемии и реперфузии. ПАЦИЕНТЫ И МЕТОДЫ. Для исследования использовали биоптаты тканей 12 пациентов с гистологически подтвержденным диагнозом рак почки. Пункционную биопсию проводили до остановки кровоснабжения, на 10-й минуте ишемии и через 20 мин после восстановления кровотока в почке. Относительную экспрессию генетических локусов определяли методом ПЦР в реальном времени. РЕЗУЛЬТАТЫ. Обнаружено: 1) отсутствие на 10-й минуте ишемии достоверных отличий транскриптомного профиля большинства исследованных нами генов от аналогичных показателей до проведения ишемии, за исключением снижения экспрессии гена CASP7 и ICAD; 2) достоверное увеличение экспрессии как про-апоптозных генов (BAX, CASP3 и 7, p53 и APAF1), так и антиапоптозных генов (XIAP, MDM2 и BCL2) через 20 мин после восстановления кровотока в тканях почки; 3) изменение в балансе экспрессии пар прои антиапоптозных генов p53/MDM2 и Bax/ BCL2 на 10-й минуте ишемии и через 20 мин после восстановления кровотока. ЗАКЛЮЧЕНИЕ. Полученные данные характеризуют транскриптомное состояния почечной ткани в ранний период после ишемии и восстановления в ней кровотока как инициаторную точку сдвига баланса прои антиапоптозных генов.
Для цитирования:
Кутилин Д.С., Димитриади С.Н., Водолажский Д.И., Франциянц Е.М., Кит О.И. ВЛИЯНИЕ ТЕПЛОВОЙ ИШЕМИИ-РЕПЕРФУЗИИ НА ЭКСПРЕССИЮ АПОПТОЗ-РЕГУЛИРУЮЩИХ ГЕНОВ В ПОЧЕЧНОЙ ТКАНИ БОЛЬНЫХ С ПОЧЕЧНО-КЛЕТОЧНЫМ РАКОМ. Нефрология. 2017;21(1):80-86. https://doi.org/10.24884/1561-6274-2017-21-1-80-86
For citation:
Kutilin D.S., Dimitriadi S.N., Vodolazhsky D.I., Frantsiyants E.M., Kit O.I. EFFECT OF THERMAL ISCHEMIA-REPERFUSION ON EXPRESSION OF APOPTOSIS-REGULATING GENES IN THE RENAL TISSUE OF PATIENTS WITH RENAL CELL CARCINOMA. Nephrology (Saint-Petersburg). 2017;21(1):80-86. (In Russ.) https://doi.org/10.24884/1561-6274-2017-21-1-80-86
ВВЕДЕНИЕ
Органосохраняющие операции при раке почки, в частности, выполнение резекции опухолей сложных локализаций, требуют применения продолжительной тепловой ишемии с последующей реперфузией [1]. Ишемия/реперфузия является основной причиной развития острого повреждения почек (ОПП) [2]. Общее клиническое состояние данного подхода по-прежнему ассоциируется с высоким уровнем заболеваемости и смертности, несмотря на значительные успехи в поддерживающей терапии [3]. Важные открытия были сделаны в определении биологических последствий ишемического повреждения почек. Морфологический ответ клеток почечных канальцев зависит от интенсивности и тяжести ишемии и включает в себя потерю клеточной полярности, апоптоз, дедифференцировку жизнеспособных клеток, пролиферацию, дифференцировку и реституцию нормального эпителия [4]. Молекулярные механизмы, лежащие в основе каждого из этих явлений, интенсивно изучаются и имеют значительные перспективы для новых терапевтических подходов, направленных на повышение качества лечения и/или ускорения процесса восстановления.
В качестве возможного механизма, приводящего к гибели клеток почечных канальцев и эпителия после ишемического воздействия на почки, рассматривается апоптоз [5]. Апоптоз, характеризующийся сморщиванием клеток, конденсацией и фрагментацией ядер и межнуклеосомной деградацией ДНК, был зарегистрирован в культивируемых клетках почечных канальцев в образцах биоптатов человека, полученных из почек трупов [6]. Поэтому в настоящее время интерес исследователей направлен на идентификацию внутриклеточных путей, участвующих в рецепции стимулов, передаче сигналов и реализации фаз апоптоза клетками трубчатого эпителия почек в результате воздействия ишемии/реперфузии.
По данным ряда авторов, даже при использовании тепловой ишемии стандартной продолжительности (до 20 мин включительно) в раннем послеоперационном периоде возникают осложнения в виде развития острого повреждения почек (ОПП) в 20-30% случаев [6-9]. Ишемия тканей сопровождается повреждением субклеточных структур, в том числе митохондрий, что приводит к активации факторов апоптоза и инициации каспаз-зависимого апоптозного каскада, в результате которого клетки «совершают самоубийство» [10].
До настоящего времени влияние тепловой ишемии и последующей реперфузии на транскрипционный профиль апоптоз-регулирующих генов в почечной ткани пациентов, больных раком, описано недостаточно [11]. Поэтому целью нашего исследования стало изучение изменения экспрессии апоптоз-регулирующих генов MDM 2, BAX, CASP7, CASP3, CASP8, CASP9, BCL2, CASP8/ FADD (CFLAR), p53, APAF1, AIFM1, ICAD, XIAP в почечной ткани больных с почечно-клеточным раком для расширения представлений о фундаментальных молекулярных механизмах повреждающего действия ишемии и реперфузии.
ПАЦИЕНТЫ И МЕТОДЫ
Для исследования использовали биоптаты тканей 12 пациентов популяции Юга России с гистологически подтвержденным диагнозом рак почки, поступивших на лечение в ФГБУ РНИОИ МЗ РФ в 2014-2015 гг. Исследование было одобрено этическим комитетом ФГБУ РНИОИ; в каждом конкретном случае было получено информированное согласие больного на включение его в данное исследование, в том числе, на биопсию почки.
Продолжительность тепловой ишемии почки в процессе проведения операции не превышала 20 мин. Во время проведения лапароскопической резекции почки с использованием тепловой ишемии, до остановки кровоснабжения в резецируемой почке с помощью пистолета Pro Mag Ultra иглой 16 G выполняли пункционную биопсию среднего сегмента резецируемой почки, забирая столбик ткани интактной паренхимы. Пункционную биопсию повторяли на 10-й минуте ишемии и через 20 мин после восстановления кровотока в почке. Гемостаз осуществляли при помощи электрокоагуляции, в случае необходимости накладывался гемо статический шов. Образцы для транспортировки в лабораторию и хранения мгновенно замораживали в жидком азоте без использования крио-/транспортных РНК-сред. Максимальное время от взятия образца до его заморозки в жидком азоте составляло не более 20 с.
Фрагменты ткани измельчали и растирали в фарфоровых ступках в лизирующем растворе, содержащем 4 М гуанидин тиоцианат, 25 мМ цитрат натрия, 0,5% саркозил и 0,1 М 2-меркаптоэтанол. Дальнейшее выделение РНК из тканей проводили по методу P. Chomczynski и N. Sacchi [12]. Полученные образцы суммарной РНК обрабатывали препаратами ДНК-азы. Синтез кДНК проводили с использованием коммерческих наборов «Reverta-L» («Интерлабсервис», Россия).
Методом RT-qPCR определяли величины относительной экспрессии 13 генетических локусов: MDM2, BAX, CASP7, CASP3, CASP8, CASP9, BCL2, CASP8/FADD (CFLAR), p53, APAFI, AIFMI, ICAD, XIAP. В качестве референсного использовали ген ACTB. Дизайн специфичных олигону- клеотидных праймеров (таблица) осуществлялся нами с использованием референсных последовательностей NCBI GenBank и программы Primer- BLAST на основе следующих принципов: область отжига олигонуклеотидных праймеров должна быть в диапазоне 58-63 °С; GC-состав в диапазоне 40-60%; в последовательности праймера должны отсутствовать стабильные вторичные структуры - шпильки и димеры, e-value последовательности праймера должно стремится к нулю и быть не больше 0,05, а query coverage (покрытие целевой последовательности) 100% (для версии BLASTN 2.3.1+), температуры отжига праймеров (forward и reverse) не должны различаться друг от друга более чем на 0,50. При подборе праймеров учитывался сплайсинг мРНК (использовали опцию «Primer must span an exon-exon junction» программы Primer-BLAST): так для гена ACTB прямой праймер покрывает соответствующую последовательность в конце 3-го экзона, а обратный праймер - последовательность в начале 4-го экзона.
Таблица
Характеристика используемых в исследовании праймеров
Наименование праймеров | № NCBI GenBank | Последовательность | T отжига, 0C | |
|---|---|---|---|---|
ACTB (reference) | NM_001101.3 | Прямой: AAC CGC GAG AAG ATG ACC C Обратный: AGC ACA GCC TGG ATA GCA AC | 60 60 | |
MDM2 | NM_001145339.2 | Прямой: TAG GAG All TGT IIG GCG TGC Обратный: CCT GCT GAT TGA CTA CTA CCA A | 60 60 | |
BAX | NM_001291428.1 | Прямой: GGG ACG AAC TGG ACA GTA ACA Обратный: GCT GCC ACT CGG AAA AAG AC | 61 60 | |
BCL2 | NM_000633.2 | Прямой: GGA TCC AGG ATA ACG GAG GC Обратный: GAA ATC AAA CAG AGG CCG CA | 63 58 | |
р53 | NM_000546.5 | Прямой: MG GAA CTC AAG GAT GCC CA Обратный: CGG GAG GTA GAC TGA CCC T | 58 62 | |
CASP3 | NM_004346.3 | Прямой: CTG GAA TAT CCC TGG ACA ACA GT Обратный: TCG ACA TCT GTA CCA GAC CGA | 63 61 | |
CASP8 | NM_001228.4 | Прямой: CTG AAG CAA ACA GCC AGT GC Обратный: GAC CTC AAT TCT GAT CTG CTC AC | 60 63 | |
CASP9 | NM_032996.3 | Прямой: TGA GAC CCT GGA CGA CAT CT Обратный: TCC CTT TCA CCG AAA CAG CA | 60 58 | |
CASP7 | NM_033338.5 | Прямой: AAG CTG ACT TCC TCT TCG CC Обратный: TCC AGG TCT TTT CCG TGC TC | 60 60 | |
CFLAR | NM_003879.5 | Прямой: GCC GAG GCA AGA TAA GCA AG Обратный: AAT CCA GTT GAT CTG GGG CAA | 60 60 | |
AIFM1 | NM_001130847.3 | Прямой: TCA GGG ACA AAG TGG TCG TG Обратный: ATC TTC ATG CTG CTC ACC GT | 60 58 | |
APAF1 | NM_001160.2 | Прямой: ACC TCT GCT GAC AAG ACT GC Обратный: GTT GTG GCC CCT CAA TTC AT | 60 58 | |
XIAP | NM_001167.3 | Прямой: ACT GAG AAA ACA CCA TCA CTA ACT Обратный: TGT CCT TGA AAC TGA ACC CCA | 60 60 | |
ICAD | NM_213566.1 | Прямой: TCT GTC CAG CAT CAT CCT CC Обратный: GGT GGC ACA ACT CTG ACG TA | 60 60 | |
Анализируемые последовательности генетических локусов амплифицировали в 25 мкл ПЦР-смеси, содержащей 12 нг кДНК, 0,25мМ dNTPs, 2,5 мМ MgCl2, 1х-ый ПЦР-буфер и 1 ед. акт. SynTaq ДНК-полимеразы с ингибирующими активность фермента антителами («Синтол», Россия), краситель EVA-Green и по 400 нМ прямого и обратного праймеров для референсного гена (β-актина, ACTB) или гена-мишени. Количественную ПЦР-РВ-амплификацию проводили на термоциклере «Bio-Rad CFX96» («Bio-Rad», USA) по следующей программе: первичная денатурация: t=95 0C в течение 3 мин 40 циклов: t=95 0C в течение 10 с, t=58 0C в течение 30 с, t=72 0C в течение 30 с. Относительную экспрессию генетического локуса (RE) рассчитывали по формуле RE =2_ΔΔα [13, 14]. Нормализацию проводили по референс- ному гену ACTB и экспрессии генов в образцах пункционной биопсии, отобранных у этих же пациентов до остановки кровоснабжения, последовательно по схеме, приведенной ниже:
- Нормализация по референсному гену: ДСО = C(t)target - C(t)ACTB.
- Расчёт медианы Д^) по каждому гену контрольной (образцы пункционной биопсии до остановки кровоснабжения) и опытной (через 10 мин после ишемии и 20 мин после реперфузии) групп.
- Нормализация по контрольной группе:
ДДC(t) = ДC(t)Медиана опытной группы – ДC(t) Медиана контрольной группы.
- Окончательный результат (кратное различие (Fold difference): 2-ДДС®.
Статистический анализ результатов выполняли с использованием пакета прикладных статистических программ «Microsoft Excel 2013» («Microsoft Corporation», США) и STATISTICA 8.0 (StatSoft Inc., США). Результаты представлены в виде среднего арифметического ± ошибка средней. Статистическую значимость различий двух средних определяли с помощью непараметрического критерия Вилкоксона для связных выборок; частот - х2-критерия Пирсона. Нулевую статистическую гипотезу об отсутствии различий и связей отвергали при p<0,05.
РЕЗУЛЬТАТЫ
На 10-й минуте проведения тепловой ишемии транскриптомный профиль исследованных нами генов MDM2, BAX, CASP3, CASP8, CASP9, BCL2, CASP8/FADD (CFLAR), p53, APAF1, AIFM1 и XIAP достоверно не отличался от аналогичных показателей экспрессии этих же генетических локусов до проведения ишемии (контроль), и только экспрессия генов CASP7 и ICAD статистически достоверно (p<0,05) снижалась на 40 и 10% соответственно по отношению к показателям контроля (рис. 1).
Через 20 мин после восстановления кровотока (реперфузии) наблюдалось статистически достоверное (p<0,05) увеличение экспрессии генов в тканях почки по сравнению с состоянием до проведения тепловой ишемии (рис. 2) как проапоптоз- ных генов - BAXна 30%, CASP3 и 7 на 30%, p53 на 60% и APAF1 на 50%, так и антиапоптозных генов XIAP на 30%, MDM2 на 30% и BCL2 на 40%.
Через 20 мин после реперфузии почки относительно состояния на 10-й минуте ишемии наблюдалось статистически достоверное (p<0,05) увеличение экспрессии следующих генов MDM2, CASP7, CASP3, CASP8, CASP9, BCL2, p53, APAF1, AIFM1, ICAD и XIAP на 40, 110, 80, 40, 150, 80, 60, 80, 200, 20% и 50% соответственно (рис. 3).
При оценке соотношения экспрессии пар про- и антиапоптозных генов p53/MDM2 и BAX/BCL2 на 10-й минуте ишемии и через 20 мин после восстановления кровотока (рис. 4) обнаружены изменения в балансе экспрессии этих генов. На 10-й минуте тепловой ишемии почки соотношение p53/MDM2 на 8% (p<0,05) выше, чем до ишемии, что связано со снижением экспрессии MDM2 в этой временной точке относительно состояния до ишемии на 8%; а соотношение BAX/BCL2 на 10% (p<0,05) выше, чем до ишемии, что связано с изменением экспрессии обоих генов. На стадии реперфузии соотношение p53/MDM2 на 25% (p<0,05) выше, чем до ишемии, что обусловлено более значительным увеличением экспрессии гена p53, чем MDM2; а соотношение экспрессии генов BAX/BCL2 на 10% (p<0,05) ниже, чем до ишемии, что обусловлено более значительным увеличением экспрессии гена BCL2, чем гена BAX.
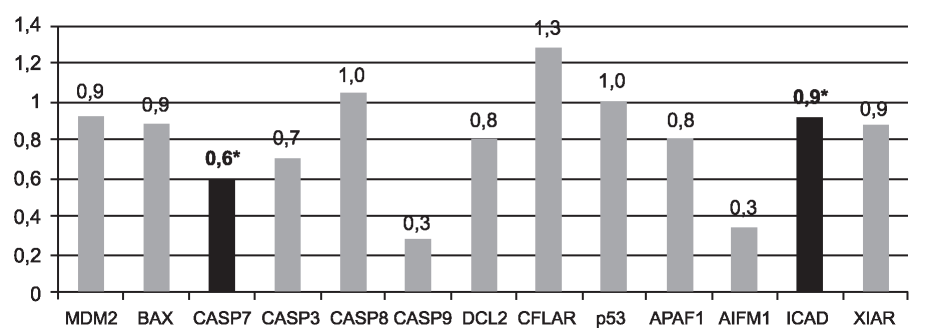
Рис. 1. Изменение экспрессии генов на 10-й минуте ишемии почки относительно состояния до ишемии. *Отмечены локусы, изменения в которых были статистически достоверны для p<0,05.
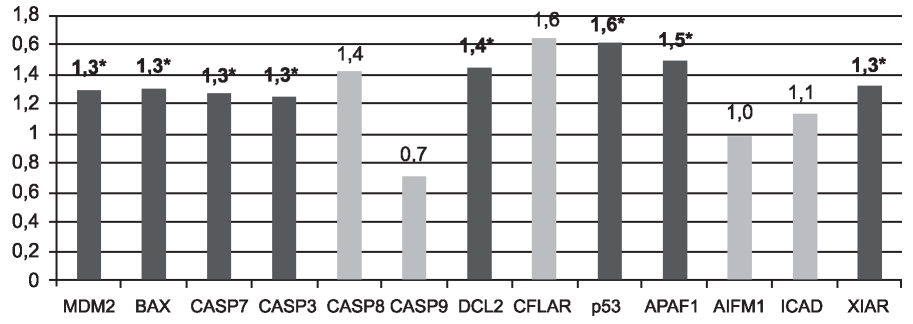
Рис. 2. Изменение относительной экспрессии генов через 20 мин после реперфузии почки относительно состояния до ишемии. *Отмечены локусы, изменения в которых были статистически достоверны для p< 0,05.
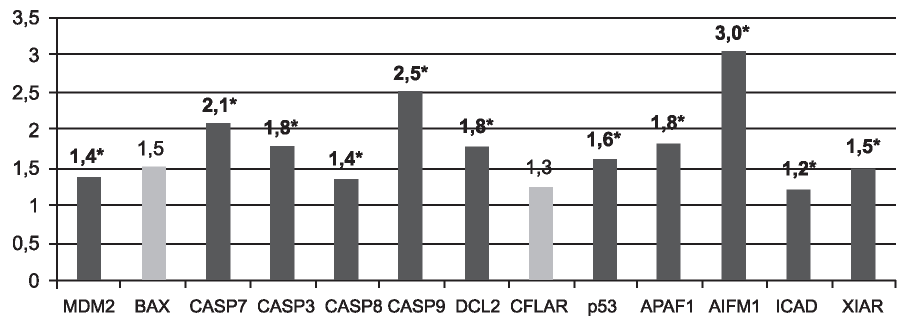
Рис. 3. Изменение относительной экспрессии генов через 20 мин после реперфузии почки относительно состояния на 10 минуте ишемии. *Отмечены локусы, изменения в которых были статистически достоверны для p<0,05.
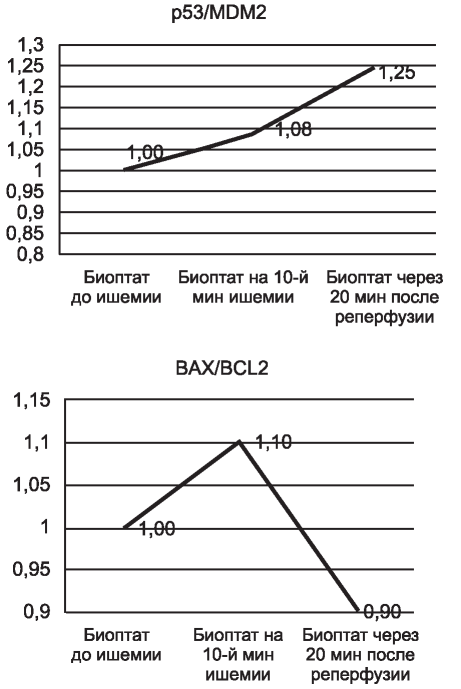
Рис. 4. Соотношение экспрессии пар про-/антиапоптозных генов p53/MDM2 и BAX/BCL2 до ишемии, на 10-й минуте ишемии и через 20 мин после восстановления кровотока в почке.
ОБСУЖДЕНИЕ
Отсутствие статистически достоверных изменений экспрессии большинства как про-, так и антиапоптозных кластеров генов во время проведения тепловой ишемии почки свидетельствует о том, что прекращение снабжения почки на 10 мин не создает необходимых условий для изменения транскрипционной активности исследованных генов, вовлеченных в регуляцию механизмов внутреннего и/или внешнего рецепторного путей апоптоза. Также нами не исключается возможность того, что для реализации каких-либо изменений необходим более длительный интервал времени (латентный период). Статистически значимое снижение экспрессии в данном временном диапазоне было отмечено для одной из эффекторных каспаз - каспазы-7, что можно охарактеризовать как ингибирование апоптоза, а также для антиапоптозного гена ICAD, участвующего в предотвращении фрагментации ДНК и конденсации хроматина.
Через 20 мин после восстановления кровотока (реперфузии), по сравнению с состоянием до проведения ишемии, наблюдается множественная активация транскрипции исследованных генетических локусов (см. рис. 2). Статистически значимо через 20 мин после реперфузии почки наблюдалась активация транскрипции генов, продукты которых вовлечены в регуляцию р53-зависимого пути апоптоза (MDM2 и р53), митохондриального пути апоптоза (продукт гена BAX образует олигомерные поры в митохондриальной мембране, что приводит к высвобождению цитохрома С, продукт гена APAF1, связываясь с цитохромом С и dATP, формирует апаптосому) и эффекторную часть каспазного каскада (гены эффекторной каспазы-3 и -7, CASP3 и 7). Также наблюдалось статистически достоверное увеличение экспрессии на 30% гена XIAP, основной функцией которого является ингибирование процесса апоптоза в клетках [15]. XIAP связывает и ингибирует каспазы-3, -7 и -9, таким образом, блокируя как внешний (рецепторный), так и внутренний (митохондриальный) пути апоп- тоза [16].
Пермеабилизация митохондриальной мембраны регулируется белками семейства BCL2 [17]. Встраивание в мембрану митохондрий белков BAX приводит к образованию пороподобных структур, а активация и функционирование BAX может блокироваться антиапоптотическим белком BCL-2 [18]. В нашем эксперименте через 20 мин после реперфузии почки в её тканях обнаружено статистически достоверное увеличение экспрессии гена BCL2 (превышающее увеличение экспрессии гена BAX), результатом чего может быть ингибирование митохондриального пути апоптоза.
p53 относится к генам-онкосупрессорам, но одной из важных функций продукта этого гена (белка p53) является активация белков репарации ДНК при её повреждении [19]. Существенное и статистически достоверное увеличение экспрессии этого белка в почечной ткани на этапе реперфузии может свидетельствовать об усилении процессов образования АФК и повреждении ДНК. С другой стороны - увеличение в почечной ткани пациентов экспрессии гена р53 может стимулировать экспрессию гена MDM2 [20]. Продукт гена MDM2 в свою очередь блокирует действие р53, связываясь с ним, убиквитинилирует его для последующей деградации протеасомой. Всё это в совокупности с активаций экспрессии гена XIAP и BCL2, вероятно, препятствует развитию апоптических процессов в данном временном интервале.
При сравнении транскриптомных характеристик исследуемых генов на 10-й минуте ишемии и через 20 мин после реперфузии наблюдаются более значительные отличия, чем при сравнении с состоянием до ишемии. Достоверно увеличивается экспрессия всех генов, за исключением BAX и CFLAR. Следует отметить значительное повышение экспрессии генов CASP8, CASP9 и AIFMI (см. рис. 3) и их важную роль в развитии апоптоза. Каспаза-8 - классическая инициирующая каспаза, участвующая в передаче сигнала от рецепторов апоптоза Fas, TNF-R1 и DR1-5 связывается с белком FADD и инициирует протеолитический каскад [21]. Каспаза-9 активирует каспазу-3, которая в свою очередь расщепляет прокаспазу-9, таким образом создается цикл амплификации апоптозного сигнала, при этом активация каспазы-9 сопровождается высвобождением модуля CARD, повышающего экспрессию антиапоптозных генов [22]. В результате индукции апоптоза белок AIFM1 перемещается в ядро, где он вызывает конденсацию и фрагментацию хромосом; кроме того, он индуцирует высвобождение митохондриями апоптогенного фактора цитохрома С [23].
При анализе соотношения экспрессии генов p53/MDM2 и BAX/BCL2 (см. рис. 4) необходимо учитывать тот факт, что экспрессия генов MDM2 и BCL2 значительно превышает экспрессию генов p53 и BAX на 48 и 71% (при сравнении относительно гена ACTB) соответственно. Однако обнаруженные изменения соотношений экспрессии отражают состояние баланса про/антиапоптозных систем в клетках почек, подвергнутых ишемии/ реперфузии. При этом наибольшее отклонение от состояния до ишемии характерно для системы p53/MDM2 через 20 мин после реперфузии. Это может объясняться накоплением повреждений в ДНК активными формами кислорода на стадии реперфузии, что вызывает повышение экспрессии гена p53 для активации репарационных процессов. Соотношение экспрессии генов BAX/BCL2 относительно состояния до ишемии изменяется менее значительно, наибольшее отличие в балансе BAX/BCL2 наблюдается между 10-й минутой ишемии и через 20 мин после реперфузии.
ЗАКЛЮЧЕНИЕ
В рамках проведенного нами исследования установлено, что ишемия и реперфузия оказывают разноплановый характер воздействия на уровень относительной экспрессии апоптозрегулирующих генетических локусов. В обоих случаях (ишемия и реперфузия) наблюдается почти синхронное угнетение (при ишемии) или активация (реперфузия) транскрипционной активности про-апоптозных и антиапоптозных генов. Это состояние сохраняющегося паттерна транскрипционной активности при различной модальности её направленности, вероятно, является характерным для состояния почечной ткани в ранний период после ишемии и восстановления в ней кровотока. Вероятность развития апоптоза по «митохондриальному пути» и по p53-индуцированному сигнальному пути является максимальным на 20-й минуте реперфузии. Какой именно из этих механизмов реализуется, будет зависеть от индивидуальных паттернов транскрипционной активности исследованных генов у каждого пациента.
Список литературы
1. Матвеев ВБ, Перлин ДВ, Фигурин КМ, Волкова МИ. Органосохраняющее лечение рака почки. Практ онкол 2005; (3):162-166 [Matveev VB, Perlin DV, Figurin KM, Volkova MI. Organosohranyayuschee lechenie raka pochki. Prakticheskaya onkologiya 2005; (3):162-166]
2. Смирнов АВ, Каюков ИГ, Добронравов ВА, Румянцев АШ. Острое повреждение почек: концептуальные проблемы. Нефрология 2014;18(2):8-24 [Smirnov AV, Kaiukov IG, Dobronravov VA, Rumyantsev ASh. Ostroe povrezhdenie pochek: kontceptualnye problemy. Nefrologiia 2014;18(2):8-24]
3. Liano F, Pascual J. Madrid acute renal failure study group. Epidemiology of acute renal failure: A prospective, multicenter, community-based study. Kidney Int 1996; (50): 811–818
4. Sheridan AM, Bonventre JV: Cell biology and molecular mechanisms of injury in ischemic acute renal failure. Curr Opin Nephrol Hypertens 2000; (9): 327–434
5. Zhang Y, Fu Z, Zhong Z et al. Hypothermic Machine Perfusion Decreases Renal Cell Apoptosis During Ischemia/Reperfusion Injury via the Ezrin/AKT Pathway. Artificial Organs 2015 doi: 10.1111/aor.12534
6. Burns AT, Davies DR, McLaren AJ et al: Apoptosis in ischemia/reperfusion injury of human renal allografts. Transplantation 1998;(66): 872–876
7. Becker F. Assessing the impact of ischemia time during partial nephrectomy. European Urology 2009; (56): 625–635
8. Tompson RH, Lane BR, Lohse CM et al: Renal function after partial nephrectomy: effect of warm ischemia relative to quantity and quality of preserved kidney. Urology 2012; 79(2): 356–360
9. Мосоян МС. Открытая, лапароскопическая и роботассистированная нефрэктомия при локализованном раке почки: что предпочесть? Нефрология 2014;18(6):76-81 [Mosoian MS. Otkrytaia, laparoskopicheskaia i robot-assistirovannaia nefrektomiia pri lokalizovannom rake pochki: chto predpochest? Nefrologia 2014;18(6):76-81]
10. Sims NR, Muyderman H. Mitochondria, oxidative metabolism and cell death in stroke. Biochimica et Biophysica Acta 2010; 1802 (1): 80–91 11. Eckardt K-U, Bernhardt WW, Weidemann A et al. Role of hypoxia in the pathogenesis of renal disease. Kidney Int 2005; 68:46–51
11. Chomczynski P, Sacchi N. The single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction: twenty-something years on. Nature Protocols 2006; 2: 581-585
12. Schmittgen TD, Livak KJ. Analyzing real-time PCR data by the comparative CT method. Nature Protocols 2008; 3: 1101-1108
13. Коган МИ, Чибичян МБ, Водолажский ДИ. Изменение экспрессии генетических локусов в мононуклеарной фракции периферической крови больных раком предстательной железы. Клин онкол 2012; 5: 59-60 [Kogan MI, Chibichyan MB, Vodolazhskii DI. Izmenenie ekspressii geneticheskih lokusov v mononuklearnoi fraktsii perifericheskoi krovi bol’nih rakom predstatel’noi zhelezi. Klinicheskaya onkologiya 2012; 5: 59-60]
14. Irmler M, Thome M, Hahne M et al. Inhibition of death receptor signals by cellular FLIP. Nature 1997; 388(6638):190-195
15. Liston P, Roy N, Tamai K et al. Suppression of apoptosis in mammalian cells by NAIP and a related family of IAP genes. Nature 1996; 379 (6563): 349–353
16. Deveraux QL, Reed JC. IAP family proteins – suppressors of apoptosis. Genes Dev 1999; 13 (3): 239–252
17. Marzo I, Brenner C, Zamzanii N. Bax and adenine nucleotide translocator cooperate in the mitochondrial control of apoptosis. Science 1998; 281: 2027-2031
18. Schendel SL, Azirnov R, Pawlowski K. Ion channel activity of the BH3 only Bcl2 family member, BID. J Biol Chem 1999; 274: 21932-21936
19. Lakin ND, Stephen PJ. Regulation of p53 in response to DNA damage. Oncogene 1999; 18(53): 7644-7655
20. Read AP, Strachan T. Human molecular genetics, 2nd ed. New York: Wiley, 1999
21. Мартынова ЕА. Регуляция активности каспаз в апоптозе. Биоорганическая химия 2003; 29(5): 518-543. [Martynova EA. Reguljacija aktivnosti kaspaz v apoptoze. Bioorganicheskaja himija 2003; 29(5): 518-543]
22. Ferreira P, Villanueva R, Martínez-Júlvez M et al. Structural insights into the coenzyme mediated monomer-dimer transition of the pro-apoptotic apoptosis inducing factor. Biochemistry 2014; 53 (25): 4204-4215
Об авторах
Д. С. КутилинРоссия
Денис Сергеевич Кутилин, кандидат биологических наук, старший научный сотрудник.
Лаборатория молекулярной онкологии
344037, г. Ростов-на-Дону, ул. 14-я линия, д. 63.
С. Н. Димитриади
Россия
Сергей Николаевич Димитриади, старший научный сотрудник, врач-уролог, доктор медицинских наук
Отделение онкоурологии
344037, г. Ростов-на-Дону, ул. 14-я линия, д. 63.
Д. И. Водолажский
Россия
Дмитрий Игоревич Водолажский, кандидат биологических наук.
Лаборатория молекулярной онкологии, руководитель
344037, г. Ростов-на-Дону, ул. 14-я линия, д. 63.
Е. М. Франциянц
Россия
Елена Михайловна Франциянц, доктор биологических наук.
Лаборатория изучения патогенеза злокачественных опухолей, руководитель
344037, г. Ростов-на-Дону, ул. 14-я линия, д. 63.
О. И. Кит
Россия
Профессор Олег Иванович Кит, доктор медицинских наук, директор.
344037, г. Ростов-на-Дону, ул. 14-я линия, д. 63.
Рецензия
Для цитирования:
Кутилин Д.С., Димитриади С.Н., Водолажский Д.И., Франциянц Е.М., Кит О.И. ВЛИЯНИЕ ТЕПЛОВОЙ ИШЕМИИ-РЕПЕРФУЗИИ НА ЭКСПРЕССИЮ АПОПТОЗ-РЕГУЛИРУЮЩИХ ГЕНОВ В ПОЧЕЧНОЙ ТКАНИ БОЛЬНЫХ С ПОЧЕЧНО-КЛЕТОЧНЫМ РАКОМ. Нефрология. 2017;21(1):80-86. https://doi.org/10.24884/1561-6274-2017-21-1-80-86
For citation:
Kutilin D.S., Dimitriadi S.N., Vodolazhsky D.I., Frantsiyants E.M., Kit O.I. EFFECT OF THERMAL ISCHEMIA-REPERFUSION ON EXPRESSION OF APOPTOSIS-REGULATING GENES IN THE RENAL TISSUE OF PATIENTS WITH RENAL CELL CARCINOMA. Nephrology (Saint-Petersburg). 2017;21(1):80-86. (In Russ.) https://doi.org/10.24884/1561-6274-2017-21-1-80-86
JATS XML








































