Перейти к:
ЧАСТОТА ВЫЯВЛЕНИЯ И ПРОГНОЗ АНТИТЕЛЬНООПОСРЕДОВАННОГО ОТТОРЖЕНИЯ ПРИ АЛЛОТРАНСПЛАНТАЦИИ ПОЧКИ
Аннотация
ЦЕЛЬ ИССЛЕДОВАНИЯ: определить частоту выявления и исходы антительно-опосредованного отторжения (AMR, antibody-mediated rejection) при рутинном морфологическом и иммунологическом мониторировании. ПАЦИЕНТЫ И МЕТОДЫ. В исследование вошли 55 реципиентов аллографта почки (АП) согласно критериям включения: совместимость с донором по группе крови, отрицательный цитотоксический кросс-матч-тест, как минимум, три биопсии АП. Все реципиенты получили стандартную иммуносупрессивную терапию: глюкокортикостероиды, базиликсимаб, ингибиторы кальциневрина, микофенолата мофетил. Пациентам выполняли протокольные биопсии (3, 6, 12 мес и далее ежегодно) и/или по показаниям: отсроченная функция АП, подъем креатинина ≥25%, протеинурия ≥1 г/сут или ее нарастание. Биопсии оценивали согласно критериям Banff 2013. Скрининг донор-специфических антител выполняли иммуноферментным анализом, а мониторинг – с помощью мультиплексного анализа Luminex (xMAP Technology). Терапия AMR включала глюкокортикостероиды, плазмаобмен, внутривенный иммуноглобулин, ритуксимаб, бортезомиб. Утрату функции АП и возврат на диализ учитывали как исход. Прогноз аллотрансплантации (АТП) оценивали на основе анализа выживаемости методом Каплана–Мейера. Медиана периода наблюдения от АТП составила 65 (47; 80) мес. РЕЗУЛЬТАТЫ. Морфологические признаки AMR были выявлены в 13% биопсий (n=390), а критерии AMR Banff 2013 – у 45% реципиентов (n=25) в разные сроки посттрансплантационного периода. Острое AMR (aAMR) регистрировали у 13 реципиентов, а хроническое активное (сAMR) – у 12. Субклиническим течение AMR было в 48% случаев. Персистенцию AMR выявили у 56% больных, а хронификацию – у 77%, несмотря на проводимую терапию. Кумулятивная выживаемость пациентов в общей группе за период наблюдения составила 94,5%, выживаемость АП – 79%. Выживаемость АП при AMR была ниже, чем у больных без AMR (73% и 100%, plog-rank=0,016). Различий в выживаемости АП в группах с аAMR и cAMR, а также с клиническим и субклиническим течением AMR выявлено не было. ЗАКЛЮЧЕНИЕ. AMR может быть распространенной и недооцениваемой клинической проблемой, связанной со снижением сроков функционирования АП и эффективности АТП в целом. Своевременное выявление и лечение этого типа иммунного конфликта требует рутинного проведения иммунологического и морфологического мониторинга.
Ключевые слова
Для цитирования:
Добронравов В.А., Храброва М.С., Мухаметдинова А.О., Сиповский В.Г. ЧАСТОТА ВЫЯВЛЕНИЯ И ПРОГНОЗ АНТИТЕЛЬНООПОСРЕДОВАННОГО ОТТОРЖЕНИЯ ПРИ АЛЛОТРАНСПЛАНТАЦИИ ПОЧКИ. Нефрология. 2016;20(6):82-89.
For citation:
Dobronravov V.A., Khrabrova M.S., Mukhametdinova A.O., Sipovskiy V.G. INCIDENCE AND PROGNOSIS OF ANTIBODY-MEDIATED REJECTION IN KIDNEY ALLOGRAFTS. Nephrology (Saint-Petersburg). 2016;20(6):82-89. (In Russ.)
ВВЕДЕНИЕ
В соответствии с Banff 2013 [1] диагноз антительно-опосредованного отторжения (AMR, antibody-mediated rejection), одного из основных факторов потери аллографта почки (АП) [2, 3], может быть установлен только при выполнении морфологического исследования. В большинстве исследований частота выявления AMR низкая (410%) [2, 4, 5]. Однако эти данные могут не полностью отражать истинную ситуацию по распространенности AMR, поскольку основаны на результатах индикационных биопсий. В подтверждение представлено несколько работ, в которых по данным протокольных биопсий АП частота выявления отторжения значительно выше (18-40%) [6-9]. Целью исследования было определить частоту выявления AMR при рутинном морфологическом и иммунологическом мониторировании и его исходы у пациентов, получивших стандартную иммуносупрессивную терапию (ИСТ).
ПАЦИЕНТЫ И МЕТОДЫ
Исследуемая группа пациентов.
В исследование были включены 55 пациентов, которым была выполнена аллогенная трансплантация почки в НИИ нефрологии ПСПбГМУ им. акад. И.П. Павлова в 2007-2012 гг. Критериями включения были: совместимость с донором по группе крови, отрицательный цитотоксический кросс-матч-тест и, как минимум, три биопсии АП. Основные клинико-демографические показатели исследуемой группы (n=55) представлены в табл. 1.
Морфологический и иммунологический мониторинг.
В соответствии с программой морфологического мониторинга состояния АП всем пациентам выполняли протокольные биопсии (3, 6, 12 мес после АТП и далее ежегодно). Показаниями к выполнению индикационных биопсий (в промежутки между протокольными) были: отсроченная функция АП, нарастание креатинина сыворотки крови ≥25% от предыдущего уровня, появление протеинурии ≥1 г/сут или ее нарастание на 50%, а также морфологический контроль проведенной терапии Т-клеточного и В-клеточного отторжения. Биопсии трансплантата выполняли под контролем сонографии в В-режиме с цветовым картированием и контролем биопсийного канала иглой для пункции 18G.
Морфологический анализ. Для светооптического исследования 4 мкм серийные срезы биоптата окрашивали гематоксилином и эозином, реактивом Шиффа (PAS), трихромальной окраской. Выраженность морфологических изменений АП оценивали в соответствии с Banff 2013 [1]. Персистирующим гуморальное отторжение считали при наличии гломерулита и/или перитубулярного капиллярита (рис. 1) в следующей биопсии, выполненной в срок >5 нед после первой с признаками AMR. Иммунофлюоресцентное исследование С4d в перитубулярных капиллярах (C4d- ptc) выполняли на замороженных срезах с FITC- мечеными моноклональными антителами.
Таблица 1
Основные клинико-демографические показатели в исследуемой группе
Показатель | Пациенты (n=55) |
|---|---|
Пол, Ж/М | 29/26 |
Возраст реципиента, годы, M±SD | 35±12 |
Возраст донора, годы, M±SD | 44±10 |
АТП от живого донора, % | 36 |
Повторная АТП, % | 3,6 |
Продолжительность ЗПТ, мес, m (25-75%) | 10 (5;35) |
HLA mismatch, m (25-75%) | 5(3;5) |
HLA mismatch>3, % | 87,3 |
ПРА перед АТП, % | 7,2 |
ВХИ, мин, M±SD | 463±378 |
ВТИ, мин, M±SD | 65±29 |
Отсроченная функция АП, % | 45 |
Примечание. АП - аллографт почки; АТП - аллотрансплантация почки; ВХИ - время холодовой ишемии; ВТИ - время тепловой ишемии; ЗПТ - заместительная почечная терапия; ПРА - предсуществующие антитела; HLA mismatch - несовпадение по локусам системы генов HLA.
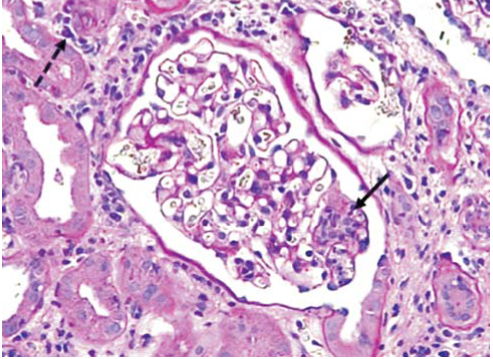
Рис. 1. Морфологические проявления антительно-опосредованного отторжения: микроваскулярное воспаление аллографта почки. Сплошная стрелка - гломерулит; пунктирная стрелка - перитубулярный капиллярит. Окраска ШИК (реактив Шиффа). Ув. X100.
Иммунологический анализ. Количество несовпадений по системе генов HLA (HLA mismatch) стандартно определяли при типировании донора и реципиента по локусам A, B, DR, а в 20% случаев (n=11) было выполнено типирование по локусам HLA C, -DQ, -DP. Предсуществующие антитела (ПРА) определяли иммуноферментным анализом (ИФА). Скрининг ДСА выполняли ИФА, а последующий контроль при ДСА-позитивности, рутинный мониторинг, а также в случае выявления морфологических признаков AMR при отрицательном результате ИФА - с помощью мультиплексного анализа Luminex (xMAP Technology). Реакцию на ДСА (Luminex) считали позитивной при средней интенсивности флюоресценции (MFI, mean fluorescence intensity) ≥ 500.
Иммуносупрессивная терапия и терапия отторжения.
Индукционная и базисная терапия у всех пациентов включала пульсовое введение глюкокортикостероидов (ГКС), анти-CD25 моноклональное антитело (базиликсимаб), ингибиторы кальциневрина и микофенолата мофетил (ММФ). В связи с высоким уровнем сенсибилизации двум пациентам (ПРА 67 и 25%) перед АТП был выполнен плазмаобмен (ПО) и введен внутривенный иммуноглобулин (ВВИГ). При первичном выявлении AMR проводили лечение ГКС (500-250-125 мг внутривенно с переходом на пероральный прием 0,5 мг/кг и снижением до поддерживающей дозы в течение 2 нед) в сочетании с ПО (с замещением 1-1,5 объема циркулирующей плазмы; № 3-6 с интервалом 2-3 дня) и введением ВВИГ в суммарной дозе 1 г/кг массы. Если пациент получал циклоспорин А, выполняли конверсию на такролимус. При сохраняющихся признаках AMR по данным иммуноморфологического контроля продолжали терапию ПО и ВВИГ с присоединением анти-CD20-агента (ритуксимаб) однократно в дозировке 375 мг/м2. В случае персистенции МВВ и ДСА выполняли повторное введение ритуксимаба и/или проводили курсы бортезомиба (1,3 мг/м2 2-кратно с интервалом 2 нед). При отсутствии признаков активности AMR при контрольной биопсии продолжали рутинный клинико-морфологический и иммунологический мониторинг.
Исходы и клинические показатели.
На момент биопсии с отторжением оценивали клинические признаки дисфункции АП: суточную протеинурию, креатинин и расчётную СКФскв EPI. Окончанием периода наблюдения считалась дата последнего морфологического исследования для пациентов без AMR и дата последнего клинического обследования для пациентов с AMR. Исходом считали полную потерю функции АП и возврат на диализ.
Статистический анализ.
Для анализа различий между оцениваемыми параметрами в группах применялись критерий χ2, точный тест Фишера, t-критерий, критерий Манна-Уитни. Для анализа выживаемости был использован метод Каплана-Мейера. Статистическую значимость различий между кривыми выживаемости оценивали с помощью Log-rank-теста. При анализе выживаемости АП случаи потери трансплантата не по причине отторжения (n=3: рецидив фокально-сегментарного гломеруло- склероза, стеноз артерии трансплантата, апосте- матозный пиелонефрит) учитывали как цензурированные наблюдения. Достоверными различия считали при значениях p<0,05. Обработку данных производили с помощью пакетов программ прикладного статистического анализа (XLSTAT 2016 for Windows для анализа кумулятивной частоты, Statistica 8.0 для анализа остальных данных). Данные представлены в виде среднего значения и стандартного отклонения (M±SD) или среднего значения и стандартной ошибки среднего (M±SEM) и в виде медианы и интерквартильного интервала [m (25-75%)].
РЕЗУЛЬТАТЫ
Распространенность и структура антительно-опосредованного отторжения.
Медиана периода наблюдения от трансплантации до конца наблюдения составила 65 (47; 80) мес. Признаки AMR были выявлены в 13% от всех выполненных (индикационных и протокольных) биопсий (n=390). В результате диагноз AMR был установлен в те или иные сроки посттрансплантационного периода у 45% реципиентов (n=25). Кумулятивная частота AMR в исследуемой группе равномерно нарастала, достигнув 76% к 100 мес после АТП (рис. 2).
Таблица 2
Основные клинико-демографические показатели в исследуемых группах
Показатель | AMR- (n=30) | AMR+ (n=25) | p AMR+ vs AMR- | eAMR (n=13) | cAMR (n=12) | P aAMR и cAMR |
|---|---|---|---|---|---|---|
Пол, Ж/М | 18/12 | 11/14 | 0,181 | 5/8 | 6/6 | 0,43 |
Возраст реципиента, годы, M±SD | 36±12 | 34±11 | 0,691 | 32±9 | 40±13 | 0,115 |
Возраст донора, годы, M±SD | 43±9 | 44±11 | 0,706 | 44±13 | 44±9 | 0,589 |
АТП от живого донора, % | 40 | 32 | 0,371 | 38 | 33 | 0,387 |
Повторная АТП, % | 0 | 8 | 0,202 | 15 | 0 | 0,26 |
Продолжительность ЗПТ, мес, m (25-75%) | 9,5 (4;36) | 10 (6;24) | 0,852 | 11 (6;24) | 10 (6;31,5) | 0,849 |
HLA mismatch, m (25-75%) | 5(3;6) | 4(3;5) | 0,214 | 4(2;5) | 4(3;5) | 0,744 |
HLA mismatch>3, % | 90 | 84 | NS | 69 | 100 | NS |
Наличие ПРА перед АТП, % | 3,3 | 12 | 0,239 | 23 | 0 | 0,124 |
ВХИ, мин, M±SD | 438±358 | 493±407 | 0,726 | 416±377 | 578±438 | 0,242 |
ВТИ, мин, M±SD | 71±31 | 58±24 | 0,057 | 54±24 | 62±25 | 0,325 |
Отсроченная функция АП, % | 43 | 48 | 0,72 | 31 | 67 | 0,07 |
Примечание. AMR - антительно-опосредованное отторжение (antibody-mediated rejection); aAMR - острое антительно- опосредованное отторжение; cAMR - хроническое активное антительно-опосредованное отторжение; HLA mismatch - несовпадение по локусам системы генов HLA; NS - статистически незначимые различия (not significant); АТП - аллотрансплантация почки; АП - аллографт почки; ВХИ - время холодовой ишемии; ВТИ - время тепловой ишемии; ЗПТ - заместительная почечная терапия; ПРА - предсуществующие антитела.
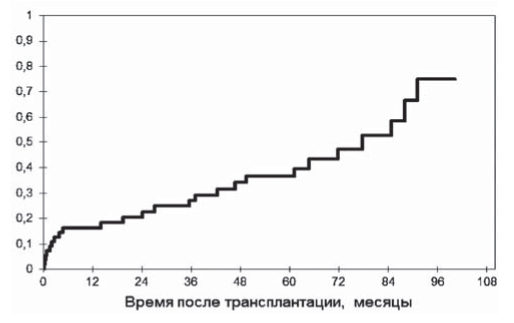
Рис. 2. Кумулятивная частота развития антительно- опосредованного отторжения у реципиентов аллографта почки (n=55). AMR - антительно-опосредованное отторжение (antibody-mediated rejection).
У 13 реципиентов АП имели место морфологические признаки острого AMR (aAMR), а у 12 - AMR впервые выявлено уже с признаками хронификации в виде развития гломерулопатии (ГП) (хроническое активное AMR; cAMR). По основным клинико-демографическим показателям предтрансплантационного периода пациенты с AMR не отличались от пациентов без гуморального отторжения, как и группы aAMR и сAMR (табл. 2).
Микроваскулярное воспаление (МВВ), основное морфологическое проявление AMR, в большинстве случаев было представлено сочетанным поражением капилляров клубочка и интерстиция (см. рис. 1). Случаи изолированных гломерулита или перитубулярного капиллярита находили значительно реже (табл. 3). Хроническое активное гуморальное отторжение закономерно регистрировали в более поздние сроки после АТП, чем острое AMR (55 (35;78) мес и 3 (1;14) мес, соответственно, p<0,001). В группе cAMR выраженность интерстициального фиброза и тубулярной атрофии была закономерно выше. Среднее значение балла Banff для ГП в группе cAMR составило 1,33±0,19. Отложения C4d-ptc достоверно чаще выявляли при aAMR, чем при cAMR (84 и 42%, p=0,013). По другим морфологическим и клиническим показателям, указанным в табл. 3, группы aAMR и cAMR достоверно не отличались.
Персистенцию МВВ в последующей биопсии регистрировали в 56% случаев AMR (табл.3). В группе aAMR в 77% случаев определяли хронификацию процесса, несмотря на проводимую терапию. Медиана периода от момента диагностики aAMR до выявления ГП при последующем морфологическом исследовании составила 13 (10; 22) мес. Кумулятивная частота выявления ГП в биоптатах АП представлена на рис. 3.
Предсуществующие ДСА регистрировали у 9 пациентов, а сформировавшиеся de novo - у 16. Из 9 случаев предсуществующих ДСА 4 были к анти-HLA-антителам I класса, 5 - к анти-HLA- антителам II класса. У 5 пациентов регистрировали de novo ДСА к I классу, у 8 - ко II классу (в том числе анти-HLA-DQ ДСА у трех пациентов), у 2 пациентов - к обоим классам анти-HLA-антител. У одного пациента были обнаружены de novo анти-MICA-антитела.
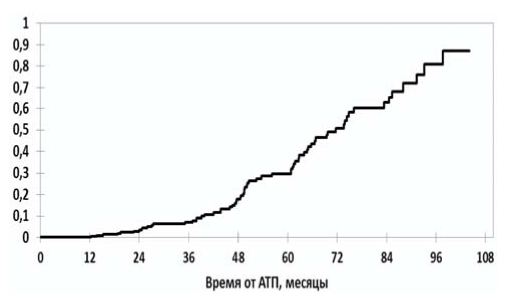
Рис. 3. Кумулятивная частота выявления гломерулопатии в биоптатах аллографта почки (n=390). АТП - аллотрансплантация почки.
Таблица 3
Клинико-морфологические параметры у пациентов с антительно-опосредованным отторжением
Клинические параметры | Все случаи AMR (n=25) |
|---|---|
Среднее число биопсий на пациента, M±SD | 8±3 |
AMR с клиническими проявлениями, % | 52 |
Время от АТП до выполнения биопсии c AMR, мес, m (25-75%) | 27 (3;61) |
Раннее (до 1 года)/позднее (более 1 года после АТП), n/n | 9/16 |
СКФ CKD-EPI, мл/мин/1,73 м2, M±SD | 36±15 |
Протеинурия, г/сут, m (25-75%) | 0,3 (0,1; 0,9) |
Морфологические параметры |
|
Гломерулит (g), баллы по Banff, M±SEM | 1,9±0,24 |
Перитубулярный капиллярит (ptc), баллы по Banff, M±SEM | 1,3±0,18 |
ИФТА, баллы по Banff, M±SEM* | 1,2±0,15 |
C4d-ptc, баллы по Banff, M±SEM | 1,3±0,23 |
C4d-ptc позитивность, % | 64 |
МВВ (g+ptc)/только g /только ptc, % | 64/20/16 |
Персистенция МВВ в следующей биопсии, % | 56 |
В сочетании с Т-клеточным отторжением, % | 16 |
Примечание. АТП - аллотрансплантация почки; ИФТА* - интерстициальный фиброз и тубулярная атрофия (среднее значение баллов по Banff); МВВ - микроваскулярное воспаление; СКФ - скорость клубочковой фильтрации; AMR - антительно- опосредованное отторжение (antibody-mediated rejection); С4d-ptc - результат реакции иммуногистохимии на С4d в перитубулярных капиллярах; g (glomerulitis) - гломерулит; M±SEM - среднее ± стандартная ошибка среднего; n/n - количество случаев, имеющих признак/количество случаев без признака; ptc (peritubular capillaritis) - перитубулярный капиллярит.
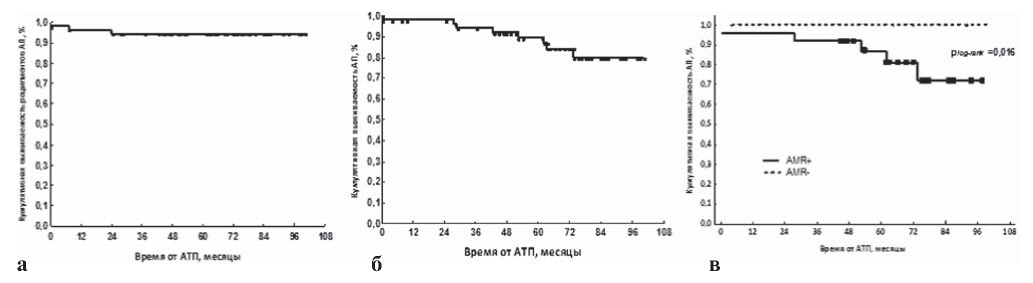
Рис. 4. а - выживаемость реципиентов АП (n=55); б - выживаемость АП в общей группе (n=55); в - выживаемость АП в группах с/без AMR. АП - аллографт почки; АТП - аллотрансплантация почки; AMR - антительно-опосредованное отторжение.
Терапия AMR в группах aAMR и сAMR достоверно не отличалась, ритуксимаб получили 38% пациентов с aAMR и 33% с cAMR, а бортезомиб - 15 и 25% соответственно.
Выживаемость пациентов и аллографта почки.
9-летняя кумулятивная выживаемость пациентов составила 94,5% (рис. 4а), а выживаемость АП - 79 % (см. рис. 4б). 9-летняя выживаемость АП у пациентов с AMR была ожидаемо ниже 73% (см. рис. 4в). Различий в выживаемости АП в подгруппах aAMR и cAMR ((plog-rank=0,1), так же как и между подгруппами клинического/субклинического течения AMR (plog-rank=0,1), не выявили. Случаев потери АП у пациентов с C4d-ptc-негативным гуморальным отторжением не было (plog-rank=0,038). Кумулятивная выживаемость АП при наличии ГП была достоверно ниже (plog-rank=0,018), чем при отсутствии этого вида хронического повреждения, и за весь период наблюдения составила 72%.
ОБСУЖДЕНИЕ
Суждения о развитии той или иной степени иммунного конфликта лежат в основе представления об аллогенной трансплантации, когда формирование иммунных реакций возникает вследствие выраженного полиморфизма системы HLA, определяющего несовпадения по ее локусам у подавляющей пропорции реципиентов АП.
AMR является грозным осложнением посттрансплантационного периода, зачастую приводя к потери АП при сверхостром или остром течении. Эти риски на практике заложены в определение совместимости цитотоксическим кросс-матч-тестом, положительная реакция которого рассматривается как стандартное противопоказание к АТП, поскольку в отсутствие превентивных мер практически всегда сопровождается развитием острого или сверхострого течения отторжения по гуморальному типу и потерей трансплантированного органа.
В течение длительного периода времени существовало весьма спокойное отношение к развитию реакций отторжения, которое стимулировалось очевидным улучшением ближайших результатов (снижением частоты и клинической значимости отторжений в раннем посттрансплантационном периоде на фоне введения в широкую клиническую практику ингибиторов кальцинев- рина, ММФ и деплетирующих агентов) [10, 11].
Основу для такого подхода создает распространенная терминология, которая упрощает представления о сути иммунологического конфликта, сводя к общему термину «отторжение» без уточнения его механизмов, делая ведение «отторжения», основанное на эмпирической клинической диагностике и лечении, неоправданным и губительным для трансплантата.
Вместе с тем, очевидно существование по крайней мере 2 архетипов отторжения - опосредованного преимущественно Т- и В-лимфоцитами (клеточное и гуморальное соответственно). Более того, в пределах каждого могут быть выделены различные клинико-морфологические фенотипы, имеющие разное прогностическое значение [5, 12-14]. В клинической практике под отторжением зачастую понимают ситуацию с клиническими проявлениями в виде развития дисфункции АП. Однако также очевидно, что за исключением острых вариантов могут существовать и более медленно развивающиеся случаи иммунного конфликта, протекающие субклинически до тех пор, пока объем повреждения за счет клеточной инфильтрации, МВВ и фиброза не достигнет критического [13].
В представляемом исследовании внимание было сфокусировано на клинических и субкли- нических вариантах AMR, возникающих у реципиентов АП с отрицательным цитотоксическим кросс-матч-тестом и низким уровнем предсуществующих анти-HLA-антител. Примененный подход представлял собой тщательный иммунологический и морфологический мониторинг с контролем анти-HLA-антител и выполнением протокольных исследований АП, помимо биопсий со стандартными клиническими показаниями.
Во-первых, нами было установлена неожиданно высокая частота развития AMR - почти у половины реципиентов АП выявлены признаки этого типа отторжения в те или иные сроки посттрансплантационного периода. Почти при каждом седьмом морфологическом исследовании АП, большинство из которых составили протокольные биопсии, выявляли признаки МВВ - типичного проявления AMR. Эти данные находятся в соответствии с наблюдениями других, немногочисленных исследований, в которых для поиска AMR были использованы аналогичные подходы [9, 13, 15]. Напротив, в исследованиях с анализом морфологических данных на основе выполненных по клиническим показаниям биопсий АП частота AMR составляет от 3 до 18% [2, 5, 8] и, на наш взгляд, является существенно заниженной за счет выпадения субклинических случаев и случаев с минимальными клиническими проявлениями.
AMR - явно неоднородное состояние, а суть поиска стратегий эффективного ведения, сводится к необходимости стратификации, основанной на клинических, морфологических и молекулярногенетических подходах [16, 17]. В рамках выявленных случаев AMR очевидно наличие, по крайней мере, двух клинико-иммуноморфологических фенотипов. Один из них - острый, чаще выявляемый в индикационных биопсиях в виде МВВ, в более ранние сроки пострансплантационного периода и, как правило, сопровождающийся снижением функции АП, депозитами C4d-ptc. Другой вариант AMR, наблюдавшийся нами, может быть охарактеризован как «первично хронический». В этом случае морфологические проявления активно текущего AMR с поражением микроциркуляции АП сопровождались очевидными признаками хронификации в виде ГП, несмотря на отсутствие острых, клинически значимых эпизодов в прошлом. Такие субклинические изменения выявляли в достоверно более поздние сроки после АТП в сравнении с острым AMR [55 (35;78) мес и 3 (1; 14) мес], зачастую без классической депозиции C4d-ptc. Механизмы формирования ГП могут быть связаны с постоянным воздействием небольших концентраций ДСА на аллографт в течение всего посттрансплантационного периода, приводящим к расщеплению базальной мембраны и экспансии lamina rara intema с субэндотелиальной депозицией материала, включающего иммунные комплексы при потере способности эндотелия к аккомодации [13, 18, 19].
МВВ, основное морфологическое проявление AMR, в большинстве случаев было представлено сочетанным поражением капилляров клубочка и интерстиция. В некоторых случаях находили изолированное поражение капилляров интерстиция или клубочка. Прогностическое значение последнего нуждается в уточнении, однако ряд данных указывают на то, что гломерулит, включая его изолированные формы, может иметь более важное значение для выживаемости АП, требуя своевременной верификации и соответствующей настороженности [20, 21].
В целом, AMR, безусловно, связано с резким ухудшением прогноза выживаемости АП, в то время как значение Т-клеточного отторжения не столь очевидно и остается предметом дискуссий [2, 22]. Полученные нами при длительном наблюдении реципиентов АП исследованной группы данные полностью подтверждают такие представления. При 9-летней выживаемости АП в общей группе, составившей 79%, Т-клеточное отторжение не было причиной потери АП ни в одном случае. В то же время, кумулятивная выживаемость АП при развитии AMR была достоверно более низкой. Приведенные наблюдения позволяют считать причиной потери АП при AMR отчетливую склонность к персистированию и хронификации, несмотря на достаточно агрессивную терапию, направленную на основные патогенетические механизмы этого типа отторжения [13, 14, 23-25]. Вместе с тем, следует учесть, что выживаемость АП при ГП составила 72% за 9-летний период, что сравнимо с данными эталонных международных обсервационных исследований [26] и отечественных данных [27] для неселекционированных по наличию отторжения групп реципиентов АП. Это является косвенным свидетельством того, что настойчивое лечение, включавшее элиминацию циркулирующих анти-HLA-антител, контроль Т- и В-клеточных иммунных реакций, угнетение популяции плазмацитов, может приводить к улучшению прогноза таких больных и повышать эффективность АТП. Подтверждение таких предположений нуждается в проведении контролируемых исследований.
Более радикальным подходом в будущем может быть стратегия выявления реципиентов с повышенным риском, основанная на поиске и идентификации факторов прогноза развития разных фенотипов AMR [21] и проведения превентивной терапии, эффективность которой уже продемонстрирована на примере АВО-несовместимых АП [23].
Ограничениями исследования являются относительно небольшое число реципиентов АП, а также отсутствие предтрансплантационного типирования HLA по всем локусам, что могло занизить данные о частоте отторжения. Об этом свидетельствует выявление у некоторых реципиентов анти-HLA-антител, направленных к нетипируемым в рутинной трансплантационной практике локусов DP, DQ, C, а также MICA. Примененный подход с регулярным морфологическим и иммунологическим мониторингом относится к сильным сторонам исследования и в настоящее время применяется лишь в единичных трансплантационных центрах [9, 13, 14].
ЗАКЛЮЧЕНИЕ
Представленные данные определенно указывают на то, что AMR может быть распространенной и недооцениваемой проблемой, связанной со снижением сроков функционирования АП и эффективности АТП, в целом. Своевременное выявление и лечение этого типа иммунного конфликта требует рутинного проведения иммунологического и морфологического мониторинга.
Список литературы
1. Haas M, Sis B, Racusen LC et al. Banff 2013 Meeting Report: Inclusion of C4d-negative antibody-mediated rejection and antibody-associated arterial lesions. Am J Transplant 2014; 14 (2): 272-283
2. Lefaucheur C, Loupy A, Vernerey D et al. Antibody mediated vascular rejection of kidney allografts: a population-based study. Lancet 2013; 9863: 313-319
3. Orandi BJ, Chow EH, Hsu A et al. Quantifying renal allograft loss following early antibody-mediated rejection. Am J Transplant 2015; 15 (2): 489-498
4. Lionaki S, Panagiotellis K, Iniotaki A et al. Incidence and clinical significance of de novo donor specific antibodies after kidney transplantation. Clin Dev Immunol 2013; 2013: http://www. hindawi.com/journals/jir/2013/849835
5. Dorje C, Midtvedt K, Holdaas H et al. Early versus late acute antibody-mediated rejection in renal transplant recipients. Transplantation 2013; 96 (1): 79-84
6. Bohmig GA, Regele H, Horl WH. Protocol biopsies after kidney transplantation. Transpl Int 2005; 18 (2): 131-139
7. Yamamoto T, Watarai Y, Takeda A et al. De Novo Anti-HLA DSA Characteristics and Subclinical Antibody-Mediated Kidney Allograft Injury. Transplantation 2015; Epub ahead of print
8. Sellares J, de Freitas DG, Mengel M et al. Understanding the causes of kidney transplant failure: the dominant role of antibody-mediated rejection and nonadherence. Am J Transplant 2012; 12 (2): 388-399
9. Loupy A, Vernerey D, Tinel CJ et al. Subclinical Rejection Phenotypes at 1 Year Post-Transplant and Outcome of Kidney Allografts. Am Soc Nephrol 2015; 26 (7): 1721-1731
10. Woodroffe R, Yao GL, Meads C et al. Clinical and costeffectiveness of newer immunosuppressive regimens in renal transplantation: a systematic review and modelling study. Health Technol Assess 2005; 9 (21): 1-179, iii-iv
11. Kyriakides G, Miller J. Use of cyclosporine in renal transplantation. Transplant Proc 2004; 36 (2 Suppl):167S-172S
12. Einecke G, Sis B, Reeve J et al. Antibody-mediated mi crocirculation injury is the major cause of late kidney transplant failure. Am J Transplant 2009; 9 (11): 2520-2531
13. Wiebe C, Gibson IW, Blydt-Hansen TD et al. Evolution and clinical pathologic correlations of de novo donor-specific HLA antibody post kidney transplant. Am J Transplant 2012; 12 (5): 1157-1167
14. Papadimitriou JC, Drachenberg CB, Ramos E et al. Antibody-mediated allograft rejection: morphologic spectrum and serologic correlations in surveillance and for cause biopsies. Transplantation 2013; 95 (1): 128-136
15. Yamanaga S, Watarai Y, Yamamoto T et al. Frequent development of subclinical chronic antibody-mediated rejection within 1 year after renaltransplantation with pre-transplant positive donor-specific antibodies and negative CDC crossmatches. Hum Immunol 2013; 74 (9): 1111-1118
16. Halloran PF, Merino Lopez M, Barreto Pereira A.. Identifying subphenotypes of antibody-mediated rejection in kidney transolants. Am J Transplant 2016; 16 (3): 908-920
17. Halloran PF, Famulski KS, Chang J. A probabilistic approach to histologic diagnosis of antibody-mediated rejection in kidney transplant biopsies. Am J Transplant 2016; Jun 24: Epub ahead of print
18. Fotheringham J, Angel CA, McKane W. Transplant glomerulopathy: morphology, associations and mechanism. Nephron Clin Pract 2009; 113 (1): c1-7
19. Drachenberg CB, Papadimitriou JC. Endothelial injury in renal antibody-mediated allograft rejection: a systematic view based on pathogenesis. Transplantation 2013; 95 (9):1073-1083
20. Nabokow A, Dobronravov VA, Khrabrova M et al. Longterm kidney allograft survival in patients with transplant glomerulitis. Transplantation 2015; 99 (2): 331-339
21. Храброва МС, Добронравов ВА, Набоков АВ и др. Микроваскулярное воспаление как прогностический фактор при трансплантации почки. Нефрология 2015; 19 (5): 34-41 [Khrabrova MS, Dobronravov VA, Nabokov AV i dr. Mikrovaskulyarnoe vospalenie kak prognosticheskiy factor pri transplantacii pochki. Nefrologiya 2015; 19 (5): 34-41]
22. Naesens M, Kuypers DR, De Vusser K et al. The histology of kidney transplant failure: a long-term follow-up study. Transplantation 2014; 98 (4): 427-435
23. Bagnasco SM, Zachary AA, Racusen LC et al. Time course of pathologic changes in kidney allografts of positive crossmatch HLA-incompatible transplant recipients. Transplantation 2014; 97 (4): 440-445
24. Tsuji T, Yanai M, Itami H et al. Microvascular inflammation in early protocol biopsies of renal allografts in cases of chronic active antibody-mediated rejection. Nephrology (Carlton) 2015; 20 Suppl 2: 26-30
25. Miura M, Harada H, Fukasawa Y et al. Long-term histopathology of allografts in sensitized kidney recipients. Clin Transplant 2012; 26 Suppl 24: 32-36
26. Collaborative Transplant Study [Электронный ресурс]. Режим доступа: http://www.ctstransplant.org/public/graphics/ sample.shtml
27. Бикбов БТ, Томилина НА. Заместительная терапия больных с хронической почечной недостаточностью методами перитонеального диализа и трансплантации почки в Российской Федерации в 1998-2011 г. (Отчет по данным Российского регистра заместительной почечной терапии. Часть вторая). Нефрология и диализ 2014; 16 (2): 192-227 [Bikbov BT, Tomilina NA. Zamestitelnaya terapiya bolnich s khronicheskoy pochechnoy nedostatochnostiu metodami peritonealnogo dializa i transplantacii pochki v Rossiyskoy Federacii v 1998-2011 g. (Otchet po dannim Rossiyskogo registra zamestitelnoy pochechnoy terapii. Chast vtoraya). Nefrologiya i dializ 2014; 16 (2): 192-227]
Об авторах
В. А. ДобронравовРоссия
Профессор Добронравов Владимир Александрович, доктор медицинских наук
Научно-исследовательский институт нефрологии.
197022, Россия, Санкт-Петербург, ул. Л. Толстого, д. 17.
М. С. Храброва
Россия
Храброва Мария Сергеевна, кандидат медицинских наук.
Кафедра пропедевтики внутренних болезней, ассистент.
197022, Россия, Санкт-Петербург, ул. Л. Толстого, д. 17, корп. 54
А. О. Мухаметдинова
Россия
Мухаметдинова Анастасия Олеговна. Кафедра пропедевтики внутренних болезней.
197022, Россия, Санкт-Петербург, ул. Л. Толстого, д. 6/8.
В. Г. Сиповский
Россия
Доцент Сиповский Василий Георгиевич, кандидат медицинских наук.
Научно-исследовательский институт нефрологии.
197022, Россия, Санкт-Петербург, ул. Л. Толстого, д. 6/8.
Рецензия
Для цитирования:
Добронравов В.А., Храброва М.С., Мухаметдинова А.О., Сиповский В.Г. ЧАСТОТА ВЫЯВЛЕНИЯ И ПРОГНОЗ АНТИТЕЛЬНООПОСРЕДОВАННОГО ОТТОРЖЕНИЯ ПРИ АЛЛОТРАНСПЛАНТАЦИИ ПОЧКИ. Нефрология. 2016;20(6):82-89.
For citation:
Dobronravov V.A., Khrabrova M.S., Mukhametdinova A.O., Sipovskiy V.G. INCIDENCE AND PROGNOSIS OF ANTIBODY-MEDIATED REJECTION IN KIDNEY ALLOGRAFTS. Nephrology (Saint-Petersburg). 2016;20(6):82-89. (In Russ.)
JATS XML








































