Перейти к:
ОЦЕНКА УРОВНЕЙ НЕФРИНА И ПОДОЦИНА В МОЧЕ У БОЛЬНЫХ С САХАРНЫМ ДИАБЕТОМ
https://doi.org/10.24884/1561-6274-2017-21-2-33-40
Аннотация
ЦЕЛЬ: определить величину экскреции с мочой маркеров подоцитарного повреждения и уточнить их значение для ранней диагностики диабетической нефропатии (ДН) у больных с сахарным диабетом (СД) с разной выраженностью альбуминурии/протеинурии. ПАЦИЕНТЫ И МЕТОДЫ. Обследовано 74 больных с СД (30 СД 1 и 44 СД 2 типа), которые были разделены на 3 группы: I группа (n=41) – с альбуминурией (АУ) <30 мг/г креатинина мочи (A1), II группа (n=13) – с АУ 30–300 мг/г (А2), III группа (n=20) – с протеинурией (ПУ). ХБП-С1 выявлена у 41 пациента, ХБП-С2 у 25, ХБП-С3 у 8 человек. Артериальная гипертензия наблюдалась у 52 из 74 (70%) обследованных, преимущественно при СД2. Контроль – 10 здоровых. В моче иммуноферментным методом определены уровни структурных белков подоцитов – нефрина и подоцина. РЕЗУЛЬТАТЫ. Нефринурия (НУ) >5,84 нг/мл/г, не встречающаяся у здоровых, выявлялась у 63% пациентов I гр., у 77% – II гр. и у 80% – III гр. Подоцинурия (ПДУ) >1,73 нг/мл/г выявлялась у 78% пациентов I гр., у 54% – II гр. и у 83% – III гр. НУ у больных с ПУ была достоверно выше, чем при АУ<30 мг/г. ПДУ в подгруппах с разной АУ/ПУ была одинаково высокой и не различалась между типами СД. Выявлена прямая корреляция НУ с АУ (R=0,947, р<0,05). Показатели НУ и ПДУ прямо коррелировали с сывороточным креатинином (R=0,489, р<0,05 и R=0,468, р<0,05) и обратно с СКФ (R=–0,461, р<0,05 и R=–0,36, р<0,05). При длительности СД менее 5 лет НУ прямо коррелировала с НвА1с, а у больных СД 2 – обратно с систолическим АД. ЗАКЛЮЧЕНИЕ. Определение уровней в моче нефрина и подоцина может использоваться для ранней диагностики и мониторирования течения ДН.
Ключевые слова
Для цитирования:
Бобкова И.Н., Щукина А.А., Шестакова М.В. ОЦЕНКА УРОВНЕЙ НЕФРИНА И ПОДОЦИНА В МОЧЕ У БОЛЬНЫХ С САХАРНЫМ ДИАБЕТОМ. Нефрология. 2017;21(2):33-40. https://doi.org/10.24884/1561-6274-2017-21-2-33-40
For citation:
Bobkova I.N., Shchukina A.A., Shestakova M.V. ASSESSMENT OF NEPHRIN AND PODOCIN LEVELS IN THE URINE OF PATIENTS WITH DIABETES MELLITUS. Nephrology (Saint-Petersburg). 2017;21(2):33-40. (In Russ.) https://doi.org/10.24884/1561-6274-2017-21-2-33-40
ВВЕДЕНИЕ
Во многих развивающихся и в большинстве развитых стран мира наблюдается стремительный рост заболеваемости сахарным диабетом (СД), что позволило в настоящее время говорить о пандемии этой болезни. Так, по опубликованным в 2015 г. данным Международной федерации диабета (IDF), в мире 415 миллионов людей в возрасте 20-79 лет страдают СД, через 20 лет прогнозируют увеличение этого количества до 640 миллионов (на 55%) [1]. Согласно Российскому Государственному регистру больных с СД, на январь 2015 г. в нашей стране по обращаемости в лечебные учреждения насчитывается 4095 миллиона больных, что составляет 2,8% населения РФ [2]. За последние 5 лет распространенность СД в РФ увеличилась на 23%, главным образом за счет СД 2-го типа, причем более чем у половины этих больных СД ранее не был диагностирован [2, 3]. Между тем, результаты контрольноэпидемиологических исследований, проведенных ФГБУ Эндокринологический научный центр, показали, что истинная распространенность СД в России, выявленная в разных возрастных группах при активном скрининге, приблизительно в 2-3 раза превышает официально зарегистрированную, что составляет около 10 миллионов человек (7% населения нашей страны) [4]. Россия входит в десятку стран-лидеров по заболеваемости СД, занимая в этом рейтинге пятую позицию [1].
Одним из наиболее опасных последствий СД, причиной инвалидизации и высокой смертности является диабетическая нефропатия (ДН), занимающая ведущие позиции в структуре терминальной почечной недостаточности (тПН) у больных на заместительной почечной терапии [1, 5]. В России при общей заниженной частоте регистрируемых осложнений СД распространенность нефропатии недооценивается особенно серьезно. Так, при активном скрининге у больных СД 2-го типа частота выявления ДН в 6 раз превысила регистрируемую в общей популяции СД 2-го типа [2].
Значительная распространенность СД, высокий риск развития и тяжесть связанных с этим заболеванием сосудистых осложнений (в частности ДН), растущее бремя финансовых затрат на их лечение, бесспорно, представляют серьезные проблемы для здравоохранения разных стран. В этой связи особую актуальность приобретает раннее выявление нефропатии с целью своевременного начала нефропротекции и отдаления развития тПН.
Единственным используемым в рутинной практике методом ранней диагностики ДН является определение уровня альбуминурии (АУ). Было показано, что АУ коррелирует с выраженностью морфологических изменений в почках [6]. Экскреции альбумина с мочой в количестве от 30 до 300 мг/сут (30-300 мг/г креатинина мочи), ранее называемая микроальбуминурией (МАУ), длительное время считалась маркером, отражающим начальные функциональные и структурные изменения в почке при СД. Однако проведенные к настоящему времени исследования доказали, что характерные для СД экспансия мезангия, увеличение толщины гломерулярной базальной мембраны и объёма клубочков обнаруживаются и при меньших значениях АУ (<30 мг/сут или < 30 мг/г креатинина мочи); при МАУ эти изменения более выражены, и в части клубочков уже может выявляться гломерулосклероз, появление же стойкой протеинурии (ПУ) свидетельствует о потере около 50-70% клубочков [5-8]. Градация АУ и определение ее диагностического уровня стали предметом длительной дискуссии. Согласно современным международным и отечественным рекомендациям, при сохранении прежних численных значений МАУ сегодня называют «высокой АУ» (подчеркивая, что это уже клинически значимый, а не самый ранний признак), для уровня АУ <30 мг/сут, традиционно считавшегося «нор- моальбуминурией», предложено определение «повышенная АУ», «оптимальной» считают АУ <10 мг/сут [8-10]. Анализ рандомизированных исследований (HOPE, LIFE, Framingham Heart Study и др.) показал, что МАУ и так называемая «low-grade albuminuria», как отражение генерализованной дисфункции эндотелия сосудов, тесно связаны с повышением риска развития сердечнососудистых катастроф и смертности от любых причин даже в популяции населения без СД и артериальной гипертензии (АГ). Поэтому значимость повышения АУ для диагностики субкли- нического течения ДН далеко не абсолютна. Все вышеизложенное определяет актуальность поиска более информативных и специфичных ранних маркеров поражения почек при СД.
Цель исследования: определить величину экскреции с мочой структурно-функциональных белков подоцитов (нефрина и подоцина) и уточнить значение данных мочевых показателей как ранних маркеров субклинического течения ДН у больных с СД с разной степенью выраженности АУ/ПУ
ПАЦИЕНТЫ И МЕТОДЫ
В исследование включены 74 пациента с диагнозом СД, в том числе, 30 - с СД 1-го типа и 44 - с СД 2-го типа, из них 37 (50%) мужчин, 37 (50%) женщин в возрасте от 18 до 80 лет. Средний возраст больных с СД 1-го типа составил 36,9±17 лет, длительность основного заболевания - 18,4±13 лет. Средний возраст обсследуемыых с СД 2-го типа составил 60,5±10 лет, длительность заболевания - 11,5±7,5 лет. Пациенты находились на обследовании и лечении в ФГБУ Эндокринологический научный центр (ЭНЦ) МЗ РФ, в клинике нефрологии, внутренних и профессиональных заболеваний им. Е.М. Тареева ПМГМУ им. И.М. Сеченова. В группу контроля вошли 10 здоровых добровольцев (4 мужчины, 6 женщин в возрасте от 19 до 77 лет).
Из исследования исключали пациентов: с декомпенсированным СД (уровень гликозилированного гемоглобина HbA1c >10%); ПУ более 2 г/сут; выраженной дисфункцией почек (СКФ<15 мл/ мин/1,73 м2); острым воспалительным заболеванием любой этиологии на момент исследования; острым или хроническим гломерулонефритом; ишемической болезнью почек; онкологической патологией, системными васкулитами, амилоидозом, сердечной недостаточностью III-IV ст. (по NYHA), острым нарушением мозгового кровообращения, тяжелой артериальной гипертензией 3 степени, беременных.
Всем больным было выполнено клиническое обследование, включавшее сбор анамнеза, осмотр с определением индекса массы тела (ИМТ, кг/м2), общеклинические анализы крови и мочи, концентрации альбумина в утренней порции мочи иммунотурбидиметрическим методом, рассчитано соотношение концентрации альбумина к креатинину мочи (мг/г креатинина мочи), в сыворотке крови оценены концентрация глюкозы, уровень HbA1c, креатинина, произведен расчет СКФ по формуле CKD-EPI, выполнено УЗИ почек для оценки их размеров и исключения аномалии развития, нефролитиаза.
Специальным методом исследования явилось определение в утренней порции мочи уровня структурно-функциональных белков подоцитов - нефрина (n=74) и подоцина (n=70) - с помощью наборов для иммуноферментного анализа («ELISA Kit») производства «CUSABIO» (China) с расчетом концентрации на единицу креатинина мочи в исследованном образце.
Результаты исследования маркеров подоцитар- ного повреждения сравнивали в группах больных с СД, различающихся по выраженности альбуминурии/протеинурии [8]:
I группа (n=41) - пациенты с СД 1-го и 2-го типа с АУ < 30 мг/гСг (A1);
II группа (n=13) - пациенты с СД 1-го и 2-го типа с АУ 30-300 мг/гСг (А2);
III группа (n=20) - пациенты с СД 1-го и 2-го типа с ПУ.
Артериальная гипертензия (АГ) наблюдалась у 52 из 74 (70%) обследованных, преимущественно у больных с СД 2-го типа. Коррекция АГ проводилась с помощью ингибиторов АПФ, блокаторов кальциевых каналов. ХБП 1 стадии выявлена у 41 обследованного пациента, ХБП 2 стадии - у 25, ХБП 3 стадии - у 8 человек.
Статистический анализ полученных данных проводили с использованием пакета прикладных статистических программ «STATISTICA 10,0» («StatSoft», США). При анализе уровней медиаторов в моче, имеющих отличное от нормального распределение, оценивали медиану, разброс величин по отношению к медиане характеризовали показателем интерквартильного размаха [25; 75%], куда входят 50% всех полученных значений. При сравнении двух групп использовали непараметрический критерий Манна-Уитни. Для выявления и оценки связей между исследуемыми показателями применяли непараметрический корреляционный анализ по методу Спирмена. Достоверность различий частот в двух группах оценивали с помощью критерия χ2 с поправкой Йетса. Нулевую статистическую гипотезу об отсутствии различий и связей отвергали при p<0,05.
РЕЗУЛЬТАТЫ
Показатели нефринурии (НУ) и подоцинурии (ПДУ), превышающие по уровню 75-й перцентиль в контрольной группе (т.е. практически не встречающиеся у здоровых), мы принимали за «положительные» значения (НУ+ >5,84 нг/мл/г; ПДУ+ >1,73 нг/мл/г). НУ+ выявлялась, в среднем, у 69% (52 из 74) больных с СД: у 63% (26 из 41) пациентов с АУ <30 мг/г (A1), у 77% (10 из 13) - с АУ 30-300 мг/г (А2) и у 80% (16 из 20) - с ПУ (рис. 1).
ПДУ+ выявлялась у 74% (31 из 70) общей группы больных с СД, в том числе, у 78% (31 из 40) пациентов I группы (А1), у 54% (7 из 13) - из II группы (с А2) и у 83% (52 из 70) больных из III группы (с ПУ) (рис.2). Больные с СД1 и СД2 типов с НУ+ и ПДУ+ в каждой подгруппе распределились практически равномерно (см. рис. 1, 2).
Средний уровень НУ в подгруппах больных с альбуминурией А1 и А2 не различался между СД 1-го и 2-го типов (7,06 [5,98;7,22] и 7,03 [6,07;7,82] нг/мл/г - СД1 и СД2 с альбуминурией А1 соответственно, р>0,05; 9,56 [7,66;9,56] и 6,91 [6,73;7,06] нг/мл/г - СД1 и СД2 с альбуминурией А2 соответственно, р>0,05), что, по-видимому, отражает общность механизмов повреждения подоцитов при диабете. При клинически явной ДН, протекающей с ПУ, экскреция нефрина с мочой была достоверно выше, чем в подгруппе с альбуминурией А1 (таблица).
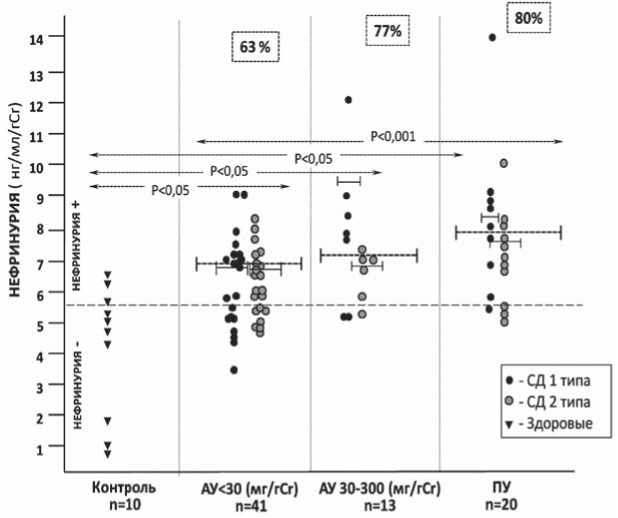
Рис. 1. Нефринурия у больных с сахарным диабетом (n=74).
У пациентов с СД1 типа с ПУ нефринурия достоверно превышала таковую у больных СД2 типа (8,67 [8,04;9,93] и 7,46 [7,38;7,68] нг/мл/г соответственно, р<0,05).
Средний уровень ПДУ в подгруппах больных с альбуминурией А1 и А2 и с ПУ был одинаково высок (таблица) и не различался между СД 1 и 2 типов (2,5[2,1;2,86] и 2,7 [2,4;3,01] нг/мл - СД1 и СД2 с альбуминурией А1 соответственно, р>0,05; 2,05[2,03;2,45] и 2,6 [2,0;3,27] нг/мл/г - СД1 и СД2 с с альбуминурией А2 соответственно, р>0,05; 2,6 [2,12;3,09] и 2,8 [2,2;4,24] нг/мл/г - СД1 и СД2 с ПУ соответственно, р>0,05).
У пациентов с СД 1 типа выявлена прямая корреляция НУ с выраженностью АУ (R=0,47, р<0,05), эта связь была более выраженной у больных с альбуминурией А2 (R=0,947, р<0,05). Наиболее сильной и достоверной была взаимосвязь НУ с ПУ (R=0,953, р<0,01).
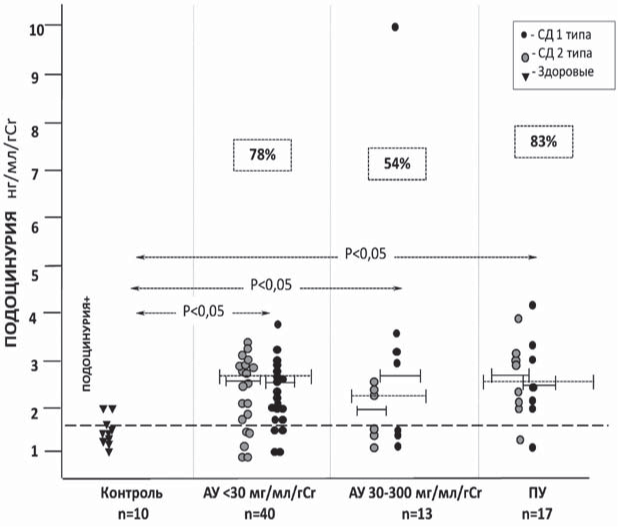
Рис. 2. Подоцинурия у больных с сахарным диабетом (n=70).
Показатели НУ и ПДУ у больных с СД 1-го типа прямо коррелировали с уровнем креатинина сыворотки крови (R=0,489, р<0,05 и R=0,468, р<0,05 соответственно) и обратно - со СКФ (R=-0,461, р<0,05 и R=-0,36, р<0,05 соответственно), что отражает роль подоцитарного повреждения не только в нарушении проницаемости гломерулярного фильтра, но и в развитии гломерулосклероза и формировании дисфункции почек. На это указывает и выявленная нами прямая взаимосвязь между уровнем НУ и длительностью СД, которая была достоверной и имела наибольшую силу у пациентов с СКФ менее 60 мл/мин независимо от типа диабета (R=0,73, р<0,05).
У пациентов с длительностью СД1 и СД2 менее 5 лет НУ прямо коррелировала с показателем гликозилированного гемоглобина НвА1с (R=0,84, р<0,01).
На величину показателя НУ при разной длительности диабета оказывала влияние АГ. Это более четко прослеживалось у больных с СД 2-го типа, у которых АГ выявлялась не только в процессе развития ДН, но часто предшествовала развитию патологии почек. У данной категории больных нами выявлена прямая достоверная связь систолического артериального давления с выраженностью экскреции нефрина с мочой (R=0,33, р<0,05).
Таблица
Средние показатели нефринурии (НУ+) и подоцинурии (ПДУ+) в подгруппах больных с сахарным диабетом, Ме [интерквартильный размах], n=52
Подгруппы обследованных | Экскреция с мочой маркеров повреждения подоцитов | |
|---|---|---|
НУ+ (нг/мл/гСг ) | ПДУ+ (нг/мл/гСг) | |
СД с АУ <30 мг/гСг | 7,04 [6,07;7,22] n=26 | 2,5 [2,03;3,01] n=31 |
II. СД с АУ 30-300 мг/гСг | 7,36 [6,73;9,56] n=10 | 2,03 [1,48;3,04] n=7 |
III. СД с ПУ | 7,76 [7,42;8,49] n=16 | 2,7 [2,03;3,73] n=14 |
IV. Здоровые | 5,3 [1,0;5,84] n=10 | 1,56 [1,21;1,73] n=10 |
р (I, II, III, IV) | p I–III <0,001 | p I–III > 0,05 |
ОБСУЖДЕНИЕ
В последние десятилетия предметом пристального внимания и научных исследований в нефрологии являются подоциты и их участие в патогенезе различных протеинурических форм поражения почек не только наследственных, но и приобретенных, в том числе ДН.
Предпосылками к такому направлению исследований послужили экспериментальные работы, продемонстрировавшие важную роль подоцитов в поддержании нормальной структуры и функции почечного клубочка и ключевое значение этих нарушений в развитии ПУ и прогрессировании гломерулосклероза [11-14]. В ранее опубликованном обзоре мы подробно осветили структурные и функциональные изменения подоцитов, ассоциированные с метаболическими, эндокринными и гемодинамическими расстройствами при СД, ознакомили с результатами современных экспериментальных и клинических исследований по данным вопросам [15]. В частности было показано, что воздействие на подоциты гипергликемии, конечных продуктов гликозилирования (КПГ), компонентов активированной ренин-ангиотензин-альдостероновой системы (РААС), внутриклубочковой гипертензии, оксидативного стресса и других факторов приводит к повреждению комплекса адгезивных белков, закрепляющих подоциты на базальной мембране клубочка (БМК), к перестройке актинового цитоскелета с развитием эффекта сглаживания подоцитарных отростков, усиленному апоптозу подоцитов с последующим их отслоением от БМК и экскрецией с мочой как целых клеток (подоцитурия), так и отдельных подоцитарных белков (нефрина, подоцина и др.) [16-21]. Важно, что ультраструктурные и функциональные нарушения в подоцитах предшествуют повышению альбуминурии и могут обнаруживаться даже при непродолжительном течении СД, что определяет еще один важный аспект изучения маркеров подоцитарной дисфункции - для ранней диагностики и мониторирования течения ДН.
По нашим данным, высокая экскреция маркеров подоцитарного повреждения отмечалась у части пациентов уже при альбуминурии < 30 мг/г, а при развитии МАУ и особенно ПУ частота обнаружения высокой нефрин- и подоцинурии нарастала. Ожидаемо, что наиболее высокие показатели НУ выявлялись у пациентов с ПУ, отражая более выраженные изменения в подоцитах при клинически явной ДН. Полученные нами результаты согласуются с другими исследованиями, свидетельствующими о вовлечении подоцитов в процессы инициации почечного повреждения при СД. В частности, А. Patari и соавт. [22] провели кросс-секционное исследование у больных с СД
1-го типа и выявили методом иммуноблоттинга НУ у 30% больных СД с нормоальбуминурией (в нашем исследовании соответствует АУ А1), у 17% - с МАУ (в нашем исследовании соответствует АУ А2), у 28% - с ПУ, тогда как в моче здоровых лиц нефрин не определялся. В работе В. Jim [23] НУ выявлялась у 54% больных с нормоальбуминурией и у всех больных СД 2-го типа с ПУ и МАУ. Как и в нашем исследовании, средний уровень экскреции нефрина с мочой у пациентов с МАУ и особенно с ПУ достоверно превышал таковой у пациентов с меньшей величиной АУ.
Повышенные концентрации глюкозы, воздействуя на подоциты, активируют экспрессию в них коллагена IV типа и фибронектина, подавляют механизмы расщепления внеклеточного матрикса (снижают продукцию матриксной металлопротеиназы 2-го типа и увеличивают продукции её тканевого ингибитора), что в целом способствует утолщению БМК [24]. Гипергликемия вызывает реорганизацию актиновых фибрилл в цитосклете подоцита с нарушением архитектоники его тела и ножек, способствуя таким образом развитию АУ/ ПУ [24]. Одним из основных механизмов, посредством которых гипергликемия оказывает повреждающее действие на структуры почки, в том числе подоциты, является неферментативное гликозилирование белков с образованием токсичных продуктов. Наибольшее повреждающее действие оказывают КПГ. Они образуются в организме больного с СД довольно быстро, в течение нескольких месяцев, после чего даже тщательная компенсация гликемии уже не способна полностью устранить присутствие этих веществ. Именно необратимостью КПГ объясняют продолжающееся прогрессирование сосудистых осложнений даже при хорошей компенсации СД. Подоциты являются мишенью для КПГ, о чем свидетельствует экспрессия ими соответствующих рецепторов. Так, in vitro в культуре подоцитов экспериментальных животных с СД и подоцитов пациентов с СД было продемонстрировано снижение ими экспрессии нефрина под воздействием гликированного альбумина, который проявлял свои эффекты при соединении с рецепторами КПГ [25]. Экспрессию рецепторов КПГ в подоцитах активирует не только гипергликемия, но и ангиотензин-II (АТ-II) через АТ2-рецепторы [25]. Эти сигнальные пути могут представлять дополнительный интерес как потенциальный объект воздействия препаратов, блокирующих РААС, с точки зрения уменьшения токсических эффектов КПГ.
По нашим данным, у пациентов с СД 1-го и СД 2-го типов с длительностью заболевания не более 5 лет выявлялась сильная высокодостоверная взаимосвязь НУ с уровнем гликозилированного гемоглобина, что также указывает на ключевую роль гипергликемии в формировании подоцитарной дисфункции даже при непродолжительном течении СД и подчеркивает необходимость достижения оптимального контроля гликемии для профилактики развития и нарастания тяжести ДН.
По современным представлениям, повреждающее воздействие на подоциты оказывает системная, а также внутриклубочковая гипертензия, что было продемонстрировано при ДН и гипертоническом нефроангиосклерозе [26-29]. Установлено, что длительное воздействие мощного гидравлического пресса приводит к механическому растяжению подоцитов, нарушению синтеза адгезивных белков, снижению экспрессии ряда структурных подоцитарных белков [30]. Введение ангиотензина в эксперименте у крыс, помимо развития АГ, сопровождалось апоптозом подоцитов и уменьшением экспрессии нефрина [31]. Кроме того, в эксперименте показано, что подоциты сами являются одним из источников синтеза компонентов РААС в почке. Высокие концентрации глюкозы и механическое растяжение индуцируют синтез АТ-II подоцитами через активацию экспрессии ангиотензиногена. Под воздействием повреждающих факторов подоциты экспрессируют АТ1- и АТ2-рецепторы, приобретая, таким образом, способность отвечать на действие циркулирующего АТ-II. Помимо гипергликемии и механического растяжения, продукцию АТ-II в подоцитах активируют трансформирующий фактор роста-β1, реактивные кислородные радикалы, компоненты ПУ [32, 33].
В нашем исследовании достоверная взаимосвязь АГ с выраженностью экскреции нефрина с мочой выявлялась у больных с СД 2-го типа, при СД 1-го типа она не достигла уровня статистической значимости, что, как мы полагаем, связано с большей частотой обнаружения АГ именно в группе больных с СД 2-го типа. Больные с СД 2-го типа были старше, многие из них уже имели АГ к моменту развития у них ДН.
Экспериментальными исследованиями последних лет было убедительно показано, что повреждение подоцитов имеет первостепенное значение не только в нарушении проницаемости фильтрационного барьера и развитии ПУ, но и в формировании гломерулосклероза и нарушении функции почек [13]. При интенсивном или продолжительном воздействии повреждающих факторов происходит значительное слущивание подоцитов в мочевое пространство, что при ограниченной пролиферативной способности этих клеток приводит к подоцитопении. На месте потери подоцита БМК оголяется, сращивается с капсулой Шумлянского-Боумена, формируя очаги гломерулосклероза. Кроме того, в процессе повреждения подоциты утрачивают способность экспрессировать специфические подоцитарные белки, меняют эпителиальный фенотип и начинают экспрессировать маркеры мезенхимальных клеток. Подобно фибробластам, трансдифференцированные подоциты приобретают способность продуцировать матриксные белки (фибронектин, коллаген и др.), ускоряя таким образом формирование гломерулосклероза и нарушение функции почек [13, 34, 35].
На важную роль подоцитарной дисфункции в механизмах прогрессирования ДН косвенно указывают и результаты нашего исследования. Так, у пациентов с СД с разной выраженностью АУ/ПУ показатель экскреции с мочой нефрина прямо коррелировал с уровнем креатинина в сыворотке крови и обратно - с СКФ, а у пациентов со стойким снижением СКФ менее 60 мл/мин выявлялась сильная прямая взаимосвязь между уровнем нефринурии и длительностью СД, что отражает причинно-следственную взаимосвязь пролонгированного повреждения подоцитов при длительном течении СД с развитием дисфункции почек.
ЗАКЛЮЧЕНИЕ
Таким образом, у большинства (от 63 до 74%) больных с СД выявляется высокая экскреция с мочой маркеров повреждения подоцитов (нефрина, подоцина), предшествующая развитию клинически значимой альбуминурии и ПУ, что позволяет использовать данные мочевые тесты для ранней доклинической диагностики гломерулярного повреждения при СД.
Тесные корреляции уровня в моче биомаркеров подоцитарной дисфункции (в большей степени нефринурии) с клиническими проявлениями поражения почек (выраженностью альбуминурии/ протеинурии, артериальной гипертонии, почечной дисфункции), а также уровнем гликозилированного гемоглобина крови раскрывают перспективы применения изученных мочевых тестов для неинвазивного мониторирования развивающихся при СД гломерулярных изменений и оценки риска их прогрессирования.
Список литературы
1. International Diabetes Federation atlas (7th edition update). Brussels, Belgium. International Diabetes Federation; 2015. Available from: http://www.diabetesatlas.org/
2. Дедов ИИ, Шестакова МВ, Викулова ОК. Государственный регистр сахарного диабета в Российской Федерации: статус 2014 г. и перспективы развития. Сахарный диабет 2015; 18 (3): 5-22. DOI: 10.14341/DM201535-22 [Dedov II, Shestakova MV, Vikulova OK. Nacionalnyj registr saharnogo diabeta v Rossijskoj Federacii: status 2014 i perspectivy razvitija. Saharnyj Diabet 2015; 18(3): 5-22]
3. Дедов ИИ, Шестакова МВ, Галстян ГР. Распространенность сахарного диабета 2 типа у взрослого населения России (исследование NATION). Сахарный диабет 2016; 19(2): 104-112. DOI: 10.14341/DM2004116-17 [Dedov II, Shestakova MV, Galstjan GR. Rasprostranjonnost saharnogo diabeta 2 tipa u vzroslogo naselenija Rossii (issledovanie NATION). Saharnyj Diabet 2016; 19(2): 104-112]
4. Дедов ИИ. Сахарный диабет: развитие технологий в диагностике, лечении и профилактике. Сахарный диабет 2010; 13(3): 6-13. DOI: 10.14341/2072-0351-5480 [Dedov II. Saharnyj diabet: razvitie tehnologij v diagnostike, lechenii i profilaktike. Saharnyj Diabet 2010; 13(3): 6-13]
5. Шестакова МВ, Шамхалова МШ, Ярек-Мартынова ИЯ и др. Сахарный диабет и хроническая болезнь почек: достижения, нерешенные проблемы и перспективы лечения. Сахарный диабет 2011; 14(1): 81-88. DOI:0.14341/2072-03516254 [Shestakova MV, Shamhalova Msh, Jarek-Martynova IYa i dr. Saharnyj diabet i hronicheskaja bolezn pochek: dostizhenija, nereshennye problemy i perspectivy lechenija. Saharnyj Diabet 2011; 14(1): 81-88]
6. Shestakova M, Mukhin N, Dedov I et al. Protein-loading test, urinary albumin excretion and renal morphology in diagnosis of subclinical diabetic nephropathy. J Int Med 1992, 231 (3): 213- 217
7. Dalla Vestra M, Saller A, Bortoloso E et al. Structural involvement in type 1 and type 2 diabetic nephropathy. Diabetes Metab 2000; 26 (4): 8-14. DOI: 10.2337/diabetes.52.4.1031
8. Смирнов АВ, Добронравов ВА, Кисина АА и др. Клинические рекомендации по диагностике и лечению диабетической нефропатии. Нефрология 2015; 19(1): 67-77. DOI [313.053036.865+613.693]-08.847 [Smirnov AV, Dobronravov VA, Kisina AA i dr. Klinicheskije recomendacii po diagnostice i lecheniju diabeticheskoj nefropatii. Nefrologia 2015; 19(1): 67-77]
9. National Kidney Foundation. KDOQI Clinical Practice Guideline for Diabetes and CKD: 2012 update. Am J Kidney Dis 2012; 60 (5):850-886
10. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Intern 2013; 3: 1-150
11. Pavenstadt H, Kriz W, Kretzler M. Cell biology of the glomerular podocyte. Physiol Rev 2003; 83(1): 253-307. DOI: 10.1152/physrev.00020.2002
12. Barisoni L, Kopp JB. Update in podocyte biology: putting one’s best foot forward. Curr Opin Nephrol Hypertens 2003; 12(3): 251-258. DOI: 10.1097/01.mnh.0000069861.94246.8c
13. Shankland SJ. The podocyte′s response to injury: Role in proteinuria and glomerulosclerosis. Kidney Int 2006: 69; 21312147. DOI: 10.1038/sj.ki.5000410
14. Kriz W, Elger M, Nagata M et al. The role of podocytes in the development of glomerular sclerosis. Kidney Int 1994: suppl 45; S64-S72
15. Бобкова ИН, Шестакова МВ, Щукина АА. Диабетическая нефропатия – фокус на повреждение подоцитов. Нефрология 2015; 2 (19): 33-44 [Bobkova IN, Shestakova MV, Schukina AA. Diabeticheskaja nefropatija –fokus na povrezhdenie podocytov. Nefrologija 2015; 2 (19): 33-44]
16. Granier C, Makni K, Molina L. Gene and protein markers of diabetic nephropathy. Nephrol Dial Transplant 2008; 23: 7922799. DOI: 10.1093/ndt/gfm834
17. Ziyadeh FN, Wolf G. Pathogenesis of podocytopathy and proteiuria in diabetic glomerulopathy. Current Diabetes Reviews 2008; 4: 39-45. DOI: 10.2174/157339908783502370
18. Wolf G, Chen S, Ziyadeh FN. From the periphery of glomerular capillary wall toward the center of disease. Podocyte injury comes of age in diabetic nephropathy. Diabetes 2005; 54(6): 1626-1634. DOI.org/10.2337/diabetes.54.6.1626
19. Stitt-Cavanagh E, MacLeod L, Kennedy CRJ. The podocyte in diabetic kidney disease. The Scientific World Journal 2009; 9:1127-1139. DOI: 10.1100/tsw.2009.133
20. Reddy GR, Kotlyarevska K, Ransom RF. The podocyte and diabetes mellitus: is the podocyte key to the origins of diabetic nephropathy? Сurr Opin Nephrol Hypertens 2008; 17: 32-36. DOI: 10.1097/MNH.0b013e3282f2904d
21. Steffes MW, Schmidt D, McGregory R, Basgen JM. Glomerular cell number in normal subject and in type 1diabetic patients. Kidney Int 2001; 59: 2104-2113. DOI: 10.1046/j.15231755.2001.00725.x
22. Patari A, Forsblom C, Havana et al. Nephrinuria in diabetic nephropathy of type 1 diabetes. Diabetes 2003; 52: 2969-2974. DOI: 10.2337/diabetes.52.12.2969
23. Jim B, Ghanta M, Qipo A et al. Dysregulated nephrin in diabetic nephropathy of type 2 diabetes: A cross Sectional study. PLoS ONE 2012; 7(5): e36041. DOI: 10.1371/journal.pone.0036041
24. Gruden G, Perin PC, Camussi G. Insight on the pathogenesis of diabetic nephropathy from the study of podocyte and mesangial cell biology. Current Diabetes Review 2005; 1(1): 27-40
25. Stitt-Cavanagh E, MacLeod L, Kennedy CRJ. The podocyte in diabetic kidney disease. Scientific World Journal 2009; 9: 1127–1139. DOI: 10.1100/tsw.2009.133
26. Cooper ME. Interaction of metabolic and haemodinamic factors in mediating experimental diabetic nephropathy. Diabetologia 2001; 44: 1957-1972. DOI: 10.1007/s001250100000
27. Wang G, Lai FM, Kwan BC et al. Podocyte loss in human hypertensive nephrosclerosis. Am J Hypertens 2009; 22: 300-306. DOI: 10.1038/ajh.2008.360
28. Forbes JM, Bonnet F, Russo LM et al. Modulation of nephrin in the diabetic kidney: association with systemic hypertension and increasing albuminuria. J of Hypertension 2002; 20(5): 985-992
29. Amazonas RB, de Almedia Sanita R, Kawashi H et al. Prevention of hypertension with or without renin-angiotensin system inhibition precludes nephrin loss in the early stage of experimental diabetes mellitus. Nephron Physiol 2007; 107; 57-64
30. Lewko B, Stepinski J. Hypergliycemia and mechanical stress: Targeting the renal podocyte. J Cell Physiol 2009; 221(2): 288-295. DOI: 10.1002/jcp.21856
31. Jia J, Ding G, Zhu J et al. Angiotensin II infusion induced nephrin expression changes and podocyte apoptosis. Am J Nephrol 2008; 28 (3): 500-507. DOI: 10.1159/000113538
32. Abbate M, Zoja C, Morigi M et al. Transforming growth factor-beta1 is up-regulated by podocytes in response to excess intraglomerular passage of proteins: a central pathway in progressive glomerulosclerosis. Am J Pathol 2002; 161(6): 2179–2193. doi: 10.1016/S0002-9440(10)64495-1
33. Durvasula RV, Petermann AT, Hiromura K et al. Activation of a local tissue angiotensin system in podocytes by mechanical strain. Kidney Int 2004; 65(1): 30–39. DOI: 10.1111/j.15231755.2004.00362.x
34. Li Y, Kang YS, Dai C et al. Epithelial-to-mesenchymal transition is a potential pathway leading to podocyte dysfunction and proteinuria. Am J Pathol 2008; 172(2): 299–308. DOI: 10.2353/ ajpath.2008.070057 35. Liu Y. New Insights into epithelial-mesenchymal transition in kidney fibrosis. J Am Soc Nephrol 2010; 21: 212-222. DOI: 10.1681/ASN.2008121226
Об авторах
И. Н. БобковаРоссия
Профессор Ирина Николаевна Бобкова, доктор медицинских наук.
Научно-исследовательский отдел нефрологии Научно-исследовательского центра; кафедра нефрологии и гемодиализа Института профессионального образования.
119991, Россия, Москва, ул. Трубецкая, д. 8, стр. 2.
А. А. Щукина
Россия
Анна Александровна Щукина, аспирант.
Кафедра нефрологии и гемодиализа Института профессионального образования.
119991, Россия, Москва, ул. Трубецкая, д. 8, стр. 2.
М. В. Шестакова
Россия
Академик Российской академии наук, профессор Шестакова Марина Владимировна, доктор медицинских наук.
Эндокринологический научный центр, директор Института диабета.
117036, Россия, Москва, ул. Дмитрия Ульянова, д. 11.
Рецензия
Для цитирования:
Бобкова И.Н., Щукина А.А., Шестакова М.В. ОЦЕНКА УРОВНЕЙ НЕФРИНА И ПОДОЦИНА В МОЧЕ У БОЛЬНЫХ С САХАРНЫМ ДИАБЕТОМ. Нефрология. 2017;21(2):33-40. https://doi.org/10.24884/1561-6274-2017-21-2-33-40
For citation:
Bobkova I.N., Shchukina A.A., Shestakova M.V. ASSESSMENT OF NEPHRIN AND PODOCIN LEVELS IN THE URINE OF PATIENTS WITH DIABETES MELLITUS. Nephrology (Saint-Petersburg). 2017;21(2):33-40. (In Russ.) https://doi.org/10.24884/1561-6274-2017-21-2-33-40
JATS XML








































