Перейти к:
ФАКТОРЫ ПРОГРЕССИРОВАНИЯ ВТОРИЧНЫХ ГЛОМЕРУЛОНЕФРИТОВ У ДЕТЕЙ
https://doi.org/10.24884/1561-6274-2017-21-4-73-78
Аннотация
Ключевые слова
Для цитирования:
Козыро И.А., Сукало А.В. ФАКТОРЫ ПРОГРЕССИРОВАНИЯ ВТОРИЧНЫХ ГЛОМЕРУЛОНЕФРИТОВ У ДЕТЕЙ. Нефрология. 2017;21(4):73-78. https://doi.org/10.24884/1561-6274-2017-21-4-73-78
For citation:
Kozyro I.A., Sukalo A.V. FACTORS OF PROFGRESSION OF SECONDARY GLOMERULONEPHRITIS IN CHILDREN. Nephrology (Saint-Petersburg). 2017;21(4):73-78. (In Russ.) https://doi.org/10.24884/1561-6274-2017-21-4-73-78
ВВЕДЕНИЕ
Системная красная волчанка (СКВ) и геморрагический васкулит Шенлейна-Геноха (ГВ) занимают лидирующие позиции среди системных вазопатий у детей. Поражение почек при СКВ, по данным световой микроскопии, варьирует, в среднем, от 50 до 70%. Однако при использовании электронной микроскопии те или иные признаки поражения почек при СКВ удается обнаружить даже при отсутствии мочевого синдрома. При ГВ характерные черты гломерулопатии выявляют в 25-80% случаев.
На сегодняшний день не существует ни одного «универсального» специфического для волчаночного и нефрита при ГВ маркера, позволяющего проводить раннюю диагностику, мониторинг активности непосредственно нефрита, что указывает на необходимость поиска наиболее чувствительных и специфичных предикторов обострения почечного процесса для оптимизации лечения и прогноза при данном заболевании [6].
Целью нашего исследования явилось исследование факторов активации T-(CCL5/RANTES)- и В (BAFF)-лимфоцитов, провоспалительных медиаторов (Caspase-1, TNFa, IL- 1β), маркеров сосудистых нарушений и прогрессирования фиброгенеза (VEGF, TGF-β1) у детей с вторичными гломерулонефритами (ГН) [вследствие СКВ, люпуснефрита (ЛН), посткапилляротоксического (ПН) и нефрита при АНЦА-васкулите] и уточнение их вклада в развитие и прогрессирование вышеприведенной патологии.
ПАЦИЕНТЫ И МЕТОДЫ
Для выявления молекулярных медиаторов развития и прогрессирования ГН у детей проведен ИФА с использованием тест-систем R&D Systems Quantikine ELISA: «Human CCL5/RANTES», «Human BAFF/BLys/TNFSF13B», «TNFa», «VEGF», «Human Caspase-1/ICE», «Human IL- 1β/IL-1F2», «Human TGF-β1». Постановку реакций проводили в соответствии с инструкциями по применению прилагаемыми производителями (США, Канада). Учет результатов проводили на ИФА - анализаторе «АИФ-М/340» («Витязь», Республика Беларусь) при длине волны 450 нм.
Статистический анализ результатов выполняли с использованием пакета прикладных статистических программ «Microsoft Excel 2003» («Microsoft Corporation», США). Результаты представлены в виде среднего арифметического ± ошибка средней. Статистическую значимость различий двух средних определяли с помощью t-критерия Стьюдента; частот - х2-критерия Пирсона. Оценку силы взаимосвязи между количественными признаками проводили с помощью коэффициента корреляции (r) Пирсона. Нулевую статистическую гипотезу об отсутствии различий и связей отвергали при p<0,05.
РЕЗУЛЬТАТЫ
Проведено обследование 106 пациентов с первичными и вторичными ГН, а также 36 условно здоровых детей группы контроля. Основную группу составили 40 пациентов с вторичными ГН вследствие СКВ, ЛН (n=20), вторичным посткапилляротоксическим нефритом (ПН) вследствие геморрагического васкулита Шенлейна-Геноха (n=16), вторичным нефритом вследствие системного васкулита (СВ), гранулематоза Вегенера (n=4). В группу сравнения вошли пациенты с IgA-нефропатией (n=21), нефропатией минимальных изменений (n=21), фокально-сегментарным гломерулосклерозом (n=21), мезангиокапиллярным гломерулонефритом (n=3). 34 пациента были обследованы динамически в процессе лечения. Возраст пациентов варьировал от 2 до 18 лет (13,2±4,1 года). Проведено клиниколабораторное, инструментальное, иммунологическое, вирусологическое обследование Выполнена гистологическая, иммуногистохимическая и электронно-микроскопическая оценка нефробиоптатов текущего (n=106) и архивного (27 с ЛН и ПН) материала.
Результаты исследования регулятора активации нормальной Т-клеточной экспрессии и секреции CCL5/RANTES и фактора активации В-лимфоцитов BAFF в сыворотке крови пациентов с вторичными, первичными ГН и здоровых детей представлены в табл. 1.
У пациентов с СКВ, ЛН концентрация CCL5/ RANTES в сыворотке крови составила 450-2000 ЕД (25-75%, ДИ 495-755), медиана - 530, в среднем 747,0±106,8. У пациентов с вторичным ПН CCL5/RANTES 470-1800 ЕД (25-75%, ДИ 515-1220), медиана - 770, в среднем 921,3±114,1, при поражении почек вследствие СВ концентрация CCL5/RANTES составила 520-2000 ЕД (2575%, ДИ 525-2000), медиана - 1265, в среднем 1263,0±425,8 (рис. 1).
В период снижения активности патологического процесса (ремиссии) у пациентов с вторичными ГН происходило достоверное уменьшение концентрации CCL/RANTES (250-1500, ДИ 475500, медиана 500, в среднем 550,7±29,16) в сравнении с обострением (р=0,0002), рис. 2.
У пациентов с СКВ, ЛН концентрация BAFF в сыворотке крови составила 125-2000 ЕД (2575%, ДИ 250-600), медиана - 425, в среднем 326±140,6. У пациентов с вторичным ПН BAFF в сыворотке крови 240-1000 ЕД (25-75%, ДИ 325625), медиана - 435, в среднем 515,6±67,5, при поражении почек вследствие системного васкулита концентрация BAFF в сыворотке крови составила 400-1000 ЕД (25-75%, ДИ 440-1000), медиана - 740, в среднем 720,0±162,5 (рис. 3).
В период снижения активности патологического процесса (ремиссии) у пациентов с вторичными ГН происходило достоверное уменьшение концентрации BAFF (с 125-2000 до 110-1000 ЕД, ДИ 325-1000 до 250-370, медиана с 480 до 290, в среднем 631,5±75,97) в сравнении с обострением (р=0,01) (рис. 4).
Показано участие факторов активации Т- и В-лимфоцитов (CCL/RANTES, BAFF) в развитии вторичных ГН в сравнении с контролем и группой первичных ГН. При вторичных ГН концентрация CCL/RANTES, BAFF коррелировала со степенью тяжести патологического процесса в почечной ткани: АГ, креатинином в сыворотке крови, выраженностью протеинурии и длительностью ее персистирования, гематурии, морфологическими и лабораторными признаками высокой активности ЛН и ПН. В случае положительной клиниколабораторной динамики отмечалось снижение вышеприведенных молекул и, наоборот, при развитии обострения заболевания концентрация CCL/RANTES и BAFF повышалась, что позволяет использовать их в клинической практике в качестве дополнительных иммунологических маркеров для диагностики и оценки эффективности проводимой патогенетической терапии.
Таблица 1
Концентрация молекул активации RANTES и BAFF у детей с ГН
Группы | Медиаторы | Концентрация, ЕД | 25-75% ДИ | Медиана | M±m |
|---|---|---|---|---|---|
Вторичные ГП | RANTES | 450-2000 * | 510-1200** | 535 | 868,3±82,42 |
BAFF | 125-2000 * | 250-675 | 440 | 589,9±79,4 | |
Первичные ГП | RANTES | 125-1200** | 460-660 | 500 | 550,7±29,16 |
BAFF | 62,5-1200 ** | 200-417,5 | 280 | 317±23,34 | |
Здоровые дети | RANTES | 125-510 *,** | 365-480 | 460 | 411,7±18,39 |
BAFF | 62,5-300 *,** | 125-250 ** | 150 | 174,4±10,93 |
* p=0.0001; ** р=0,0003.
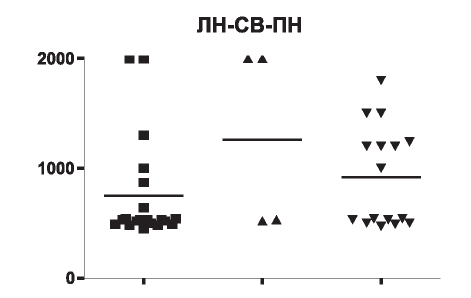
Рис. 1. Концентрация CCL/RANTES в сыворотке крови у пациентов с вторичными ГН.

Рис. 2. Концентрация CCL/RANTES в сыворотке крови у пациентов с вторичными ГН в период активных проявлений и ремиссии.
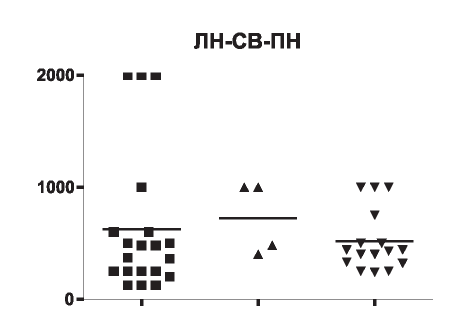
Рис. 3. Концентрация BAFF в сыворотке крови у пациентов с вторичными ГН.

Рис. 4. Концентрация BAFF в сыворотке крови в периоды обострения и ремиссии у пациентов с вторичными ГН (р=0,01).
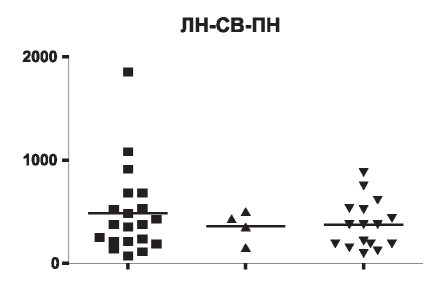
Рис. 5. Концентрация VEGF в сыворотке крови у пациентов с вторичными ГН.
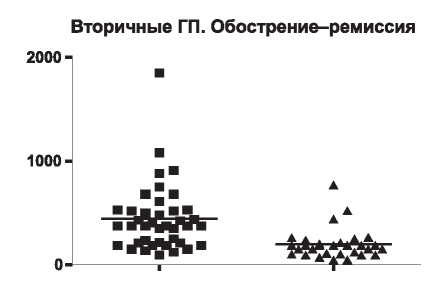
Рис. 6. Концентрация VEGF в сыворотке крови при обострении и ремиссии вторичных ГН.

Рис. 7. Концентрация TGF-1β в сыворотке крови у пациентов с вторичными ГН.
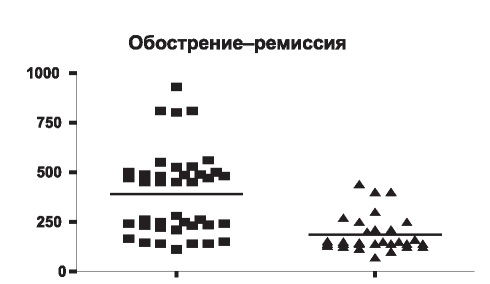
Рис. 8. Концентрация TGF-1β в сыворотке крови у пациентов с обострением и ремиссией ЛН и ПН.
Результаты определения концентрации сосудистого фактора роста VEGF и профибротического фактора роста TGF-1β приведены в табл. 2.
У пациентов с СКВ, ЛН концентрация VEGF в сыворотке крови составила 70-1850 ЕД (25-75%, ДИ 210-605), медиана - 375, в среднем 483,2±93,4. У пациентов с вторичным ПН концентрация VEGF 93,8-880 ЕД (25-75%, ДИ 188-525), медиана - 375, в среднем 374,6±58,6, при СВ концентрация VEGF в сыворотке крови составила 150-500 ЕД (25-75%, ДИ 250-465), медиана - 390, в среднем 357,5±75,7 (рис. 5)
В период снижения активности патологического процесса (ремиссии) у пациентов с вторичными ГП происходило достоверное уменьшение концентрации VEGF (с 93,8-1850 до 46,9-770 ЕД, ДИ 210-525 до 100-222,5, медиана с 375 до 188, в среднем от 442±51,3 до 198±27,1) в сравнении с обострением (р=0,01) (рис. 6).
У пациентов с ЛН концентрация TGF-1β в сыворотке крови составила 112,0-500,0 ЕД (2575%, ДИ 145-271,5), медиана - 230, в среднем 246,4±27,9, с вторичным ПН TGF-1β в сыворотке 140,0-930,0 ЕД (25-75%, ДИ 225-542,5), медиана - 475, в среднем 458,1±60,9, с СВ концентрация TGF-1β 165-810,0 ЕД (25-75%, ДИ 322,5-655), медиана - 490,0, в среднем 488,8±131,7 (рис. 7).
В период снижения активности патологического процесса (ремиссии) у пациентов с вторичными ГП происходило достоверное уменьшение концентрации TGF-1β (с 112-930 до 70-440 ЕД, ДИ от 230-495 до 135-230, медиана с 450 до 147,5, в среднем от 389,5±33,01 до 186,9±16,9) в сравнении с обострением (р=0,001), рис. 8.
У пациентов с вторичными ГП (ЛН, ПН) и ФСГС концентрация профибротических факторов роста коррелировала с клиническими (уровнем сывороточного креатинина, АГ, выраженностью протеинурии) и морфологическими признаками тяжести патологического процесса (гиперклеточность клубочков с сегментарным некрозом, сегментарный ГС с наличием спаек, наличие субэндотелиальных эозинофильных депозитов, процент тотально склерозированных клубочков, фиброклеточных и фиброзных полулуний, утолщение стенок сосудов и периваскулярной инфильтрацией), а также формированием резистентности к проводимой терапии. Исследование VEGF у пациентов с ЛН, ПН и ФСГС в динамике позволяет прогнозировать течение вторичных ГП и ФСГС.
Результаты определения молекулярных медиаторов - провоспалительных цитокинов каспазы-1, IL-1β TNFa представлены в табл. 3.
Таблица 2
Концентрация факторов роста VEGF и TGF-1 β у пациентов с ГН
Группы | Медиаторы | Концентрация, ЕД | 25-75% ДИ | Медиана | M±m |
|---|---|---|---|---|---|
Вторичные ГП | VEGF | 70-1850 * | 188-525 | 375 | 427,1±52,7 |
TGF-1β | 112-930 * | 151,5-485 | 261,5 | 355,3±34,6 | |
Первичные ГП | VEGF | 23,4-1200 | 110-237,5 ** | 150 | 225,7±29,9 |
TGF-1β | 62,5-820,0 | 150-400 ** | 245 | 277,3±19,2 | |
Здоровые дети | VEGF | 23,4-415 * | 125-215 ** | 127,5 | 157±12,9 |
TGF-1β | 31,2-180 * | 120-150 ** | 140 | 130,9±4,9 |
* p=0,0001, ** р=0,001.
Таблица 3
Концентрация провоспалительных цитокинов каспазы-1, IL-1 β, TNFa у детей с ГН
Группы | Медиаторы | Концентрация, ЕД | 25-75% ДИ | Медиана | M±m |
|---|---|---|---|---|---|
Вторичные ГП | Каспаза-1 | 25-400 * | 90-365 | 220 | 215,3±22,2 |
IL-1 β | 15,6-95 * | 15,6-31,3 | 28,5 | 34,2±3,4 | |
TNFa | 25-125 * | 40,0-67,5 | 60 | 60,09±4,3 | |
Первичные ГП | Каспаза-1 | 300-400 | 80-250 ** | 120 | 169,7±14,9 |
IL-1 β | 3,9-85,0 | 10-25 ** | 15,6 | 18,6±1,6 | |
TNFa | 15,6-85,0 | 20-47,5 ** | 31,2 | 37,3±2,3 | |
Здоровые дети | Каспаза-1 | 12,5-100 * | 45-70 ** | 50 | 52,57±3,9 |
IL-1 β | 3,9-31,2 * | 7,3-16,3 ** | 13,8 | 12,84±1,2. | |
TNFa | 15,6-62,5 * | 31,2-42,5 ** | 40 | 37,9±2,03 |
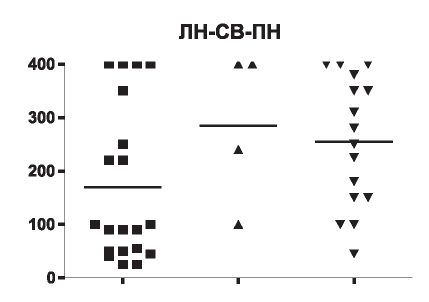
Рис. 9. Концентрация каспазы-1 в сыворотке крови при вторичных ГП.

Рис. 10. Концентрация каспазы-1 в сыворотке крови при обострении и ремиссии у пациентов с вторичными гломерулопатиями.
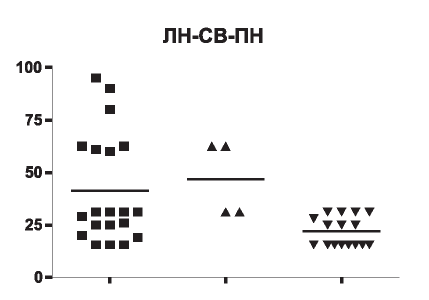
Рис. 11. Концентрация IL-1 β в сыворотке крови у детей с ЛН, СВ, ПН.

Рис. 12. Концентрация IL-1 β в сыворотке крови при обострении и ремиссии вторичных ГП.
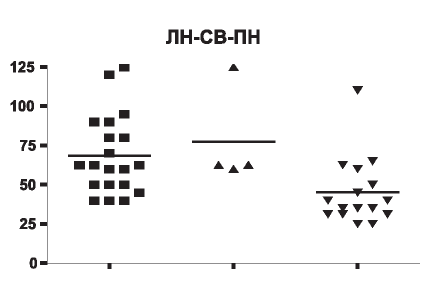
Рис. 13. Концентрация TNFa в сыворотке крови при вторичных ГП.
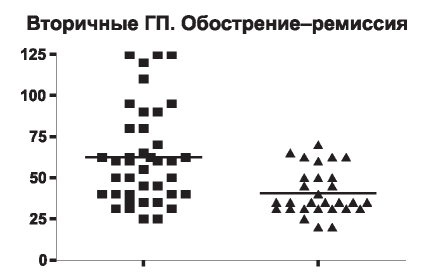
Рис. 14. Концентрация TNFa в сыворотке крови при вторичных ГП в периоды обострения и ремиссии.
У пациентов с ЛН концентрация каспазы в сыворотке крови составила 25-400 ЕД (25-75%, ДИ 50-300), медиана - 95, в среднем 170±32,3, с вторичным ПН концентрация каспазы составила 45-400 ЕД (25-75%, ДИ 150-365), медиана - 265, в среднем 254,4±30,4, с СВ 100-400 ЕД (25-75%, ДИ 170-400), медиана - 320, в среднем 285±72,3 (рис. 9).
В период снижения активности патологического процесса (ремиссии) у пациентов с вторичными ГП происходило достоверное уменьшение концентрации каспазы (с 25-400 до 45-400 ЕД, доверительный интервал от 100-400 до 75-235, медиана с 245 до 100, в среднем 242,3±21,9 до 157±19,6) в сравнении с обострением (р=0,007), рис. 10.
У пациентов с ЛН концентрация IL-1β в сыворотке крови составила 15,6-95,0 ЕД (25-75%, ДИ 22,5-61,75), медиана - 31,2, в среднем 41,3±5,8. У пациентов с вторичным ПН IL-1 β в сыворотке крови 15,6-31,3 ЕД (25-75%, ДИ 15,6-29,6), медиана - 20,3, в среднем 22,04±1,7. У детей с нефритом вследствие СВ концентрация IL-1 β - 31,2-62,5 ЕД (25-75%, ДИ 31,25-62,5), медиана - 46,9, в среднем 46,9± 9 (рис. 11).
В период снижения активности патологического процесса (ремиссии) у пациентов с вторичными ГП происходило достоверное уменьшение концентрации IL-1β (с 15,6-95,0 до 3,9-62,5 ЕД, доверительный интервал 19,5-60,5 до 11,7-31,2, медиана с 31,2 до 15,6, в среднем 36,6±3,5 до 20,7±2,2) в сравнении с обострением (р=0,007) (рис. 12).
У пациентов с СКВ, ЛН концентрация TNFa в сыворотке крови составила 40,0-125,0 ЕД (25-75%, ДИ 50-85), медиана - 62,5, в среднем 68,6±5,6. У пациентов с вторичным ПН TNFa в сыворотке 25,0-110,0 ЕД (25-75%, ДИ 31,2-37,5), медиана - 37,5, в среднем 45,07±5,4. У детей с СВ TNFa в сыворотке крови 60-125,0 ЕД (2575%, ДИ 61,25-93,75), медиана - 62,5, в среднем 77,5±15,8 (рис. 13).
В период снижения активности патологического процесса (ремиссии) у пациентов с вторичными ГП происходило достоверное уменьшение концентрации TNFa (с 25,0-125 до 20-70 ЕД, доверительный интервал 40-80 до 31,2-50,0, медиана с 60 до 35, в среднем 62,6±4,6 до 40,7±2,5) в сравнении с обострением (р=0,003) (рис. 14).
У пациентов с вторичными ГП выявлено достоверное увеличение концентрации каспазы-1, IL-1β и TNFa (р<0,05) в сравнении со здоровыми. В группах пациентов с вторичными ГП концентрация провоспалительных цитокинов коррелировала со степенью тяжести патологического процесса в почечной ткани (выраженностью протеинурии, гематурии, уровнем сывороточного креатинина, АГ, морфологическими и лабораторными признаками высокой активности ЛН и ПН).
Установленное достоверное увеличение концентрации провоспалительных цитокинов каспазы-1, IL-1β TNFa у пациентов с вторичными ГП (р<0,05) по сравнению с контролем и группой сравнения, а также изменение концентрации вышеприведенных цитокинов в процессе лечения или, наоборот, развития рецидива болезни свидетельствует об их участии в патогенезе ЛН, ПН и нефрита при системном васкулите, что позволяет использовать их в качестве дополнительных критериев в диагностике и оценке адекватности проводимой терапии.
ЗАКЛЮЧЕНИЕ
Показано участие факторов активации Т- и В-лимфоцитов (CCL/RANTES, BAFF), профибротических факторов роста (TGF-1β VEGF) и провоспалительных цитокинов (каспазы-1, IL-1β TNFa) в развитии вторичных ГП, их корреляция со степенью тяжести патологического процесса в почечной ткани, а также изменение концентрации вышеприведенных молекул в случае обострения или ремиссии, что позволяет использовать их в клинической практике в качестве дополнительных иммунологических маркеров для диагностики и оценки эффективности проводимой патогенетической терапии.
Список литературы
1. Salgado A, Herrera-Diaz C. Lupus nephritis: an overview of recent findings. Autoimmune disease, Volume 2012, Article ID 849684, 21 p
2. Jordan N, Lutalo PM, D’Cruz DP. Novel therapeutic agents in clinical development for Systemic Lupus Erythematosus. BMC Medicine 2013; 3 11(1):120
3. Niaudet P, Salomon R. Systemic Lupus Erythematosus. In: E.D Avner, W.E. Harmon, P Niaudet. Pediatric Nephrology, 5th ed. Philadelphia: Lippincott Williams&Wilkins, 2004; 865-886
4. Rees L. In L. Rees, N. Webb, P. Brogan. Paediatric nephrology, London: Oxford University Press, 2007; 282-296
5. Avramescu C, Biciusca V, Daianu T. et al. Cytokine panel and histopathological aspects in the systemic lupus erythematosus. Romanian journal of Morphology and Embryology 2010; 51(4): 633-640
6. Brunner HI, Bennett MR, Mina R et al. Association of noninvasively measured renal protein biomarkers with histologic features of lupus nephritis. Arthritis Rheum 2012 Aug;64(8):2687-2697
7. Edelbauer M, Kshirsagar S, Riedl M et al. Markers of childhood lupus nephritis indicating disease activity. Pediatr Nephrology 2011; 26:401-410
8. Vachvanichsanong P, McNeil E. Pediatric lupus nephritis: more options, more chances? Lupus 2013; 22(6):545-553
9. Watson L, Beresford M. Urine biomarkers in juvenile-onset SLE nephritis. Pediatr Nephrol 2013; 28(3): 363-374
10. Vincent FB, Saulep-Easton D, Feggett WA et al. The BAFF/ APRIL system: emerging functions beyond B cell biology and autoimmunity. Cytokine Growth Factor Rev 2013 Jun;24(3):203-215
11. Козыро ИА, Сукало АВ. Новые маркеры в диагностике люпус-нефрита у детей (обзор литературы). Нефрология 2015;19 (3):39-43 [Kozyiro IA, Sukalo AV. Novyie markeryi v diagnostike lyupus-nefrita u detey (obzor literaturyi).Nefrologiya 2015;19 (3):39-43]
Об авторах
И. А. КозыроБеларусь
Доц., канд. мед. наук
Республика Беларусь, г. Минск, 220116, пр. Дзержинского, д. 83. Белорусский государственный медицинский университет, 1-я кафедра детских болезней.
А. В. Сукало
Беларусь
Проф., академик, д-р мед.наук
Республика Беларусь, г. Минск, 220116, пр. Дзержинского, д. 83. Белорусский государственный медицинский университет, 1-я кафедра детских болезней. Заведующий, зам. Председателя Президиума Национальной академии наук Беларуси.
Рецензия
Для цитирования:
Козыро И.А., Сукало А.В. ФАКТОРЫ ПРОГРЕССИРОВАНИЯ ВТОРИЧНЫХ ГЛОМЕРУЛОНЕФРИТОВ У ДЕТЕЙ. Нефрология. 2017;21(4):73-78. https://doi.org/10.24884/1561-6274-2017-21-4-73-78
For citation:
Kozyro I.A., Sukalo A.V. FACTORS OF PROFGRESSION OF SECONDARY GLOMERULONEPHRITIS IN CHILDREN. Nephrology (Saint-Petersburg). 2017;21(4):73-78. (In Russ.) https://doi.org/10.24884/1561-6274-2017-21-4-73-78
JATS XML








































