Перейти к:
ПОСТТРАНСПЛАНТАЦИОННЫЙ САХАРНЫЙ ДИАБЕТ У РЕЦИПИЕНТОВ РЕНАЛЬНОГО ТРАНСПЛАНТАТА: ОПЫТ ОДНОГО ЦЕНТРА
https://doi.org/10.24884/1561-6274-2017-21-6-20-28
Аннотация
Посттрансплантационный сахарный диабет (ПТСД), развивающийся у реципиентов ренального трансплантата, может не только способствовать развитию различных осложнений, но и оказывать существенное негативное влияние на результаты трансплантации почки (ТП).
Цель. Сравнение клинико-демографических показателей и результатов ТП у реципиентов ренального трансплантата с ПТСД и без данного осложнения.
Пациенты и методы. В исследование включены 439 пациентов 18 лет и старше без претрансплантационного диабета, которым была выполнена ТП от умершего донора в нашем центре с 01.01.2007 г. по 31.12.2016 г. Все пациенты после ТП получали ингибиторы кальцинейрина и микофенолаты, 322 больных принимали такролимус (ТАК), 117 – циклоспорин А (ЦсА). Иммуносупрессию без стероидов получали 17 реципиентов.
Результаты. ПТСД развился у 41 (9,3%) из 439 пациентов: у 33 (10,2%) из 322 на ТАК и 8 из 117 (6,8%) на ЦсА, p=0,368. Группы с ПТСД и без ПТСД не различались по полу, доле больных с поликистозом почек, модальности и продолжительности диализной терапии, характеру иммуносупрессии, хотя имелась тенденция к более старшему возрасту и более высокому индексу массы тела у больных с ПТСД. В группе ПТСД было достоверно больше больных с исходным метаболическим синдромом (31,7% против 12,3%, p=0,002), посттрансплантационными хирургическими осложнениями (21,9% против 8,5%, p=0,012), грибковыми инфекциями (14,6% против 5,0%, p=0,026), сердечно-сосудистыми осложнениями (26,8% против 9,8%, p=0,003), пациентов, погибших с функционирующим трансплантатом (17,1% против 5,5%, p=0,0012). Выживаемость реципиентов и трансплантатов была достоверно ниже в группе ПТСД (p=0,008 и p=0,022 соответственно).
Заключение. ПТСД негативно влияет на результаты ТП. Профилактика, раннее выявление и адекватное лечение ПТСД могут способствовать снижению частоты осложнений после ТП и улучшению выживаемости реципиентов и трансплантатов.
Ключевые слова
Для цитирования:
Прокопенко Е.И., Ватазин А.В., Щербакова Е.О., Кантария Р.О. ПОСТТРАНСПЛАНТАЦИОННЫЙ САХАРНЫЙ ДИАБЕТ У РЕЦИПИЕНТОВ РЕНАЛЬНОГО ТРАНСПЛАНТАТА: ОПЫТ ОДНОГО ЦЕНТРА. Нефрология. 2017;21(6):20-28. https://doi.org/10.24884/1561-6274-2017-21-6-20-28
For citation:
Prokopenko E.I., Vatazin A.V., Shcherbakova E.O., Kantariya R.O. NEW-ONSET DIABETES MELLITUS AFTER KIDNEY TRANSPLANTATION: SINGLE CENTER EXPERIENCE. Nephrology (Saint-Petersburg). 2017;21(6):20-28. (In Russ.) https://doi.org/10.24884/1561-6274-2017-21-6-20-28
ВВЕДЕНИЕ
Трансплантация почки (ТП) является оптимальным методом лечения пациентов с терминальной почечной недостаточностью (тХПН), однако на результаты ТП могут негативно влиять различные осложнения посттрансплантационного периода. Одним из таких осложнений является посттрансплантационный сахарный диабет (ПТСД), или вновь возникший после трансплантации сахарный диабет (new-onset diabetes after transplantation), как нередко его называют в англоязычной литературе. ПТСД не только негативно влияет на почечный трансплантат, но и вызывает такие же ранние и поздние осложнения, как и сахарный диабет 2-го типа, при этом развиваются эти осложнения гораздо быстрее [1]. Известно, что ПТСД способствует развитию или усугубляет тяжесть уже имеющихся сердечно-сосудистых заболеваний, а также может вызывать поражение многих других органов и систем [2]. В то же время, течение посттрансплантационного периода несколько отличается у пациентов с ПТСД и у больных с сахарным диабетом 2-го типа, развившимся до ТП, поэтому ПТСД принято изучать отдельно.
Частота ПТСД, по данным разных исследований, варьирует от 2% до 53%, возможно, из- за использования в более ранних исследованиях различных критериев установления диагноза [3]. В настоящее время общепринятым подходом стало применение диагностических критериев сахарного диабета для общей популяции [4]. По- видимому, частота ПТСД неодинакова в различных регионах мира. Например, по данным отдельных центров и многоцентровых исследований, в Египте общая частота развития диабета после ТП составила в целом 18,2%, во Франции - 7% через 2 года наблюдения, в Судане - 8,6%, а в США - 16% через 12 мес наблюдения после ТП и 24% - через 36 мес [5-8].
Имеется достаточно много факторов риска развития ПТСД. К немодифицируемым факторам риска относятся старший возраст, афроамериканское, испанское или южноазиатское происхождение, генетическая предрасположенность (включая носительство аллелей HLA A28, A30, B27), семейный анамнез сахарного диабета, поликистозная болезнь почек у реципиента, нарушение толерантности к глюкозе до трансплантации, а также ТП от донора мужского пола и умершего донора [4, 9-15]. Модифицируемые факторы риска включают ожирение, метаболический синдром, малоподвижный образ жизни, вирусный гепатит C, цитомегаловирусную инфекцию, применение кортикостероидов, ингибиторов кальцинейрина (при этом такролимус, ТАК, считается более диабетогенным, чем циклоспорин А, ЦсА), сиролимуса, острое отторжение почечного трансплантата [2, 4, 11, 16-19]. Однако в отношении некоторых факторов риска единого мнения нет. Например, недавнее исследование, проведенное в Словакии, не подтвердило влияние цитомегаловирусной инфекции на развитие ПТСД [20]. Что касается диабетогенного действия ТАК, было показано, что у реципиентов ренального трансплантата с невысокими концентрациями данного препарата в крови частота развития ПТСД существенно ниже по сравнению с больными с высокими концентрациями - 9,4% против 38,4% при 5-летнем сроке наблюдения [21]. Частота ПТСД на фоне применения ТАК в значительной степени зависит от дозы и продолжительности использования кортикостероидов. Минимизация кортикостероидов в сочетании с применением формы ТАК с замедленным высвобождением (исследование ADVANCE) обеспечивает приемлемую эффективность иммуносупрессии и относительно невысокую частоту развития ПТСД [22]. Опыт Университета Миннесоты с 15-летним сроком наблюдения пациентов после ТП свидетельствует о том, что быстрая отмена кортикостероидов не ухудшает выживаемость реципиентов и трансплантатов, уменьшая при этом частоту различных осложнений, в том числе ПТСД [23].
Выше уже было сказано, что клиническое значение ПТСД весьма велико. Результаты ряда исследований выявили повышение риска смерти реципиентов почечного трансплантата с ПТСД по сравнению с пациентами без диабета, преимущественно за счет сердечно-сосудистых осложнений [24-26]. Кроме того, ПТСД снижает качество жизни пациентов, повышает частоту госпитализаций, а также общую стоимость лечения. В лечении сахарного диабета, развившегося после ТП, в зависимости от клинической ситуации используют как инсулин, так и пероральные сахароснижающие препараты, в том числе - лекарства новых поколений (ингибиторы дипептидилпептидазы-4, глитазоны), однако требуются дальнейшие исследования для установления оптимальных подходов к лечению ПТСД [27].
Ведение пациентов с ПТСД является более сложным, чем больных с сахарным диабетом, не связанным с трансплантацией, поскольку после ТП быстро изменяется почечная функция, а также резистентность к инсулину (из-за изменений режима иммуносупрессии, эпизодов отторжения, инфекций, хирургических осложнений), имеются сложные лекарственные взаимодействия между иммуносупрессантами и препаратами для лечения артериальной гипертензии, гиперлипидемии, гиперурикемии, сахароснижающими средствами [28]. Несмотря на существующие проблемы, выявление ПТСД становится более ранним, а лечение совершенствуется благодаря постоянной работе многочисленных групп исследователей, накоплению опыта и разработке унифицированных критериев диагностики и принципов лечения таких пациентов.
Целью настоящего исследования было сравнение клинико-демографических показателей и результатов трансплантации почки у реципиентов ренального трансплантата с ПТСД и без данного осложнения.
ПАЦИЕНТЫ И МЕТОДЫ
В одноцентровое ретроспективное исследование были включены 439 пациентов в возрасте 18 лет и старше, которым была выполнена ТП в МОНИКИ им. М.Ф. Владимирского с 01.01.2007 г. по 31.12.2016 г. Критериями исключения были сахарный диабет до трансплантации почки, первично нефункционирующий трансплантат, смерть или потеря функционирующего трансплантата (по любой причине) в раннем послеоперационном периоде - в течение 1 мес после трансплантации. Во всех случаях ТП была выполнена от умершего донора.
Среди реципиентов было 258 мужчин (58,8%) и 181 (41,2%) женщина. Медиана возраста больных на момент операции составила 42,7 [33,9; 51,9] года, медиана индекса массы тела - 24,4 [21,6; 27,5]. До трансплантации 274 (62,4%) пациента получали лечение регулярным гемодиализом (ГД), 120 (27,3%) - перитонеальным диализом (ПД), 24 (5,5%) - ПД с последующим переходом на ГД. У 21 (4,8%) больного трансплантация была выполнена до начала заместительной почечной терапии (ЗПТ). Медиана продолжительности ЗПТ в общей группе пациентов составила 19,7 [8,9; 35,9] мес. У подавляющего числа пациентов - 413 (94,1%) ТП была первой, и только у 26 (5,9%) - второй.
Все пациенты получали после ТП иммуносупрессивную терапию, включавшую ингибитор кальцинейрина - ЦсА или ТАК, препарат из группы микофенолатов; в большинстве случаев больные принимали также преднизолон. ТАК принимали 322 (73,3%), а ЦсА - 117 (26,7%) реципиентов; иммуносупрессию без стероидов получали 17 человек. Индукция иммуносупрессии осуществлялась у 409 (93,2%) пациентов (базиликсимаб или даклизумаб, или лимфоцит-истощающие антитела), 30 (6,8%) больных не получали индукционную терапию. При развитии острого клеточного отторжения пациентам назначалась пульстерапия метилпреднизолоном по 500 мг ежедневно в течение трех дней подряд, в ряде случаев производилась конверсия с ЦсА на ТАК (если исходно пациент получал ЦсА); гуморальное отторжение лечили плазмаферезом в сочетании с введением внутривенного иммуноглобулина и ритуксимаба. Медиана сроков наблюдения после ТП составила 4,89 [2,52; 7,21] года.
Посттрансплантационный сахарный диабет диагностировали с использованием критериев диагностики сахарного диабета и других нарушений гликемии (ВОЗ, 1999-2013). Диагноз ПТСД устанавливался у пациентов без анамнеза сахарного диабета, если после ТП выявлялся уровень глюкозы венозной плазмы натощак ≥ 7,0 ммоль/л или при случайном определении ≥ 11,1 ммоль/л и наличии классических симптомов гипергликемии, или ≥ 11,1 ммоль/л через 2 ч после приема 75 г глюкозы при проведении орального глюкозотолерантного теста, или при HbA1C ≥ 6,5 ммоль/л [29-31]. Для выявления метаболического синдрома использовали критерии IDF [32, 33]. Все пациенты с ПТСД наблюдались эндокринологом, в зависимости от выраженности гипергликемии назначались диета с ограничением легкоусвояемых углеводов или препараты инсулина или пероральные сахароснижающие препараты.
Статистический анализ данных. Показатели с распределением, отличающимся от нормального, описывались при помощи медианы и межквартильного размаха (1-3-й квартиль); качественные показатели - в долях (процентах) либо в абсолютных значениях. Межгрупповой анализ данных проводился с помощью критерия Манна-Уитни. Для оценки достоверности различия качественных признаков (долей в группах) использовался х2-критерий. Сравнение выживаемости реципиентов и ренальных трансплантатов в группах больных проводилось с помощью метода Каплана-Майера. При оценке выживаемости трансплантатов смерть с функционирующим трансплантатом считалась потерей трансплантата. В качестве критического уровня достоверности различий в сравнениях групп был принят уровень 0,05.
РЕЗУЛЬТАТЫ
ПТСД развился у 41 (9,3%) из 439 пациентов с трансплантированной почкой. Появление ПТСД наблюдали у 33 из 322 (10,2%) реципиентов, получавших иммуносупрессию на основе ТАК, и у 8 из 117 (6,8%) больных, получавших ЦсА. Достоверных различий по частоте диабета в зависимости того, какой ингибитор кальцинейрина принимали пациенты после ТП, не выявлено, p=0,368. Сравнительная клинико-демографическая характеристика пациентов с ПТСД и без ПТСД приведена в табл. 1.
Как видно из табл. 1, группы пациентов с ПТСД и без ПТСД не различались по гендерному составу, доле больных с поликистозом почек, наличию HLA-антигенов A28, A30, B27, виду и продолжительности ЗПТ до трансплантации. Не было также различий в характере иммуносупрессивной терапии: среди пациентов с ПТСД было несколько больше больных, получавших такролимус (80,5% по сравнению с 72,6% в группе без ПТСД), однако различия не достигали статистической значимости. Группы с ПТСД и без ПТСД не различалась по суммарной дозе метилпреднизолона в раннем послеоперационном периоде и характеру индукционной терапии антителами. Мы не обнаружили различий и по доле пациентов, получавших поддерживающую иммуносупрессию без стероидов, но таких пациентов было очень мало в обеих группах, поэтому обнаружить влияние стероидов на развитие ПТСД было сложно.
Таблица 1
Клинико-демографическая характеристика реципиентов реального трансплантата с посттрансплантационным сахарным диабетом и без диабета
Показатель | Пациенты с ПТСД, n = 41 | Пациенты без ПТСД, n = 398 | P |
|---|---|---|---|
Возраст, лет | 48,6 [39,2; 56,1] | 42,1 [33,2; 51,4] | 0,086 |
Мужчины : женщины | 68,3% : 31,7% | 57,8% : 42,2% | 0,244 |
Индекс массы тела | 25,8 [23,8; 27,9] | 24,3 [21,5; 27,5] | 0,062 |
Доля больных с метаболическим синдромом до ТП | 31,7 | 12,3 | 0,002 |
Доля больных с поликистозом почек, % | 14,6 | 10,5 | 0,429 |
Доля пациентов с HLA A28, % | 7,3 | 4,3 | 0,421 |
Доля пациентов с HLA A30, % | 9,8 | 5,6 | 0,292 |
Доля пациентов с HLA B27,% | 14,6 | 12,7 | 0,806 |
Соотношение видов ЗПТ: без ЗПТ/ПД/ГД/ПД+ГД, % | 7,3/31,7/61,0/0 | 4,5/26,9/62,6/6,0 | 0,333 |
Продолжительность ЗПТ до трансплантации, мес | 19,2 [8,1; 35,6] | 19,7 [8,9; 36,2] | 0,905 |
Доля больных, получавших такролимус, % | 80,5 | 72,6 | 0,354 |
Доля больных на постоянной иммуносупрессии без кортикостероидов, % | 2,4 | 4,0 | 0,941 |
Суммарная доза метилпреднизолона в/в, г | 1,25 [1,0; 1,5] | 1,25 [1,0; 1,75] | 0,386 |
Индукция антителами: без индукции/анти-CD25 ат/АТГ (Тимо), % | 4,9/95,1/0 | 6,8/90,2/3,0 | 0,463 |
Примечание. анти-СД25 ат - антитела к CD25 (базиликсимаб или даклизумаб); АТГ - антитимоцитарный глобулин; Тимо - тимоглобулин.
Имелась тенденция к более старшему возрасту больных на момент ТП (48,6 [39,2; 56,1] года против 42,1 [33,2; 51,4] года, p=0,09) и к более высокому индексу массы тела (25,8 [23,8; 27,9] против 24,3 [21,5; 27,5], p=0,06) у реципиентов с ПТСД по сравнению с пациентами, не имеющими нарушений углеводного обмена после трансплантации. В группе с ПТСД было достоверно больше больных, у которых имелся метаболический синдром до ТП - 31,7% по сравнению с 12,3%, p=0,002.
У 38 из 41 (92,6%) пациента с ПТСД заболевание развилось в течение первого месяца после трансплантации, и только у 3 пациентов - в различные сроки позднего посттрансплантационно- го периода, от 4 до 12 мес с момента ТП. В дебюте ПТСД инсулинотерапии требовали 40,5% пациентов, получали лечение пероральными сахароснижающими препаратами - 51,4%, корригировали гликемию только диетой - 5,4%. В последующем по мере планового снижения интенсивности иммуносупрессии (целевых концентрация ингибиторов кальцинейрина, доз преднизолона) у немалой части пациентов гликемия снизилась в такой степени, что стало возможным прекратить медикаментозную терапию. В отдаленном пост- трансплантационном периоде (через 6 мес после дебюта диабета и позднее) 36,8% пациентов с ПТСД находились только на диетотерапии, однако остальные 63,2% нуждались в лечении инсулином или пероральными препаратами.
Группы пациентов с ПТСД и без диабета были сравнимы по частоте острого отторжения, острого и хронического отторжения суммарно, урологических осложнений, инфекционных осложнений в целом и онкологических осложнений (табл. 2).
Таблица 2
Осложнения и исходы трансплантации почки у пациентов с посттрансплантационным сахарным диабетом и без диабета
Показатель | Пациенты с ПТСД, n = 41 | Пациенты без ПТСД, n = 398 | p |
|---|---|---|---|
Срок наблюдения после ТП, лет | 5,37 [2,85; 7,41] | 4,87 [2,49; 7,17] | 0,557 |
Доля больных с отсроченной функцией трансплантата, % | 60,0 | 49,5 | 0,03 |
Доля пациентов с острым отторжением, % | 14,6 | 10,8 | 0,437 |
Доля пациентов с острым и хроническим отторжением, % | 17,1 | 11,8 | 0,320 |
Хирургические осложнения, % | 21,9 | 8,5 | 0,012 |
Урологические осложнения % | 12,2 | 8,5 | 0,392 |
Все инфекционные осложнения, % | 58,5 | 55,5 | 0,744 |
Вирусные инфекции, % | 26,8 | 17,3 | 0,139 |
Бактериальные инфекции, % | 48,8 | 45,7 | 0,744 |
Грибковые инфекции, % | 14,6 | 5,0 | 0,026 |
Сердечно-сосудистые осложнения, % | 26,8 | 9,8 | 0,003 |
Онкологические осложнения, % | 0,0 | 3,0 | 0,614 |
Смерть с функционирующим трансплантатом, % | 17,1 | 5,5 | 0,012 |
Потеря трансплантата (без учета смерти реципиента), % | 14,6 | 9,5 | 0,448 |
Потеря трансплантата (включая смерть реципиента), % | 31,7 | 15,1 | 0,004 |
Обращает на себя внимание значимо более высокий процент отсроченной функции трансплантата в группе пациентов с развившимся впоследствии ПТСД. Интересно, что у пациентов с ПТСД значимо выше была частота хирургических осложнений (21,9% по сравнению с 8,5% у больных без ПТСД, p=0,012), которые включали кровотечения, образование гематом и лимфоцеле, требовавших хирургической коррекции, разрывы трансплантата, нагноение послеоперационной раны, нагноение хода перитонеального катетера у пациентов на ПД. В то время как частота вирусных и бактериальных инфекций была сходной в сравниваемых группах, доля пациентов с грибковыми осложнениями была значимо выше в группе пациентов с ПТСД - 14,6% против 5,0% в группе без диабета, p=0,026.
За время наблюдения 17,1% больных с ПТСД погибли с функционирующим ренальным трансплантатом, и этот показатель был значимо выше, чем в группе пациентов без диабета, в которой доля больных, умерших с работающим трансплантатом, составила 5,5%, p=0,012. По частоте потери трансплантата без учета смерти пациента достоверных различий между группами не выявлено, однако потеря трансплантата, включая смерть реципиента с функционирующей почкой, была значимо выше у пациентов с ПТСД - 31,7% за весь период наблюдения против 15,1%, p=0,026.
Для более тонкой оценки влияния ПТСД на результаты ТП были проанализированы кривые выживаемости реципиентов и трансплантатов с помощью метода Каплана-Майера (рис. 1, 2).
Оказалось, что и выживаемость реципиентов, и выживаемость почечных трансплантатов была достоверно хуже у пациентов с ПТСД. Особенно заметными эти различия становятся при больших сроках наблюдения. При этом у больных с ПТСД выживаемость трансплантатов, цензурированная по смерти пациентов (когда смерть пациента с функционирующим трансплантатом не учитывалась как потеря трансплантата), достоверно не отличалась от соответствующего показателя у реципиентов без диабета.
Структура причин смерти с функционирующим трансплантатом была сходной в обследуемых группах. В группе без ПТСД умерли 22 пациента из 398, при этом 6 (27,3%) больных умерли от сердечно-сосудистых осложнений, 10 (45,5%) - от инфекций (во всех случаях это были тяжелые пневмонии), 2 (9,1%) - от злокачественных опухолей, 4 (18,2%) - от других причин. Среди пациентов с ПТСД, умерших с функционирующим трансплантатом (7 больных), от соответствующих причин погибли 2 (28,6%), 3 (42,9%), 0 (0%) и 2 (28,6%) больных. Различия между группами по структуре причин смерти не были достоверными.
ОБСУЖДЕНИЕ
В нашем одноцентровом ретроспективном исследовании при средних сроках наблюдения пациентов после ТП почти 5 лет частота развития ПТСД составила 9,3%, что примерно соответствует данному показателю у европейских пациентов с почечным трансплантатом, но ниже, чем частота ПТСД в США, что обусловлено, по-видимому, различиями в этническом составе больных [6, 8]. По нашим данным, реципиенты с развившимся ПТСД были старше и имели исходно более высокий индекс массы тела по сравнению с больными без диабета, хотя различия между группами только стремились к статистической достоверности. Представляется весьма важным, что в группе ПТСД было значимо больше пациентов с претрансплантационным метаболическим синдромом, который описан в литературе как значимый фактор риска посттрансплантационного диабета [17]. По-видимому, при ведении после ТП пациентов с метаболическим синдромом (без исходного сахарного диабета) необходима особая клиническая настороженность в отношении развития нарушений углеводного обмена в послеоперационном периоде. Кроме того, модификация образа жизни, физические нагрузки, диета с ограничением легкоусвояемых углеводов могут быть особенно эффективными в предотвращении ПТСД именно у этих пациентов [34].
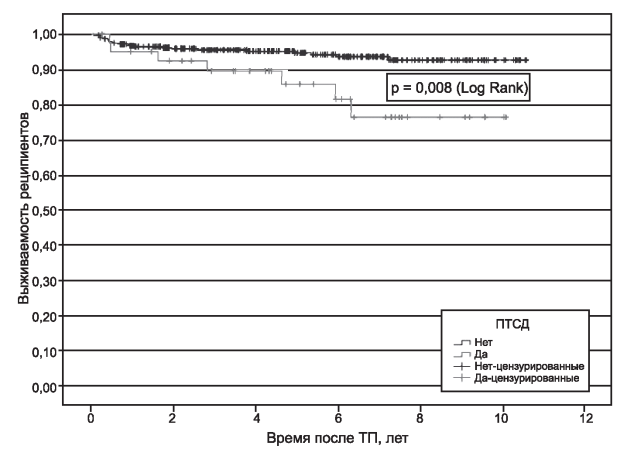
Рис. 1. Выживаемость реципиентов ренального трансплантата с ПТСД и без ПТСД.
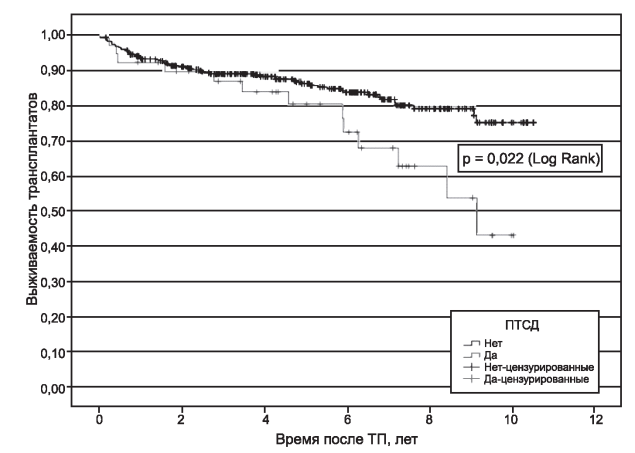
Рис. 2. Выживаемость ренальных трансплантатов у пациентов с ПТСД и без ПТСД.
Не обнаружено различий между пациентами с ПТСД и без диабета по доле больных с поликистозом почек, носительству аллелей HLA A28, A30, B27, модальности ЗПТ и продолжительности ЗПТ до трансплантации. Примечательно, что мы также не выявили влияния особенностей иммуносупрессивной терапии на частоту развития ПТСД. Группы не различались по доле больных, получавших ТАК или ЦсА, доле пациентов на иммуносупрессии без кортикостероидов, суммарной дозе метилпреднизолона, хотя считается, что ТАК и кортикостероиды способствуют более частому развитию ПТСД [4, 11, 18, 35]. Вероятнее
всего, мы не смогли показать влияние бесстеро- идной схемы иммуносупрессии на частоту ПТСД из-за малого числа реципиентов, не получающих кортикостероиды в составе поддерживающей иммуносупрессии. С другой стороны - мета-анализ результатов отмены кортикостероидов через 3-6 мес после ТП не выявил влияния такой тактики на частоту ПТСД [36]. Более того, некоторое увеличение частоты острого отторжения при ранней отмене стероидов может нивелировать благоприятное влияние бесстероидной иммуно супрессии на метаболизм глюкозы [36].
Вероятно, отсутствие различий в частоте развития сахарного диабета после ТП между группами пациентов, получающих ТАК или ЦсА, можно объяснить, по крайней мере, частично практикой нашего центра трансплантации, предусматривающей более быстрое снижение поддерживающей дозы пероральных кортикостероидов при приеме ТАК по сравнению с иммуносупрессией на основе ЦсА, а также относительно невысокие целевые концентрации ТАК в крови (не более 14 нг/мл в раннем послеоперационном периоде, не более 8 нг/мл - в позднем).
В нашем исследовании, как и в ранее опубликованных работах, ПТСД у большинства пациентов (92,6%) развивался в раннем послеоперационном периоде. Достаточно крупное исследование показало, что у 52,4% реципиентов ПТСД был диагностирован в первые 6 мес после операции, а еще у 11,5% - от 6 до 12 мес [5], а в группе французских пациентов с почечным трансплантатом медиана интервала между ТП и манифестацией ПТСД составила 1,6 мес [6]. Характерной особенностью ПТСД с дебютом в раннем послеоперационном периоде является снижение выраженности гипергликемии при дальнейшем наблюдении на фоне постепенного снижения дозы кортикостероидов и концентрации ингибиторов кальцинейрина в крови, что также было показано в нашей группе пациентов: доля больных с диабетом, которые корригировали гликемию только диетой, возросла с течением времени более чем в 6 раз.
В группе пациентов с ПТСД было больше пациентов с отсроченной функцией трансплантата и с хирургическими осложнениями, что не так просто объяснить. Одним из механизмов повышения частоты вновь возникшего диабета у реципиентов с вышеуказанными осложнениями может быть острый и хронический системный воспалительный ответ, известный как фактор риска метаболических нарушений [37]. При отсроченной функции описана более высокая частота острого отторжения трансплантата, которое обычно купируют внутривенным введением метилпреднизолона, что может являться пусковым механизмом ПТСД. Однако мы не обнаружили разницы в частоте острого и хронического отторжения ренального трансплантата, суммарной дозе метилпреднизолона между группами пациентов с ПТСД и без него в отличие от исследования E.S. Siraj et al., в котором ПТСД был ассоциирован с повышением частоты острого отторжения трансплантированной почки [38]. При этом не совсем ясно, являлся ли в вышеупомянутом исследовании ПТСД причиной криза отторжения или лечение отторжения трансплантата кортикостероидами способствовало манифестации диабета.
Важнейшей причиной смерти пациентов после ТП и потери трансплантатов являются инфекционные осложнения. В континууме причин склонности к инфекциям реципиентов солидных органов одну из главных ролей играет иммуносупрессия, однако метаболические нарушения тоже могут вносить свой вклад. Мы не выявили повышения общей частоты инфекционных осложнений у наших пациентов с ПТСД, как и частоты вирусных и бактериальных инфекций, но частота развития грибковых инфекций у них была достоверно выше в сравнении с пациентами без сахарного диабета.
Представляется крайне важным, что пациенты с ПТСД в нашем исследовании имели достоверно более высокую частоту сердечно-сосудистых осложнений и чаще умирали с функционирующим почечным трансплантатом по сравнению с больными без нарушений углеводного обмена. Выживаемость реципиентов и трансплантатов (с учетом смерти с функционирующим трансплантатом) также была достоверно хуже в группе реципиентов с ПТСД, что подтверждает высокую клиническую значимость сахарного диабета, развившегося после трансплантации. В большинстве исследований в этой области также выявлено негативное влияние ПТСД на выживаемость пациентов с трансплантированной почкой, а также повышение риска кардиоваскулярных осложнений при ПТСД [8, 24, 39]. Однако по структуре причин смерти с функционирующим трансплантатом группы больных с ПТСД и без данного осложнения не различались; в обеих группах ведущей причиной летальности были инфекционные осложнения (фатальные вирусно-бактериально-пневмоцистные пневмонии), а сердечно-сосудистые заболевания занимали второе место. По нашим данным, как и по данным других авторов, снижение выживаемости ренальных трансплантатов обусловлено при ПТСД не повышением частоты отторжения, а увеличением летальности пациентов с функционирующим трансплантатом [25].
ЗАКЛЮЧЕНИЕ
ПТСД был и остается серьезной проблемой у пациентов после ТП, особенно с учетом того, что средний возраст больных, которым выполняется трансплантация, становится выше, а доля пациентов с тХПН, имеющих повышенный индекс массы тела, метаболический синдром, возрастает. ПТСД способствует увеличению частоты грибковых инфекций, сердечно-сосудистых осложнений у пациентов с трансплантированной почкой, снижает выживаемость реципиентов и ренальных трансплантатов. Безусловно, профилактика ПТСД (в том числе - индивидуализация иммуносупрессии, предупреждение инфекций, диета, физические нагрузки), своевременная диагностика нарушений углеводного обмена и адекватная коррекция гликемии способны минимизировать негативное влияние ПТСД на частоту осложнений посттран- сплантационного периода и улучшить результаты ТП.
Список литературы
1. First MR, Dhadda S, Croy R et al. New onset diabetes after transplantation (NODAT): an evaluation of definitions in clinical trials. Transplantation 2013; 96: 58-64. doi: 10.1097/TP.0b013e318293fcf8
2. Lv C, Chen M, Xu M et al. Influencing factors of new-onset diabetes after a renal transplant and their effects on complications and survival rate. PLoS One 2014; 9: e99406. doi: 10.1371/journal.pone.0099406
3. Balla A, Chobanian M. New-onset diabetes after transplantation: a review of recent literature. Curr Opin Organ Transplant 2009; 14: 375-379. doi: 10.1097/MOT.0b013e32832dbb98
4. Palepu S, Prasad GV. New-onset diabetes mellitus after kidney transplantation: Current status and future directions. World J Diabetes 2015; 6(3): 445-455. doi: 10.4239/wjd.v6.i3.445
5. Elmagd MM, Bakr MA, Metwally AH, Wahab AM. Clinicoepidemiologic study of posttransplant diabetes after living donor renal transplant. Exp Clin Transplant 2008; 6: 42-47. pmid: 17400559
6. Kamar N, Mariat C, Delahousse M et al. Diabetes mellitus after kidney transplantation: a French multicentre observational study. Nephrol Dial Transplant 2007; 22: 1986-1993. doi: 10.1093/ndt/gfm011
7. Ahmed IAM, Osman RKH, Khalifa NO et al. New-onset diabetes after transplant in a Sudanese renal transplant population: prevalence and risk factors. Exp Clin Transplant 2017 Jun 28. doi: 10.6002/ect.2016.0198
8. Kasiske BL, Snyder JJ, Gilbertson D, Matas AJ. Diabetes mellitus after kidney transplantation in the United States. Am J Transplant 2003; 3: 178-185. doi: 10.1034/j.1600-6143.2003.00010.x
9. Cheungpasitporn W, Thongprayoon C, Vijayvargiya P et al. The risk for new-onset diabetes mellitus after kidney transplantation in patients with autosomal dominant polycystic kidney disease: a systematic review and meta-analysis. Can J Diabetes 2016; 40(6): 521-528. doi: 10.1016/j.jcjd.2016.03.001
10. Chakkera HA, Weil EJ, Swanson CM et al. Pretransplant risk score for new-onset diabetes after kidney transplantation. Diabetes Care 2011; 34: 2141-2145. pmid: 21949218
11. Rodrigo E, Fernández-Fresnedo G, Valero R et al. Newonset diabetes after kidney transplantation: risk factors. J Am Soc Nephrol 2006; 17: S291-S295. doi: 10.1681/ASN.2006080929
12. Impedovo SV, Ditonno P, Ricapito V et al. Advanced age is not an exclusion criterion for kidney transplantation. Transplant Proc 2013; 45: 2650-2653. doi: 10.1016/j.transproceed.2013.08.003
13. Chen Y, Sampaio MS, Yang JW et al. Genetic polymorphisms of the transcription factor NFATc4 and development of new-onset diabetes after transplantation in Hispanic kidney transplant recipients. Transplantation 2012; 93: 325-330. doi: 10.1097/TP.0b013e31823f7f26
14. Nicoletto BB, Souza GC, Fonseca NK et al. Association between 276G/T adiponectin gene polymorphism and new-onset diabetes after kidney transplantation. Transplantation 2013; 96: 1059-1064. doi: 10.1097/TP.0b013e3182a45283
15. Tavira B, Gómez J, Díaz-Corte C et al. Mitochondrial DNA haplogroups and risk of new-onset diabetes among tacrolimustreated renal transplanted patients. Gene 2014; 538: 195-198. doi: 10.1016/j.gene.2014.01.036
16. Sarno G, Muscogiuri G, De Rosa P. New-onset diabetes after kidney transplantation: prevalence, risk factors, and management. Transplantation 2012; 93: 1189-1195. pmid: 22475764
17. Israni AK, Snyder JJ, Skeans MA, Kasiske BL. Clinical diagnosis of metabolic syndrome: predicting new-onset diabetes, coronary heart disease, and allograft failure late after kidney transplant. Transpl Int 2012; 25: 748-757. doi: 10.1111/j.1432-2277.2012.01488.x
18. Pereira MJ, Palming J, Rizell M et al. Cyclosporine A and tacrolimus reduce the amount of GLUT4 at the cell surface in human adipocytes: increased endocytosis as a potential mechanism for the diabetogenic effects of immunosuppressive agents. J Clin Endocrinol Metab 2014; 99: E1885-E1894. doi: 10.1210/ jc.2014-1266
19. Gyurus E, Kaposztas Z, Kahan BD. 1. Sirolimus therapy predisposes to new-onset diabetes mellitus after renal transplantation: a long-term analysis of various treatment regimens. Transplant Proc 2011; 43: 1583–1592. doi: 10.1016/j.transproceed.2011.05.001
20. Dedinská I, Laca Ľ, Miklušica J et al. Correlation between CMV infection and posttransplantation new-onset diabetes mellitus. Int J Org Transplant Med 2016; 7 (3): 173-182. pmid: 27721964
21. Okumi M, Unagami K, Hirai T et al. Diabetes mellitus after kidney transplantation in Japanese patients: the Japan academic consortium of kidney transplantation study. Int J Urol 2017; 24(3):197-204. doi: 10.1111/iju.13253
22. Mourad G, Glyda M, Albano L et al. Incidence of posttransplantation diabetes mellitus in de novo kidney transplant recipients receiving prolonged-release tacrolimus-based immunosuppression with 2 different corticosteroid minimization strategies: ADVANCE, a randomized controlled trial. Transplantation 2017; 101(8): 1924-1934. doi: 10.1097/TP.0000000000001453
23. Serrano OK, Kandaswamy R, Gillingham K et al. Rapid discontinuation of prednisone in kidney transplant recipients: 15-year outcomes from the University of Minnesota. Transplantation 2017 Apr 3. doi: 10.1097/TP.0000000000001756 [Epub ahead of print]
24. Cosio FG, Pesavento TE, Kim S et al. Patient survival after renal transplantation: IV. Impact of post-transplant diabetes. Kidney Int 2002; 62: 1440-1446. pmid: 12234317
25. Cole EH, Johnston O, Rose CL, Gill JS. Impact of acute rejection and new-onset diabetes on long-term transplant graft and patient survival. Clin J Am Soc Nephrol 2008; 3: 814-821. doi: 10.2215/CJN.04681107
26. Cooper L, Oz N, Fishman G et al. New onset diabetes after kidney transplantation is associated with increased mortality – a retrospective cohort study. Diabetes Metab Res Rev 2017 Jul 21. doi: 10.1002/dmrr.2920
27. Lo C, Jun M, Badve SV et al. Glucose-lowering agents for treating pre-existing and new-onset diabetes in kidney transplant recipients. Cochrane Database Syst Rev 2017 Feb 27;2:CD009966. doi: 10.1002/14651858.CD009966.pub2
28. Shivaswamy V, Boerner B, Larsen J. Post-transplant diabetes mellitus: causes, treatment, and impact on outcomes. Endocr Rev 2016; 37(1): 37–61. doi: 10.1210/er.2015-1084
29. Definition, diagnosis, and classification of diabetes mellitus and its complications: report of a WHO consultation. Part 1: diagnosis and classification of diabetes mellitus (WHO/NCD/ NCS/99.2). Geneva: World Health Organization; 1999
30. Sharif A, Hecking M, de Vries APJ et al. Proceedings from an international consensus meeting on posttransplantation diabetes mellitus: recommendations and future directions. Am J Transplant 2014; 14(9): 1992–2000. doi: 10.1111/ajt.12850
31. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. В: Дедов ИИ, Шестакова МВ, Майоров АЮ., ред. Сахарный диабет 2017; 20(1S): 1-112. doi: 10.14341/dm20171s8 [Algoritmy specializirovannoj medicinskoj pomoshhi bol’nym saharnym diabetom / Pod redakciej Dedova II, Shestakovoj MV, Majorova AJu. Saharnyj diabet. 2017; 20(1S): 1-112. doi: 10.14341/dm20171s8]
32. Alberti KG, Zimmet P, Shaw J; IDF Epidemiology Task Force Consensus Group. The metabolic syndrome: a new worldwide definition. Lancet 2005; 366: 1059 –1062. doi: 10.1016/S0140-6736(05)67402-8
33. Alberti KG, Eckel RH, Grundy SM et al. Harmonizing the metabolic syndrome. Circulation 2009; 120: 1640-1645. doi: 10.1161/circulationaha.109.192644
34. Sharif A, Moore R, Baboolal K. Influence of lifestyle modification in renal transplant recipients with postprandial hyperglycemia. Transplantation 2008; 85: 353–358
35. Weir MR, Fink JC. Risk for post transplant diabetes mellitus with current immunosuppressive medications. Am J Kidney Dis 1999; 34: 1–13. doi: 10.1016/S0272-6386(99)70101-0
36. Pascual J, Galeano C, Royuela A, Zamora J. A systematic review on steroid withdrawal between 3 and 6 months after kidney transplantation. Transplantation 2010; 90(4): 343-349. doi: 10.1097/TP.0b013e3181e58912
37. Hotamisligil GS. Inflammation and metabolic disorders. Nature 2006; 444(7121): 860-867. doi: 10.1038/nature05485
38. Siraj ES, Abacan C, Chinnappa P et al. Risk factors and outcomes associated with posttransplant diabetes mellitus in kidney transplant recipients. Transplant Proc 2010; 42: 1685–1689
39. Wauters RP, Cosio FG, Suarez Fernandez ML et al. Cardiovascular consequences of new-onset hyperglycemia after kidney transplantation. Transplantation 2012; 94: 377–382
Об авторах
Е. И. ПрокопенкоРоссия
Прокопенко Елена Ивановна - доктор медицинских наук, факультет усовершенствования врачей, кафедра трансплантологии, нефрологии и искусственных органов.
129110, Москва, ул. Щепкина, д. 61/2, тел.: (495) 684-57-91
А. В. Ватазин
Россия
Ватазин Андрей Владимирович - доктор медицинских наук, проф., факультет усовершенствования врачей, кафедра трансплантологии, нефрологии и искусственных органов.
129110, Москва, ул. Щепкина, д. 61/2, тел.: (495) 684-54-53
Е. О. Щербакова
Россия
Щербакова Евгения Оттовна - кандидат медицинских наук, факультет усовершенствования врачей, кафедра трансплантологии, нефрологии и искусственных органов.
129110, Москва, ул. Щепкина, д. 61/2, тел.: (495) 684-57-91
Р. О. Кантария
Россия
Кантария Русудана Отаровна - кандидат медицинских наук, факультет усовершенствования врачей, кафедра трансплантологии, нефрологии и искусственных органов.
129110, Москва, ул. Щепкина, д. 61/2, тел.: (495) 684-57-91
Рецензия
Для цитирования:
Прокопенко Е.И., Ватазин А.В., Щербакова Е.О., Кантария Р.О. ПОСТТРАНСПЛАНТАЦИОННЫЙ САХАРНЫЙ ДИАБЕТ У РЕЦИПИЕНТОВ РЕНАЛЬНОГО ТРАНСПЛАНТАТА: ОПЫТ ОДНОГО ЦЕНТРА. Нефрология. 2017;21(6):20-28. https://doi.org/10.24884/1561-6274-2017-21-6-20-28
For citation:
Prokopenko E.I., Vatazin A.V., Shcherbakova E.O., Kantariya R.O. NEW-ONSET DIABETES MELLITUS AFTER KIDNEY TRANSPLANTATION: SINGLE CENTER EXPERIENCE. Nephrology (Saint-Petersburg). 2017;21(6):20-28. (In Russ.) https://doi.org/10.24884/1561-6274-2017-21-6-20-28
JATS XML








































