Перейти к:
НОВЫЙ ОБРАЗ ВИТАМИНА К – БОЛЬШЕ, ЧЕМ ФАКТОР СВЕРТЫВАНИЯ КРОВИ
https://doi.org/10.24884/1561-6274-2018-22-1-29-37
Аннотация
Введение. Двадцать лет назад стало известно, что метаболизм витамина К связан с гемостазом. С тех пор были установлены разнообразные функции витамина, опосредованные через его кофакторы – Gla-протеины. В многочисленных публикациях подтверждено, что Gla-протеины участвуют не только в свертывании крови, но и ответственны за другие физиологические процессы, например, метаболизм костной ткани, состояние сосудов и энергетический гомеостаз.
Цель. Представить новые данные о роли витамина К в физиологических процессах вне системы гемостаза, а также оценить потенциальную возможность его применения для предотвращения заболеваний сердечно-сосудистой и костной систем.
Материалы и методы. Был проведен поиск в международных базах данных Scopus, PubMed и Google Scholar по ключевым словам: «vitamin K», «vitamin K2», «vitamin K osteoporosis», «vitamin K metabolism», «vitamin K deficiency», bone metabolism», «vitamin K cardiovascular diseases», «vitamin K osteocalcin», «osteocalcin», «matrix Gla-protein», «vitamin K matrix Gla-protein».
Результаты. Структура и биологическое действие витамина К. Витамин К во всех молекулярных формах, за исключением длинных менахинонов (МК-10, МК-13), хорошо абсорбируется в кишечнике. Витамин К1 менее активен и в большей степени участвует в поддержании гемостаза, в то время как МК-4 и МК-7 более активны и содержатся в основном вне печени (в частности, в сосудистой стенке), активируя там витамин К-зависимые белки. Рекомендуемая дневная доза витамина К составляет 120 и 90 мкг/сут для мужчин и женщин соответственно. Наибольшая безопасная доза МК-7, рекомендованная Schurgers и соавт. для пациентов, получающих пероральные антикоагулянты и приводящая к допустимым вариациям протромбинового времени, – 50 мкг/сут. Витамин К действует как кофактор для гаммаглутамилкарбоксилазы, который превращает остатки глутамата недокарбоксилированных Gla-белков (Glu) в остатки гамма-карбоксиглутамата (Gla), образующие кальций-связывающие центры. В ходе этого процесса хинон витамина К под действием витамин К-эпоксид редуктазы (vitamin K-epoxide reductase; VKOR) преобразуется в гидрохинон (КН2), необходимый для посттрансляционного карбоксилирования. Далее неактивный КН2 переходит в эпоксид витамин К, который, в свою очередь, ретрансформируется из хинона витамина К под действием варфарин-чувствительной VKOR.
Витамин К-зависимые протеины как биомаркеры статуса витамина К. Gla-протеины включают печеночные факторы коагуляции – II, VII, IX, X, протеины С, S и Z, как и внепеченочные Gla-протеины, такие как остеокальцин (ОС), матриксные Gla-протеины (MGP), блокирующий рост специфический белок 6 (growth-arrest specific gene 6 protein; Gas6), пролин-богатый Gla белки 1 и 2, конантокин G и T, Gla-богатый протеин (GRP) [14]. Гамма-карбоксилирование этих Gla-протеинов необходимо для осуществления их роли по захвату кальция Са2+ и внедрения его в кристаллы гидроксиапатита. Недостаток витамина К может привести к неадекватному карбоксилированию Gla-протеинов, что, в свою очередь, будет препятствовать вышеописанному процессу.
Остекальцин. Два типа ОК могут быть обнаружены в сыворотке – карбоксилированный ОC (cОC) и недокарбоксилированный (ucОC). Разные исследования показали, что низкое потребление витамина К приводит к повышению ucОC, а высокое – к преобладанию cОC. Функции ОC не до конца понятны, однако, известно, что ucОC сыворотки обратно коррелирует с минеральной плотностью бедренной кости и прямо – с риском ее перелома.
Матриксный Gla-протеин (MGP). MGP экспрессируется во многих тканях и действует как местный ингибитор сосудистой кальцификации, причем ингибиторная активность зависит от посттрансляционной модификации MGP, включающей карбоксилирование остатков Gla и фосфорилирование серина. Первый из этих процессов является витамин К-зависимым. Карбоксилированная и фосфорилированная форма MGP (cMGP) функционально активна и способна предотвратить эктопическую кальцификацию и апоптоз гладкомышечных клеток сосудистой стенки, в то время как декарбоксилированный и дефосфорилированный MGP (ucMGP) функционально не активен [29]. Было показано, что концентрация общего циркулирующего MGP ассоциирована с факторами риска ишемической болезни сердца, повышенный уровень дефосфорилированного MGP был обнаружен у пациентов с атеросклерозом, а недокарбоксилированного MGP – у больных с сердечно-сосудистыми заболеваниями, причем оба коррелировали со степенью васкулярной кальцификации.
Блокирующий рост специфический белок 6 (Gas6). Gas6 до сих пор недостаточно изучен, но его функции связаны с регуляцией клеточного роста, миграцией и пролиферацией, выживаемостью клетки, апоптозом, узнаванием умирающей клетки, фагоцитозом, клеточной адгезией, миелинизацией нервного волокна. Итогом взаимодействия Gla-компонета Gas6 и производных кумарина может быть прогрессирование широкого спектра патологий, включая рак, сердечно-сосудистые, неврологические заболевания, аутоиммунные процессы, а также хроническая болезнь почек. Gas6 играет важную роль в атерогенезе. Так, он индуцирует хемотаксис гладкомышечных клеток сосудов и вместе с Axl-рецептором опосредует прогрессирование атеросклеротических повреждений.
Богатый Gla-протеин (GRP). Полностью гамма-карбоксилированный GRP включает 15 остатков карбоксиглутамата (Gla). Такая высокая плотность остатков Gla в GRP, его уникальная способность связывать кальций и высокие распространенность/содержание в тканях млекопитающих позволяют предположить критичную функцию GRP как глобального модулятора обмена кальция. Исследования in vitro показали, что GRP накапливается в местах патологической аккумуляции кальция; этот белок способен напрямую связывать кристаллы фосфата кальция и действовать как негативный регулятор остеогенной дифференцировки и ингибитор сосудистой и суставной кальцификации.
Недостаточность витамина К и патологические состояния у человека Применение пероральных антикоагулянтов.
Пероральные антикоагулянты действуют как антагонисты витамина К и взаимодействуют с MGP и GRP. Долгосрочное применение непрямых антикоагулянтов может быть ассоциировано с незначительным повышением хрупкости костей и риском перелома в связи с остеопорозом. Второй потенциальный побочный эффект, который может быть спровоцирован этой терапией, – сосудистая кальцификация.
Недостаточность витамина К как фактор риска хронической болезни почек (ХБП). В последние годы недостаточность витамина К была описана как новый патологический механизм сосудистой кальцификации у больных с ХБП. Низкий статус витамина К у пациентов ГД может быть связан с диетой, ограничивающей потребление натрия и калия, так как эти электролиты присутствует в тех же пищевых источниках, что и витамины К1 и К2. Следует отметить, что потребление витамина К с пищей у больных ГД достаточно для поддержания нормального гемостаза, но может быть недостаточно для адекватного карбоксилирования и активации Gla-протеинов, что приводит в итоге к снижению ингибирования кальцификации MGP и повышению жесткости артерий.
Заключение. Хорошо известна классическая роль витамина К в активации печеночных Gla-протеинов, ответственных за нормальный гемостаз. В последние годы описаны новые функции витамин К-зависимых Gla-протеинов, включая ингибирование сосудистой кальцификации (MGP, GRP), регуляцию костного метаболизма (ОК) и сигнальных путей (Gas6). До сих пор многое не до конца понятно в отношении конкретной роли различных форм внепеченочных Gla-протеинов, как и в отношении потребности в витамине К в здоровом и больном состояниях. Надлежащая коррекция дефицита витамина К может улучшить состояние костной ткани и артериальных сосудов.
Для цитирования:
Петкова Н.И., Петрова К.Б., Близнакова М.И., Паскалев Д.Н., Галунска Б.Т. НОВЫЙ ОБРАЗ ВИТАМИНА К – БОЛЬШЕ, ЧЕМ ФАКТОР СВЕРТЫВАНИЯ КРОВИ. Нефрология. 2018;22(1):29-37. https://doi.org/10.24884/1561-6274-2018-22-1-29-37
For citation:
Petkova N.Y., Petrova K.B., Bliznakova M.I., Paskalev D.N., Galunska B.T. THE NEW FACE OF VITAMIN K – MORE THAN BLOOD CLOTTING FACTOR. Nephrology (Saint-Petersburg). 2018;22(1):29-37. https://doi.org/10.24884/1561-6274-2018-22-1-29-37
INTRODUCTION
The discovery of vitamin K belongs to the Danish biochemist Carl Peter Henrik Dam (1895-1976). During his work (1928-1930) in the Biochemical Institute at the Copenhagen University Dam observed hemorrhagic disorders in chickens on cholesterol and fat- free diet for 2-3 weeks. He noted a new coagulation disorder accompanied with lengthened blood clotting time, anemia and hemorrhage [1].
Ten years later, E.A. Doisy's group isolated an active substance related to this blood clotting disorder. Although at the time the isolated substance had not been established, chemical and physical properties were correctly attributed to a substituted 1,4-naphthoquinone. Subsequent works by H. Dam, rewarded with the Nobel Prize for medicine in 1943 «for his discovery of vitamin K», with E.A. Doisy «for his discovery of the chemical nature of vitamin K», led to the characterization of the molecule termed as vitamin K (Koagulationsvitamin) [2].
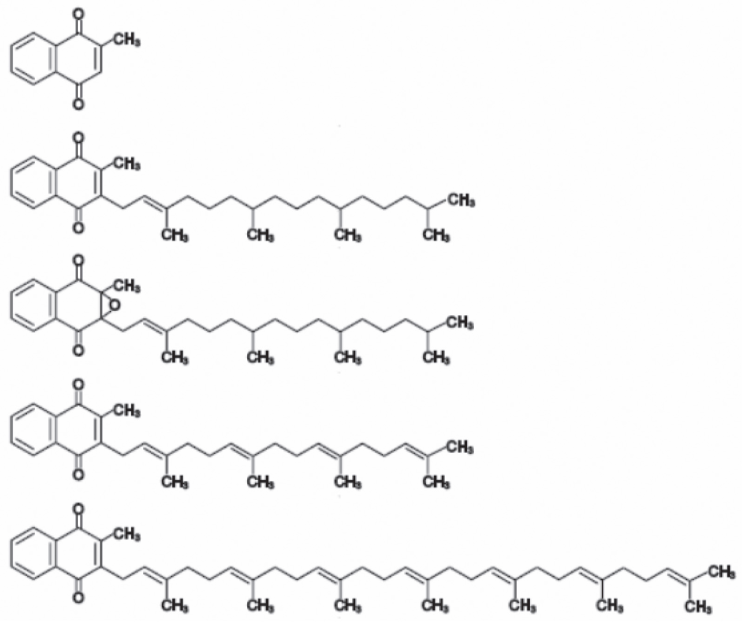
Figure 1. Chemical structures of vitamin K forms (after [7]). From top: menadione, phylloquinone (vitamin K1), phylloquinone epoxide, menaquinone-4 (MK-4), menaquinone-7 (MK-7).
Рис. 1. Химическая структура форм витамина К (по [7]). Сверху вниз: менадион, филлохинон (витамин К1), филлохинон эпоксид, менахинон-4 (МК-4), менахинон-7 (МК-7).
Until the last two decades, the role of vitamin K was related only to blood clotting. Nowadays a multiple new faces of vitamin K were discovered. Many of these functions are mediated by old and newly discovered vitamin K dependent Gla-proteins and take place in bone metabolism, inhibition of vascular calcification, cell signaling, energy and glucose homeostasis.
The current review does not cover all aspects of vitamin K functions. A certain aspects of vitamin K and Gla-proteins role beyond the hemostasis were selected.
Literature search was done using the online databases Scopus, PubMed and Google Scholar. In total 26024 results since 2007 were found and reviewed. The following keywords were used: «vitamin K», «vitamin K2», «vitamin K osteoporosis», «vitamin K metabolism», «vitamin K deficiency», bone metabolism», «vitamin K cardiovascular diseases», «vitamin K osteocalcin», «osteocalcin», «matrix Gla-protein», «vitamin K matrix Gla-protein».
Structure and biologic action of vitamin K
Vitamin K includes structurally similar fat-soluble compounds containing 2-methyl-1,4-naphthoquinone ring and naturally occurring in two forms - vitamin K1 and vitamin K2 [3]. The former, also known as phylloquinone, is made in plants and algae where it is a structural component of photosynthesis chain [4]. Phylloquinone is the main type of dietary vitamin K found in green leafy vegetables. Menaquinones (vitamin K2) are referred to as MK-n, where n stands for the number of isoprenoid residues in their aliphatic chain. Menaquinones are of bacterial origin and are the major form of vitamin K in tissues. Its natural sources include fermented foods such as Japanese traditional food natto (fermented soybeans), cheese, yogurt, curd, meat, dairy, and eggs [5]. In mammalian tissues, MK-4 is the only vitamin K2 subtype that can be produced by reconstruction of phylloquinone and probably other menaquinones [6]. It should be noticed that a third, synthetic form is known - vitamin K3 (menadione) (Fig. 1).
All molecular forms of vitamin K except longchain menaquinones (MK-10, MK-13) are well absorbed. Vitamin K1 is less active and supports mainly homeostasis, while MK-4 and MK-7 are more active and accumulate preferably in extra hepatic tissues and vascular walls activating vitamin K-dependent proteins outside the liver [7]. The long-chain menaquinones are with lowest vitamin K activity [8, 9]. Vitamin K does not have a carrier protein, but is rather transported by triglyceride-rich lipoproteins (for both K1 and MK) and low-density lipoproteins (for MK only) [10, 7, 11]. Compared to phylloquinone and MK-4 MK-7 reveals longer plasma half-life (1-2 hours vs 4 days) and 2.5-fold better bioavailability than that of phylloquinone after oral intake [8].
The recommended daily dose for vitamin K1 is 120 and 90 μg/d for males and females, respectively [12]. An upper safety limit recommended by Schurg- ers et al for MK-7 is 50 μg/d for patients on oral anticoagulant treatment resulting in tolerable variations in prothrombin time by anticoagulant therapy [8]. Recently, there is insufficient scientific knowledge about dietary recommendations for menaquinones [3]. According to NHANES 43.0% of men and 62.5% of women met the established minimum for phyllo- quinone [13].
Vitamin K acts as a cofactor for the gamma- glutamyl carboxylase. This enzyme converts the glutamate residues of undercarboxylated Gla-proteins (Glu) into gamma-carboxy glutamate (Gla) residues with the latter forming calcium-binding sites. During this process vitamin K quinone by vitamin K-epoxide reductase (VKOR) or diaphorase is converted to vitamin K hydroquinone (KH2) needed for the posttranslational carboxylation. Next, the inactive KH2 is converted into vitamin K epoxide, which in turn is retransformed into vitamin K quinone by the warfarin-sensitive VKOR. Due to the presence of such active mechanism for vitamin K recycling, there is no storage form of this liposoluble vitamin in the human body. It is found that coumarin oral anticoagulants, such as warfarin, inhibit VKOR and thus interfere with vitamin K-cycle and vitamin K-dependent carboxylation of extrahepatic Gla-proteins (Fig. 2).
Vitamin K dependent proteins as biomarkers for vitamin K status
The Gla-proteins comprise a large family of proteins containing gamma-glutamyl residues in their structure. They include hepatic blood coagulation factors II, VII, IX, X, proteins C, S and Z as well as extra-hepatic Gla-proteins, such as osteocalcin (OC), matrix Gla-protein (MGP), growth-arrest specific gene 6 protein (Gas6), Proline-rich Gla protein 1 and 2, Conantokin G and T , and the Gla-rich protein (GRP) [14]. Apart from their well-known role in coagulation, the Gla-proteins participate in bone metabolism (OC), blood vessel repair (MGP and GRP), cell growth and apoptosis regulation (Gas6), tumor growth suppression, signal transduction and sphin- golipid synthesis [7]. The gamma-carboxylation of these Gla proteins is essential for their role to attract Ca2+ and to incorporate it into hydroxyapatite crystals. Vitamin K deficiency may lead to inadequate Gla-protein carboxylation which in turn hampers the before mentioned processes (Fig. 3).
Osteocalcin
Structure and Biosynthesis
Osteocalcin (OC) is one of the products of the vitamin K dependent gamma-glutamyl carboxylation of Gla proteins. OC is the most abundant non-colla- genous protein in bone that is secreted by osteoblasts following multiple post-translational modifications. OC Gla- residues confer high-affinity for binding to hydroxyapatite that explains the high concentration of carboxylated OC attached to the bone matrix. OC is a small Ca2+ -binding protein containing three Gla-residues and is indigenous to the organic matrix of bone, dentin, and possibly other mineralized tissues. It is synthesized by the osteoblasts by a process induced by 1,25(OH)2D3 during bone formation. The serum OC levels are considered as a bone formation biomarker [15, 16].
There are two types of OC that can be found in the blood serum - carboxylated OC (cOC) and undercarboxylated OC (ucOC). Their concentration in the serum depends on the vitamin K saturation of the organism. Different studies showed that low vitamin K intake is related to higher ucOC and higher vitamin K intake results in predomination of cOC. It is considered that, ucOC is a sensitive indicator of vitamin K status [9]. Depending on the immunochemical method used for its determination, the percentage of ucOC (%ucOC), when measured by hydroxyapatite binding assay, or ucOC/cOC ratio, when measured directly, can be used for evaluation of vitamin K status [17].
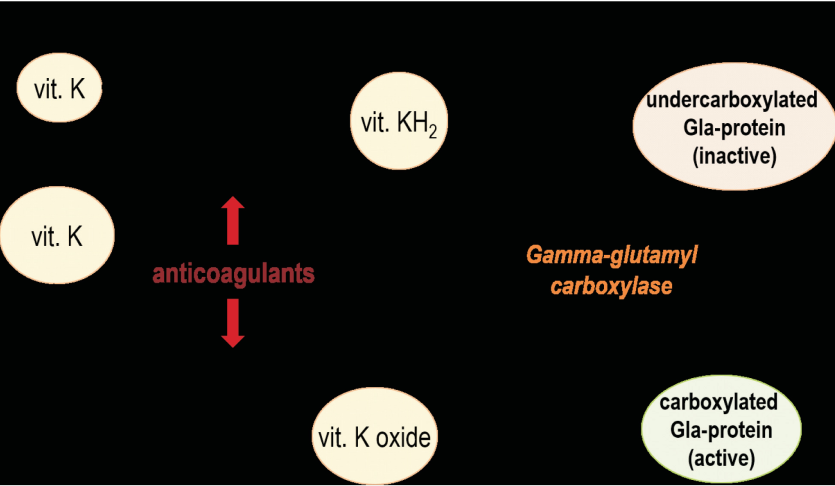
Figure 2. Vitamin K cycle.
Рис. 2. Обмен витамина К.
Витамин К действует как кофактор для гамма-глутамилкарбоксилазы, который превращает остатки глутамата недокарбоксили- рованных Gla-белков (Glu) в остатки гамма-карбоксиглутамата (Gla), образующие кальций-связывающие центры. В ходе этого процесса хинон витамина К под действием витамин К-эпоксид редуктазы (vitamin K-epoxide reductase; VKOR) преобразуется в гидрохинон (КН2), необходимый для посттрансляционного карбоксилирования. Далее неактивный КН2 переходит в эпоксид витамин К, который, в свою очередь, ретрансформируется из хинона витамина К под действием варфарин-чувствительной VKOR.

Figure 3. Biologic role of vitamin K dependent Gla-proteins
Рис. 3. Биологическая роль витамин К-зависимых Gla-протеинов.
Gla-протеины включают печеночные факторы коагуляции - II, VII, IX, X, протеины С, S и Z, как и внепеченочные Gla-протеины, такие как остеокальцин (ОС), матриксные Gla-протеины (MGP), блокирующий рост специфический белок 6 (growth-arrest specific gene 6 protein; Gas6), пролин-богатый Gla белки 1 и 2, конантокин G и T, Gla-богатый протеин (GRP). Гамма-карбоксилирование этих Gla-протеинов необходимо для осуществления их роли по захвату Са2+ и внедрения его в кристаллы гидроксиапатита. Недостаток витамина К может привести к неадекватному карбоксилированию Gla-протеинов, что, в свою очередь, будет препятствовать вышеописанному процессу.
Function and Mechanism of action
Although the exact function of OC is not fully understood, a number of epidemiological studies have been shown a relationship between ucOC concentration, bone health, fracture risk and vitamin K intake. Elevated serum ucOC is reported to correlate inversely with hipbone mineral density and positively with hip fracture risk [18, 19, 20].
Recently the researchers’ interest was attracted by the presumptive role of ucOC on glucose homeostasis and energy metabolism. The first clue for the putative role of ucOC in glucose homeostasis came from animal studies showing that injection of ucOC enhances insulin production and sensitivity when infused into wild-type mice. This indicates that ucOC is the active form of a hormone regulating blood glucose and insulin sensitivity. In vitro experiments on isolated islets and primary adipocytes first revealed that cOC is inactive, while ucOC is active in regulation glucose and energy homeostasis [21, 22]. Studies on humans extrapolate these findings and show that circulating ucOC inversely correlates with clinical parameters related to insulin sensitivity [23]. These studies suggest a protective role for ucOC and raise questions about the role of vitamin K in metabolic disease.
Matrix Gla-protein (MGP)
MGP function
MGP is a secretory protein belonging to the Gla- protein family. It is expressed by a variety of tissues, including heart, lung, kidney, skin, and the arterial vessel wall, where it is synthesized by chondrocytes, vascular smooth muscle cells, endothelial cells, and fibroblasts [24]. The first clue for the inhibitory role of MGP on soft tissue calcification came from MGP knockout mice who died within 8 weeks of birth from ruptures of the large blood vessels due to massive vascular mineralization [25]. MGP acts as a local inhibitor of vascular calcification. The inhibitory activity of MGP fully depends on its post-translational modification, including carboxylation of the Gla-residues and phosphorylation of serine. [26]. The first one of these processes is vitamin K-dependent. Experimentally the role of vitamin K on vascular mineralization was proved in a rat model of warfarin-induced vascular calcification where high dietary vitamin K intake inhibits the progression of vascular mineralization by 40% [27]. Yagami et al. have also have proven that the triggering factor of calcification was the treatment with vitamin K antagonists, i.e. with warfarin [28].
The carboxylated and phosphorylated form of MGP (cMGP) is functionally active, capable to prevent ectopic calcification and vascular smooth muscle cells apoptosis, while the decarboxylated and dephos- phorylated MGP (dp-uc MGP) is functionally inactive [29].
MGP in vascular tissue
Immunohistochemical studies have shown that in healthy vessels MGP is synthesized at relatively low rate, most likely due to the low need for calcification inhibition. Using conformation-specific antibodies capable to detect cMGP and ucMGP was concluded that ucMGP accumulates in atherosclerotic and calcified arteries, while the cMGP was almost absent. The accumulation of ucMGP in the calcified arteries leads to a decrease of its circulating level, therefore modifying the balance between tissue and circulating ucMGP. Thus the level of ucMGP can be used as a biochemical non-invasive marker for cardiovascular calcifications. Experimental studies on rats treated with warfarin demonstrated accumulation of ucMGP around the calcified lesions of the arteries. In addition, it was concluded that high vitamin K intake led to improved MGP carboxylation, regression of preformed calcifications and following increase of vascular elasticity [24, 30, 31]. Both expression levels and activity status of MGP may help to understand its exact function in the local inhibition of vascular calcification and the role of vitamin K supplementation therapy as a therapeutic approach for enhancing the activity of MGP and probably a calcification reducing factor.
Circulating MGP as a biomarker
Currently circulating MGP forms are not well- researched. Mature MGP is highly insoluble and it is not understood how and if it circulates as a free protein or associated with a carrier. Full-length MGP has been extracted from the plasma of rats in a complex with calcium, phosphate, carboxylated MGP and fetuin. MGP can undergo two posttranslational modifications: the aminoacid sequence 3-15 with three serine (ser) residues can be phosphorylated and aminoacid sequence 35-53 containing four glutamate residues (Glu) can be carboxylated into gamma-car- boxylglutamate (Gla). These modifications yield different MGP conformations which can circulate freely in the blood stream and their levels depend on the rate of MGP local synthesis and binding to calcified areas. Development of immunochemical assays to distinguish different forms of MGP allowed evaluating its role as non-invasive molecular biomarker. It was shown that total circulating MGP concentration is associated with coronary heart disease risk factors, higher circulating levels of dpMGP were found in patients with atherosclerosis, elevated ucMGP were detected in patients with cardiovascular disease and they correlate with the degree of vascular calcification [31, 32, 33]. The fact that vitamin K subclinical deficiency is related to ectopic calcification, initiate a lot of research on vascular vitamin K status. It is considered that dp-uc-MGP is a good indicator for vascular vitamin K status and it correlates with both cardiac function and mortality in aortic stenosis patients [34]. In hemodialysis patients high dp-uc MGP correlate with the degree of vascular disease [24].
Growth- arrest specific gene 6protein (Gas6)
Along with MGP and OC, another extrahepatic Gla-protein worth paying attention to is growth-arrest specific gene 6 protein (Gas6). Gas6 is still not that well studied but its functions are associated with cell growth regulation, migration and proliferation, cell survival, apoptosis, recognition of dying cells, phagocytosis, cell adhesion, cognition and nerve my- elination.
Gas6, a product of the growth arrest-specific gene 6, is a secreted protein (75 kDa) containing 11-12 carboxyglutamic acid (Gla) residues. It reveals a 43% amino acid sequence identity with protein S, known as a negative regulator of blood coagulation. Gas6 serves as a ligand for a subfamily of receptor tyrosine kinases, which function is dependent on the presence of Gla residues. These Gla-residues are formed because of post-translational transformation of Gas6 glutamic acid residues in a reaction catalyzed by the vitamin K-dependent gamma-glutamyl carboxylase. It was demonstrated that the incomplete carboxylation of Gas6 results in loss of biological activity [35]. Consequently, interfering with its Gla-content by using coumarin derivatives may influence the progress of a wide variety of pathologies including cancer, cardio vascular disease, neurological diseases, and autoimmune disease and kidney disorders.
Gas 6 plays a role in atherogenesis. Thus, it induces the chemotaxis of vascular smooth muscle cells, and together with its Axl-receptor, contributes to the progression of atherosclerotic lesions. Gas 6 and, possibly protein S as well, could inhibit calcification due to their effects on apoptosis- they may prevent apoptosis of vascular smooth muscle cells and endothelial cells. Atherosclerotic lesions showed excessive apoptosis that has been proposed as the cause of calcification initiation [36].
In the nervous system, Gas6 is involved in chemo- taxis, cell growth, and myelination. These actions are mediated by binding and activation of TAM receptors. Gas6 has been shown to regulate sexual maturation during development by activation signaling pathways such as phosphatidylinositol 3-kinase (PI3K) signaling pathway and mitogen-activated protein kinases (MAPK) [35].
Gla-rich protein (GRP)
GRP is the newest member of the vitamin K- dependent protein (VKDP) family, first identified in sturgeon calcified cartilage. Fully γ-carboxylated GRP includes highest number of γ-carboxyglutamic acid (Gla) residues amongst other Gla-proteins (15 Gla residues in human). This high density of Gla residues in GRP, its outstanding capacity for calcium- binding, and its wide pattern of tissue distribution/ accumulation in mammals, have suggested a critical function of GRP as global calcium modulator [37]. In vitro studies have shown that GRP accumulates in sites of pathologic calcium accumulation; it reveals capacity for direct binding of calcium phosphate crystals and acts as a negative regulator of osteogenic differentiation and inhibitor of vascular and articular calcification [38, 39, 40]. Additionally, recently has been shown that GRP is involved in the crosstalk between inflammation and calcification of articular tissues in osteoarthritis, acting as an antiinflammatory agent [41].
Summarizing the data about the biological role of GRP it may be concluded that together with MGP and fetuin-A it is a member of a calcification inhibitory system and acts as a back-up system for calcium binding and soft tissue/vascular calcification prevention.
Vitamin K deficiency in human pathology
Usage of oral anticoagulants
With the growing information about the role of vitamin K dependent extrahepatic Gla-proteins beyond blood coagulation, attention should be paid to the possibility of side effects of the use of non-direct oral anticoagulants. Oral anticoagulant therapy (coumarin and its derivatives - warfarin, acenocoumarol, etc.) is a widely used treatment of subjects with increased thrombosis risk. These anticoagulants act as vitamin K antagonists and interfere with MGP and GRP functionalities. Studies from the literature show that long-term use of non-direct oral anticoagulants may be associated with a modestly increased bone fragility and osteoporotic fracture risk. A second potential adverse effect is that vascular calcification may be promoted [42].
Vitamin K deficiency as a risk factor in chronic kidney disease (CKD)
The most cause of death in CKD patients is related to increased cardiovascular diseases (CVD). Higher risk of CVD is due to the overlapping of classical risk factors of atherosclerosis with specific one for CKD patients as altered calcium and phosphate metabolism; hyperhomocysteinemia; renal anemia; increased oxidative stress; micro inflammatory state etc. Phosphate is the principle substrate that is deposited in the arterial wall. Phosphate can activate transcription of certain genes in vascular smooth muscle cells (VSCM) and pericytes, leading to their transformation in osteoblast-like cells and thus to «ossifica- tion» of the arterial wall [43, 44]. In the last years, vitamin K deficiency as a novel pathologic mechanism for vascular calcification in CKD patients was described. Study of E.C. Cranenburg et al (2012) reported low vitamin K intake in 40 hemodialysis (HD) patients as compared to a reference population of healthy adults in the Netherlands. Low vitamin K status in HD-patients may be related to sodium and potassium restricted dietary regimen inasmuch as sodium and potassium are naturally present in the main dietary sources for both vitamin K1 and K2. It seems that dietary vitamin K intake in HD-patients is sufficient to maintain normal blood clotting, but could be not enough for satisfactory carboxylation and activation of Gla-proteins finally leading to decreased calcification-inhibitory effect of MGP and arterial hardening [45, 24, 46].
Study on vitamin K status evaluated by the levels of ucOC in Bulgarian postmenopausal women on HD revealed four times higher plasma levels of ucOC compared to the control group. The concentration of ucOC was positively correlated with parathyroid hormone (PTH) levels and the duration of HD treatment. Additionally, the increased ucOC was positively associated with the reduced bone density and the 10- year risk of osteoporosis fractures. The authors proposed that supplementation with vitamin K may have beneficial effect on bone health in postmenopausal women on chronic HD treatment. [47].
CONCLUSIONS
It is well known the classical role of vitamin K in activation of liver Gla-proteins responsible for normal hemostasis. In the last years a new roles of vitamin K dependent Gla-proteins are elucidated including vascular calcification inhibition (MGP, GRP), bone metabolism (OC) regulation of signal transduction (Gas6). There are still many uncertainties over the precise role of the various forms of extrahepatic Gla-proteins, as well as the need of vitamin K supplementation in health and disease.
Considerably more work is required in the area of vitamin K including understanding relative bioavailability, optimal tissue-specific status indicators and the relative importance of gamma-carboxylation status to the growing number of health outcomes that may be influenced by vitamin K inadequacy.
Список литературы
1. Dam H. Cholesterin Stoffweschel in Huhnereiern and Huhnchen. Biochemische Zeitschrift 1929;215:475-792
2. Binkley SB, MacCorquodale DW, Thayler SA et al. The isolation of vitamin K. J Biol Chem 1939;130:219-234
3. Beulens JW, Booth SL, van den Heuvel EG et al. The role of menaquinones (vitamin K2) in human health. Br J Nutr 2013;110 (8):1357-1368
4. Gröber U, Reichrath J, Holick MF et al. Vitamin K: an old vitamin in a new perspective. Dermatoendocrinol 2014;6(1):e968490-2
5. Maresz K. Proper Calcium Use: Vitamin K2 as a Promoter of Bone and Cardiovascular Health. Integrative Medicine 2015;14(1):34-39
6. Conly JM, Stein K. The production of menaquinones (vitamin K2) by intestinal bacteria and their role in maintaining coagulation homeostasis. Prog Food Nutr Sci 1992;16(4):307-343
7. Shearer M, Newman P. Metabolism and cell biology of vitamin K. Thromb Haemost 2008;100:530-547
8. Schurgers LJ, Teunissen KJ, Hamulyák K et al. Vitamin Kcontaining dietary supplements: comparison of synthetic vitamin K1 and natto-derived menaquinone-7. Blood 2007:109(8):3279-3283
9. Booth SL, Al Rajabi A. Determinants of vitamin K status in humans. Vitam Horm 2008;78:1-22
10. Shearer MJ, Fu X, Booth SL. Vitamin K Nutrition, Metabolism, and Requirements: Current Concepts and Future Research. Adv Nutr 2012;3:182–195
11. Schurgers JL, Vermeer C. Differential lipoprotein transport pathways of K-vitamins in healthy subjects. Biochimica et Biophysica Acta 2002;1570:27-32
12. Food and Nutrition Board, Insititue of Medicne. Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Zinc. Institute of Medicine (US) Panel on Micronutrients. Washington (DC): National Academies Press (US) (2001) ISBN-10: 0-309-07279-4 ISBN-10: 0-309-07290-5
13. Harshman SG, Finnan EG, Barger KJ et al. Vegetables and Mixed Dishes Are Top Contributors to Phylloquinone Intake in US Adults: Data from the 2011-2012 NHANES. J Nutr 2017;147(7):1308-1313
14. Cranenburg EC, Schurgers LJ, Vermeer C. Vitamin K: the coagulation vitamin that became omnipotent. Thromb Haemost 2007;98(1):120-125
15. Rehder DS, Gundberg CM, Booth SL et al. Gammacarboxylation and fragmentation of osteocalcin in human serum defined by mass spectrometry. Mol Cell Proteomics 2015;14:1546–1555
16. Shea MK, Booth SL. Concepts and Controversies in Evaluating Vitamin K Status in Population-Based Studies. Nutrients 2016; 8(8):1-25
17. Theuwissen E, Magdeleyns EJ, Braam LA et al. Vitamin K status in healthy volunteers. Food Funct 2014;5:229–234
18. Knapen MH, Drummen NE, Smit E et al. Three-year low-dose menaquinone-7 supplementation helps decrease bone loss in healthy postmenopausal women. Osteoporos Int 2013;24:2499–2507
19. Emaus N, Gjesdal CG, Almas B et al. Vitamin K2 supplementation does not influence bone loss in early menopausal women: A randomised double-blind placebo-controlled trial. Osteoporos Int 2010;21:1731–1740
20. Bolton-Smith C, McMurdo ME, Paterson CR et al. Twoyear randomized controlled trial of vitamin K1 (phylloquinone) and vitamin D3 plus calcium on the bone health of older women. J Bone Miner Res 2007;22:509–519
21. Ferron M, McKee MD, Levine RL et al. Intermittent injections of osteocalcin improve glucose metabolism and prevent type 2 diabetes in mice. Bone 2012;50:568–575
22. Ferron M, Hinoi E, Karsenty G et al. Osteocalcin differentially regulates beta cell and adipocyte gene expression and affects the development of metabolic diseases in wild-type mice. Proc Natl Acad Sci USA 2008;105:5266–5270
23. Pollock NK, Bernard PJ, Gower BA et al. Lower uncarboxylated osteocalcin concentrations in children with prediabetes is associated with beta-cell function. J Clin Endocrinol Metab 2011;96:E1092–E1099
24. Schurgers L, Uitto J, Reutelingsperger C. Vitamin Kdependent carboxylation of matrix Gla-protein: a crucial switch to control ectopic mineralization. Trends in Molecular Medicine 2013;19(4):2017-226
25. Luo G, Ducy P, McKee MD et al. Spontaneous calcification of arteries and cartilage in mice lacking matrix GLA protein. Nature 1997;386(6620):78-81
26. Murshed M, Schinke T, McKee MD et al. Extracellular matrix mineralization is regulated locally; different roles of two gla-containing proteins. J Cell Biol 2004;165:625–630
27. Schurgers LJ, Spronk HM, Soute BA et al. Regression of warfarin-induced medial elastocalcinosis by high intake of vitamin K in rats. Blood 2007;109:2823–2831
28. Yagami K, Enomoto-Iwamoto M, Koyama E et al. New role for matrix Gla protein in skeletogenesis. 46-th Annual Meeting, Orthopaedic Research Society. (Orlando, Florida, March 12-15, 2000)
29. Guanghong J, Stormont RM, Gangahar DM et al. Role of matrix Gla protein in angiotensin II-induced exacerbation of vascular calcification. Am J Physiol Heart Circ Physiol 2012;303:H523– H532
30. Schurgers LJ, Cranenburg EC, Vermeer C. Matrix Glaprotein: the calcification inhibitor in need of vitamin K. Thromb Haemost 2008;100(4):593-603
31. Schurgers LJ, Teunissen KJ, Knapen MH et al. Reutelingsperger, JP. Cleutjens, C. Vermeer. Novel conformation-specific antibodies against matrix gamma-carboxyglutamic acid (Gla) protein: undercarboxylated matrix Gla protein as marker for vascular calcification. Arterioscler Thromb Vasc Biol 2005;25:1629–1633
32. O’Donnell CJ, Shea JMK, Price PA et al. Matrix Gla protein is associated with risk factors for atherosclerosis but not with coronary artery calcification. Arterioscler Thromb Vasc Biol 2006;26:2769–2774
33. Parker BD, Schurgers LJ, Brandenburg VM et al. The associations of fibroblast growth factor 23 and uncarboxylated matrix Gla protein with mortality in coronary artery disease: the Heart and Soul Study. Ann Intern Med 2010;152:640–648
34. Ueland T, Gullestad L, Dahl CP et al. Undercarboxylated matrix Gla protein is associated with indices of heart failure and mortality in symptomatic aortic stenosis. J Intern Med 2010;268:483–492
35. Ferland G. Vitamin K and the Nervous System: An Overview of its Actions. Adv Nutr 2012;3:204–212
36. Jiang L, Liu CY, Yang QF et al. Plasma Level of Growth Arrest–Specific 6 (GAS6) Protein and Genetic Variations in the GAS6 Gene in Patients With Acute Coronary Syndrome. Am J Clin Pathol 2009;131:738-743
37. Viegas CS, Simes DC, Laizé V et al. Gla-rich protein (GRP), a new vitamin K-dependent protein identified from sturgeon cartilage and highly conserved in vertebrates. J Biol Chem 2008;283(52):36655-36664
38. Viegas CS, Cavaco S, Neves PL et al. Gla-rich protein (GRP) is a novel vitamin K dependent protein present in serum and accumulated at sites of pathological calcifications. Am J Pathol 2009;175:2288-2298
39. Viegas CS, Herfs M, Rafael MS et al. Gla-rich protein is a potential new vitamin K target in cancer: evidences for a direct GRP-mineral interaction. Biomed Res Int 2014;2014:340216
40. Viegas CS, Rafael MS, Enriquez JL et al. Gla-rich protein (GRP) acts as a calcification inhibitor in the human cardiovascular system. Arterioscler Thromb Vasc Biol 2015;35:399-408
41. Cavaco S, Viegas CS, Rafael MS et al. Gla-rich protein is involved in the cross-talk between calcification and inflammation in osteoarthritis. Cell Mol Life Sci 2016;73:1051-1065
42. van Gorp RH, Schurgers LJ. New Insights into the Pros and Cons of the Clinical Use of Vitamin K Antagonists (VKAs) Versus Direct Oral Anticoagulants (DOACs). Nutrients 2015;7(11):9538–9557
43. Gluba-Brzózka A, Michalska-Kasiczak M, Franczyk-Skóra B et al. Markers of increased cardiovascular risk in patients with chronic kidney disease. Lipids Health Dis. 2014;13:135
44. Stompór T. Coronary artery calcification in chronic kidney disease: An update. World J Cardiol 2014;6(4):115-129
45. Cranenburg EC Schurgers, LJ, Uiterwijk HH et al. Vitamin K intake and status are low in hemodialysis patients. Kidney Int 2012; 82(5):605-610
46. McCabe K, Adams M, Holden M. Vitamin K status in chronic kidney disease. Nutrients 2013;5:4390-4398
47. Zhelyazkova-Savova M, Galunska B, Gerova D et al. Undercarboxylated Osteocalcin in Postmenopausal Patients on hemodialysis. Nephrology (St. Petersburg) 2011;15(3):35-39
Об авторах
Н. И. ПетковаБолгария
Варна
К. Б. Петрова
Болгария
Варна
М. И. Близнакова
Болгария
Варна
Д. Н. Паскалев
Болгария
Варна
Б. Т. Галунска
Болгария
Варна
Рецензия
Для цитирования:
Петкова Н.И., Петрова К.Б., Близнакова М.И., Паскалев Д.Н., Галунска Б.Т. НОВЫЙ ОБРАЗ ВИТАМИНА К – БОЛЬШЕ, ЧЕМ ФАКТОР СВЕРТЫВАНИЯ КРОВИ. Нефрология. 2018;22(1):29-37. https://doi.org/10.24884/1561-6274-2018-22-1-29-37
For citation:
Petkova N.Y., Petrova K.B., Bliznakova M.I., Paskalev D.N., Galunska B.T. THE NEW FACE OF VITAMIN K – MORE THAN BLOOD CLOTTING FACTOR. Nephrology (Saint-Petersburg). 2018;22(1):29-37. https://doi.org/10.24884/1561-6274-2018-22-1-29-37
JATS XML








































