Перейти к:
БЕЗОПАСНОСТЬ ПРИМЕНЕНИЯ ЭМПАГЛИФЛОЗИНА В ОТНОШЕНИИ ПОЧЕК У НОРМОГЛИКЕМИЧЕСКИХ КРЫС С СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТЬЮ
https://doi.org/10.24884/1561-6274-2018-22-1-83-90
Аннотация
Цель: оценить влияние ингибитора глюкозонатриевого котранспортера SGLT-2 эмпаглифлозина на состояние почек у недиабетических крыс линии Wistar c экспериментальной сердечной недостаточностью.
Материал и методы. Хроническую сердечную недостаточность (СН) моделировали путем лигирования левой коронарной артерии. Первую группу составили 11 животных с СН, у которых проводили лечение эмпаглифлозином («Джардинс®», «Берингер Ингельхайм») внутрь в дозе 1 мг/кг в течении 3 мес. Во второй группе крыс с СН (n=10) препарат не назначали. У животных измеряли мочевые концентрации и величины суточной экскреции глюкозы, белка и альбумина. В образцах мочи также устанавливалась экспрессия миРНК-21. Морфологическое исследование ткани почек выполнялось с помощью световой микроскопии.
Результаты. Назначение эмпаглифлозина экспериментальным животным приводило к закономерно более высоким значениям диуреза, концентрации глюкозы в моче и ее суточной экскреции. Не было выявлено значимых различий в уровнях альбуминурии и протеинурии или экспрессии миРНК-21 в моче в группах с эмпаглифлозином и без него. У животных, получавших препарат, обнаружено несколько менее выраженное повреждение клеток тубулярного эпителия по сравнению с крысами только с сердечной недостаточностью.
Заключение. Полученные данные, по крайней мере, подтверждают безопасность длительного применения эмпаглифлозина в отношении почек даже в условиях высокого риска.Для цитирования:
Оковитый С.В., Береснева О.Н., Парастаева М.М., Иванова Г.Т., Ивкин Д.Ю., Ивкина А.С., Сиповский В.Г., Зарайский М.И., Карпов А.А., Кучер А.Г., Богданова Е.О., Сиповская Е.Б., Куликов А.Н., Каюков И.Г. БЕЗОПАСНОСТЬ ПРИМЕНЕНИЯ ЭМПАГЛИФЛОЗИНА В ОТНОШЕНИИ ПОЧЕК У НОРМОГЛИКЕМИЧЕСКИХ КРЫС С СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТЬЮ. Нефрология. 2018;22(1):83-90. https://doi.org/10.24884/1561-6274-2018-22-1-83-90
For citation:
Okovity`i` S.V., Beresneva O.N., Parastaeva M.M., Ivanova G.T., Ivkin D.Yu., Ivkina A.S., Sipovskii V.G., Zaraiyskii` M.I., Karpov A.A., Kucher А.G., Bogdanova E.O., Sipovskaya E.B., Kulikov A.N., Kayukov I.G. EMPAGLIFLOZIN RENAL SAFETY IN NORMOGLYCEMIC RATS WITH HEART FAILURE. Nephrology (Saint-Petersburg). 2018;22(1):83-90. (In Russ.) https://doi.org/10.24884/1561-6274-2018-22-1-83-90
ВВЕДЕНИЕ
В настоящей работе продолжается описание результатов длительного эксперимента, посвященного изучению влияния конкурентного ингибитора натрий-глюкозного котранспортера проксимальных канальцев почек (SGLT-2) - эмпаглифлозина (Эмп) на состояние сердечно-сосудистой системы и почек у нормогликемических крыс. Некоторые данные, полученные при выполнении данного исследования, уже были опубликованы ранее [1, 2].
Сахарный диабет (СД) является тяжелым мультисистемным заболеванием, ассоциирующимся с наличием сердечно-сосудистых проявлений и выраженными повреждениями почек и мочевыводящих путей [3]. В Западной Европе и США примерно у 40% всех пациентов, требующих регулярной диализной терапии, причиной терминальной почечной недостаточности (ТПН) является СД [4]. В свою очередь, развитие ТПН определяется наличием при СД экстра- и интраренального атеросклероза и диабет-ассоциированного повреждения клубочков (диабетическая нефропатия - ДН). Кроме того, в почках у больных с СД часто наблюдается выраженное интерстициальное воспаление [5]. Наконец, пациенты-диабетики составляют группу высокого риска в отношении контраст-индуцированного острого повреждения почек (КИ-ОПП). Они же часто страдают от бактериальных инфекций мочевых путей, иногда приводящих к поражениям почечной ткани как таковой [6].
Мультисистемность СД требует терапевтических подходов и лекарственных препаратов, способных оказывать плейотропные воздействия [7-9]. Например, желательно, чтобы антигипер- гликемические препараты оказывали прямое, кар- дио- и(или) нефропротекторное воздействия [10].
Таким условиям во многом соответствуют конкурентные ингибиторы мембранного натрий/глю- козного котранспортера - SGLT-2. Имеющиеся данные не оставляют сомнений в том, что ингибиторы SGLT-2 обладают целым рядом позитивных плейотропных терапевтических эффектов, в том числе кардио- и нефропротекторным [7-11]. Однако далеко не все вопросы относительно последствий их применения (в том числе в плане кардио- и особенно нефропротекции) остаются разрешенными. Большинство исследований, подтвердивших нефро- и кардиопротективное действия ингибиторов SGLT-2, выполнены на пациентах с сахарным диабетом или экспериментальных моделях данного заболевания. В такой ситуации нефро- и кардиопротективные эффекты данных препаратов могли быть следствием их метаболического (антигипергликемического) действия. Собственные же кардиальные и ренальные влияния ингибиторов SGLT-2 могут оказаться замаскированным. Кроме того, не известны многие конкретные механизмы воздействия этих средств на сердечно-сосудистую систему и почки. В силу этих обстоятельств было предпринято настоящее исследование, в котором изучали потенциальные нефро- и кардиопротекторные эффекты ингибитора SGLT-2 эмпаглифлозина у крыс линии Wistar с экспериментальной сердечной недостаточностью (СН). В данном сообщении преимущественно описаны последствия сравнительно длительной экспозиции (3 мес) эмпаглифлозина на состояние почек на морфологическом и функциональном уровне.
МАТЕРИАЛ И МЕТОДЫ
Исследование проведено на взрослых крысах- самцах стока Wistar массой 190-210 г (n=21), разделенных с помощью рандомизации на две группы. Хроническую сердечную недостаточность (СН) моделировали путем перманентного лигирования левой коронарной артерии [11]. Первую группу (группа интервенции, СН+Эмп) составили 11 крыс, у которых моделировали ХСН, и через 1 мес после операции начинали лечение эмпаглифлозином («Джардинс®», «Берингер Ингельхайм») внутрь в дозе 1 мг/кг. Вторую группу (группа сравнения, СН) составили 10 крыс с ХСН, не получавших лечения.
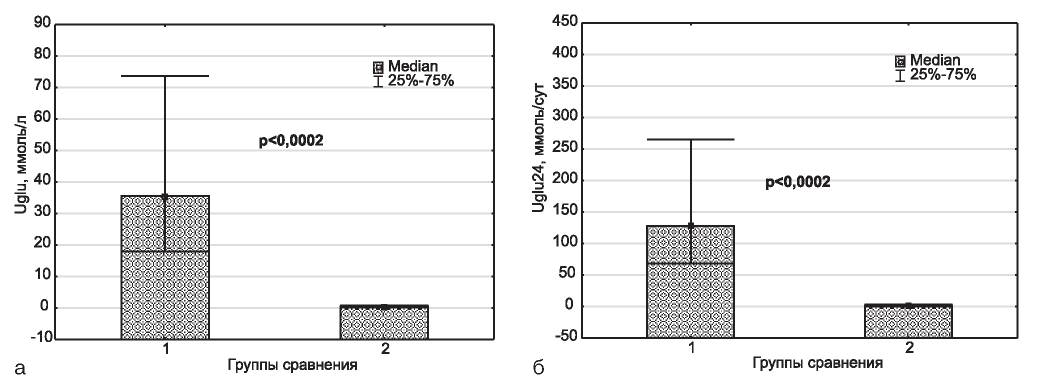
Рис. 1. Концентрация (а) в моче и суточная экскреция (б) глюкозы в сравниваемых группах. 1 - СН+Эмп, 2 - СН.
Срок наблюдения составил 3 мес. После операции оценивали эффективность модели эхокардиографическим методом, критериями успешности модели ХСН считали наличие участков истончения миокарда, нарушений локальной и/или глобальной сократимости левого желудочка (ЛЖ).
Животные получали стандартный пищевой рацион (0,34% NaCl). Доступ к воде был свободным. Через 3 мес после начала применения эм- паглифлозина крыс помещали в метаболические клетки для сбора мочи в течение суток. Объем мочи (V) измеряли и с помощью стандартных лабораторных анализаторов определялись мочевые концентрации альбумина (UA) и общего белка (UTP), рассчитывали величины суточной экскреции (UX24, где Х - концентрация соответствующего вещества) этих веществ.
В образцах мочи также устанавливали экспрессию микроРНК-2 (миРНК-21) при помощи реакции амплификации (RealTime PCR-протокол). Расчет проводили по методу 2deltaCt.

Рис. 2. Объем мочи (диурез) в сравниваемых группах. 1 - СН+Эмп, 2 - СН.
Для патогистологического исследования фрагменты почечной паренхимы каждого животного фиксировали незамедлительно после получения образцов ткани в 4% параформальдегиде на фосфатном буфере, рН 7,4, в течение 24 ч при комнатной температуре. После стандартной обработки тканевых фрагментов (обезвоживание и пропитка) из парафиновых блоков были приготовлены 4-5 мкм серийные срезы.
Препараты окрашивались реактивом Шиффа (PAS), трихромальной окраской (Masson), гематоксилином и эозином. Изучение патоморфологических изменений проводилось в светооптическом микроскопе «Carl Zeiss Imager Z2» (Германия). Оценка патогистологических изменений проводилась при обзорной микроскопии. Анализ патоморфологических изменений кортикального и медуллярного слоев оценивался по распространенности того или иного патологического признака [отсутствует, незначительный (до 25%), умеренный (<50%), выраженный (>50%)].
Статистический анализ выполнялся с помощью пакета прикладных программ STATISTICA 10. Результаты представлялись как медиана [ин- терквартильный размах]. Использован тест Манна-Уитни.
Все исследования проведены в соответствии с Приказом Министерства здравоохранения и социального развития РФ от 23 августа 2010 г. № 708н «Об утверждении Правил лабораторной практики» при одобрении этическим комитетом ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России.
РЕЗУЛЬТАТЫ
Назначение эмпаглифлозина экспериментальным животным приводило к закономерно более высоким значениям, как концентрации глюкозы в моче, так и ее суточной экскреции (рис. 1).
В группе интервенции выявлены, также, значимо большие величины суточного объема мочи (рис. 2).
Уровни протеинурии (рис. 3) и альбуминурии (рис. 4) в группах сравнения статистически значимо не различались.
Также не было выявлено значимых отличий в уровнях экспрессии миРНК-21 в моче у крыс с СН, получавших и не получавших эмпаглифлозин (рис. 5).
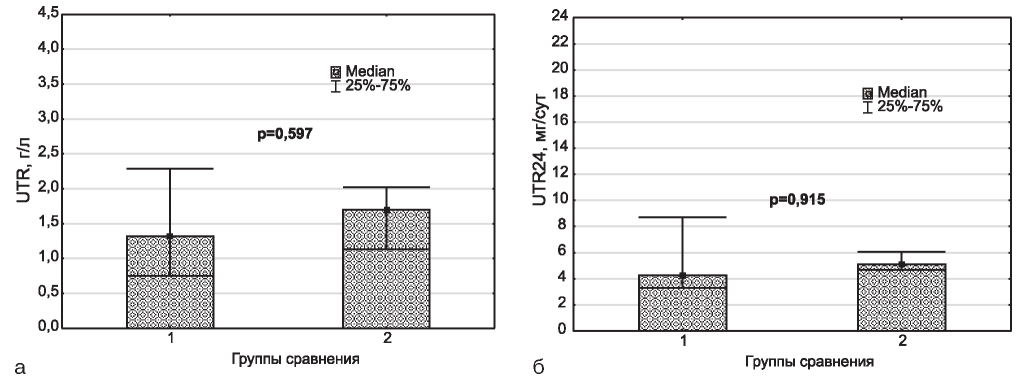
Рис. 3. Концентрация (а) в моче и суточная экскреция (б) общего белка в сравниваемых группах. 1 - СН+Эмп, 2 - СН.

Рис. 4. Концентрация (а) в моче и суточная экскреция (б) альбумина в сравниваемых группах. 1 - СН+Эмп, 2 - СН.

Рис. 5. Экспрессия микроРНК-21 в моче в группах сравнения. 1 - СН+Эмп, 2 - СН.
В обеих группах были детектированы схожие патоморфологические изменения. В клубочках наблюдалось сморщивание тонких базальных мембран капилляров клубочков, в которых фокальносегментарно располагались эритроцитарные микротромбы и круглоклеточные лейкоциты, однако без гломерулита. В капсуле изменений не было, склероза капиллярных петель не наблюдалось.
В мезангии фокально-сегментарно выявлялись признаки экспансии мезангиального матрикса и гиперклеточности. Существенных различий в описанных структурных изменениях между группами не было выявлено.

Рис. 6. А. Выраженные дистрофические изменения эпителия канальцев в периваскулярной зоне вплоть до некробиоза у животных с СН, не получавших эмпаглифлозин - белая стрелка. Б. Минимальные дистрофические изменения эпителия канальцев в периваскулярной зоне у животных с СН, получавших эмпаглифлозин - белая стрелка. Окраска PAS. Ув. х200.

Рис. 7. Периартериальный склероз у экспериментальных животных с СН - белая стрелка. Окраска по Массону. Ув. х200.
В тубулоинтерстиции (ТИН) наблюдались признаки исчезновения щеточной каемки эпителия канальцев паренхимы. Распространенными проявлениями были гиалиново-капельная и вакуо- лярная дистрофии. В сосудистом русле ТИН отмечалось очаговое полнокровие перитубулярных микрососудов.
Были обнаружены некоторые различия в выраженности патологических изменений между группами. Так, более выраженные дистрофические изменения клеток тубулярного эпителия с деструкцией щеточной каемки, вакуолизацией цитоплазмы и очаговым некробиозом наиболее часто (в соотношении 1:3) выявлялись у крыс с ХСН, не получавших эмпаглифлозин, по сравнению с группой, получавшей лечение. Причем локализация данных изменений отмечалась в юкстамедуллярной зоне, преимущественно вокруг артериовенозного пучка. Вены при этом были существенно дилатированы (рис. 6, 7).
В артериях у животных обеих групп были выявлены признаки венозного полнокровия, незначительного периартериального отека и склероза. В единичных артериях животных обеих групп отмечались микротромбы.
Суммарно можно констатировать, что в обеих выборках обнаруживается картина хронического венозного полнокровия. Наряду с проявлениями хронических дисциркуляторных изменений в клубочках, периваскулярного склероза и дистрофических изменений эпителия канальцев в обеих группах, определенные структурные различия все же имели место (см. рис. 6, 7). Выявленные различия, в принципе можно трактовать как несколько менее выраженное повреждение клеток эпителия у крыс с СН+Эмп по сравнению с животными с СН.
ОБСУЖДЕНИЕ
Ранее мы опубликовали сведения о последствиях месячной экспозиции эмпаглофлозина в плане, прежде всего, почек. Такие последствия выражались в закономерном нарастании концентрации глюкозы в моче и ее суточной экскреции. Концентрация альбумина в моче у лабораторных животных сравниваемых групп значимо не различалась. Между тем, суточная экскреция этого белка у крыс группы интервенции оказалась значимо большей. Уровень экспрессии миРНК-21 в моче у крыс, получавших эмпаглифлозин, также был выше, чем у животных, не получавших препарат [1]. На первом этапе эксперимента мы также не зафиксировали увеличения объема мочи на фоне приема ингибитора SGLT-2 [1], тогда как трехмесячный прием эмпаглифлозина вызывал значимый рост диуреза (см. рис. 2). Стоит обратить внимание, что медианные значения суточного выведения мочи на первом этапе эксперимента в группе интервенции составили: 4,0 [3,20 - 5,60], в группе сравнения - 3,20 [2,80 - 5,0]; на втором этапе эксперимента в группе интервенции: 3,80 [3,60 - 4,30], в группе сравнения - 2,95 [2,80 - 3,10]. Иначе говоря, величины объема мочи в сравниваемых группах на обоих этапах эксперимента оказывались очень близкими и прослеживалась тенденция к нарастанию этого показателя на фоне назначения препарата. При этом не достижение соответствующего уровня статистической значимости в первом случае, по-видимому, вызвано очень большим разбросом данных, как в группе интервенции, так и в группе сравнения.
Как при месячном, так и при трехмесячном назначении эмпаглифлозина сохранялся стойкий глюкозурический ответ на препарат (см. рис. 1). Однако в отношении двух других изученных параметров - экскреции альбумина и мочевой экспрессии миРНК-21 данные на двух этапах эксперимента существенно различались. Как уже указывалось выше, через месяц после применения эмпаглифлозина суточная экскреция (но не концентрация в моче) альбумина у крыс группы интервенции оказалась значимо большей [1]. В то же время, на описываемом этапе эксперимента значимых межгрупповых различий в уровнях как мочевой концентрации, так и суточной экскреции альбумина установлено не было (см. рис. 4). При трехмесячной экспозиции эмпаглифлозина также не было обнаружено значимых различий в отношении величин экспрессии миРНК-21 в моче (см. рис. 5), тогда как при месячной этот параметр в группе интервенции имел существенную направленность к росту [1].
Таким образом, полученные данные могут указывать на одну довольно интересную вещь. Возможно, на начальных этапах назначения эмпаглифлозина почки неоднозначно реагируют на прием препарата или на вызванные им изменения тубулярного трафика глюкозы, что и выражается в более высоких уровнях мочевой экскреции альбумина или экспрессии миРНК-21 в моче. Однако с течением времени почки адаптируются к возможным негативным ренальным эффектам эмпаглифлозина, полностью сохраняя реакцию на его основное глюкозурическое действие. Возможность такой адаптации подтверждается и морфологическими данными, которые можно трактовать как свидетельство несколько менее выраженного повреждения клеток эпителия у крыс с СН+Эмп по сравнении с животными с СН (см. рис. 6).
ЗАКЛЮЧЕНИЕ
Результаты настоящего исследования в комплексе с данными, полученными ранее, показали, что влияние эмпаглифлозина на состояние почек у нормогликемических крыс с сердечной недостаточностью неоднозначно. На первых этапах экспозиция препарата может вызывать небольшую альбуминурию и нарастание относительного уровня экспрессии миРНК-21 в моче. Однако с течением времени почки адаптируются к возможным негативным последствиям назначения эмпаглифлозина при сохранении его глюкозурического эффекта. Эти данные, по крайней мере, подтверждают безопасность длительного применения данного средства в условиях высокого риска и в отсутствие нарушений углеводного обмена. Анализ морфологических изменений в почках позволяет надеяться на развитие определенного нефропротективного эффекта. Однако данный вопрос требует дальнейшего уточнения.
Список литературы
1. Куликов АН, Береснева ОН, Парастаева ММ и др. Влияние эмпаглифлозина на состояние почек у нормогликемических крыс с сердечной недостаточностью. Нефрология 2017; 21(2): 83-92 [Kulikov AN, Beresneva ON, Parastaeva MM i dr. Vliyanie empagliflozina na sostoyanie pochek u normoglikemicheskih kryis s serdechnoy nedostatochnostyu. Nefrologiya 2017; 21(2): 83-92]
2. Куликов АН, Оковитый СВ, Ивкин ДЮ и др. Эффекты эмпаглифлозина при экспериментальной модели хронической сердечной недостаточности у крыс с нормогликемией. Сердечная недостаточность 2016; 17(6):454-460 [Kulikov AN,Okovityiy SV, Ivkin DYu. Effektyi empagliflozina pri eksperimentalnoy modeli hronicheskoy serdechnoy nedostatochnosti u kryis s normoglikemiey. Serdechnaya nedostatochnost 2016; 17(6):454-460]
3. Смирнов АВ, Добронравов ВА, Кисина АА и др. Клинические рекомендации по диагностике и лечению диабетической нефропатии. Нефрология 2015;19(1): 67-77 [Smirnov AV, Dobronravov VA, Kisina AA i dr. Klinicheskie rekomendacii po diagnostike i lecheniyu diabeticheskoj nefropatii. Nefrologiya 2015;19(1): 67-77]
4. Mima A. Diabetic nephropathy: protective factors and a new therapeutic paradigm. J Diabetes Complications 2013;27(5):526–530
5. Hoshino J, Mise K, Ueno T et al. A pathological scoring system to predict renal outcome in diabetic nephropathy. Am J Nephrol 2015;41(4-5):337–344
6. Patschan D, Müller GA. Acute kidney Injury in diabetes mellitus. Int J Nephrol 2016; 2016:6232909
7. Tang SC, Chan GC, Lai KN. Recent advances in managing and understanding diabetic nephropathy. F1000Res 2016 May 31;5. pii: F1000 Faculty Rev-1044. doi: 10.12688/f1000research.7693.1
8. Vallianou NG, Geladari E, Kazazis CE. SGLT-2 inhibitors: Their pleiotropic properties. Diabetes Metab Syndr 2016; pii: S1871-4021(16)30226-0. doi: 10.1016/j.dsx.2016.12.003. [Epub ahead of print]
9. Vallon V, Thomson SC. Targeting renal glucose reabsorption to treat hyperglycaemia: the pleiotropic effects of SGLT2 inhibition. Diabetologia 2017; 60(2):215-225
10. Бабенко АЮ, Байрашева ВК. Диабетическая нефропатия. Зависит ли ренопротекция от выбора сахароснижающей терапии. Мед совет 2015; (7): 32-43 [Babenko AYU, Bajrasheva VK. Diabeticheskaya nefropatiya. Zavisit li renoprotekciya ot vybora saharosnizhayushchej terapii. Medicinskij sovet 2015; (7): 32-43]
11. Kalra S, Singh V, Nagrale D. Sodium-Glucose Cotransporter-2 Inhibition and the Glomerulus: A Review. Adv Ther 2016; 33(9):1502-1518
Об авторах
С. В. ОковитыйРоссия
Оковитый Сергей Владимирович – профессор, кафедра фармакологии и клинической фармакологии, заведующий кафедрой.
197376, Санкт-Петербург, ул. проф. Попова, д. 14, (812) 234-13-29
О. Н. Береснева
Россия
Береснева Ольга Николаевна - канд. биол. наук, лаборатория клинической физиологии почек, старший научный сотрудник.
197022, Санкт-Петербург, ул. Л.Толстого, д. 17, корп. 54, (812) 346-39-26
М. М. Парастаева
Россия
Парастаева Марина Магрезовна - кандидат биологических наук, лаборатория клинической физиологии почек, старший научный сотрудник.
197022, Санкт-Петербург, ул. Л.Толстого, д. 17, корп. 54. (812) 346-39-26
Г. Т. Иванова
Россия
Иванова Галина Тажимовна - кандидат биологических наук, лаборатория экспериментальной и клинической кардиологии, старший научный сотрудник.
199034, Санкт-Петербург, наб. Макарова, д. 6., (812) 328-07-01
Д. Ю. Ивкин
Россия
Ивкин Дмитрий Юрьевич - кандидат биологических наук, директор.
197376, Санкт-Петербург, ул. Профессор Попова, д. 14, лит. А., (812) 234-13-29
А. С. Ивкина
Россия
Ивкина Арина Сергеевна - лаборатория фармакологических исследований, научный сотрудник.
197376, Санкт-Петербург, ул. Профессор Попова, д. 14, лит. А, (812) 234-13-29
В. Г. Сиповский
Россия
Богданова Евдокия Олеговна - лаборатория биохимического гомеостаза, научный сотрудник.
197022, Санкт-Петербург, ул. Л.Толстого, д. 17, корп. 54, (812) 338-69-01
М. И. Зарайский
Россия
Зарайский Михаил Игоревич - профессор кафедра клинической лабораторной диагностики с курсом молекулярной медицины.
197022, Санкт-Петербург, ул. Л.Толстого, д. 17, корп. 54, (812) 346-39-26
А. А. Карпов
Россия
Карпов Андрей Александрович – младший научный сотрудник.
194156, Санкт-Петербург, ул. Пархоменко, д. 15, (812) 702-51-68А. Г. Кучер
Россия
Кучер Анатолий Григорьевич – профессор, заместитель директора.
197022, Санкт-Петербург, ул. Л.Толстого, д. 17, корп. 54, +7921 4211817
Е. О. Богданова
Россия
Сиповский Василий Георгиевич - кандидат медицинских наук, лаборатория клинической иммунологии и морфологии, заведующий лабораторией.
197022, Санкт-Петербург, ул. Л.Толстого, д. 17, корп. 54, (812) 338-69-32
Е. Б. Сиповская
Россия
Сиповская Елена Борисовна - лаборатория клинической иммунологии и морфологии, научный сотрудник.
197022, Санкт-Петербург, ул. Л.Толстого, д. 17, корп. 54, (812) 338-69-32
А. Н. Куликов
Россия
Куликов Александр Николаевич – профессор, отдел клинической физиологии и функциональной диагностики, руководитель.
197022, Санкт-Петербург, ул. Льва Толстого, д. 6-8., Тел.: (812) 338-71-23
И. Г. Каюков
Россия
Каюков Иван Глебович – профессор, лаборатория клинической физиологии почек, заведующий.
197022, Санкт-Петербург, ул. Л.Толстого, д. 17, корп. 54, (812) 346-39-26
Рецензия
Для цитирования:
Оковитый С.В., Береснева О.Н., Парастаева М.М., Иванова Г.Т., Ивкин Д.Ю., Ивкина А.С., Сиповский В.Г., Зарайский М.И., Карпов А.А., Кучер А.Г., Богданова Е.О., Сиповская Е.Б., Куликов А.Н., Каюков И.Г. БЕЗОПАСНОСТЬ ПРИМЕНЕНИЯ ЭМПАГЛИФЛОЗИНА В ОТНОШЕНИИ ПОЧЕК У НОРМОГЛИКЕМИЧЕСКИХ КРЫС С СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТЬЮ. Нефрология. 2018;22(1):83-90. https://doi.org/10.24884/1561-6274-2018-22-1-83-90
For citation:
Okovity`i` S.V., Beresneva O.N., Parastaeva M.M., Ivanova G.T., Ivkin D.Yu., Ivkina A.S., Sipovskii V.G., Zaraiyskii` M.I., Karpov A.A., Kucher А.G., Bogdanova E.O., Sipovskaya E.B., Kulikov A.N., Kayukov I.G. EMPAGLIFLOZIN RENAL SAFETY IN NORMOGLYCEMIC RATS WITH HEART FAILURE. Nephrology (Saint-Petersburg). 2018;22(1):83-90. (In Russ.) https://doi.org/10.24884/1561-6274-2018-22-1-83-90








































