Перейти к:
ЧТО МЫ ЗНАЕМ И ЧЕГО НЕ ЗНАЕМ О ЗАБОЛЕВАНИЯХ ПОЧЕК У ЖЕНЩИН; ВОПРОСЫ БЕЗ ОТВЕТОВ И ОТВЕТЫ НА НЕЗАДАННЫЕ ВОПРОСЫ: РАЗМЫШЛЕНИЯ ПО ПОВОДУ ВСЕМИРНОГО ДНЯ ПОЧКИ И МЕЖДУНАРОДНОГО ЖЕНСКОГО ДНЯ
https://doi.org/10.24884/1561-6274-2018-22-2-12-25
Аннотация
Около 10% взрослого населения планеты страдают хронической болезнью почек, которая входит в список 20 основных причин смерти во всем мире и ведет к пагубным последствиям как для самих пациентов, так и для членов их семей. Всемирный День Почки в 2018 году совпадает с Международным женским днем, что дает нам повод задуматься об особой важности состояния здоровья женщин, и в особенности о «почечном здоровье», для ныне живущей популяции и для будущих поколений. Нам представляется не только уникальная возможность узнать как можно больше об особенностях заболеваний почек у женщин, но и шире использовать полученные знания. Женщины, девушки и девочки в целом составляют примерно 50% населения мира и вносят огромный вклад в жизнь общества, не говоря уже о важнейшей роли в семейной жизни. Вместе с тем, гендерные различия в доступе к образованию, медицинской помощи и участии в клинических исследованиях все еще существуют практически повсеместно. Беременность, представляющая особую нагрузку на организм женщины, и нередко оказывающаяся поводом для выявления уже существующих заболевания почек, может также приводить к манифестации острых и хронических почечных заболеваний, которые, в свою очередь, могут сказываться на потомстве – в том числе и на состоянии почек. Многие аутоиммунные и другие заболевания чаще развиваются у женщин, чем у мужчин, и неблагоприятно сказываются на способности к деторождению и на состоянии плода. Осложнения диализа у женщин отличаются от осложнений у мужчин и, кроме того, женщины с большей вероятностью оказываются донорами, нежели реципиентами почечного трансплантата. В этой передовой статье мы сконцентрировали внимание на том, что мы знаем и чего мы не знаем о «почечном здоровье» и заболеваниях почек у женщин, и на том, что мы можем и должны узнать в будущем для улучшения исходов заболеваний почек во всем мире.
Ключевые слова
Для цитирования:
Пикколи Д.Б., Альрухами М., Лиу Ж., Захарова Е., Левин А.8. ЧТО МЫ ЗНАЕМ И ЧЕГО НЕ ЗНАЕМ О ЗАБОЛЕВАНИЯХ ПОЧЕК У ЖЕНЩИН; ВОПРОСЫ БЕЗ ОТВЕТОВ И ОТВЕТЫ НА НЕЗАДАННЫЕ ВОПРОСЫ: РАЗМЫШЛЕНИЯ ПО ПОВОДУ ВСЕМИРНОГО ДНЯ ПОЧКИ И МЕЖДУНАРОДНОГО ЖЕНСКОГО ДНЯ. Нефрология. 2018;22(2):12-25. https://doi.org/10.24884/1561-6274-2018-22-2-12-25
For citation:
Piccoli G.B., Alrukhaimi M., Liu Zh., Zakharova E., Levin A. WHAT WE DO AND DO NOT KNOW ABOUT WOMEN AND KIDNEY DISEASES; QUESTIONS UNANSWERED AND ANSWERS UNQUESTIONED: REFLECTION ON WORLD KIDNEY DAY AND INTERNATIONALWOMAN’S DAY. Nephrology (Saint-Petersburg). 2018;22(2):12-25. (In Russ.) https://doi.org/10.24884/1561-6274-2018-22-2-12-25
ВВЕДЕНИЕ
Около 10% взрослого населения планеты страдают хронической болезнью почек (ХБП), которая входит в список 20 основных причин смерти во всем мире [1] и ведет к пагубным последствиям как для самих пациентов, так и для членов их семей. Всемирный День Почки в 2018 году совпадает с Международным женским днем, что дает нам повод задуматься об особой важности состояния здоровья женщин, и в особенности о «почечном здоровье», для ныне живущей популяции и для будущих поколений. Нам представляется не только уникальная возможность узнать как можно больше об особенностях заболеваний почек у женщин, но и шире использовать полученные знания.
Женщины, девушки и девочки в целом составляют примерно 50% населения мира и вносят огромный вклад в жизнь общества, не говоря уже о важнейшей роли в семейной жизни. И дело не только в вынашивании, рождении, вскармливании и воспитании детей, но и в заботе о здоровье семьи и общества в целом. Женщины в XXI веке продолжают стремиться к равенству в бизнесе, коммерции и профессиональных начинаниях, зачастую сталкиваясь с отсутствием равноправия во многих областях. В различных странах по всему миру доступ к образованию и здравоохранению не одинаков для мужчин и женщин; женщины недостаточно представлены во многих клинических исследованиях, что ограничивает доказательную базу, на основании которой формируются рекомендации по улучшению исходов (рис. 1).
В этой передовой статье мы сконцентрировали внимание на том, что мы знаем и чего мы не знаем о «почечном здоровье» и заболеваниях почек у женщин, и на том, что мы можем и должны узнать в будущем для улучшения исходов заболеваний почек для всех людей во всем мире.
Что мы знаем и чего мы не знаем
Беременность создает особую нагрузку на организм женщины и является ведущей причиной острого повреждения почек (ОПП) у женщин детородного возраста; ОПП и преэклампсия (ПЭ) могут приводить к последующему развитию ХБП, но степень реально существующего риска не вполне ясна [2-5]. В свою очередь ХБП, даже на ранних стадиях, оказывает негативное влияние на течение беременности [6, 7]. Риск повышения скорости прогрессирования ХБП создает серьезные этические проблемы, касающиеся наступления и пролонгирования беременности [6-8]. Мы знаем, что ПЭ повышает вероятность развития артериальной гипертензии и ХБП в отдаленном периоде, но мы не знаем, могут ли наблюдение и ренопротективные методы затормозить прогрессирующую потерю функции почек, и если могут, то каким образом [9-12].

Рис. 1. Половые различия в континууме ХБП.
СКВ - системная красная волчанка; РА - ревматоидный артрит; СС - системная склеродермия; ОПП - острое повреждение почек; ХБП - хроническая болезнь почек; АИ - аутоиммунный; АВФ - артериовенозная фистула; ГД - гемодиализ; ТП - трансплантация почки.
Мы знаем, что системные заболевания, такие как системная красная волчанка (СКВ), ревматоидный артрит (РА) и системная склеродермия (СС), чаще развиваются у женщин, чем у мужчин. Но мы не знаем, каков вклад этих состояний в прогрессирование до терминальной стадии почечной недостаточности (тПН) у женщин.
Мы знаем, что в когортных исследованиях распространенность ХБП у женщин всегда меньше, и скорость прогрессирования в направлении тПН ниже, чем у мужчин [13-15]. Но мы не знаем, связано ли это с различиями в выявлении поражений почек, различиями в доступе к медицинской помощи или же с истинными различиями в тяжести процесса и заболеваемости, и если связано, то в какой степени.
Риск развития сердечно-сосудистых заболеваний у женщин с ХБП выше, чем у женщин без ХБП [16], но все же ниже, чем у мужчин с такой же степенью повреждения почек. В когортах больных на гемодиализе отмечаются различия в типах сосудистого доступа у женщин и мужчин, что может быть связано с биологическими и системными факторами. В некоторых регионах имеются различия в использовании перитонеального диализа и гемодиализа у женщин и мужчин.
Мы знаем, что женщины с большей долей вероятности отдадут почку для пересадки, чем получат ее. Но мы не знаем, связано ли это с различиями в заболеваемости ХБП у женщин по сравнению с мужчинами, с социокультурными факторами или же с другими причинами.
Мы знаем, что во многих регионах мира сохраняются гендерные различия в доступе к медицинской помощи, но у нас нет данных для непосредственной оценки этих различий, в особенности что касается беднейших стран и регионов.
Беременность, преэклампсия, гипертензивные осложнения беременности и здоровье плода. Значение здоровья женщин для «почечного здоровья» в настоящем и будущем
Что мы знаем
ПЭ является основной причиной ОПП и материнской смертности в развивающихся странах [2, 17]. Беременность - самая частая причиной ОПП у женщин детородного возраста [10, 18, 19]. Помимо ПЭ, различные заболевания и состояния могут приводить к развитию ОПП, ассоциированного с беременностью. Причины ОПП различаются в зависимости от региона: криминальный септический аборт - главная причина ОПП в странах, где легальные аборты запрещены, тогда как ПЭ, возникшая после искусственного оплодотворения, становится ведущей причиной ОПП в развитых странах [12, 20-22].
ПЭ и гипертензивные осложнения беременности составляют 3-10% от всех случаев беременности [2-3, 18]. При этой патологии поражение почек, являющихся основной мишенью, развивается вследствие нарушения баланса между про- ангиогенными и антиангиогенными факторами, ведущего к массивному эндотелиальному повреждению и развитию гипертензии и протеинурии. Заболеваемость ПЭ особенно высока в странах с низким и средним доходом (что возможно отражает наличие нераспознанных хронических заболеваний), пик заболеваемости приходится на начало и конец репродуктивного периода [12, 20-22].
Взаимоотношения между почками и плацентой с очевидностью носят двусторонний характер. Наличие ХБП является фактором риска развития ПЭ и гипертензивных осложнений беременности (рис. 2). Кроме того, ряд других факторов риска ПЭ (диабет, иммунные заболевания, фоновая гипертензия, ожирение и метаболический синдром) являются также и факторами риска развития ХБП. Поскольку при многих из упомянутых заболеваний возникает та или иная степень нарушения функции почек, это также является косвенным подтверждением роли почечной функции в развитии ПЭ. Современные определения ПЭ, основанные на новых ангиогенных-антиангиогенных маркерах, позволяют выявить различия между «плацентарными» и «материнскими» причинами ПЭ [23, 24], что может играть важную роль для ведения пациенток во время беременности и после родоразрешения.
Известно, что имеются отдаленные последствия ПЭ для здоровья как матери, так и плода, их активно изучают, но до настоящего времени многое еще остается не известным и не изученным.
ПЭ представляет фактор риска развития ХБП и тХПН у матери [3-5]. Механизмы не вполне ясны, однако поскольку характерным признаком ПЭ является потеря подоцитов, предполагается значимая роль гломерулярного повреждения [25]. Ассоциированный с ПЭ эндотелиоз, наблюдаемый, однако, и при нормальной беременности, может предвещать гломерулосклероз; одновременно могут присутствовать также канальцевые и сосудистые повреждения [26, 27].
Помимо рисков для матери, ПЭ ассоциирована с внутриутробной и перинатальной смертностью, преждевременными родами и задержкой внутриутробного развития; последние два осложнения ведут к рождению «маловесных детей» [2, 3, 5]. Маловесные и недоношенные дети подвержены риску неврологического дефицита и постнаталь- ных осложнений, в особенности сепсиса [28-32]. Эти риски могут быть особенно значимыми в странах с низким и средним доходом, поскольку выживаемость и бездефицитная выживаемость сильно зависят от возможности обеспечения интенсивной терапии и ухода в постнатальном периоде [20, 21]. Кроме того, «маловесные дети» имеют повышенный риск отдаленных последствий, таких как развитие диабета, метаболического синдрома, сердечно-сосудистых заболеваний (ССЗ) и ХБП во взрослом возрасте [33-37]. Поскольку развитие почек завершается в последнюю фазу беременности, задержка и недоразвитие почек с уменьшением количества нефронов, по-видимому, являются основой повышенного риска ХБП и гипертензии у недоношенных детей и детей с гипотрофией [33-37].
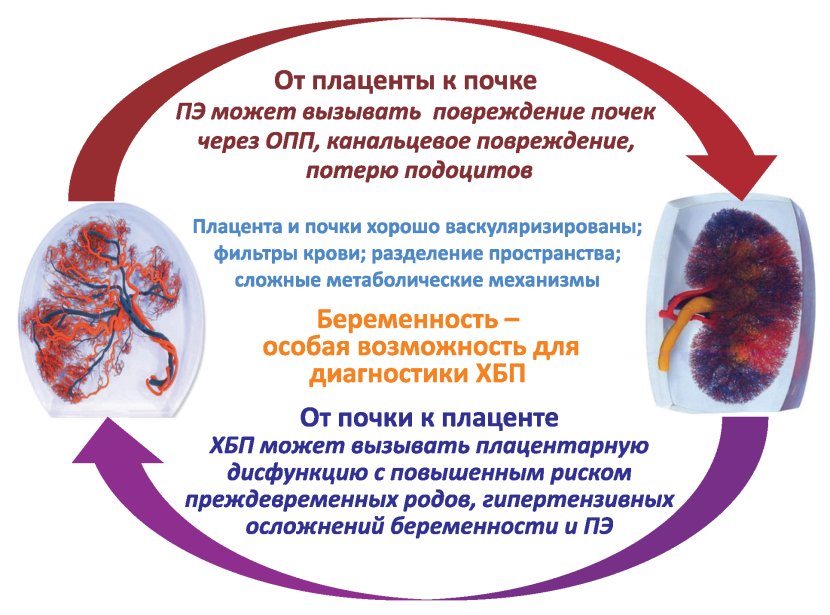
Рис. 2. Беременность и функция почек: сложные взаимодействия между двумя органами - почкой и плацентой.
ПЭ - преэклампсия; ОПП - острое повреждение почек; ХБП - хроническая болезнь почек.
Таблица 1
Неблагоприятные исходы беременности у пациенток с хронической болезнью почек и их потомства
Событие | Определение | Основные проблемы |
|---|---|---|
Материнская смерть | Смерть в период беременности или в течение 1 нед - 1 мес после родов | Наблюдается редко, поэтому не может быть оценена количественно, по крайней мере, в странах с высоким доходом, где в основном связана с тяжелыми обострениями иммунных заболеваний (в первую очередь СКВ). Остается проблемой смерть от ОПП в странах с низким доходом, обусловлена потребностью в диализе и также не может быть оценена количественно |
Прогрессирование ХБП | Снижение СКФ, повышение сКр, переход в другую стадию ХБП | Оценивается и рассчитывается по-разному, в том числе и в зависимости от акушерской практики (родоразрешение при ухудшении функции почек); составляет от 20 до 80% при далеко зашедшей ХБП. Возможно не ускоряется при ранних стадиях ХБП |
Иммунологические обострения и СКВ у новорожденных | Обострение иммунных заболеваний во время беременности | Частота считается повышенной в период беременности, особенно при СКВ, что вероятно происходит за счет тех пациенток, кто вступает в беременность с активным заболеванием или свежим обострением. Нет общепризнанного определения «безопасной» зоны, но складывается впечатление, что при неактивном, хорошо контролируемом заболевании частота не повышена по сравнению с тщательно подобранным контролем (небеременные пациентки) |
Отторжение трансплантата | Острое отторжение в период беременности | Также как при СКВ, частота эпизодов отторжения не повышена по сравнению с подобранными контрольными случаями; проблему могут представлять незапланированные беременности у пациенток с нестабильной функцией трансплантата |
Выкидыш | Потеря плода на сроке менее 21-24 нед гестации | Частота может быть повышена при ХБП, но данных недостаточно. Проблему представляют иммунные заболевания (преимущественно, хотя не исключительно выкидыши связаны с присутствием ВПАК) и диабетическая нефропатия |
Мертворождение | Рождение нежизнеспособного ребенка после 21-24 нед гестации | Вероятно, частота не повышена при ранних стадиях ХБП, может быть проблемой у пациенток на диализе; если мертворождение не связано с крайней степенью недоношенности, оно может быть обусловлено наличием СКВ, других иммунных заболеваний и диабетической нефропатии |
Перинатальная смерть | Смерть в течение 1 нед - 1 мес после рождения | Обычно происходит вследствие крайней степени недоношенности, которая несет в себе риск респираторного дистресса, неонатального сепсиса и вну- тримозговых кровоизлияний |
Рождение «маловесных» и «очень маловесных» детей | Масса тела ребенка при рождении <2500 - 1500 г соответственно | Необходим анализ в соответствии с гестационным возрастом (см. специальные таблицы) |
Преждевременные роды,ранние преждевременные роды, крайне преждевременные роды | Роды на сроке до 37-34 или 28 нед гестации соответственно | Повышен риск преждевременных и ранних преждевременных родов при разных стадиях ХБП; ранние преждевременные роды могут представлять проблему при недиагностированной ХБП, ХБП с поздним обращением и ПЭ-ОПП (см. специальные таблицы) |
МГВП(ВУЗР) | < 5-го или < 10-го цен- тиля для гестационного возраста | Находятся в обратной зависимости от преждевременных родов; вероятно, имеется связь МГВП/ВУЗР с риском гипертензии, метаболического синдрома и ХБП во взрослом возрасте |
Пороки развития | Любой порок развития | Частота пороков развития при ХБП не повышена, если матери не получали тератогенных препаратов (ММФ, ингибиторов mTor, ингибиторов АПФ, БРА); исключение составляют диабетическая нефропатия (связывают с диабетом) и наследственные заболевания, такие как ПКБП и рефлюкс-нефропатия; а также ВАПМП, которые могут быть обнаружены уже при рождении |
Наследственные заболевания почек | Любая ХБП | Некоторые формы ХБП носят наследственный характер или характеризуются наследственной предрасположенностью; помимо ПКБП, рефлюкса и ВАПМП, генетическую основу имеют болезнь Альпорта, IgA-нефропатия, канальцевые дисфункции и митохондриальные болезни; они обычно проявляются во взрослом возрасте и недостаточно хорошо изучены |
ХБП - гипертензия | Повышенный риск гипертензии и ХБП во взрослом возрасте | Позднее созревание нефронов ведет к уменьшению их количества у недоношенных детей; риск, вероятно, выше для МГВП и детей с ВУЗР по сравнению с недоношенными детьми нормального для гестационного возраста массы тела |
Другие отдаленные последствия | Нарушения развития | В основном развиваются вследствие преждевременных родов - внутримозговые кровоизлияния и неонатальный сепсис не являются специфичными для ХБП, но угрожают всем преждевременно рожденным детям |
Примечание. СКВ - системная красная волчанка; ОПП - острое почечное повреждение; СКФ - скорость клубочковой фильтрации; сКр - сывороточный креатинин; ХБП - хроническая болезнь почек; ВПАК - волчаночно-подобный антикоагулянт; ПЭ-ОПП - преэклампсия острое почечное повреждение; МГВП - маленький для гестационного возраста плод; ВУЗР - внутриутробная задержка развития; ММФ - микофенолата мофетил; mTor - механистическая мишень рапамицина; иАПФ - ингибитор ангиотензин-превращающего фермента; БРА - блокатор рецептора ангиотензина II; ПКБП - поликистозная болезнь почек; ВАПМП - врожденные аномалии почек и мочевых путей; IgA - иммуноглобулин A.
Беременность при хронической болезни почек, на диализе и после трансплантации
Что мы знаем
Хроническая болезнь почек
ХБП является фактором риска неблагоприятных исходов беременности уже на ранних стадиях (табл. 1) [6, 38, 39]. Риск последовательно повышается от ХБП 1 стадии к ХБП 5 стадии и к тому же относительно более высок при гломерулярных заболеваниях, аутоиммунных заболеваниях и диабетической нефропатии [6, 7, 38-41]. Исходы беременности у женщин, ставших донорами почки, позволяют предположить, что уменьшение массы почечной паренхимы ассоциировано с повышенным риском ПЭ и гипертензивных осложнений беременности [42, 43].
Фоновая гипертензия и протеинурия являются важными модуляторами рисков, связанных с беременностью, но не всех рисков в одинаковой степени. Мы знаем, что риск возникновения пороков развития не повышен по сравнению с общей популяцией (исключая, разумеется, наследственные заболевания, такие как рефлюкс-нефропатия, поликистозная болезнь почек или врожденные аномалии почек и мочевых путей); материнская смертность низка (в странах с высоким доходом); а вот частота преждевременных родов и рождения детей с гипотрофией действительно связана уже с 1 стадией ХБП и растет по мере ухудшения функции почек. Влияние беременности на прогрессирование ХБП не вполне ясно, поскольку дизайн, акушерская тактика и продолжительность наблюдения в проведенных исследованиях различались. В целом известно, что непосредственное и отдаленное снижение функции почек, ассоциированное с беременностью, несвойственно ранним стадиям ХБП, но по мере усугубления тяжести ХБП риск ее прогрессирования возрастает [6, 7, 38-41, 44-48].
Беременность может оказаться поводом для выявления и установления диагноза ХБП. В странах с низкими или неравномерно распределенными ресурсами даже далеко зашедшая ХБП у женщин может оказаться выявленной лишь во время беременности. Последствия, связанные с началом диализа, могут порождать важные клинические и этические проблемы; в странах с высокими ресурсами и развитой пренатальной медицинской помощью диагностика ранних стадий ХБП дает возможность обеспечить более интенсивное лечение и наблюдение [49-51].
Диализ и трансплантация
При тПН репродуктивная способность снижена. Данные, полученные в Европе и Австралии, указывают, что между женщинами с трансплантированной почкой и общей популяцией имеется соотношение 1:10, такое же соотношение между женщинами на диализе и женщинами с трансплантированной почкой (вероятность забеременеть у женщин на диализе составляет 1:100 по отношению к общей популяции) [52, 53]. Тем не менее, первые единичные случаи успешной беременности на диализе описаны уже в 70-е годы, а в новом тысячелетии возможность беременности на диализе стала общепризнанной [8, 54, 55].
Имеются сообщения о более чем 1000 беременностей у женщин на диализе [55]. Наиболее важным достижением явилась демонстрация мощной взаимосвязи между интенсивностью (частотой и продолжительностью) диализных процедур и благополучными исходами беременности. Так, увеличение интенсивности диализа, вплоть до ежедневного, является в настоящее время стандартом оказания медицинской помощи беременным на диализе [8, 54]. Знание о возможности благоприятных исходов беременности на диализе как для женщин, так и для потомства, может повлиять на тактику предгравидарного консультирования в случаях далеко зашедшей ХБП.
Репродуктивная способность отчасти восстанавливается после трансплантации почки [56-60]. Однако даже в идеальной ситуации (нормальная функция трансплантата, отсутствие гипертензии и протеинурии, и как минимум 2 года после трансплантации без эпизодов отторжения) риск осложнений у женщин с трансплантированной почкой выше, чем в общей популяции. В целом, если исключено применение тератогенных препаратов (микофеноловой кислоты и рапамицина), исходы беременности после трансплантации почки обусловлены теми же факторами риска, что и при ХБП в целом (функция почек, гипертензия и протеинурия) [59].
Опыт ведения беременности у женщин со сниженной или почти полностью утраченной функцией трансплантата ограничен, и консультирование в таких случаях основывается преимущественно на индивидуальном опыте врача и косвенных доказательствах [61, 62]. Технологии искусственного оплодотворения в некоторых ситуациях приобретают все большую популярность, но исследования в этой области у женщин с ХБП немногочисленны; многоплодная беременность может представлять дополнительный риск при ХБП, причем как для женщин с заболеваниями собственных почек, так и для реципиенток почечного трансплантата.
Аутоиммунные заболевания, женщины и заболевания почек
Что мы знаем
Аутоиммунные заболевания, такие как СКВ, РА и СС, поражают преимущественно женщин и характеризуются системным воспалением, приводящим к дисфункции органов-мишеней, в том числе и почек. Половые различия в заболеваемости и тяжести течения этих заболеваний являются следствием сложных взаимодействий множества гормональных, генетических и эпигенетических факторов (табл. 2). Аутоиммунные заболевания, в совокупности представляющие ведущую причину заболеваемости и смертности у взрослых женщин, тяжелым бременем ложатся на систему здравоохранения [63-65].
СКВ представляет собой аутоиммунное заболевание с вовлечением многих органов и тканей, поражающее около 5 млн людей по всему миру. Среди больных с СКВ преобладают женщины (соотношение женщин и мужчин 9:1) и лица неевропейского происхождения. Особенно значимо преобладание женщин на пике репродуктивного возраста - оно достигает в этот период 15:1. Биологическая основа этой предрасположенности активно изучается: одним из объяснений являются количество Х-хромосом и генетические варианты Х-хромосом [66-68]. Другим важным этиологическим фактором, по-видимому, может служить уровень эстрогенов. Основное действие эстрогенов реализуется через транскрипционную активность рецепторов к эстрогену, тогда как у женщин с СКВ Т-клеточный рецепторный профиль этих рецепторов нарушен [69, 70]. Недавно была идентифицирована еще одна возможная причина СКВ - белок катепсин S, являющийся триггером иммунной атаки на здоровые клетки, особенно у женщин [71]. Многочисленные генетические маркеры, не- относящиеся к HLA-системе, могут быть основой предрасположенности к СКВ у лиц европейского, латиноамериканского и афро-американского происхождения [72]. Предрасположенность к СКВ в период беременности также носит многофакторный характер, одним из факторов является повышение экспрессии интерферона-α (ИФН-α). Повышенное количество ИФН-α, экспрессируемого плацентой, играет патогенетическую роль при СКВ, оказывая, с одной стороны, влияние на успешную плацентацию, а с другой стороны - увеличивая предрасположенность к СКВ [73]. Структурные и функциональные нарушения регуляторных Т-клеток (которые, по-видимому, обеспечивают модулирование толерантности материнского организма к антигенам плода) также могут вносить вклад в патологию беременности у женщин с СКВ [74]. Поражение почек при СКВ наблюдается примерно в половине случаев и включает как гломерулярные, так и интерстициальные, и сосудистые повреждения. Волчаночный нефрит является основным фактором риска заболеваемости и смертности при СКВ и, несмотря на применение мощных терапевтических вмешательств, по-прежнему ведет к значительному нарушению функции почек у множества больных [75]. Поражение почек вызывает особое беспокойство при консультировании женщин с СКВ, планирующих беременность. Предсуществующая почечная патология и снижение уровня С4 представляют высокий риск развития активного нефрита в период беременности [76]. Социоэкономические различия также оказывают влияние на состояние здоровья пациентов с СКВ. Бедность ассоциирована с большим количеством отдаленных последствий и повреждений, связанных с СКВ, и в 1,67 раза повышает вероятность развития клинически значимых последствий. Частота неблагоприятных исходов беременности при СКВ у черных женщин и женщин латиноамериканского происхождения вдвое выше по сравнению с белыми. У черных женщин социоэкономический статус оказался определяющим для исходов беременности, внося основной вклад в развитие неблагоприятных исходов [77, 78].
Таблица 2
Половые различия заболеваемости и тяжести течения аутоиммунных заболеваний
Показатель | СКВ | РА | СС | |
|---|---|---|---|---|
Пик заболеваемости | Репродуктивный возраст | Перименопауза | После 50-60 лет | |
| Соотношение женщин/мужчин | Пиковое 15:1 | Пиковое 4:1 | Пиковое 14:1 | |
Общее 9:1 | После 60 лет 1:1 | Общее 3:1 | ||
Влияние эстрогенов | Высокий уровень | Негативное | Положительное | ? |
Низкий уровень | ? | Негативное | Негативное | |
Примечание. СКВ - Системная красная волчанка; РА - ревматоидный артрит; СС - системная склеродермия.
РА также поражает преимущественно женщин (соотношение женщин и мужчин 4:1) с пиком заболеваемости в возрасте 45-55 лет, что совпадает с перименопаузальным периодом. Эти данные позволяют предположить наличие взаимосвязи между дефицитом эстрогенов и началом заболевания. Соотношение женщин и мужчин в возрасте старше 60 лет составляет 1:1, что подразумевает роль изменения уровня половых гормонов в развитии РА; об этом же свидетельствует и хорошо известное смягчение симптоматики и даже развитие ремиссии РА в период беременности [79-81]. Поражение почек при РА наблюдается достаточно часто, носит многофакторный характер и является предиктором смертности. Риск развития ХБП у больных с РА превышает таковой в общей популяции. Развитие ХБП может быть результатом целого ряда длительно протекающих процессов, в том числе специфического поражения почек в рамках РА (гломерулонефрит, интерстициальный нефрит), хронического воспаления, нефротоксического воздействия применяемых лекарственных препаратов и наличия коморбидных состояний. Мощная ассоциация между активностью РА и АА амилоидозом повышает заболеваемость, амилоидоз является основной причиной тХПН у пациентов с РА и поражением почек. Необходимо отметить также, что некоторые пожизненно применяемые виды комбинированной фармакотерапии сами по себе обладают различными побочными эффектами в отношении почек [82-84].
Преобладает у женщин и СС (соотношение женщин и мужчин колеблется от 3:1 до 14:1) с пиком заболеваемости на пятом и шестом десятилетиях жизни. Возможная роль эстрогенов в патогенезе СС опосредована через их стимулирующее воздействие на рецепторы трансформирующего фактора роста-β! и тромбоцитарного фактора роста [85]. Васкулопатия является одним из ведущих проявлений СС, предполагается, что гипоэстрогенемия в постменопаузальном периоде усиливает сосудистые изменения у женщин с СС [86]. При СС наблюдаются различные поражения почек, самым серьезным из которых является склеродермический почечный криз, протекающий с клиникой злокачественной артериальной гипертензии и острой почечной недостаточностью. Однако чаще наблюдается ишемическая нефропатия с альбуминурией, гипертензией и медленным прогрессированием ХБП [87]. Острая почечная недостаточность без гипертензии у пациентов с СС может быть обусловлена интерстициальным нефритом или сочетанием СС с АНЦА-ассоциированым васкулитом, в последнем случае исходы являются неблагоприятными [88-98].
Женщины, хроническая болезнь почек и доступ к заместительной почечной терапии
Что мы знаем
Несмотря на то, что заместительная почечная терапия (ЗПТ), включая диализ и трансплантацию почки, является жизнеобеспечивающим методом лечения, не все пациенты получают ЗПТ. Доля больных с тПН, получающих ЗПТ, значительно различается между странами и регионами и сложным образом зависит от экономического состояния страны и от системы здравоохранения [90, 91]. Лишь 50% всех больных в мире, нуждающихся в ЗПТ, получают это лечение [92], а если рассматривать отдельно страны с низким и средним доходом, то эта доля оказывается еще меньше; почти на всей территории субэкваториальной Африки ЗПТ получают менее 2% пациентов с тПН [93]. Неравный доступ к ЗПТ вызывает особую озабоченность, поскольку во многих сообществах имеет место дискриминация женщин и девочек в отношении доступа к ЗПТ. Причины этой дискриминации коренятся главным образом в социокультурных факторах [94, 95].
Гендерные различия в доступе к диализу
Как минимум 2 млн 284 тыс людей могут преждевременно умереть из-за недостаточной доступности ЗПТ, причем различия в лечении особенно велики в странах с низким доходом. По самым скромным подсчетам в Азии и Африке 1 млн 907 тыс и 432,000 пациентов соответственно не получают ЗПТ. К 2030 г. оценочное количество больных на ЗПТ должно увеличиться более чем вдвое и достичь 5,439 миллионов (3,899-7,640 миллиона), наибольший прирост ожидается в Азии (с 0,968 миллиона до предполагаемых 2,162 миллионов [1,71-3,14 миллиона]) [92]. Эти цифры получены в результате тщательного систематического анализа.
Данные, которые позволяли бы оценивать гендерные различия в лечении, немногочисленны. Исследования, проведенные в Африке, показали, что мужчины с большей вероятностью будут получать ЗПТ по сравнению с женщинами [96, 97]. В Японии лечение тПН у женщин осуществляется более чем вдвое реже, чем у мужчин (3,287 мужчин и 1,764 женщин на 1 миллион популяции, получающей лечение) [91]: никаких объяснений этим данным не представлено. В одном из исследований, проведенных в США, сообщается, что у женщин отношение шансов позднего начала диализа значительно выше, чем у мужчин - 1,70 [98]. Установлено, что осведомленность о наличии заболевания почек у женщин существенно ниже, чем у мужчин (2,9 ± 1,6% у женщин и 17,9 ± 5,9% у мужчин), что может быть одной из причин позднего начала ЗПТ [99].
Смертность на диализе у мужчин и женщин одинакова, но частота некоторых осложнений диализа и заболеваемость у женщин выше. По данным американского отчета о 111 653 госпитализациях пациентов, получающих программный гемодиализ, частота госпитализаций и вероятность повторной госпитализации в течение 30 дней у женщин оказалась выше [100].
Кроме того, у женщин, получающих гемодиализ, преимущественное использование артериове- нозных фистул, обеспечивающее снижение смертности, частоты осложнений и стоимости лечения, менее распространено, чем у мужчин [101]. Этому можно найти целый ряд объяснений, включая анатомические/хирургические проблемы, обусловленные диаметром сосудов, время обращения за медицинской помощью и разногласия в позициях. Систематически этот вопрос не изучался.
Оценка дозы диализа по Kt/V может приводить к «недодиализу» у женщин, поскольку у них в среднем ниже объем распределения мочевины и общее количество воды в организме по сравнению с мужчинами [102]. Имеются данные о худших клинических показателях, в том числе более выраженной анемии и худшем питании и качестве жизни у женщин, получающих диализ [103]. Причины этого остаются неясными.
Гендерныеразличия в доступе к трансплантации почки
Трансплантация является оптимальным методом ЗПТ для пациентов, не имеющих противопоказаний. Данные, полученные во всем мире, свидетельствуют, что женщины с меньшей вероятностью окажутся реципиентами почечного трансплантата, будь то трансплантация от трупного или от живого донора. Вместе с тем, женщины с большей вероятностью станут живыми донорами для трансплантации почки [104]. Данные из различных стран, в том числе из США, Франции, Китая и Индии, подтверждают различия в частоте трансплантации почек (у женщин ниже, чем у мужчин), а также меньшую вероятность попасть в лист ожидания и большую длительность пребывания на диализе до включения в лист ожидания для женщин. Матери и жены с большей вероятностью окажутся донорами почки [91,105-108]. Гендерное неравенство существует и в педиатрической популяции. Опрос, проведенный в 35 странах, участвующих в Регистре Европейского Общества Педиатрической Нефрологии/Европейской Почечной Ассоциации - Европейской Ассоциации Диализа и Трансплантации, показал, что девочки имеют худший доступ к трансплантации почки по сравнению с мальчиками [109].
Социоэкономические факторы, несомненно, играют роль в неравенстве между полами в отношении трансплантации, особенно в странах и регионах с низким и средним доходом. Как правило, именно мужчины обеспечивают основной доход семьи, и это может быть для них препятствием к донорству почки. Гендерные различия в служебном положении и доходах могут вносить вклад в различия доступности трансплантации, поскольку занятость и более высокий доход обычно связаны с лучшей страховкой, покрывающей стоимость трансплантации.
Психологические факторы и образование также влияют на гендерное неравенство. Данные, полученные в США, свидетельствуют, что черные женщины с меньшей вероятностью захотят трансплантацию от живого донора - невостребованные предложения трансплантации почки у них случаются в два раза чаще, чем у мужчин. В то же время, они с меньшей долей вероятности будут рассматриваться как кандидаты на трансплантацию [110]. В других сообщениях описывают возрастное и гендерное неравенство в доступе к трансплантации почки, причиной которого является более позднее информирование о трансплантации почки; причем даже независимо от возраста женщины, скорее всего, не будут иметь возможности обсудить перспективы трансплантации с представителями профессионального сообщества. Эти данные свидетельствуют о потребности в клинических рекомендациях и образовании для женщин, социальных служб и медицинских работников [111].
Настоящее и будущее - чего мы не знаем
Представленные выше данные, касающиеся беременности, ОПП, аутоиммунных заболеваний, ХБП, диализа и трансплантации, свидетельствуют о том, что остается еще много нерешенных вопросов. В странах с высоким доходом, в которых растет материнский возраст и частота искусственного оплодотворения, возможен рост ПЭ, что, в свою очередь, в случаях неблагоприятных исходов для плода может сказаться на будущих поколениях. Рост частоты применения методов экстракорпорального оплодотворения у женщин старшего материнского возраста может вести к возникновению многоплодных беременностей, предрасполагающих к ПЭ, внутриутробной задержке развития или и к тому, и другому. Означает ли это вероятный рост ХБП и ССЗ у женщин в будущем?
Из-за значительной гетерогенности ХБП мы не знаем, сказываются ли различия в характере нефропатий на исходах беременности, и если сказываются, то каким образом? Доказательства, помимо касающихся наиболее распространенных нефропатий, таких как IgA-нефропатия, волчаночный нефрит, диабетическая нефропатия и рефлюкс-нефропатия, крайне скудны [44, 45, 112-114]. Как следует определять предграви- дарные риски беременности в свете пороговых значений протеинурии? Показания в отношении времени начала диализа в период беременности не установлены, также как не установлена роль частоты и длительности диализа в таких случаях. Для реципиенток почечного трансплантата (особенно с учетом таких факторов, как политика расширенного донорства, старший возраст на момент трансплантации и возрастное снижение репродуктивной функции) возможен пересмотр взглядов на беременность при субоптимальной функции трансплантата [56, 60]. Однако не ясно, как это может повлиять на непосредственные и отдаленные исходы для матери и плода.
Беременность у девочек-подростков весьма распространена в некоторых регионах и часто ассоциирована с низкими доходами и уровнем культуры. Неустоявшиеся правовые нормы для искусственного оплодотворения и недостаток систематической оценки функции почек в таких ситуациях указывают на необходимость дальнейших исследований.
Несмотря на убедительные доказательства роли половых гормонов для здоровья сосудов и иммунорегуляции, остается неясным столь значимое преобладание женщин среди больных СКВ, РА и СС по сравнению с другими системными заболеваниями, такими, например, как АНЦА- ассоциированные васкулиты и гемолитико- уремический синдром. При этом следует отметить, что тромботическая тромбоцитопеническая пурпура также чаще встречается у женщин, хотя это вероятно обусловлено связью этой патологии с другими заболеваниями, более распространенными у женщин. Частота вовлечения почек у женщин с СКВ во время беременности и сходства/ различия с теми, у кого развивается ПЭ, еще недостаточно изучены. Роль различных лекарственных препаратов и ответ на терапию при атуоим- мунных заболеваниях в зависимости от пола пациентов также остаются не изученными.
Особое внимание к сходству между различными состояниями, роли половых гормонов в воспалении, иммуномодуляции и сосудистом здоровье, со временем может привести к важным выводам и клиническим открытиям. Если женщины разного возраста с большей вероятностью становятся живыми донорами, влияет ли это на риск ССЗ и тПН? Достаточно ли изучен ли этот вопрос в настоящее время, когда имеется возможность применения современных диагностических критериев ХБП и сложных инструментов оценки почечного резерва? Осложняются ли дополнительные воздействия, которые испытывают женщины, ставшие донорами почки, гормональными изменениями сосудов при старении? И повышен ли риск ХБП и ПЭ у молодых женщин, ставших донорами почки?
В контексте специфических видов терапии, направленных на лечение и замедление прогрессирования ХБП, знаем ли мы о гендерных различиях в ответе на терапию иАПФ/БРА? Должны ли мы корректировать дозы в зависимости от пола больных? Если биология сосудов иммунной системы подвержена, как это указано выше, влиянию половых гормонов, то что мы знаем о влиянии различных видов терапии на уровень и соотношение половых гормонов? Как сказываются изменения экономической, социальной и культурной ситуации на здоровье женщин в странах с низким и средним доходом, и каково влияние нутриционно- го статуса на ХБП в свете роста частоты таких заболеваний, как ожирение, диабет и гипертензия?
ЗАКЛЮЧЕНИЕ
У женщин имеются специфические риски заболеваний почек; заболевания почек, так же как и проблемы, связанные с доступом к лечению, оказывают серьезное влияние на здоровье ныне живущих и будущих поколений. Чтобы поддерживать здоровье семей, общества и популяции в целом, необходимо активно выступать за повышение доступности медицинской помощи для женщин.
Исследования, направленные на изучение уникальной роли половых гормонов и взаимодействия половых гормонов с другими физиологическими механизмами, чрезвычайно важны для лучшего понимания особенностей прогрессирования заболеваний почек. Дальнейшие исследования специфических иммунологических состояний, таких как беременность (рассматриваемая как состояние иммунной толерантности к «не своему»), а также СКВ и другие аутоиммунные и системные заболевания, могут привести к открытиям в понимании их сути и изменениям парадигмы лечения.
Имеется отчетливая необходимость в повышении осведомленности, своевременной диагностике и адекватном наблюдении женщин с ХБП в период беременности. В свою очередь беременность может оказаться поводом для обследования и ранней диагностики ХБП, что позволит планировать ранние терапевтические вмешательства.
Всемирный день Почки 2018 и Международный женский день отмечают одновременно, что дает нам повод привлечь внимание общественности к важности состояния здоровья женщин и, в особенности, их «почечного здоровья».
13-й Всемирный День Почки пропагандирует приемлемый по уровню затрат и равный доступ к образованию по вопросам здоровья, медицинской помощи и мерам профилактики для женщин, девушек и девочек во всем мире.
Совпадение Всемирного Дня Почки и Международного женского дня дает нам также возможность разработать и предложить наилучшую практику и спланировать будущие исследования, чтобы в конечном итоге оптимизировать исходы для всех людей с заболеваниями почек или с риском этих заболеваний.
Список литературы
1. GBD 2015 Disease and Injury Incidence and Prevalence Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015. Lancet 2016; 388(10053):1545–1602. doi: 10.1016/S0140-6736(16)31678-6
2. von Dadelszen P, Payne B, Li J et al. Prediction of adverse maternal outcomes in pre-eclampsia: development and validation of the full PIERS model. Lancet 2011; 377(9761):219–227. doi: 10.1016/S0140-6736(10)61351-7
3. Mol BWJ, Roberts CT, Thangaratinam S, Magee LA, et al. Pre-eclampsia. Lancet 2016; 387(10022):999–1011. doi: 10.1016/S0140-6736(15)00070-7
4. Vikse BE, Irgens LM, Leivestad T et al. Preeclampsia and the risk of end-stage renal disease. N Engl J Med 2008;359(8):800–809. doi: 10.1056/NEJMoa0706790
5. Theilen LH, Fraser A, Hollingshaus MS et al. All-Cause and Cause-Specific Mortality After Hypertensive Disease of Pregnancy. Obstet Gynecol 2016;128(2):238–244
6. Piccoli GB, Cabiddu G, Attini R et al. Risk of Adverse Pregnancy Outcomes in Women with CKD. J Am Soc Nephrol 2015;26(8):2011–2022. doi: 10.1681/ASN.2014050459
7. Zhang J-J, Ma X-X, Hao L et al. A Systematic Review and Meta-Analysis of Outcomes of Pregnancy in CKD and CKD Outcomes in Pregnancy. Clin J Am Soc Nephrol 2015;10(11):1964–1978. doi: 10.2215/CJN.09250914
8. Alkhunaizi A, Melamed N, Hladunewich MA. Pregnancy in advanced chronic kidney disease and end-stage renal disease. Curr Opin Nephrol Hypertens 2015;24(3):252–259. doi: 10.1097/MNH.0000000000000119
9. Piccoli GB, Cabiddu G, Castellino S et al. A best practice position statement on the role of the nephrologist in the prevention and follow-up of preeclampsia: the Italian study group on kidney and pregnancy. J Nephrol 2017;30(3):307–317. doi: 10.1007/s40620-017-0390-1
10. Liu Y, Ma X, Zheng J, Liu X, Yan T. Pregnancy outcomes in patients with acute kidney injury during pregnancy: a systematic review and meta-analysis. BMC Pregnancy Childbirth 2017;17(1):235. doi: 10.1186/s12884-017-1402-9
11. Jim B, Garovic VD. Acute Kidney Injury in Pregnancy. Semin Nephrol 2017; 37(4):378–385. doi: 10.1016/j. semnephrol.2017.05.010
12. Acharya A. Management of Acute Kidney Injury in Pregnancy for the Obstetrician. Obstet Gynecol Clin North Am 2016 Dec;43(4):747–765. doi: 10.1016/j.ogc.2016.07.007
13. Iseki K. Gender differences in chronic kidney disease. Kidney International 2008;74(4):415–417. doi: 10.1038/ki.2008.261
14. Nitsch D, Grams M, Sang Y et al. Associations of estimated glomerular filtration rate and albuminuria with mortality and renal failure by sex: a meta-analysis. BMJ 2013;346:f324. doi: 10.1136/bmj.f324
15. Levin A, Djurdjev O, Beaulieu M, Er L. Variability and risk factors for kidney disease progression and death following attainment of stage 4 CKD in a referred cohort. Am J Kidney Dis 2008;52(4):661–671. doi: 10.1053/j.ajkd.2008.06.023
16. Weiner DE, Tighiouart H, Elsayed EF et al. The Framingham predictive instrument in chronic kidney disease. J Am Coll Cardiol 2007;50(3):217–224. doi: 10.1016/j.jacc.2007.03.037
17. Oladapo OT, Adetoro OO, Ekele BA et al. When getting there is not enough: a nationwide cross-sectional study of 998 maternal deaths and 1451 near-misses in public tertiary hospitals in a low-income country. BJOG 2016;123(6):928–938. doi:10.1111/1471-0528.13450
18. Tranquilli AL, Dekker G, Magee L et al. The classification, diagnosis and management of the hypertensive disorders of pregnancy: A revised statement from the ISSHP. Pregnancy Hypertens 2014;4(2):97–104. doi:10.1016/j.preghy.2014.02.001
19. Liu Y, Bao H, Jiang Z et al. Pregnancy-related Acute Kidney Injury and a Review of the Literature in China. Intern Med 2015;54(14):1695–1703. doi: 10.2169/ internalmedicine.54.3870
20. Prakash J, Pant P, Prakash S et al. Changing picture of acute kidney injury in pregnancy: Study of 259 cases over a period of 33 years. Indian J Nephrol 2016;26(4):262–267. doi: 10.4103/0971-4065.161018
21. Ibarra-Hernández M, Orozco-Guillén OA, de la AlcantarVallín ML et al. Acute kidney injury in pregnancy and the role of underlying CKD: a point of view from México. J Nephrol 2017;30(6):773–780. doi: 10.1007/s40620-017-0444-4
22. Blázquez A, García D, Rodríguez A et al. Is oocyte donation a risk factor for preeclampsia? A systematic review and meta-analysis. J Assist Reprod Genet 2016 Jul;33(7):855–863. doi: 10.1007/s10815-016-0701-9
23. O’Gorman N, Wright D, Poon LC et al. Multicenter screening for pre-eclampsia by maternal factors and biomarkers at 11-13 weeks’ gestation: comparison with NICE guidelines and ACOG recommendations. Ultrasound Obstet Gynecol 2017;49(6):756–760. doi: 10.1002/uog.17455
24. Zeisler H, Llurba E, Chantraine F et al. Predictive Value of the sFlt-1:PlGF Ratio in Women with Suspected Preeclampsia. N Engl J Med 2016;374(1):13-22. doi: 10.1056/NEJMoa1414838
25. 25. Garovic VD. The Role of the Podocyte in Preeclampsia. Clin J Am Soc Nephrol 2014;9(8):1337–1340. doi: 10.2215/CJN.05940614
26. Wide-Swensson D, Strevens H, Willner J. Antepartum percutaneous renal biopsy. Int J Gynaecol Obstet 2007;98(2):88–92. doi: 10.1016/j.ijgo.2007.03.049
27. Shiiki H, Dohi K, Hanatani M et al. Focal and segmental glomerulosclerosis in preeclamptic patients with nephrotic syndrome. Am J Nephrol 1990;10(3):205–212. PMID: 2382682
28. Linsell L, Malouf R, Morris J. et al. Risk Factor Models for Neurodevelopmental Outcomes in Children Born Very Preterm or With Very Low Birth Weight: A Systematic Review of Methodology and Reporting. Am J Epidemiol 2017;185(7):601–612. doi: 10.1093/aje/kww135
29. Guellec I, Lapillonne A, Marret S et al. Effect of Intra- and Extrauterine Growth on Long-Term Neurologic Outcomes of Very Preterm Infants. J Pediatr 2016;175:93–99.e1. doi: 10.1016/j.jpeds.2016.05.027
30. Moore T, Hennessy EM, Myles J et al. Neurological and developmental outcome in extremely preterm children born in England in 1995 and 2006: the EPICure studies. BMJ 2012;345:e7961. doi: 10.1136/bmj.e7961
31. Guillén Ú, DeMauro S, Ma L et al. Relationship Between Attrition and Neurodevelopmental Impairment Rates in Extremely Preterm Infants at 18 to 24 Months: A Systematic Review. Arch Pediatr Adolesc Med 2012;166(2):178–184. doi: 10.1001/archpediatrics.2011.616
32. Ranke MB, Schweizer R, Rodemann SM et al. Schoolchildren born VLBW or VLGA show height-related changes in body composition and muscle function but no evidence of metabolic syndrome risk factors. Results from the NEOLONG study. J Pediatr Endocrinol Metab 2016;29(2):163–172. doi: 10.1515/jpem-2015-0266
33. Castanys-Muñoz E, Kennedy K, Castañeda-Gutiérrez E et al. Systematic review indicates postnatal growth in term infants born small-for-gestational-age being associated with later neurocognitive and metabolic outcomes. Acta Paediatr 2017;106(8):1230–1238. doi: 10.1111/apa.13868
34. Ong KK, Kennedy K, Castañeda-Gutiérrez E et al. Postnatal growth in preterm infants and later health outcomes: a systematic review. Acta Paediatr 2015;104(10):974–986. doi: 10.1111/apa.13128
35. Low Birth Weight and Nephron Number Working Group. The Impact of Kidney Development on the Life Course: A Consensus Document for Action. Nephron 2017;136(1):3–49. doi: 10.1159/000457967
36. Luyckx VA, Bertram JF, Brenner BM et al. Effect of fetal and child health on kidney development and long-term risk of hypertension and kidney disease. Lancet 2013;382(9888):273–283. doi: 10.1016/S0140-6736(13)60311-6
37. Luyckx VA, Brenner BM. Birth weight, malnutrition and kidney-associated outcomes--a global concern. Nat Rev Nephrol 2015;11(3):135–149. doi: 10.1038/nrneph.2014.251
38. Davison JM, Lindheimer MD. Pregnancy and chronic kidney disease. Semin Nephrol 2011;31(1):86–99. doi: 10.1016/j.semnephrol.2010.10.008
39. Hall M. Pregnancy in Women with CKD: A Success Story. Am J Kidney Dis 2016;68(4):633–639. doi: 10.1053/j. ajkd.2016.04.022
40. Nevis IF, Reitsma A, Dominic A et al. Pregnancy outcomes in women with chronic kidney disease: a systematic review. Clin J Am Soc Nephrol 201;6(11):2587–2598. doi: 10.2215/CJN.10841210
41. Cabiddu G, Castellino S, Gernone G et al. A best practice position statement on pregnancy in chronic kidney disease: the Italian Study Group on Kidney and Pregnancy. J Nephrol 2016;29(3):277–303. doi: 10.1007/s40620-016-0285-6
42. Garg AX, Nevis IF, McArthur E et al. Gestational hypertension and preeclampsia in living kidney donors. N Engl J Med 2015;372(2):124–133. doi: 10.1056/NEJMoa1408932
43. Josephson MA. Transplantation: pregnancy after kidney donation: more questions than answers. Nat Rev Nephrol 2009;5(9):495–497. doi: 10.1038/nrneph.2009.129
44. Gianfreda D, Quaglini S, Frontini G et al. Does pregnancy have any impact on long term damage accrual and on the outcome of lupus nephritis? J Autoimmun 2017;84:46–54. doi: 10.1016/j. jaut.2017.06.003
45. Blom K, Odutayo A, Bramham K, Hladunewich MA. Pregnancy and Glomerular Disease: A Systematic Review of the Literature with Management Guidelines. Сlin J Am Soc Nephrol 2017;12(11):1862-1872. doi: 10.2215/CJN.00130117
46. Imbasciati E, Gregorini G, Cabiddu G et al. Pregnancy in CKD stages 3 to 5: fetal and maternal outcomes. Am J Kidney Dis 2007;49(6):753–762. doi: 10.1053/j.ajkd.2007.03.022
47. Fischer MJ. Chronic kidney disease and pregnancy: maternal and fetal outcomes. Adv Chronic Kidney Dis 2007;14(2):132– 145. doi: 10.1053/j.ackd.2007.01.004
48. Bramham K. Diabetic Nephropathy and Pregnancy. Semin Nephrol 2017;37(4):362–369. doi: 10.1016/j. semnephrol.2017.05.008
49. Eswarappa M, Rakesh M, Sonika P et al. Spectrum of renal injury in pregnancy-induced hypertension: Experience from a single center in India. Saudi Journal of Kidney Diseases and Transplantation 2017;28(2):279. DOI: 10.4103/1319-2442.202790
50. Prakash J. The kidney in pregnancy: A journey of three decades. Indian J Nephrol 2012;22(3):159–167. doi: 10.4103/0971-4065.98750
51. Piccoli GB, Fassio F, Attini R et al. Pregnancy in CKD: whom should we follow and why? Nephrol Dial Transplant 2012;27 Suppl 3:iii111–118. doi: 10.1093/ndt/gfs302
52. Piccoli GB, Cabiddu G, Daidone G et al. The children of dialysis: live-born babies from on-dialysis mothers in Italy – an epidemiological perspective comparing dialysis, kidney transplantation and the overall population. Nephrol Dial Transplant 2014;29(8):1578–1586. doi: 10.1093/ndt/gfu092
53. Jesudason S, Grace BS, McDonald SP. Pregnancy Outcomes According to Dialysis Commencing Before or After Conception in Women with ESRD. Clin J Am Soc Nephrol 2014;9(1):143–149. doi: 10.2215/CJN.03560413
54. Hladunewich MA, Hou S, Odutayo A et al. Intensive hemodialysis associates with improved pregnancy outcomes: a Canadian and United States cohort comparison. J Am Soc Nephrol 2014;25(5):1103–1109. doi:10.1681/ASN.2013080825
55. Piccoli GB, Minelli F, Versino E et al. Pregnancy in dialysis patients in the new millennium: a systematic review and metaregression analysis correlating dialysis schedules and pregnancy outcomes. Nephrol Dial Transplant 2016;31(11):1915–1934. doi: 10.1093/ndt/gfv395
56. Deshpande NA, James NT, Kucirka LM et al. Pregnancy outcomes in kidney transplant recipients: a systematic review and meta-analysis. Am J Transplant 2011;11(11):2388–2404. doi: 10.1111/j.1600-6143.2011.03656.x
57. Deshpande NA, Coscia LA, Gomez-Lobo V et al. Pregnancy after solid organ transplantation: a guide for obstetric management. Rev Obstet Gynecol 2013;6(3–4):116–125. PMC4002187
58. Bramham K, Nelson-Piercy C, Gao H et al. Pregnancy in renal transplant recipients: a UK national cohort study. Clin J Am Soc Nephrol 2013;8(2):290–298. doi: 10.2215/CJN.06170612
59. Piccoli GB, Cabiddu G, Attini R et al. Outcomes of Pregnancies After Kidney Transplantation: Lessons Learned from CKD. A Comparison of Transplanted, Nontransplanted Chronic Kidney Disease Patients and Low-Risk Pregnancies: A Multicenter Nationwide Analysis. Transplantation 2017;101(10):2536–2544. doi: 10.1097/TP.0000000000001649
60. Webster P, Lightstone L, McKay DB, Josephson MA. Pregnancy in chronic kidney disease and kidney transplantation. Kidney Int 2017; 91(5):1047–1056. doi:10.1016/j.kint.2016.10.045
61. Pietrzak B, Mazanowska N, Kociszewska-Najman B et al. Successful Pregnancy Outcome after In Vitro Fertilization in a Kidney Graft Recipient: A Case Report and Literature Review. Ann Transplant 2015;20:338–341. doi: 10.12659/AOT.893735
62. Norrman E, Bergh C, Wennerholm U-B. Pregnancy outcome and long-term follow-up after in vitro fertilization in women with renal transplantation. Hum Reprod 2015;30(1):205–213. doi: 10.1093/humrep/deu293
63. Tedeschi SK, Bermas B, Costenbader KH. Sexual disparities in the incidence and course of SLE and RA. Clin Immunol 2013;149(2):211–218. doi: 10.1016/j.clim.2013.03.003
64. Marder W, Vinet É, Somers EC. Rheumatic autoimmune diseases in women and midlife health. Womens Midlife Health [Internet] 2015 [cited 2017 Oct 19];1. Available from: https://www. ncbi.nlm.nih.gov/pmc/articles/PMC5444314/
65. Ortona E, Pierdominici M, Maselli A. et al. Sex-based differences in autoimmune diseases. Ann Ist Super Sanita 2016;52(2):205–212. doi: 10.4415/ANN_16_02_12
66. Petri M. Epidemiology of systemic lupus erythematosus. Best Pract Res Clin Rheumatol 2002;16(5):847–858. PMID: 12473278
67. Weckerle CE, Niewold TB. The unexplained female predominance of systemic lupus erythematosus: clues from genetic and cytokine studies. Clin Rev Allergy Immunol 2011;40(1):42–49. doi:10.1007/s12016-009-8192-4
68. Scofield RH, Bruner GR, Namjou B et al. Klinefelter’s syndrome (47,XXY) in male systemic lupus erythematosus patients: support for the notion of a gene-dose effect from the X chromosome. Arthritis Rheum 2008;58(8):2511–2517. doi: 10.1002/art.23701
69. Pierdominici M and Ortona E. Estrogen Impact on Autoimmunity Onset and Progression: the Paradigm of Systemic Lupus Erythematosus. Int Trends in Immun 2013;1(2):24–34
70. Maselli A, Conti F, Alessandri C et al. Low expression of estrogen receptor β in T lymphocytes and high serum levels of anti-estrogen receptor α antibodies impact disease activity in female patients with systemic lupus erythematosus. Biol Sex Differ [Internet] 2016 [cited 2017 Oct 19];7. Available from: https://www. ncbi.nlm.nih.gov/pmc/articles/PMC4709986/
71. Kim SJ, Schätzle S, Ahmed SS et al. Increased cathepsin S in Prdm1(-/-) dendritic cells alters the TFH cell repertoire and contributes to lupus. Nat Immunol 2017;18(9):1016–1024. doi: 10.1038/ni.3793
72. Langefeld CD, Ainsworth HC, Cunninghame Graham DS et al. Transancestral mapping and genetic load in systemic lupus erythematosus. Nat Commun 2017;8:16021. doi: 10.1038/ ncomms16021
73. Niewold TB, Hua J, Lehman TJA et al. High serum IFN-alpha activity is a heritable risk factor for systemic lupus erythematosus. Genes Immun 2007;8(6):492–502. doi: 10.1038/sj.gene.6364408
74. Tower C, Mathen S, Crocker I, Bruce IN. Regulatory T cells in Systemic Lupus Erythematosus and Pregnancy. Am J Reprod Immunol 2013;69(6):588–595. doi: 10.1111/aji.12081
75. 75. Almaani S, Meara A, Rovin BH. Update on Lupus Nephritis. CJASN 2016;CJN.05780616. doi: 10.2215/CJN.05780616
76. Buyon JP, Kim MY, Guerra MM et al. Kidney Outcomes and Risk Factors for Nephritis (Flare/De Novo) in a Multiethnic Cohort of Pregnant Patients with Lupus. Clin J Am Soc Nephrol 2017;12(6):940–946. doi: 10.2215/CJN.11431116
77. Yelin E, Yazdany J, Trupin L. Relationship Between Process of Care and a Subsequent Increase in Damage in Systemic Lupus Erythematosus. Arthritis Care & Research 2017;69(6):927–932. doi: 10.1002/acr.22977
78. Kaplowitz ET, Ferguson S, Guerra M et al. Socioeconomic Status Contributes to Racial/Ethnic Disparities in Adverse Pregnancy Outcomes among Women with Systemic Lupus Erythematosus. Arthritis Care Res 2017; 69 (6):833–841. doi: 10.1002/acr.23021
79. Myasoedova E, Crowson CS, Kremers HM et al. Is the incidence of rheumatoid arthritis rising?: results from Olmsted County, Minnesota, 1955-2007. Arthritis Rheum 2010;62(6):1576–1582. doi: 10.1002/art.27425
80. Goemaere S, Ackerman C, Goethals K et al. Onset of symptoms of rheumatoid arthritis in relation to age, sex and menopausal transition. J Rheumatol 1990;17(12):1620–1622 PMID: 2084234
81. de Man YA, Dolhain RJEM, van de Geijn FE et al. Disease activity of rheumatoid arthritis during pregnancy: results from a nationwide prospective study. Arthritis Rheum 2008;59(9):1241–1248
82. Icardi A, Araghi P, Ciabattoni M et al. Kidney involvement in rheumatoid arthritis. Reumatismo 2003;55(2):76–85. PMID: 12874640
83. Anders H-J, Vielhauer V. Renal co-morbidity in patients with rheumatic diseases. Arthritis Research & Therapy 201;13:222. doi: 10.1186/ar3256
84. Chiu H-Y, Huang H-L, Li C-H et al. Increased Risk of Chronic Kidney Disease in Rheumatoid Arthritis Associated with Cardiovascular Complications – A National Population-Based Cohort Study. PLOS ONE 2015;10(9):e0136508. doi: 10.1371/journal.pone.0153431
85. Vinet É, Bernatsky S, Hudson M et al. Effect of menopause on the modified Rodnan skin score in systemic sclerosis. Arthritis Research & Therapy 2014;16:R130. doi: 10.1186/ar4587
86. Sammaritano LR. Menopause in patients with autoimmune diseases. Autoimmun Rev 2012;11(6–7):A430–436. doi: 10.1016/j.autrev.2011.11.006
87. Penn H, Denton CP. Diagnosis, management and prevention of scleroderma renal disease. Curr Opin Rheumatol 2008;20(6):692–696. doi: 10.1097/BOR.0b013e3283108df7
88. Anders HJ, Wiebecke B, Haedecke C et al. MPO-ANCAPositive crescentic glomerulonephritis: a distinct entity of scleroderma renal disease? Am J Kidney Dis 1999;33(4):e3. PMID: 10196034
89. Zakharova EV, Makarova TA, Stolyarevich ES. ANCAAssociated Vasculitis in Patient with CREST-Syndrome – Case Report [Internet]. [cited 2017 Oct 19]. Available from: https://www. eertechz.com/Clinical-Nephrology/ACN-2-115.php
90. Eckardt K-U, Coresh J, Devuyst O et al. Evolving importance of kidney disease: from subspecialty to global health burden. Lancet 2013;382(9887):158–169. doi: 10.1016/S01406736(13)60439-0
91. Saran R, Robinson B, Abbott KC et al. US Renal Data System 2016 Annual Data Report: Epidemiology of Kidney Disease in the United States. Am J Kidney Dis 2017;69(3 Suppl 1):A7–8. doi: 10.1053/j.ajkd.2016.12.004
92. Liyanage T, Ninomiya T, Jha V et al. Worldwide access to treatment for end-stage kidney disease: a systematic review. Lancet 2015;385(9981):1975–1982. doi: 10.1016/S0140-6736-(14)61601-9
93. Ojo A. Addressing the global burden of chronic kidney disease through clinical and translational research. Trans Am Clin Climatol Assoc 2014;125:229–243; discussion 243-246
94. WHO. Addressing gender within primary health care reforms. In: WHO editor. Gender, women and primary health care renewal: a discussion paper [Internet]. [cited 2017 Oct 19]. Available from: http://apps.who.int/iris/bitstream/10665/44430/1/9789241564038_eng.pdf
95. Eguavoen ANT, Odiagbe SO, Obetoh GI. The Status of Women, Sex Preference, Decision-Making and Fertility Control in Ekpoma Community of Nigeria. J Soc Sci 2007; 15(1):43–49
96. Halle MP, Takongue C, Kengne AP et al. Epidemiological profile of patients with end stage renal disease in a referral hospital in Cameroon. BMC Nephrol 2015;16:59. doi: 10.1186/s12882-015-0044-2
97. Ajayi S, Raji Y, Bello T et al. Unaffordability of renal replacement therapy in Nigeria. Hong Kong Journal of Nephrology 2016;18:15–29
98. Kausz AT, Obrador GT, Arora P et al. Late initiation of dialysis among women and ethnic minorities in the United States. J Am Soc Nephrol 2000;11(12):2351–2357. PMID: 11095658
99. Coresh J, Byrd-Holt D, Astor BC et al. Chronic kidney disease awareness, prevalence, and trends among U.S. adults, 1999 to 2000. J Am Soc Nephrol 2005;16(1):180–188. doi: 10.1681/ASN.2004070539
100. Adams SV, Rivara M, Streja E et al. Sex Differences in Hospitalizations with Maintenance Hemodialysis. J Am Soc Nephrol 2017;28(9):2721–2728. doi: 10.1681/ASN.2016090986
101. Ethier J, Mendelssohn DC, Elder SJ et al. Vascular access use and outcomes: an international perspective from the Dialysis Outcomes and Practice Patterns Study. Nephrol Dial Transplant 2008;23(10):3219–3226. doi: 10.1093/ndt/gfn261
102. Depner TA. Prescribing Hemodialysis: The Role of Gender. Adv Ren Replace Ther 2003 Jan;10(1):71-77. doi: 10.1053/jarr.2003.50007
103. Sehgal AR. Outcomes of renal replacement therapy among blacks and women. Am J Kidney Dis 2000;35(4):S148–152. PMID: 10766013
104. Jindal RM, Ryan JJ, Sajjad I et al. Kidney transplantation and gender disparity. Am J Nephrol 2005;25(5):474–483. doi: 10.1159/000087920
105. Couchoud C, Bayat S, Villar E et al. REIN registry. A new approach for measuring gender disparity in access to renal transplantation waiting lists. Transplantation 2012; 94(5):513–519
106. Liu G, Li X, Liu T et al. Gender disparity of living donor renal transplantation in East China. Clin Transplant 2013;27(1):98–103. doi: 10.1111/ctr.12003
107. Naghibi O, Naghibi M, Nazemian F. Gender disparity in kidney transplantation. Saudi J Kidney Dis Transpl 2008;19(4):545– 550. PMID: 18580010
108. Bal MM, Saikia B. Gender bias in renal transplantation: are women alone donating kidneys in India? Transplant Proc 2007; 39(10):2961–2963. DOI: 10.1016/j.transproceed.2007.08.089
109. Hogan J, Couchoud C, Bonthuis M et al. Gender Disparities in Access to Pediatric Renal Transplantation in Europe: Data from the ESPN/ERA-EDTA Registry. Am J Transplant 2016;16(7):2097–2105. doi: 10.1111/ajt.13723
110. Gillespie A, Hammer H, Kolenikov S et al. Sex Differences and Attitudes toward Living Donor Kidney Transplantation among Urban Black Patients on Hemodialysis. Clin J Am Soc Nephrol 2014;9(10):1764–1772. doi: 10.2215/CJN.12531213
111. Salter ML, McAdams-Demarco MA, Law A et al. Age and sex disparities in discussions about kidney transplantation in adults undergoing dialysis. J Am Geriatr Soc 2014;62(5):843–849. doi: 10.1111/jgs.12801
112. Piccoli GB, Attini R, Cabiddu G et al. Maternal-fetal outcomes in pregnant women with glomerulonephritides. Are all glomerulonephritides alike in pregnancy? J Autoimmun 2017; 79: 91–98. doi: 10.1016/j.jaut.2017.01.008
113. Seeger H, Salfeld P, Eisel R et al. Complicated pregnancies in inherited distal renal tubular acidosis: importance of acid-base balance. J Nephrol 2017;30(3):455–460. doi: 10.1007/s40620-016-0370-x
114. Yefet E, Tovbin D, Nachum Z. Pregnancy outcomes in patients with Alport syndrome. Arch Gynecol Obstet 2016; 293(4):739–747. doi: 10.1007/s00404-015-3893-9
Об авторах
Джиорджина Б. ПикколиИталия
Джиорджина Барбара Пикколи - отдел клинических и биологических наук ТУ; отделение нефрологии, ГЦ Ле-Ман
Мона Альрухами
Объединенные Арабские Эмираты
Oтдел медицины
Дубай
Жи-Хонг Лиу
Китай
Нангин
Елена Захарова
Россия
Отделение нефрологии ГКБ им. С.П. Боткина;
кафедра нефрологии МГМСУ имени А.И. Евдокимова;
кафедра нефрологии РМАНПО
Москва
Адера 8, Левин
Канада
8 отдел медицины, отделение нефрологии
Ванкувер
Рецензия
Для цитирования:
Пикколи Д.Б., Альрухами М., Лиу Ж., Захарова Е., Левин А.8. ЧТО МЫ ЗНАЕМ И ЧЕГО НЕ ЗНАЕМ О ЗАБОЛЕВАНИЯХ ПОЧЕК У ЖЕНЩИН; ВОПРОСЫ БЕЗ ОТВЕТОВ И ОТВЕТЫ НА НЕЗАДАННЫЕ ВОПРОСЫ: РАЗМЫШЛЕНИЯ ПО ПОВОДУ ВСЕМИРНОГО ДНЯ ПОЧКИ И МЕЖДУНАРОДНОГО ЖЕНСКОГО ДНЯ. Нефрология. 2018;22(2):12-25. https://doi.org/10.24884/1561-6274-2018-22-2-12-25
For citation:
Piccoli G.B., Alrukhaimi M., Liu Zh., Zakharova E., Levin A. WHAT WE DO AND DO NOT KNOW ABOUT WOMEN AND KIDNEY DISEASES; QUESTIONS UNANSWERED AND ANSWERS UNQUESTIONED: REFLECTION ON WORLD KIDNEY DAY AND INTERNATIONALWOMAN’S DAY. Nephrology (Saint-Petersburg). 2018;22(2):12-25. (In Russ.) https://doi.org/10.24884/1561-6274-2018-22-2-12-25
JATS XML








































