Перейти к:
Ламинины в структуре гломерулярной базальной мембраны
Аннотация
Для цитирования:
Батюшин М.М., Пасечник Д.Г. Ламинины в структуре гломерулярной базальной мембраны. Нефрология. 2016;20(5):9-15.
For citation:
Batiushin M.M., Pasechnic D.G. Laminines in the structure of glomerular basement membrane. Nephrology (Saint-Petersburg). 2016;20(5):9-15. (In Russ.)
Общее представление о ламининах
Гломерулярный фильтрационный барьер играет важную роль в регуляции водно-электролитного обмена организма и элиминации продуктов обмена веществ. Из 900 л крови, проходящей через почки за сутки, ежедневно фильтруется 180 первичной мочи. Гломерулярный фильтрационный барьер состоит из трех компонентов: подоцитов, базальной мембраны и эндотелиоцитов, отделяя кровь от пространства капсулы Шумлянского-Боумэна. Базальная мембрана клубочка состоит из ламинина, коллагена IV типа, нидогена, гепаран сульфата и ряда других субстанций [1].
Ламинины - семейство крупных гликозилированных протеинов, связывающихся друг с другом и формирующих по меньшей мере 15 гетеротримерных макромолекул. Молекулярная масса ламинина колеблется от 400 до 900 кДа. Номенклатура названий ламинина строится по номерам цепей, которые его образуют. Например, ламинин, образуемый α5-, β2- и γ1-цепями, называется ламинин-521 [2].
В настоящее время у млекопитающих идентифицировано 16 изоформ ламинина (табл. 1).
Ламинины синтезируются различными клетками. Ламинин-521 является одним из основных молекул в гломерулярной базальной мембране и синтезируется подоцитами и эндотелиоцитами [3]. Большинство ламининов формируют крестообразную структуру, короткие глобулярные отростки которой (LN-домены) отвечают за межламининовое взаимодействие во внеклеточной среде (рис. 1).
Такое взаимодействие приводит к полимеризации ламинина, лежащей в основе формирования пространства базальной мембраны.
Таблица 1
Изоформы ламинина и композиции цепей (Aumailley M. et al., 2005 с сокращениями)
Изоформа |
|
|
| Участки экспрессии | Предполагаемая функция | Фенотипы нокаутированных мышей | Ассоциированные болезни человека |
|---|---|---|---|---|---|---|---|
Ламинин-1 | 1 | 1 | 1 | Эпителий в раннем эмбриогенезе, репродуктивные органы, почки, печень взрослых | Ранний эмбриогенез | Делеция α1-цепи | Не изучено |
Ламинин-2 | 2 | 1 | 1 | Мышечные клетки (экстрасинаптически) | Структурная целостность мышечных клеток | Делеция α2-цепи | Врожденная мышечная дистрофия А1 |
Ламинин-3 | 1 | 2 | 1 | Плацента | Не изучена | Делеция α1-цепи | Не изучено |
Ламинин-4 | 2 | 2 | 1 | Мышечные клетки (нейромы- шечное соединение) | Структурная целостность мышечных клеток | Делеция α2-цепи | Врожденная мышечная дистрофия А1 |
Ламинин-5 | ЗА | 3 | 2 | Кожа, плацента, молочные железы | Формирование гемидесмосом, клеточная миграция | Делеция α3-цепи | Контактный epidermolysis bullosa |
Ламинин-5В | 3В | 3 | 2 | Кожа, матка, легкое | Не изучена | Не изучен | Не изучено |
Ламинин-6 | ЗА | 1 | 1 | Кожа, амнион | В ассоциации с ламинином 5 сборка ЭЦМ | Делеция α3-цепи | Не изучено |
Ламинин-7 | ЗА | 2 | 1 | Кожа, амнион | В ассоциации с ламинином 5 сборка ЭЦМ | Делеция α3-цепи | Не изучено |
Ламинин-8 | 4 | 1 | 1 | Клетки эндотелия сосудов, периферические нервы, мышечные волокна, развивающаяся почка, скелетная мускулатура, тромбоциты, лейкоциты | Нейтрофильная миграция/ экстравазация, развитие эндотелия | Делеция α4-цепи | Не изучено |
Ламинин-9 | 4 | 2 | 1 | Клетки эндотелия сосудов, периферические нервы, мышечные волокна, развивающаяся почка, скелетная мускулатура | Не изучена | Не изучен | Не изучено |
Ламинин-10 | 5 | 1 | 1 | Клетки эндотелия сосудов, плацента, эмбрион | Эмбриогенез, структурный каркас, развитие волоса | Делеция α5-цепи | Не изучено |
Ламинин-11 | 5 | 2 | 1 | Плацента, нейромышечное соединение, почечные клубочки | Не изучена | Не изучен | Не изучено |
Ламинин-12 | 2 | 1 | 3 | Почечные капилляры/артериолы, клетки Лейдига в яичках | Не изучена | Не изучен | Не изучено |
Ламинин-13 | 3 | 2 | 3 | Гиппокамп | Синаптическая организация ЦНС | Не изучен | Не изучено |
Ламинин-14 | 4 | 2 | 3 | Сетчатка/ЦНС, гиппокамп | Синаптическая организация ЦНС | Не изучен | Не изучено |
Ламинин-15 | 5 | 2 | 3 | Сетчатка/ЦНС | Синаптическая организация ЦНС | Не изучен | Не изучено |
Примечание. ЭЦМ - экстрацеллюлярный матрикс.
В зависимости от длины и состава доменов короткой LN терминальной части молекулы выделяют несколько подсемейств ламининов [4]:
- классические - ламинины 1-4 и ламинин-12;
- длинные - ламинин-10,11;
- усечённые - ламинин-5;
- обнаженные - ламинины 6-9.
Ламинин проходит несколько посттрансляционных модификаций, прежде чем достигнуть окончательной формы (рис. 2).
Связи и функциональные взаимодействия ламинина
Гломерулярный наконечник длинного отростка (LG) отвечает за связь с интегриновыми и неинтегрировыми рецепторами на поверхности клеток. Известно по меньшей мере девять таких интегринов: α1 β1 , α2 β1 , α5 ρ1 , α3 β1 , α6 β1 , α6 β4 , αvβ3 , αvβ5 , α7 β1 [5]. Каждый интегрин распознает особые последовательности в α-цепи ламинина и соответственно связывается только с конкретным ламинином. Также описано связывание интегринов с β- и γ-цепью [6].
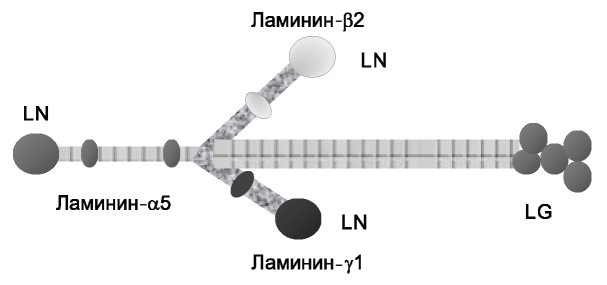
Рис. 1. Гетеротример ламинин-521.
Связывание ламинина с интегрином приводит к активизации цитоплазматического участка последнего, что сопровождается активизацией локальных адгезивных киназ (focal adhesion kinases - FAK), малых rho GTP и МАРК-пути [7].
Из числа неинтегриновых клеточных рецепторов ламинины связываются также с дистрогликановым рецептором, эластиновым рецептором, галактозит-связывающим лектином, галактозилтрансферазой, гепарин сульфатными протеогликанами и Ig-связанными базальными клеточными молекулами адгезии [6] (табл. 2).
Ламинин, в особенности α- и γ-цепи ламинина-332, участвуют в процессах миграции клеток [9]. В частности, α3-цепь связывается с помощью доменов LG2-3 с интегринами 31 и 61, которые посылают клеткам миграционные сигналы.
На ранних стадиях эмбрионального развития в период гломерулогенеза базальная мембрана представлена в основном ламинином-111 и ламинином-511 [10]. Но по мере созревания капилляров подоциты и эндотелиоциты начинают активно продуцировать лиминин-521, а ламинин-111 и ламинин-511 постепенно элиминируются.
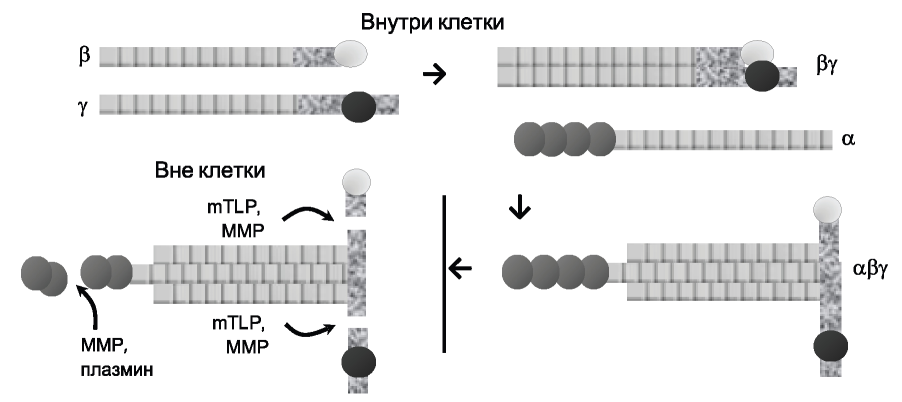
Рис. 2. Схема процессинга ламинина. mTLD - mammalian tolloid-like 1 - толлоид-1 млекопитающих; ММР - матриксные металлопротеиназы.
В гломерулярной мембране взрослого человека обнаруживается, как правило, только лами- нин-521 (рис. 3). Вместе с тем, в мезангиуме в норме у человека могут обнаруживаться α2-, α4-, β1- и γ1-цепи, а цепи α1, α2 и β1 в норме практически не встречаются [1]. Таким образом, в мезангиуме в физиологических условиях присутствуют ламинин-211 и ламинин-411. В разные периоды развития ламинин и коллаген IV типа связаны друг с другом, и молекулярная трансформация одного происходит в тесной связи с трансформацией другого. В то время как в антенатальном периоде α1- и α2-цепи коллагена IV типа связываются с β1-цепью ламинина, в постнатальном периоде α3-, α5-цепи связываются с β2- цепью ламинина [1].
Полимеризация ламининов
Базальная мембрана состоит из двух классов молекулярных связей. Первый класс формирует гетерополимерную структуру, образующую собственно матрикс мембраны, и второй класс обеспечивает рецепторную связь матрикса мембраны и поверхностных рецепторов клеток. Эти рецепторы играют не только структурную роль, обеспечивая адгезию клеток к внеклеточному матриксу, но имеют и функциональное значение. Изменение их структуры и конформации может менять структуру белков цитоскелета клетки, активность внутриклеточных сигнальных систем [4].
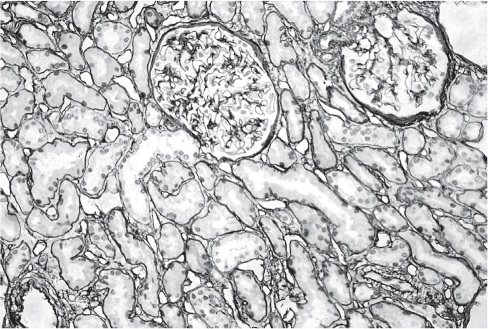
Рис. 3. Позитивная реакция с поликлональными антителами к ламинину (DAKO) в базальных мембранах клубочков, извитых канальцев и собирательных протоков.
Ламинины одновременно относятся к этим двум классам молекул, обеспечивая структурную целостность базальной мембраны и связь с рецепторами клеток. При этом показана уникальная связь между структурой молекулы ламинина, клеточными рецепторами и фенотипом клеток. Возможно, этот класс молекул является ключевыми для образования уникальных тканевых структур в эмбриогенезе. Ламинины выступают как инициирующие молекулы, запускающие процесс формирования базальной мембраны, обеспечивая связь рецепторного аппарата клеток и молекул внеклеточного матрикса. Неламининовые молекулы потенциально могут связываться с рецепторами клеток, однако без ламинина они не могут аккумулироваться и формировать структуры, связанные с клетками [11].
Полимеризация ламининов формирует сетчатую структуру, напоминающую кристаллическую [12], схематично представленную на рис. 4. Причем, полимеризация ламининов в естественных условиях не происходит в жидкостях, для этого процесса необходима связь ламининов с клеточными рецепторами.
Таблица 2
Изоформы ламинина и их рецепторы [8]

Домены LG1-3 ламининов связываются преимущественно с интегринами, а LG4-5 - с α-дистрогликаном (α-DG), гепарансульфатом и сульфатированными гликолипидами (сульфатиды) (рис. 5) [13, 14].
Среди интегринов, связывающих ламинины, также есть дифференциация - с определенными ламининами связываются определенные интегрины. К ламинин-связывающим интегринам относятся в частности α3β1, α6β1, α7β1 и α6β4 [15].
Ламинин-нидоген/энтактин комплексы обеспечивают связь ламининовых молекул с молекулами коллагена-4 и стабилизацию структуры базальной мембраны. Молекулы агрина и перлекана стабилизируют связи ламинина с интегринами и дистрогликанами.
По мнению одних исследователей, сети ламинина и коллагена IV типа регулируются все же независимо друг от друга. В частности, у мутантных мышей с отсутствием β2-цепи ламинина наблюдается формирование нормальной сети коллагена IV типа [16]. По мнению других - такая зависимость существует. В качестве примера можно привести данные синдрома Альпорта на мышах с мутацией Соl3а4, при котором продемонстрировано изменение соотношения изоформ ламинина в структуре мембраны [17].
Генетические исследования ламинина
Ламинин обеспечивает стабильность гломерулярной базальной мембране, а также оказывает влияние на рост, дифференциацию и прикрепление клеток.
Рис. 5. Схема связи ламининов с клеточной мембраной и коллагеном IV типа в структуре базальной мембраны.
Таблица 3
Локализация в хромосоме генов ламинина человека и размеры соответствующих им пептидов [18]
Название гена | Локализация хромосомы | Название цепи | Количество аминокислот | Молекулярная масса (кД) |
|---|---|---|---|---|
LAMA1 | 18p11.31 | α1 | 3,075 | 337,084 |
LAMA2 | 6q22-q23 | α2 | 3,122 | 343,905 |
LAMA3 | 18q11.2 | a3A | 1,713 | 189,335 |
a3B | 3,333 | 366,649 | ||
LAMA4 | 6q21 | α4 | 1,823 | 202,524 |
LAMA5 | 20q13.2-q13.3 | α5 | 3,695 | 399,737 |
LAMB1 | 7q22 | β1 | 1,786 | 198,038 |
LAMB2 | 3p21 | β2 | 1,798 | 195,981 |
LAMB3 | 1q32 | β3 | 1,172 | 129,572 |
LAMB4 | 7q22-q31.2 | β4 | 1,161 | 193,540 |
LAMC1 | 1q31 | γ1 | 1,609 | 177,603 |
LAMC2 | 1q25.31 | γ2 | 1,193 | 130,976 |
LAMC3 | 9q31-q34 | γ3 | 1,575 | 171,227 |
Идентифицированы гены, кодирующие большинство изоформ ламининов (табл. 3).
Исследование мутации ламинина в лабораторных условиях позволяет детально изучить его вероятную роль в развитии гломерулопатий и ремоделировании гломерулярной мембраны при этих патологических процессах. В частности, аутосомно-рецессивная мутация гена LAMB2, кодирующего синтез Р2-цепи ламинина, сопровождается развитием врожденного нефротического синдрома с офтальмологическими и неврологическими расстройствами, известного как синдром Пирсона. Интересно, что у нокаутированных Lamb2-/- мышей (экспериментальная модель синдрома Пирсона) наблюдается накопление в мембране аномальных форм - лиминина-511, -332, -211 и -111. Предположительно это обусловлено попытками компенсировать недостаток ламинина-521 [19]. Ламинин-511 является лучшим из перечисленных претендентом для замены ламинина-521 в случае мутации гена, поскольку он имеет аналогичные ламинину-521 α5- и γ1-цепи, а P1- и Р2-цепи структурно похожи. Кроме того, LG- домен а5-цепи ламинина-511 взаимодействует с интегрином α3β1 и другими рецепторами подоцитов и мезангиальных клеток, демонстрируя функциональное сходство с ламинином-521. Однако гломерулярная мембрана все равно функционирует ненормально, вероятно, это обусловлено недостаточной выработкой ламинина-511 у нокаутированных мышей [20].
При изучении мышей, нокаутированных по а1- цепи ламинина, наблюдается развитие фокальносегментарного гломерулосклероза и мезангиальной пролиферации. У них происходит повышение активности TGFβ/Smad сигнального пути в мезангиальных клетках, отвечающего в том числе за развитие почечного фиброза [21]. Также наблюдается повышение объема мезангиального матрикса [22].
У Lama4-/- нокаутированных мышей наблюдается уменьшение количества перицитов в гломерулах и перитубулярных капиллярах. Это, в свою очередь, приводит к расширению капилляров и повышению активности PDGF, связывающегося с PDGF-Rβ, что стимулирует процессы фиброза и ангиогенеза [19, 23-25]. LNα4 контактирует с эндотелиальными клетками, защищая их от апоптоза, и дефект α4-цепи сопровождается формированием ишемии сосудистого генеза [26]. Причем фибротические изменения происходят не только в почках, но и других органах, например в сердце, более того, в сердечной мышце они предположительно развиваются раньше, чем в почечной паренхиме. Возможно также развитие кардиомиопатии.
В исследовании E. Fischer и соавт. (2000) при проведении иммунофлюоресцентных исследований у лиц с разными формами хронических гло- мерулонефритов (фокально-сегментарный гломерулосклероз, мембранозная нефропатия, болезнь минимальных изменений) в случае мембранозной нефропатии обнаруживалось свечение в гломерулярной мембране β1-цепи ламинина, которая в норме выявляется у человека только на стадии эмбрионального развития (метанефрос) [27]. По мнению авторов, это обстоятельство связано с экспрессией генов и определяет изменения свойств мембран при мембранозной нефропатии, в частности, в отношении «просеивания» белка. Аналогичные данные при протеомном анализе мочи были получены нами [28].
Как известно, в процессе эмбриогенеза происходит последовательная смена ламинина-111 на ламинин-511 и потом на ламинин зрелого клубочка ламинин-521. Мутации генов, кодирующих определённые цепи ламининов, могут нарушать этот переход, что влияет на интеграцию компонентов базальной мембраны и состояние клубочкового фильтра в целом. При этом возможно повреждение не только базальной мембраны клубочков, но и канальцев. Последнее может приводить к нарушению клеточно-матриксных взаимодействий с развитием кистозных поражений [29, 30].
Заключение
Таким образом, ламинины представляют собой важный компонент клубочковой базальной мембраны, участвующий в построении функционального фильтрационного барьера. Разнообразие структуры ламининов определяет их функциональный полиморфизм. Связь ламининов с мембранами клеток обеспечивается посредством интегриновых и неинтегриновых рецепторов. Генетические аномалии ламининов определяют фенотипические проявления ряда нефропатий.
Список литературы
1. Miner JH. Building the glomerulus: a matricentic view. JASN 2005;16:857-861
2. Aumailley M, Bruckner-Tuderman L, Carter WG et al. A simplified laminin nomenclature. Matrix Biol 2005;24:326-332
3. St. John PL, Abrahamson DR. Glomerular endothelial cells and podocytes jointly synthesize laminin-1 and -11 chains. Kidney Int 2001;60:1037-1046
4. Colognato H, Yurchenco PD. Form and Function: The Laminin Family of Heterotrimers. Developmental Dynamics 2000;218:213-234
5. Tzu J, Li J, Marinkovich MP. Basement membrane and extracellular matrix molecules in the skin. In J. H. Miner, ed. In: Extracellular matrix in development and disease. Advances in developmental biology Elsevier, 2005; 129-151
6. Patarroyo M, Tryggvason K, Virtanen I. Laminin isoforms in tumor invasion, angiogenesis and metastasis. Semin. Cancer Biol 2002;12,197-207
7. Givant-Horwitz V, Davidson B, Reich R. Laminininduced signaling in tumor cells. Cancer Lett 2005;223,1-10
8. Schéele S, Nyström A, Durbeej M et al. Laminin isoforms in development and disease. J Mol Med 2007;85:825-836
9. Koshikawa N, Minegishi T, Sharabi A et al. Membrane-type matrix metalloproteinase-1 (MT1-MMP) is a processing enzyme for human laminin gamma 2 chain. J Biol Chem 2005;280,88-93
10. Miner JH, Patton BL, Lentz SI et al. The laminin alpha chains: expression, developmental transitions and chromosomal locations of alpha1-5, identification of heterotrimeric laminins 8-11 and cloning of a novel alpha3 isoform. J Cell Biol 1997;137:685-701.
11. Yurchenco PD. Basement Membranes: Cell Scaffoldings and Signaling Platforms. Cold Spring Harb Perspect Biol 2011;3:e004911
12. Hohenester E, Yurchenco PD. Laminins in basement membrane assembly. Cell Adhesion & Migration 2013;7:1,56-63
13. Ido H, Nakamura A, Kobayashi R et al. The requirement of the glutamic acid residue at the third position from the carboxyl termini of the laminin y chains in integrin binding by laminins. J Biol Chem 2007;282:11144-11154
14. Smirnov SP, McDearmon EL, Li S et al. Contributions of the LG modules and furin processing to laminin-2 functions. J Biol Chem 2002;277:18928-18937. PMID:11886875
15. Nishiuchi R, Takagi J, Hayashi M et al. Ligand-binding specificities of laminin-binding integrins: a comprehensive survey of laminin-integrin interactions using recombinant a3ß1, a6ß1, a7ß1 and a6ß4 integrins. Matrix Biol 2006;25:189-197. PMID:16413178
16. Noakes PG, Miner JH, Gautam M et al. The renal glomerulus of mice lacking s-laminin/laminin beta 2: nephrosis despite molecular compensation by laminin beta 1. Nat Genet 1995;10:400-406
17. Abrahamson DR, Prettyman AC, Robert B, John PLSt. Laminin-1 reexpression in Alport mouse glomerular basement membranes. Kidney Int 2003;63:826-834
18. Aumailley М. The laminin family. Cell Adhesion & Migration 2013;7:1:48-55
19. Abrass CK, Hansen KM, Patton BL. Laminin _4-Null Mutant Mice Develop Chronic Kidney Disease with Persistent Overexpression of Platelet-Derived Growth Factor The Am J of Pathology 2010;176(2):839-849
20. Suh JH, Jarad G, VanDeVoorde RG, Miner JH. Forced expression of laminin ß 1 in podocytes prevents nephrotic syndrome in mice lacking laminin ß2, a model for Pierson syndrome. PNAS 2011;108(37):15348-15353
21. Lan HY, Chung AC. TGF-beta/Smad signaling in kidney disease. Semin Nephrol 2012;32:236-243
22. Ning L, Kurihara H, de Vega Laminin S et al. Regulates Age-Related Mesangial Cell Proliferation and Mesangial Matrix Accumulation through the TGF-b Pathway. The Am J of Pathology 2014;184(6):1683-1694
23. Hansen KM, Abrass CK. Laminin-8/9 is synthesized by rat glomerular mesangial cells and is required for PDGF-induced mesangial cell migration. Kidney Int 2003;64:110-118
24. Hibino S, Shibuya M, Engbring JA et al. Identification of an active site on the laminin _5 chain globular domain that binds to CD44 and inhibits malignancy. Cancer Res 2004;64:4810-4816
25. Zhou Z, Doi M, Wang J et al. Deletion of laminin-8 results in increased tumor neovascularization and metastasis in mice. Cancer Res 2004;64:4059-4063
26. DeHahn KC, Gonzales M, Gonzalez AM et al. The _4 laminin subunit regulates endothelial cell survival. Exp Cell Res 2004;294:281-289
27. Fischer E, Mougenot B, Callard P et al. Abnormal expression of glomerular basement membrane laminins in membranous glomerulonephritis. Nephr Dyal Transp 2000;15:1956-1964
28. Гасанов МЗ, Батюшин ММ, Терентьев ВП, Садовничая НА. Протеомный анализ мочи пациентов с хроническим гломерулонефритом. Клиническая нефрология 2012;5-6:28-32
29. Miner JH. The Glomerular Basement Membrane. Exp Cell Res 2012;318(9):973-978
30. Золотухин ПВ, Беланова АА, Лебедева ЮА. Клеточная физиология повреждения и восстановления почек. Нефрология 2015;19(5):17-22
Об авторах
М. М. БатюшинРоссия
Д. Г. Пасечник
Россия
Рецензия
Для цитирования:
Батюшин М.М., Пасечник Д.Г. Ламинины в структуре гломерулярной базальной мембраны. Нефрология. 2016;20(5):9-15.
For citation:
Batiushin M.M., Pasechnic D.G. Laminines in the structure of glomerular basement membrane. Nephrology (Saint-Petersburg). 2016;20(5):9-15. (In Russ.)
JATS XML








































