Перейти к:
ВЛИЯНИЕ КОМБИНИРОВАННОГО ВВЕДЕНИЯ КРЫСАМ ТИРОКСИНА И ПРОПИЛТИОУРАЦИЛА НА СТРУКТУРНЫЕ ПОКАЗАТЕЛИ ПОЧЕЧНОЙ ПАРЕНХИМЫ
https://doi.org/10.24884/1561-6274-2017-21-1-57-67
Аннотация
ЦЕЛЬ РАБОТЫ – изучение динамики структурных изменений ренальной паренхимы крыс, подвергавшихся длительному комбинированному воздействию тироксина и ПТУ. МАТЕРИАЛЫ И МЕТОДЫ. Исследования проведены на беспородных самцах белых крыс массой тела 250–300 г. Гипертиреоз вызывали ежедневным внутрижелудочным введением тироксина (Т4) в количестве 50 мкг на100 гмассы тела на протяжении 30 сут. В первый день эксперимента животные были разделены на 2 группы. Животные первой группы (n=25) получали только Т4. Крысам второй группы (n=25) ежедневно вводили Т4+пропилтиоурацил (ПТУ). ПТУ вводили внутрижелудочно по 1 мг на100 гмассы тела. Пробы тканей почек собирали на 10-, 20-е и 30-е сутки эксперимента. Кроме того, был проведен сбор образцов ткани почек животных, получавших только Т4 через 20 сут после прекращения введения гормона. Полученные пробы ткани фиксировали и обрабатывали по общепринятой методике с последующей заливкой в парафин. Срезы окрашивали гематоксилином и эозином. РЕЗУЛЬТАТЫ. Установлено, что течение экспериментального гипертиреоза приводит к существенным структурным нарушениям почечной паренхимы. Ведущие проявления патологии почек при гипертиреозе – это грубые структурные повреждения канальцевого эпителия нефрона. ЗАКЛЮЧЕНИЕ. Комбинированное введение крысам тироксина и пропилтиоурацила дает слабо выраженный благоприятный эффект, ограничивая развитие структурных повреждений ренальной паренхимы и образования тромбов.
Для цитирования:
Доломатов С.И., Сиповский В.Г., Новиков Н.Ю., Касич И.Н., Мышко И.В., Дери К., Литвиненко А.Н. ВЛИЯНИЕ КОМБИНИРОВАННОГО ВВЕДЕНИЯ КРЫСАМ ТИРОКСИНА И ПРОПИЛТИОУРАЦИЛА НА СТРУКТУРНЫЕ ПОКАЗАТЕЛИ ПОЧЕЧНОЙ ПАРЕНХИМЫ. Нефрология. 2017;21(1):57-67. https://doi.org/10.24884/1561-6274-2017-21-1-57-67
For citation:
Dolomatov S.I., Sipovski V.G., Novikov N.Y., Kasich I.N., Myshko I.V., Deri К., Lytvinenko A.N. INFLUENCE OF COMBINED INJECTION OF THYROXIN AND PROPYLTHIOURACILUM ON SCTRUCTURAL INDICATORS OF RENAL PARENCHYMA. Nephrology (Saint-Petersburg). 2017;21(1):57-67. (In Russ.) https://doi.org/10.24884/1561-6274-2017-21-1-57-67
ВВЕДЕНИЕ
Согласно данным литературы, нарушения функции щитовидной железы существенно повышают риск возникновения ренальных дисфункций и почечной недостаточности [1-3]. Между тем, патофизиологические механизмы нарушения деятельности почек при гипертиреозе, характер структурных изменений ренальной паренхимы и динамика изменений гомеостатических функций почек, индуцированных избыточной секрецией йодтиронинов, остаются в центре внимания современной науки [4-7]. Большинство исследователей придерживаются мнения о том, что по мере нормализации тиреоидного статуса организма происходит восстановление функции почек. Однако ранее проведенные исследования показывают, что, во-первых, изменения почечного транспорта натрия, индуцированные гипертиреозом, сохраняются достаточно продолжительное время после нормализации тиреоидного статуса организма [8]. Во-вторых, было установлено, что продолжительное введение крысам тироксина приводит к грубым структурным повреждениям сосудистоклубочкового и канальцевого отделов нефрона, соответствующих представлению о хронической болезни почек (ХБП) [9]. Следовательно, оценка эффективности медикаментозных методов коррекции тиреоидного статуса в предотвращении патологических нарушений деятельности почек при гипертиреозе сохраняет свою актуальность. Пропилтиоурацил (ПТУ) - фармакологический препарат, который более 50 лет успешно применяется при лечении гипертиреоза [10] и его действие связано с ингибированием монодейодиназы I типа.
Поэтому целью нашей работы было изучение динамики структурных изменений ренальной паренхимы крыс, подвергавшихся длительному комбинированному воздействию тироксина и ПТУ.
МАТЕРИАЛЫ И МЕТОДЫ
Для эксперимента были отобраны беспородные самцы белых крыс массой тела 250-300 г. Гипертиреоз вызывали ежедневным внутрижелудочным введением тироксина (Т4) в количестве 50 мкг на 100 г массы тела на протяжении 30 сут. В первый день эксперимента животные были разделены на 2 группы. Животные первой группы (n=25) получали только Т4. Крысам второй группы (n=25) ежедневно вводили Т4+пропилтиоурацил (ПТУ). ПТУ вводили внутрижелудочно металлическим зондом, ежедневная доза ПТУ составляла 1 мг на 100 г массы тела.
Пробы тканей почек собирали на 10-, 20-е и на 30-е сутки эксперимента. Кроме того, был проведен сбор образцов ткани почек животных, получавших только Т4 через 20 сут после прекращения введения гормона. Для получения образцов тканей животных выводили из эксперимента путем декапитации под легкой эфирной анестезией. Полученные пробы ткани фиксировали в 10% растворе формалина. Далее материал обрабатывали по общепринятой методике с последующей заливкой в парафин. Срезы тканей толщиной 5-7 мкм окрашивали гематоксилином и эозином. Для выявления в срезах коллагеновых волокон соединительной ткани использовалась окраска по Ван-Гизону.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
На рис. 1, 2 представлены результаты анализа контрольной группы животных.
Гистологический анализ полученных образцов ткани позволил выявить умеренный характер структурных изменений в ренальной паренхиме животных, получавших только Т4 в течение 10 сут. В данной группе животных наиболее выраженные изменения были выявлены как в клубочках, так и тубулярном отделе нефрона. В клубочках отмечались признаки резко выраженного полонокровия капиллярых петель стаза, сладжа, местами микротромбоза. Морфологически это сочеталось с частичным сморщиванием, спадением капиллярных петель и расширением просвета капсулы Боумена (рис. 6).
В эпителии канальцев, приемущественно проксимальных, отмечались признаки альтерации: набухание цитоплазмы с частичной утратой щеточной каемки, диссоциация клеток, слущивание в просвет канальцев с частичной утратой щеточной каемки (рис. 3). Резко выраженное полнокровие перитубулярных капилляров с признаками стаза, сладжа и микротромбоза наблюдалось в тубулоинтерстиции (рис. 4).
Кроме того, при обзорной микроскопии выявлялись признаки периартериального отека и венозного полнокровия (рис. 5).
На 20-е сутки эксперимента в группе крыс, получавших только Т4, наблюдается дальнейший прогресс признаков повреждений клубочков и канальцев. Наряду с вышеописанными изменениями, в просвете канальцев появляются в значительном количестве гиалиновые цилиндры (рис. 9), а в тубулоинтерстиции единичные лифо- гистиоцитарные инфильтраты.
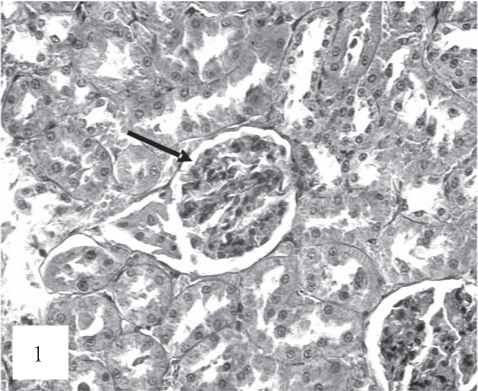
Рис. 1. Умеренная гиперемия капилляров клубочков (показано стрелкой). Окраска гематоксилином и эозином. Ув. 200.
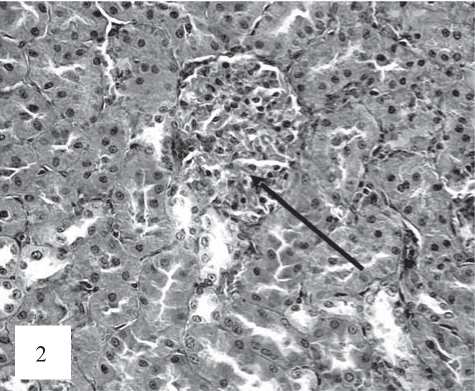
Рис. 2. Слабая коллагенизация капиллярных петель клубочков (показано стрелкой). Окраска по Ван-Гизону. Ув. 200.
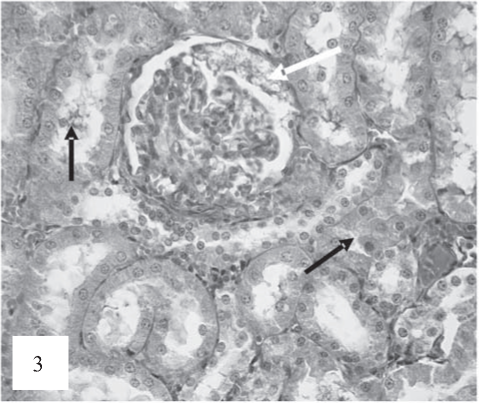
Рис. 3. Эпителий проксимальных извитых канальцев с признаками набухания цитоплазмы, некробиоза, диссоциации и слущивания в просвет канальцев (черные стрелки). В клубочках спадение капиллярых петель, расширение пространства капсулы. Очаговая гиперплазия париетальных клеток капсулы Боумена (белая стрелка). Окраска по Ван-Гизону. Ув. 200.
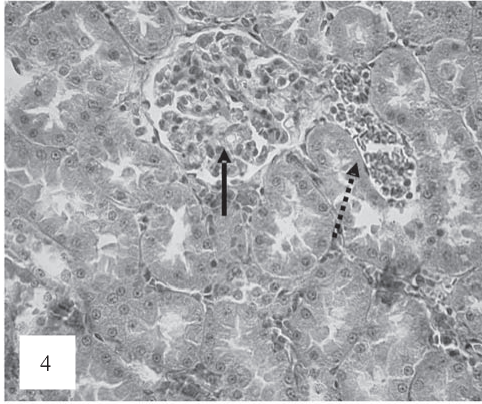
Рис. 4. Полнокровие капилляров клубочка с признаками микротромбоза (черные стрелки). Полнокровие и расширение просвета мелких сосудов тубулоинтерстиция с признаками стаза и сладжа эритироцитов (показано пунктирными стрелками). Окраска по Ван-Гизону. Ув. 200.
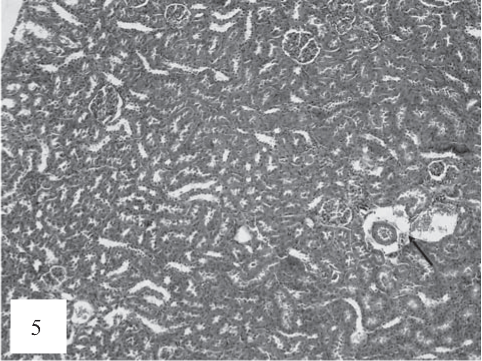
Рис. 5. Периартериальный отек, венозное полнокровие (черная стрелка). Расширение просвета дистальных канальцев. Окраска гематоксилином и эозином. Ув. 100.

Рис. 6. Канальцевый эпителий большинства проксимальных извитых канальцев набухший, цитоплазма эпителиоцитов бесструктурна, с просветлениями (показано стрелками). В просвете канальцев наблюдаются гиалиновые цилиндры (показано пунктирной стрелкой). Окраска гематоксилином и эозином. Ув. 200.
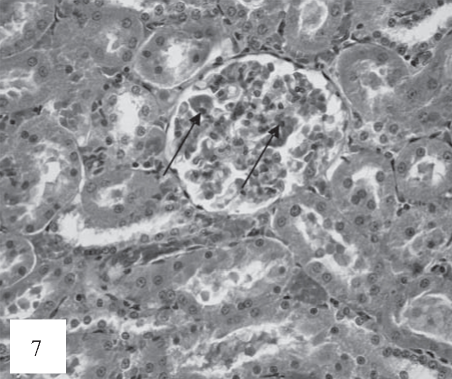
Рис. 7. Почечные клубочки гиперемированы, расширены, отечны, в капиллярных петлях наблюдаются участки, тромбоза (отмечено стрелками). Окраска гематоксилином и эозином. Ув. 200.

Рис. 8. Встречаются кровоизлияния различных размеров, которые локализуются в коре и мозговом слое почки и венозный тромбоз (показано стрелками). Окраска по Ван-Гизону. Ув. 100.
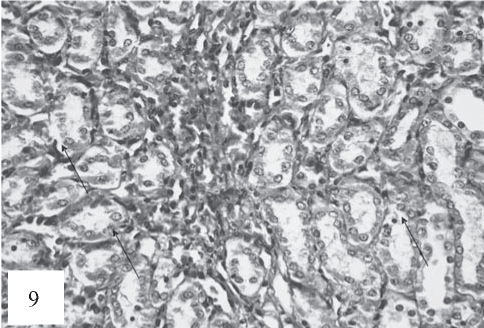
Рис. 9. Канальцы расширены, с признаками дилатации. Клетки дистальных канальцев с признаками некробиотических изменений: набухание ядер клеток с маргинацией ядерного хроматина, деструкция цитоплазмы, десквамация в просвет канальцев (показано стрелками). Очаговый тромбоз сосудов ТИН. Окраска гематоксилином и эозином. Ув. 200.
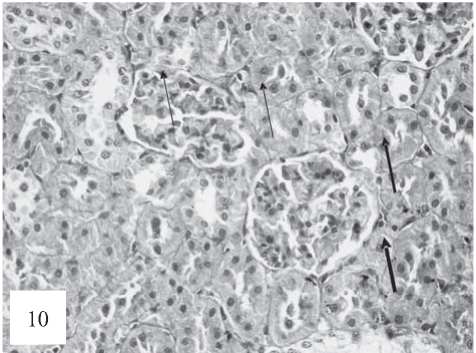
Рис. 10. Полнокровие, тромбоз капилляров почечных клубочков, «псевдолобулярная» структура клубочков (показано стрелками). Диссоциация и десквамация эпителия канальцев. Окраска гематоксилином и эозином. Ув. 200.
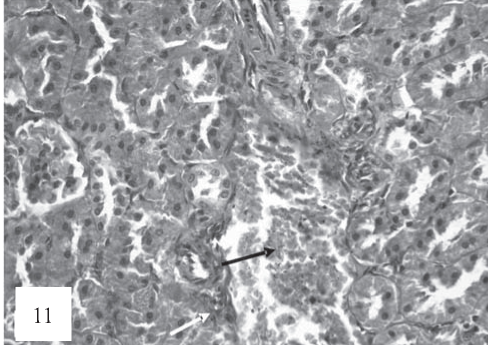
Рис. 11. В паренхиме имеют место венозное полнокровие (черная стрелка), признаки активации (набухание, гиперплазия) эндотелия артерий (белая стрелка). Окраска гематоксилином и эозином. Ув. 200.

Рис.12. Эпителий тонких канальцев и петли Генле имеет оптически светлую цитоплазму, цитоплазма части эпителиоцитов имеет значительные просветления, наблюдается деструкция единичных клеток (показано стрелками). Окраска гематоксилином и эозином. Ув. 200.
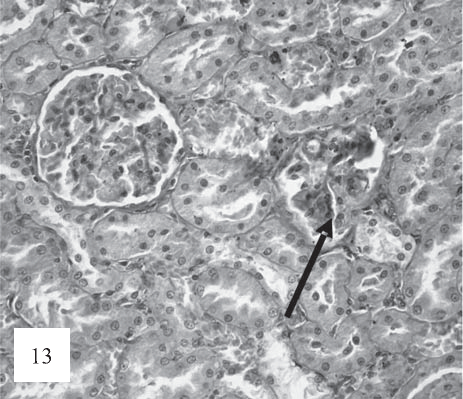
Рис. 13. Некоторые клубочки подвергаются склерозу и сморщиванию (показано стрелками). Окраска по Ван-Гизону. Ув. 200.
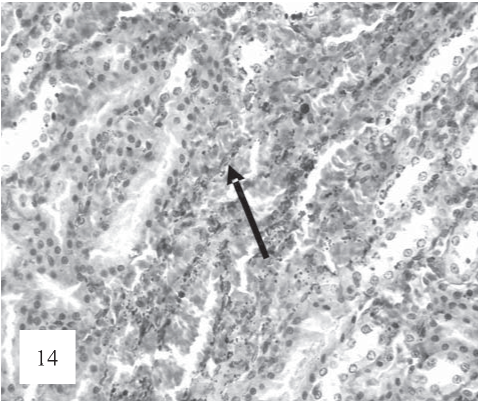
Рис. 14. В некоторых участках канальцев наблюдаются отложения гемосидерина (показано стрелками). Окраска по Ван-Гизону. Ув. 200.
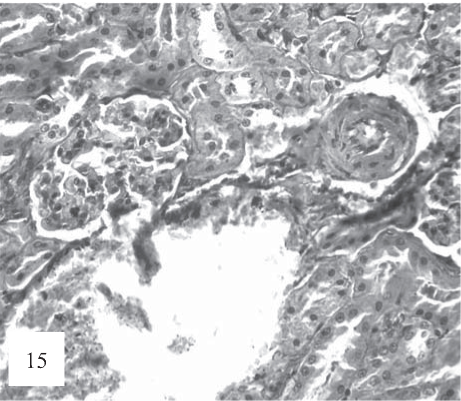
Рис. 15. Мелкие артерии в состоянии склероза и гиалиноза с выраженным периваскулярным отеком, плазматическим пропитыванием стенки и умеренной коллагенизацией ад- вентиции (показано стрелками). Окраска гематоксилином и эозином. Ув. 200.
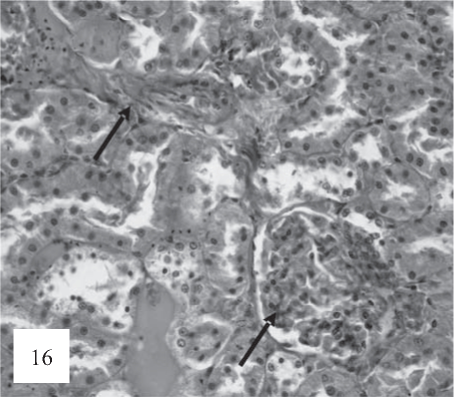
Рис. 16. В паренхиме отмечается перваскулярный склероз и фокально-сегментарная умеренная коллагенизация клубочков (показано стрелками). Окраска по Ван-Гизону. Ув. 200.
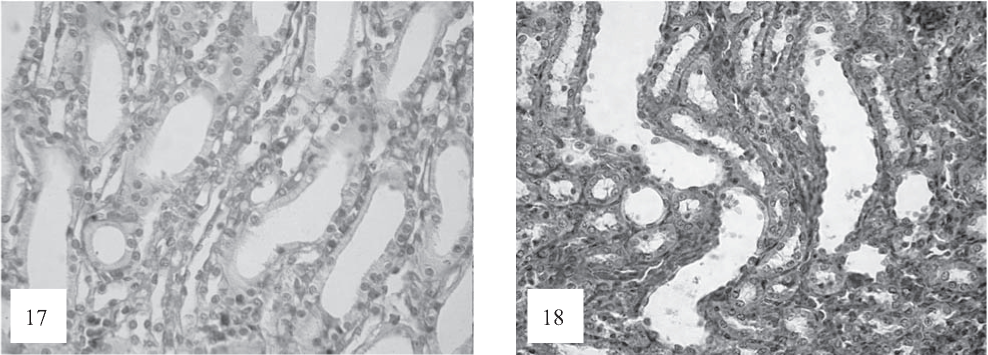
Рис. 17, 18. В дистальных канальцах эпителиоциты уплощенные с четким апикальным краем, в расширенных просветах хлопьевидные образования, фрагменты десквамированных клеток (К). Наряду с этими изменениями в канальцах также отмечаются набухание эпителия, очаговые некрозы (Н). Строма отечная. Застойная гиперемия сосудов, очаговые диапедезные кровоизлияния (Кр). Окраска по Ван-Гизону. Ув. 100.
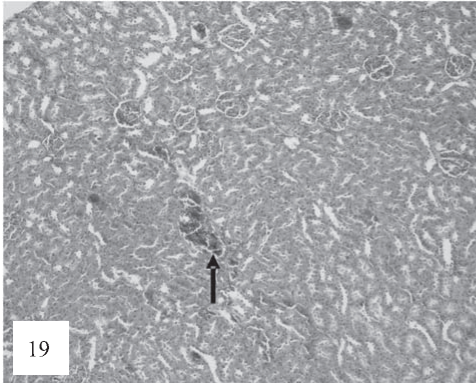
Рис. 19. В клубочках наблюдаются неравномерная гиперемия капиллярных петель с признаками стаза и очагового микротромбоза, умеренная пролиферация мезангиальных клеток, разрастание соединительной ткани. Клубочки различных размеров с лобулярным рисунком и отложением белковых масс в просвете капсулы Боумена. Окраска по Ван-Гизону. Ув. 100.
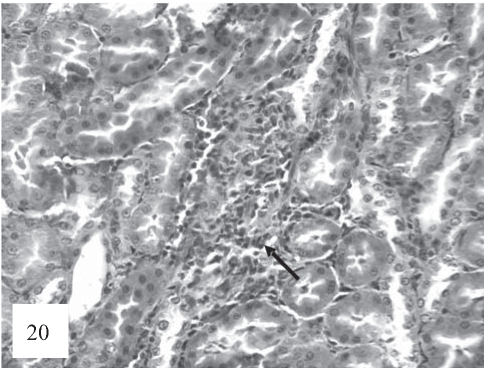
Рис. 20. Встречаются лимфогистиоцитарные инфильтраты (стрелка), расположенные в корковом и мозговом веществе почки. Окраска гематоксилином и эозином. Ув. 200.
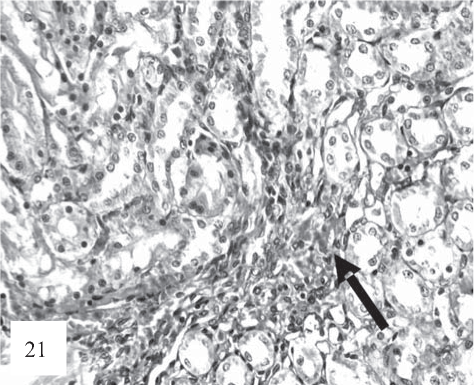
Рис. 21. Встречаются очаги кровоизлияний (показан стрелкой). Выраженная дистрофия эпителия канальцев, диссоциация, слущивание и очаговый некробиоз клеток тубулярного эпителия. Окраска гематоксилином и эозином. Ув. 200.
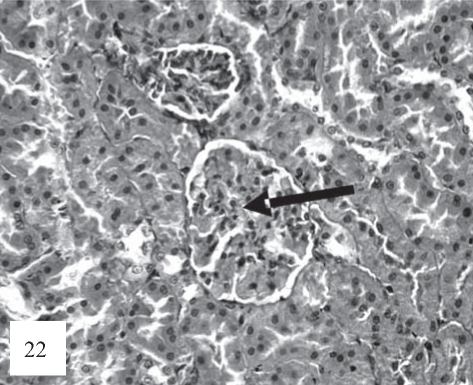
Рис. 22. Регистрируются выраженная гиперемия и микротромбоз, фокально-сегментарное спадение капиллярных петель почечных клубочков (стрелка). Сегментарная гиперклеточность мезангия. Окраска гематоксилином и эозином. Ув. 200.
В клубочках на 20-е сутки эксперимента наблюдается появление признаков гиперклеточности, связанных, по-видимому, с пролиферацией мезангиоцитов и, частично, с появлением в структурах клубочков единичных лейкоцитов (рис. 7). Кроме того, на данных сроках наблюдаются очаговые периваскулярные геморрагии в тубулоинтерстиции (рис. 8).
На 30-е сутки эксперимента в группе крыс, получавших только Т4, обнаружены наиболее тяжелые нарушения нефрона. Патологические изменения в проксимальных канальцах, наряду с вышеописанными, имели также участки фокального некробиотического процесса в ТИН (рис. 9).
Течение экспериментальной патологии сопровождается дополнительными изменениями в клубочках. В них образуются «лобулярноподобные» структуры с тромбозом, а местами и глобальной облитерацией просветов капилляров (апоплексия) (рис. 10).
В просвете капсулы почечных клубочков обнаруживаются фибриновые депозиты. В артериях отмечаются изменения, которые свидетельствуют об активации эндотелия (рис. 11).
Результаты патоморфологических исследований ренальной паренхимы крыс через 20 сут после прекращения введения тироксина на протяжении 30 дней показали, что через 20 сут после прекращения введения гормона в почках, с одной стороны, сохраняются достаточно выраженные признаки структурных нарушений, с другой - отмечаются признаки начальных этапов репарации. В частности, в эпителии, наряду с сохраняющимися признаками дистрофии, некробиоза и десквамации, отмечаются признаки частичного восстановления структуры канальцев с уменьшением проявления альтеративных изменений в них (рис. 12).
В клубочках отмечаются освобождение части капиллярных петель от мироктромбов и активная гиперклеточная реакция в мезангии с формированием лобулярного рисунка, а также фокальносегментарный склероз (рис. 13).
В тубулоинтерстиции, кроме признаков тромбоза микрососудов геморрагий, выявляются отложения гемосидерина приемущественно в соединительной ткани (рис. 14).
В артериях, наряду с периваскулярным отеком, наблюдаются признаки микротромбоза артерий с субэндотелиальным отеком (рис. 15) и перваскулярного склероза (рис. 16).
При комбинированном введении крысам Т4 и ПТУ на 10-е сутки эксперимента структура тубулярного эпителия относительно сохранна. Выявляются признаки альтерации эпителия в виде набухания эпителия, очаговой гидропической дистрофии и слущивания клеток в просвет канальцев (рис. 20).
В перитубулярных капиллярах отмечаются признаки очагового стаза и микротрмбоза , черная стрелка (рис. 19).
Структурные изменения клубочков, тубуло- интерстиция и канальцев существенно не имели существенных различий с группой животных, получавших только тироксин в течение 10 дней.
Анализируя гистопрепараты почек крыс, подвергавшихся в течение 20 сут комбинированному введению Т4 и ПТУ, мы констатируем, что эпителий проксимальных и дистальных канальцев имеет аналогичные изменения, описанные выше. Вместе с тем, как и в группе животных, получавших только тироксин, отмечались единичные лимфогистоцитарные инфильтраты (рис. 20).
В зонах некробиотических изменений канальцев иногда за счет гибели эпителия базальная мембрана канальцев частично оголяется. В таких участках регистрируются микротромбы и диапе- дезные кровоизлияния с выходом форменных элементов крови в просвет канальцев.
В клубочках наблюдались изменения, аналогичные соответствующему сроку в группе животных, получавших только тироксин.
В целом, если сравнивать структурные изменения ренальной паренхимы животных, получавших только Т4 или Т4+ПТУ, то следует отметить, что на 20-е сутки эксперимента тяжесть и распространенность, в частности, тромбозов и некробиотических изменений были более высокими в группе животных, не получавших ПТУ.
После 30 дней комбинированного введения крысам Т4 и ПТУ эпителий проксимальных и дистальных извитых канальцев набухший с признаками дистрофических изменений, местами некротизирован и слущен в просвет канальцев так, что базальная мембрана дистальных извитых канальцев оказывается лишенной эпителия (рис. 21).
Иногда, особенно вблизи очагов паренхиматозных кровоизлияний, в просвете канальцев определяются форменные элементы крови. В клубочках, с одной стороны, отмечалось отсутствие существенных патоморфологических изменений, с другой - в ряде из них наблюдалась умеренная очаговая пролиферация эндотелиоцитов и мезан- гиоцитов в капиллярных петлях клубочков. Регистрировалась выраженная гиперемия капилляров с микротромбами (рис. 22). При этом, коллагеновые отложения выявляются в минимальной степени.
Необходимо указать, что патоморфологические изменения в обеих группах имели во многом сходные признаки. Однако распространенность и тяжесть этих изменений были более выраженными в группе животных, получавших только Т4.
ОБСУЖДЕНИЕ
Необходимо отметить, что фармакологический эффект ПТУ, в конечном счете, направлен на угнетение гормоногенеза в секретирующих фолликулах щитовидной железы. В условиях нашего эксперимента терапевтические свойства препарата существенно ограничивались экзогенным поступлением тироксина. Тем не менее, целесообразность применения ПТУ, по нашему мнению, обусловлена эффективностью препарата в отношении ингибиции процессов конверсии тироксина в физиологически активную форму гормона - трийодтиронин. Почки являются важным органом-мишенью тиреоидных гормонов [11, 12]. В почечной паренхиме активно протекают процессы конверсии тироксина в физиологически активную форму - трийодтиронин [13, 14]. В свою очередь, в условиях гипертиреоза избыточная продукция трийодтиронина может стимулировать активность внутрипочечной РАС [5, 15, 16]. Активацию трийодтиронином внутрипочечной РАС допустимо рассматривать в качестве важнейшего патофизиологического механизма ренальных дисфункций при гипертиреозе. Такое предположение подтверждается благоприятным эффектом ингибиторов РАС на функциональное состояние почек [17, 18] и гистологические показатели почек крыс в условиях экспериментального гипертиреоза [9].
Опираясь на приведенные аргументы, мы предполагали, что в условиях экспериментального гипертиреоза применение ПТУ позволило бы добиться ослабления структурных нарушений ренальной паренхимы в результате подавления пусковых механизмов неадекватной активации внутрипочечной РАС. С указанных позиций наибольший интерес представляли степень и динамика структурных повреждений проксимального канальца нефрона. Данный интерес был обусловлен сообщениями о том, что активация внутрипочечной РАС может сопровождаться повышением секреции ренина не только клетками ЮГА, но и, в значительно большей степени, усилением внутриклеточной продукции компонентов РАС в канальцевом эпителии. В этом случае значительные количества ангиотензина, образующегося непосредственно в канальцевом эпителии, оказывают свое действие по аутокринному механизму, не поступая во внутриорганный и системный кровоток [19, 20]. Привлекает внимание тот факт, что в нашем эксперименте структурные нарушения ренальной паренхимы на ранних этапах течения экспериментальной патологии преимущественно затрагивают проксимальный S2 отдел канальца нефрона, в котором, главным образом, локализован автономный сегмент внутриренальной РАС [19, 20]. Действительно, вполне отчетливые признаки структурных нарушений нефроцитов проксимального извитого отдела канальца выявлены в пробах ткани крыс, получавших Т4 в течение 20 сут. По нашему мнению, поражение проксимальных извитых сегментов нефрона первичны по отношению к другим отделам нефрона и вызваны резким усилением продукции ангиотензина-II нефроцитами. В свою очередь, неограниченная стимуляция ангиотензина-II может сопровождаться индукцией воспаления [21], фиброзом ткани [22] и апоптозом эпителиальных клеток [23].
К 30-м суткам с момента начала введения гормона регистрировались грубые структурные нарушения сосудисто-клубочкового аппарата, а также эпителия по всей оси канальцевого отдела нефрона. Подчеркнем, что структурные повреждения обнаружены не только в корковых, но и медуллярных сегментах канальца. Также были выявлены множественные очаги кровоизлияния. Анализ гистологических препаратов почки крыс к 30-м суткам эксперимента позволяет констатировать грубые нарушения ренальной паренхимы и составить неблагоприятный прогноз. Такие выводы подтверждаются изучением гистологических препаратов почек крыс через 20 сут после завершения введения тироксина в течение 30 сут. В данной серии сохраняются признаки некробиотических изменений ткани на фоне заметной стимуляции репаративных процессов.
В группе крыс, подвергавшихся комбинированному воздействию тироксина и ПТУ, уже на 10-е сутки эксперимента степень повреждения ткани почек существенно не отличается от изменений в группе животных, получавших только Т4. Установлено, что на данном временном отрезке течения экспериментальной патологии изменения структуры нефрона носят достаточно умеренный характер.
По мере течения экспериментальной патологии в группе крыс, получавших ПТУ и тироксин, имеет место дальнейшее усиление деструктивных процессов на уровне канальцевого отдела. На завершающем этапе исследований в гистологических препаратах почек крыс данной группы наблюдаются некроз и десквамация нефроцитов по всей оси канальцевого отдела, оголение базальной мембраны канальцев коркового и мозгового вещества, клубочки подвергаются некробиотическим изменениям и лимфогистиоцитарной инфильтрации, обнаружены множественные очаги кровоизлияний. Вместе с тем, интенсивность повреждения ренальной паренхимы несколько ниже, чем у животных, получавших только Т4.
По нашему мнению, следует указать, что, наряду с перечисленными изменениями структур нефрона под влиянием экзогенного Т4, по мере течения экспериментальной патологии наблюдается усиление тромбоза кровеносных сосудов, что можно рассматривать в качестве признака нарушения системы регуляции агрегатного состояния крови. С одной стороны, усилению процесса образования тромбов сопутствует нарастание повреждений ренальной паренхимы и кровеносных сосудов почки. С другой стороны - следует отметить, что йодтиронины [24], ТТГ [25] и ренинангиотензиновая система [26] играют важную роль в регуляции системы контроля агрегатного состояния крови. При этом, введение животным ПТУ несколько ослабляет не только выраженность структурных нарушений нефрона, но и процесса тромбообразования.
Таким образом, нами не выявлено резко выраженного благоприятного влияния ПТУ на структурные показатели почек крыс в условиях экспериментального гипертиреоза. Было установлено, что, с одной стороны, введение животным ПТУ способствует некоторому сдерживанию интенсивности структурных повреждений ренальной паренхимы и процесса тромбообразования. С другой стороны - нами не обнаружено четких признаков активации репаративных процессов. Возможно, ограничение процессов конверсии тироксина в физиологически активную форму - трийодтиронин в значительной мере отражается на эффектах Т3 и его метаболитов (дийодтиронинов), направленных на оптимизацию обменных процессов в ренальной паренхиме [27-29], усиление антиоксидантной защиты ткани почки [30, 31], координацию факторов, регулирующих репаративные механизмы в тканях [32]. Действительно, в литературе имеются единичные сведения о том, что введение крысам ПТУ усугубляет структурные повреждения ренальной паренхимы, вызванные гентамицином, и замедляет темпы репаративных процессов в почке [33].
Таким образом, сопоставляя данные литературы с результатами собственных исследований, можно сделать несколько выводов. Во-первых, гипертиреоз вызывает грубые структурные изменения ренальной паренхимы. Ведущим патофизиологическим механизмом является поражение проксимального канальца нефрона. По мере прогрессирования эндокринной патологии происходит повреждение канальцевого эпителия по всей оси нефрона, включая структурные нарушения сосудисто-клубочкового аппарата и системы регуляции агрегатного состояния крови. Комбинированное введение крысам тироксина и ПТУ несколько ослабляет развитие структурных повреждений ренальной паренхимы и образования тромбов. Ранее полученные нами результаты демонстрируют благоприятное влияние блокаторов РААС (ингибиторов АПФ и антагонистов АТ1- рецепторов) на функциональное состояние почек [17, 18] и гистологические показатели почек крыс [9] в условиях экспериментального гипертиреоза. Следовательно, во-вторых, мы не исключаем, что в данном контексте ангиотензин-IIдопустимо рассматривать в качестве одного из гуморальных медиаторов тиреоидных гормонов, которому принадлежит ведущая роль в патогенезе и прогрессировании патологии почек при гипертиреозе. Возможно, собственно повышенный системный уровень тиреоидных гормонов не представляет прямой опасности структурной целостности ренальной паренхимы. Поэтому стратегия на нормализацию тиреоидного статуса организма не является достаточной для защиты тканей почки от повреждения и обязательно должна включать в себя применение блокаторов РААС.
ЗАКЛЮЧЕНИЕ
Течение экспериментального гипертиреоза приводит к значительным структурным нарушениям почечной паренхимы, формируя риск возникновения и прогрессирования ХБП. Особенности морфологических изменений позволяют охарактеризовать как проявления тубулоинтерсти- циального нефрита. Комбинированное введение крысам тироксина и пропилтиоурацила оказывает слабо выраженный благоприятный эффект, несколько ограничивая развитие структурных повреждений ренальной паренхимы и образования тромбов. Необходимо проведение дальнейших исследований для уточнения характера морфологических изменений в почках человека при гипертиреозе.
Список литературы
1. Basu G, Mohapatra A. Interactions between thyroid disorders and kidney disease. Indian J Endocr Metab 2012;16(2):204213. DOI: 10.4103/2230-8210.93737
2. Kim EO, Lee IS, Choi YA et al. Unresolved Subclinical Hypothyroidism is Independently Associated with Progression of Chronic Kidney Disease. Int J Med Sci 2014; 11(1): 52–59. doi: 10.7150/ijms.7186
3. Dousdampanis P, Trigka K, Vagenakis GA, Fourtounas C. The thyroid and the kidney: a complex interplay in health and disease. Int J Artif Organs 2014;37(1):1-12. doi: 10.5301/ijao.5000300
4. Iglesias P, Díez J. Thyroid dysfunction and kidney disease. European Journal of Endocrinology 2009;160:503-515
5. Vargas F, Rodríguez-Gómez I, Vargas-Tendero P et al. The renin–angiotensin system in thyroid disorders and its role in cardiovascular and renal manifestations. Journal of Endocrinology 2012;213:25-36
6. Zhang Y, Chang Y, Ryu S et al. Thyroid hormone levels and incident chronic kidney disease in euthyroid individuals: the Kangbuk Samsung Health Study. Int J Epidemiol 2014;43(5):1624-1632. doi: 10.1093/ije/dyu126
7. Wangensteen R, Segarra AB, Ramirez-Sanchez M et al. Influence of thyroid disorders on the kidney expression and plasma activity of aminopeptidase A. Endocr Regul. 2015;49(2):68-72
8. Dolomatov S, Muszkieta R, Zukow W Experimental Investigation of Acute and Delayed Renal Effect of Exogenous Thyroxine. Thyroid Disorders & Therapy 2012; 1:1. doi.org/10.4172/jtdt.1000105
9. Dolomatov S, Novikov N, Zukow W et al. Effect of captopril and losartan on the structural and functional indicators kidneys of white rats in experimental hyperthyroidism. J of Health Sciences 2011;1(3):147-166
10. Tofangchiha S, Jamshidi SM, Emami H, Dormanesh B. Investigating Antithyroid Effects of Propylthiouracil on the Ischemia and Reperfusion Injury in Rat’ Kidney and Determining the Role of Nitric Oxide in Mediating this Effect. Iran Red Crescent Med J 2014;16(10):e15605. doi: 10.5812/ircmj.15605
11. El Ters M, Patel SM, Norby SM. Hypothyroidism and reversible kidney dysfunction: an essential relationship to recognize. Endocr Pract 2014;20(5):490-499. doi: 10.4158/EP12084.RA
12. Rodríguez-Gómez I, Banegas I, Wangensteen R et al. Influence of thyroid state on cardiac and renal capillary density and glomerular morphology in rats. J Endocrinol 2013;216:43-51. doi: 10.1530/JOE-12-0208
13. Lavado-Autric R, Calvo RM, de Mena RM et al. Deiodinase activities in thyroids and tissues of iodine-deficient female rats. Endocrinology 2013;154(1):529-536. doi: 10.1210/en.2012-1727
14. Niemczyk S, Dudek M, Bartoszewicz Z et al. Determining the enzymatic activities of iodothyronine 5’-deiodinases in renal medulla and cortex. Endokrynol Pol 2013;64(3):182-185
15. Ichihara A, Kobori H, Miyashita Y et al. Differential effects of thyroid hormone on renin secretion, content, and mRNA in juxtaglomerular cells. Am J Physiol Endocrinol Metab 1998;274(2):E224-231 16. Kobori H, Hayashi M, Saruta T. Thyroid Hormone Stimulates Renin Gene Expression Through the Thyroid Hormone Response Element. Hypertension 2001;37(1):99-104
16. Доломатов СИ, Гоженко АИ, Ларина ИМ и др. Влияние натриевого рациона и каптоприла на функциональное состояние почек при экспериментальном гипертиреозе. Экспер и клин фармакол 2005;68(5):26–28 [Dolomatov SI, Gozhenko AI, Larina IM i dr. Vliyanie natrievogo raciona i kaptoprila na funkcional’noe sostoyanie pochek pri ehksperimental’nom gipertireoze. Eksperimental’naya i klinicheskaya farmakologiya 2005;68(5):26–28]
17. Dolomatov SI, Sataieva TP. Effect of ras-blockers and nocycle metabolites on the renal functions of rats exposed to thyroxine injections. J of Education, Health and Sport 2015;5(1):41-55
18. Kobori H, Nangaku M, Navar LG, Nishiyama A. The Intrarenal Renin-Angiotensin System: From Physiology to the Pathobiology of Hypertension and Kidney Disease. Pharmacol Rev 2007;59:251-287
19. Li XC, Zhuo JL. Intracellular ANG II directly induces in vitro transcription of TGF-β1, MCP-1, and NHE-3 mRNAs in isolated rat renal cortical nuclei via activation of nuclear AT1a receptors. Am J Physiol Cell Physiol 2008;294:C1034-C1045
20. Li J, Doerffel Y, Hocher B, Unger Th Inflammation in the genesis of hypertension and its complications—the role of angiotensin II. Nephrology Dialysis Transplantation 2007;22(11):3107-3109
21. Ruiz-Ortega M, Rodríguez-Vita J, Sanchez-Lopez E et al. TGF-β signaling in vascular fibrosis. Cardiovascular Research 2007;74(2):196-206
22. Bhaskaran M, Reddy K, Radhakrishanan N et al. Angiotensin II induces apoptosis in renal proximal tubular cells. Am J Physiol Renal Physiol 2003;284(5):F955-F965
23. Seg n a D, Méan M, Limacher A et al. Association between thyroid dysfunction and venous thromboembolism in the elderly: a prospective cohort study. J Thromb Haemost 2016;14(4):685-694
24. Lippi G, Danese E, Montagnana M et al. Mean platelet volume is significantly associated with serum levels of thyroidstimulating hormone in a cohort of older euthyroid subjects. Endocr Res 2015;40(4):227-230 doi:10.3109/07435800.2015.1037392
25. Wojewodzka-Zelezniakowicz M, Kisiel W, Kramkowski K et al. Quinapril decreases antifibrinolytic and prooxidative potential of propofol in arterial thrombosis in hypertensive rats. J Renin Angiotensin Aldosterone Syst 2016;17(2). pii: 1470320316647239. doi: 10.1177/1470320316647239
26. Gereben B, Zavack i AM, Ribich S et al. Cellular and Molecular Basis of Deiodinase-Regulated Thyroid Hormone Signaling. Endocrin e Reviews 2008; 29(7):898-938. doi:10.1210/er.2008-0019
27. Nigwekar SU, Strippoli GF, Navaneethan SD. Thyroid hormones for acute kidney injury. Cochrane Database Syst Rev 2013 31;1:CD006740. doi: 10.1002/14651858.CD006740.pub2
28. Shang G, Gao P, Zhao Z et al. 3,5-Diiodo-l-thyronine ameliorates diabetic nephropathy in streptozotocin-induced diabetic rats. Biochim Biophys Acta. 2013;1832(5):674-684. doi: 10.1016/j.bbadis.2013.01.023
29. Faustino LC, Almeida NAS, Pereira GF et al. Thyroid hormone and estradiol have overlapping effects on kidney glutathione S-transferase-α gene expression. Am J of Physiol – Endocrinol and Metabolism 2012;303(6): E787-E797. DOI: 10.1152/ajpendo.00223.2012
30. Kim SM, Kim SW, Jung YJ et al. Preconditioning with thyroid hormone (3,5,3-triiodothyronine) prevents renal ischemiareperfusion injury in mice. Surgery 2014;155(3):554-561. doi: 10.1016/j.surg.2013.10.005
31. St. Germain DL, Galton VA, Hernandez A. Defining the Roles of the Iodothyronine Deiodinases: Current Concepts and Challenges. Endocrinology 2009;150(3):1097-1107
32. Sepehri G, Derakhshanfar A, Saburi L. Does Propylthiouracil Increase the Gentamicin-Induced Nephrotoxicity In Rat? Iran J Basic Med Sci 2013;16(11): 1190–1195
Об авторах
С. И. ДоломатовРоссия
Доцент Доломатов Сергей Игоревич, кандидат биологических наук
Кафедра биологии медицинской
295006, Россия, г. Симферополь, бул. Ленина, д. 5/7
В. Г. Сиповский
Россия
Доцент Сиповский Василий Георгиевич, кандидат медицинских наук
Научно-исследовательский институт нефрологии
197089, Россия, Санкт-Петербург, ул. Льва Толстого, д. 17
Н. Ю. Новиков
Россия
Новиков Николай Юлиевич, доктор медицинских наук, старший научный сотрудник.
И. Н. Касич
Россия
Касич Игорь Николаевич - студент
И. В. Мышко
Россия
Мышко Илья Владимирович - студент
К. Дери
Россия
Дери Карим - студент
А. Н. Литвиненко
Россия
Литвиненко Антон Николаевич
350911, Россия, г. Краснодар, ул. Садовая, д. 9.
Рецензия
Для цитирования:
Доломатов С.И., Сиповский В.Г., Новиков Н.Ю., Касич И.Н., Мышко И.В., Дери К., Литвиненко А.Н. ВЛИЯНИЕ КОМБИНИРОВАННОГО ВВЕДЕНИЯ КРЫСАМ ТИРОКСИНА И ПРОПИЛТИОУРАЦИЛА НА СТРУКТУРНЫЕ ПОКАЗАТЕЛИ ПОЧЕЧНОЙ ПАРЕНХИМЫ. Нефрология. 2017;21(1):57-67. https://doi.org/10.24884/1561-6274-2017-21-1-57-67
For citation:
Dolomatov S.I., Sipovski V.G., Novikov N.Y., Kasich I.N., Myshko I.V., Deri К., Lytvinenko A.N. INFLUENCE OF COMBINED INJECTION OF THYROXIN AND PROPYLTHIOURACILUM ON SCTRUCTURAL INDICATORS OF RENAL PARENCHYMA. Nephrology (Saint-Petersburg). 2017;21(1):57-67. (In Russ.) https://doi.org/10.24884/1561-6274-2017-21-1-57-67
JATS XML








































