Перейти к:
МЕХАНИЗМЫ ОТТОРЖЕНИЯ ПОЧЕЧНОГО АЛЛОТРАНСПЛАНТАТА И ИММУНОЛОГИЧЕСКАЯ ТОЛЕРАНТНОСТЬ
Аннотация
В статье отражены основные причины и механизмы развития отторжения почечного аллотрансплантата, описаны современные представления о формировании иммунологической толерантности.
Ключевые слова
Для цитирования:
Ватазин А.В., Кильдюшевский А.В., Федулкина В.А., Фаенко А.П. МЕХАНИЗМЫ ОТТОРЖЕНИЯ ПОЧЕЧНОГО АЛЛОТРАНСПЛАНТАТА И ИММУНОЛОГИЧЕСКАЯ ТОЛЕРАНТНОСТЬ. Нефрология. 2016;20(6):33-41.
For citation:
Vatazin A.V., Kildjushevskiy, A.V., Fedulkina V.A., Faenko A.P. RENAL ALLOGRAFT REJECTION MECHANISMS AND IMMUNOTOLERANCE. Nephrology (Saint-Petersburg). 2016;20(6):33-41. (In Russ.)
ВВЕДЕНИЕ
Одной из главных и постоянных проблем при аллотрансплантации трупной почки (АТТП) по-прежнему остается риск отторжения почечного аллотрансплантата (ПАТ) [1]. Приблизительно 5-10% реципиентов в течение 1 года после пересадки почки возвращаются к программам гемодиализа в связи с дисфункцией трансплантата [2], а с удлинением времени после трансплантации таких пациентов становится все больше [3]. Поэтому представляется крайне важным обеспечить сохранность и максимальную эффективность функционирования ПАТ.
На современном этапе развития трансплантологии иммуно супрессия является безальтернативным методом предупреждения и лечения реакции отторжения. Совершенствование схем и протоколов иммуносупрессии помогло снизить риск развития данного осложнения [4, 5]. Однако это полностью не решило проблему отторжения, а токсичность и побочные эффекты, связанные с приемом иммуносупрессантов, вынуждают производить поиск новых препаратов и методов лечения, основанных на глубоком изучении иммунологических механизмов отторжения ПАТ и формирования толерантности к пересаженному органу.
Отторжение почечного аллотрансплантата
Отторжение трансплантированных тканей происходит в результате того, что иммунная система реципиента распознает чужеродные тканевые антигены гистосовместимости на клетках трансплантата и реагирует на них. Во многом благодаря исследованиям приживления и отторжения пересаженных тканей в животных моделях были открыты молекулы главного комплекса гистосовместимости (ГКГ или MHC), кодирование которого располагается в гене на коротком плече 6-й хромосомы [6]. Продукты генов - антигены или молекулы MHCобладают крайне выраженным полиморфизмом [7]. Обнаружено, что при сингенных пересадках, например, при пересадках тканей между однояйцевыми близнецами, которые имеют одинаковые молекулы MHC, как правило, отторжения не происходит. В то время как при аллогенных трансплантациях, когда донор и реципиент различаются по антигенам MHC, отсутствие приема иммуносупрессии приведет к неминуемому отторжению [8].
Существуют три типа молекул MHC: класса I, II и III. У людей гены MHC называются генами лейкоцитарных антигенов человека (human leukocyte antigen - HLA). В их состав входят следующие гены (рис. 1):
- класс I - HLA-A, HLA-B иHLA-C;
- класс II - HLA-DP, HLA-DQ иHLA-DR;
- класс III - C4a, C2, C4b, Bf.
Молекулы MHC I класса располагаются практически на всех ядросодержащих клетках и пре- зентируют пептид, состоящий из 9-11 аминокислот. Молекулы MHC II класса обнаруживаются только на специализированных антигенпрезентирующих клетках (АПК), к которым относятся дендритные клетки, В-лимфоциты и макрофаги, они связывают пептиды длиной 13-30 аминокислот [9]. К тому же экспрессия антигенов MHC значительно увеличивается под действием цитокинов - интерферона-γ (ИФНγ) и фактора некроза опухолей (ФНОα), что безусловно играет важную роль в развитии иммунологической реакции [10].
К продуктам генов MHC III класса относят некоторые компоненты системы комплемента, ФНО-α, белки теплового шока и др. Они не играют существенной роли в реакциях тканевой несовместимости.
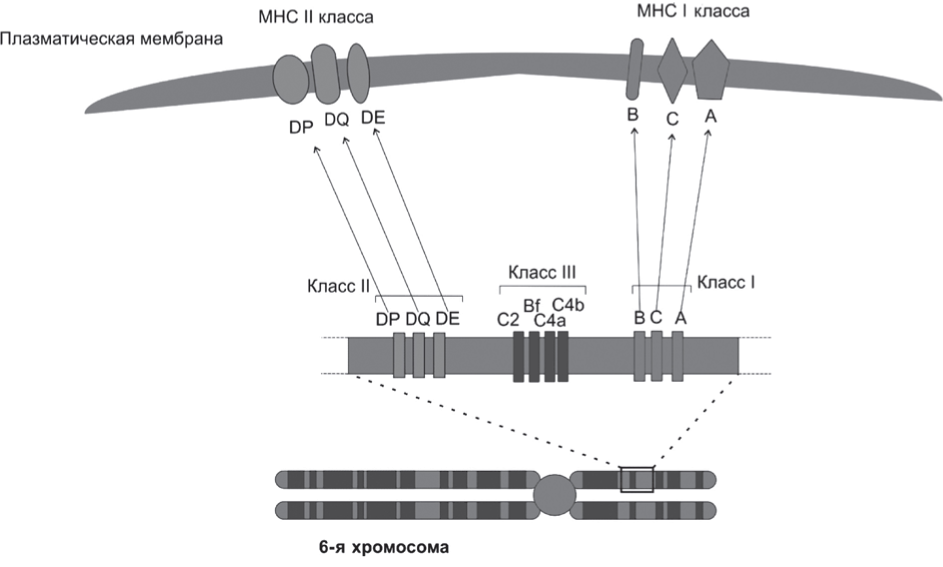
Рис. 1. Главный комплекс гистосовместимости с локализацией в 6-й хромосоме.
Молекулы MHC имеют две существенные особенности, использующиеся в трансплантационной иммунологии [8]. Первая особенность заключается в том, что всякий локус в молекуле MHC полиморфен. Различий в молекулах HLA-A1 и HLA-A2 вполне достаточно для запуска реакции отторжения. Совокупность разных молекул MHC (аллелей), экспрессируемых одной хромосомой, называется гаплотипом. Генотип - сумма двух гаплотипов.
Второй особенностью является кодоминантность экспрессии генов. MHC экспрессируются кодоминантно, т.е. у каждого индивидуума в каждом локусе проявляются аллели обеих хромосом. Следовательно, MHC-генотип индивида представлен 12 различными молекулами MHC (по два аллеля каждого из шести локусов) (рис. 2). Поэтому, согласно законам Менделя, трансплантат, пересаженный от родителей, отторгается их потомками и наоборот.
Известно, что именно несовместимость MHC донора и реципиента вызывает иммунный ответ против трансплантата, приводящий в конечном итоге к его разрушению. Также, помимо антигенов MHC, выделяют минорные антигены гистовместимости. Они, по-видимому, играют небольшую роль в процессе отторжения, за исключением тех случаев, когда главные комплексы гистосовместимости совпадают, но имеются ряд незначительных отличий в минорных антигенах гистосовместимости. В этих случаях также может произойти отторжение трансплантата. О минорных антигенах человека известно очень мало, однако существуют сообщения, что несовпадение по данной системе антигенов у однояйцовых близнецов приводит к отторжению трансплантата [11].

Рис. 2. Кодоминантное наследование генов системы HLA.
Основная функция MHC - участие в инициации Т-клеточного иммунного ответа через распознавание Т-клеточным рецептором комплекса MHC-пептид [12]. Трансплантированные органы экспрессируют молекулы MHC донора, в результате чего происходит распознавание аллоантигенов трансплантата по двум путям (рис. 3) [8]. При снижении экспрессии MHC I класса на ядросодержащих клетках происходит их узнавание NK-клетками с последующим их цитолизом или апоптозом.
Прямое распознавание происходит через взаимодействие Т-клеток реципиента и аллогенных молекул MHC, экспрессированных на донорских клетках. Такое взаимодействие объясняется молекулярной мимикрией, т.е. аллогенные MHC напоминают собственные молекулы MHC, поэтому пептид, который они презентируют, легко распознается Т-клетками реципиента. При этом в распознавании Т-клеточным рецептором может участвовать не только пептид, погруженный в молекулу MHC, но также и часть донорской молекулы MHC [13].
В непрямом или косвенном пути Т-клетки реципиента распознают чужеродный антиген через собственные АПК, которые презентируют подвергшиеся катаболизму молекулы MHC донора. В целом косвенный путь похож на нормальный процесс представления бактериального антигена [14].
Полагают, что прямой путь может быть ответствен за развитие острого отторжения, в то время как косвенный путь играет доминирующую роль в процессе хронического отторжения [15].
В реакции клеточного отторжения основное участие принимают два типа клеток CD8 и CD4 Т-клетки. CD4-клетки, так называемые Т-хелперные клетки, считаются наиболее важными в инициации и регуляции отторжения трансплантата. Независимо от пути распознавания молекулы MHC активированные Т-хелперные клетки делятся и выделяют различные цитокины, которые служат как факторами роста, так и факторами активации CD8 цитотоксических Т-клеток, В-клеток и макрофагов, которые вызывают разрушение трансплантата [16]. CD8 Т-цитотоксические также способны к секреции цитокинов, однако этой секреции без влияния Т-хелперных клеток недостаточно для запуска отторжения [17]. Основная функция CD8-клеток - прямой лизис клеток донора. Активированные макрофаги и Т-хелперные клетки сами по себе способны привести к отторжению трансплантата через развитие реакции гиперчувствительности замедленного типа. В-клетки ответственны за выработку антител, которые, связываясь со своим специфическим антигеном, принимают участие в развитие гуморального отторжения [18].
В инициации иммунологической реакции, помимо взаимодействия Т-клеточного рецептора с молекулой MHC и ее пептидом, принимают участие большой ряд молекул коактивации (рис. 4.) [19]. Полная активация Т-клеток возможна только при взаимодействии и работе двух отдельных, но синергетических сигналов. Первый сигнал заключается в том, что поставляемые через Т-клеточный рецептор антигены представляют себя и несут ответственность за специфичность иммунного ответа. Второй, или костимуляторный, сигнал - антигеннеспецифический, однако от него зависит характер направленности иммунного ответа. Многие Т-клеточные молекулы могут служить в качестве рецепторов для костимуляторных сигналов. Вместе с тем, наибольшее значение имеют молекулы CD28/CTLA-4/B7 [20]. CD28 имеет два известных лиганда B7-1 (CD80) и В7-2 (CD86), оба из которых экспрессированы, прежде всего, на активированных АПК [19]. Помимо этого, Т-клетки также презентируют CTLA-4 (цитотоксический Т - лимфоцитарный антиген), молекулу, структурно схожую с CD28, которая способна связывать B7-1 и В7-2. Однако в отличие от CD28 CTLA-4 передает тормозящий сигнал, который вызывает прекращение иммунного ответа [21].
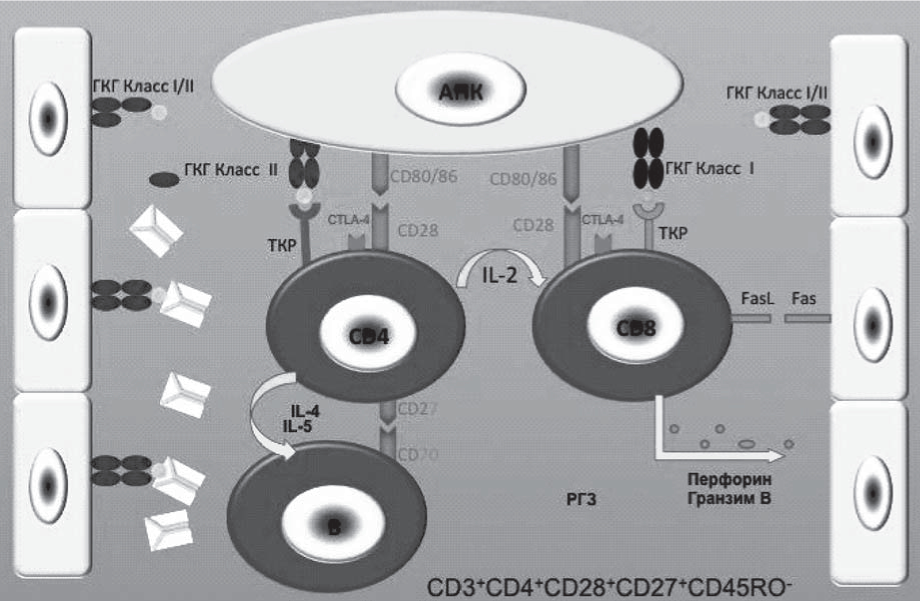
Рис. 3. Пути распознавание аллоантигена и механизмы отторжения.
Покоящиеся Т-клетки постоянно экспрессируют CD28, хотя и в значительно меньшем количестве без предварительной стимуляции, в то же время покоящиеся АПК не презентируют молекулы B7 [22]. В течение шести часов после активации АПК экспрессируют молекулы B7-2, а через 48-72 ч - молекулу B7-1. Молекулы B7-1 и В7-2 могут связаться как с CD28, обеспечивая активацию иммунного ответа, так и с CTLA-4, вызывая тормозной сигнал. CTLA-4, обладая большей авидностью к коактивационным молекулам, связывает молекулы В7 с большим сродством, чем CD28, поэтому при снижении экспрессии молекулы CD28 тормозное взаимодействие CTLA-4/B7 в конечном итоге преобладает, что ведет к прекращению иммунного ответа [19-22].
Помимо основного пути передачи второго ко- стимуляционного сигнала CD28/B7, существуют и вспомогательные пути, которые реализуются через парное взаимодействие дополнительных молекул на мембранах Т-хелперных лимфоцитов и АПК. При активации костимуляционного пути CD40-CD40L повышается экспрессия молекул B7 на АПК и усиливается выделение провоспалительных цитокинов, которые активируют Т-клетки [23]. Если в качестве АПК выступает В-клетка, то, помимо передачи дополнительного кости- муляционного сигнала на Т-хелпер, активация CD40-CD40L-пути влияет и на сам В-лимфоцит.
В результате такого взаимодействия происходит интенсивный обмен информацией между клетками с последующей стимуляцией АПК, т.е. самого В-лимфоцита [23, 24].
Еще одним путем костимуляции Т- и В-клеток является взаимодействие молекул ICOS (Inducible T-cell COStimulator, CD278) с его лигандом ICOSL. ICOS является гомологом CD28, но экспрессируется только на активированных Т-клетках, в большей мере на T-хелперных клетках 2-го типа. Лигандом для ICOS является молекула В7Һ (CD275), структурно схожая с В7, однако, не способная взаимодействовать с CD28 и CTLA-4. Стимуляция Т-клеток по пути ICOS-В7h стимулирует пролиферацию клеток и выделение цитокинов. Поскольку ICOS экспрессируется также и В-клетками, активация этого пути передачи сигнала может сопровождаться продукцией антител [25].

Рис. 4. Пути коактивации Т-клеток.
Взаимодействие молекул 0X40 (CD 134) и 0X40L (CD252) является важным костимуляци- онным сигналом для Т-клеток, сравнимым по значимости с CD28-B7, и имеет ключевое значение для формирования CD4 аллореактивных клеток памяти. Активация 0X40-0X40L-пути, подобно пути CD40-CD40L, приводит к двунаправленной стимуляции клеток: активации и стимуляции пролиферации Т-клеток и повышению продукции провоспалительных цитокинов АПК [24].
Сигнальные пути 0X40-0X40L, CD40-CD40L играют важную роль в CD28-B7-независимой активации Т-клеток. При блокаде этих путей значительно уменьшается степень повреждения аллотрансплантата [26].
При отсутствии костимуляторных сигналов Т-клетки, сталкиваясь с антигеном, подвергаются неудачной активации. Они не вырабатывают заметного количества цитокинов и не делятся, а вместо этого перестают отвечать на запросы соответствующей стимуляции на срок до нескольких недель, т.е. возникает анергия [27], или подвергаются запрограммированной клеточной смерти - апоптозу [19, 23].
Помимо молекулы CTLA-4, тормозящим пролиферацию и активацию Т-клеток обладает белок PD-1 (CD279), имеющий два лиганда - PD-L1 (B7-H1, CD274) и PD-L1 (B7-DC, CD273). Активация данного сигнального пути ингибирует пролиферацию и продукцию цитокинов антигенспецифичных CD4- и CD8-клеток. Выраженность ингибирующего действия этих молекул зависит от наличия других костимуляционных сигналов, в частности CD28-87. Блокирование этого сигнального пути ускоряет отторжение ПАТ, введение же PD-L1-Ig тормозит реакцию отторжения [28].
Процессы передачи сигналов молекулярных взаимодействий между АПК и Т-клетками весьма многогранны, в зависимости от их результата происходят дальнейшая активация и дифференцировка или анергия и апоптоз Т- и В-лимфоцитов, а также других клеток, участвующих в развитии реакции отторжения ПАТ [19, 23, 24].
Некоторые современные иммуносупрессив- ные препараты направлены на блокирование одного из костимуляционных путей, к примеру, введение CTLA-4Ig (Белатасепт) нарушает взаимодействие между молекулами B7-CTLA-4, тем самым предотвращая отторжение [29]. Другие препараты воздействуют на внутриклеточные процессы активации Т-клеток. Ингибиторы кальцинейрина (такролимус, циклоспорин) прерывают дефосфорилирование NFAT (ядерного фактора активированных Т-клеток), благодаря чему NFAT не перемещается из цитоплазмы в ядро и не происходит синтез провоспалительных цитокинов, в частности ИЛ-2 [30].
Применяемые в настоящее время иммунодепрессанты обладают исключительно мощным, блокирующим отторжение действием, однако не один из них не является антигенспецифическим [31]. Именно поэтому при тотальной иммунсупрессии снижается устойчивость к инфекциям.
Иммунологическая толерантность
Иммунологическая толерантность - состояние ареактивности в отношение того или иного антигена, которое возникает в результате предшествующего контакта с этим антигеном [32]. Активно функционирующие механизмы толерантности жизненно необходимы в процессе развития организма, так как они предотвращают развитие иммунных реакций против собственных антигенов и многих других безвредных антигенов, попадающих в организм с воздухом, пищей и т.д. Достичь поставленной цели помогают механизмы центральной и периферической толерантности (рис. 5) [31-33].
В тимусе происходит формирование Т-клеток из клеток-предшественников с еще неперестроенными генами Т-клеточных рецепторов. В процессе развития лимфоцитов в тимусе эти гены подвергаются перестройке, после чего Т-клетки начинают экспрессировать Т-клеточный рецептор (ТкР), способный распознавать пептиды в связывающей их полости молекул MHC на АПК. На этапе созревания лимфоцитов в тимусе образуются большое количество Т-клеток с дефектным ТкР, обладающим аутореактивными свойствами. Такие клетки подвергаются отрицательной селекции и, в конечном счете, погибают в результате запуска различных механизмов апоптоза [34, 35].
Процесс отрицательной селекции в тимусе несовершенен, поэтому часть аутореактивных Т-клеток все же попадают в пул периферических лимфоцитов. Предотвращение развития аутоиммунных реакций поддерживается механизмами периферической, или посттимической, толерантности. Активно функционирующими механизмами формирования периферической толерантности Т-клеток являются клональная делеция, анергия и супрессия [36].

Рис. 5. Механизмы толерантности.
Клетки могут стать неотвечающими, получив опосредованный ТкР-сигнал. Подавление их функции может происходить в результате снижении экспрессии ТкР и корецепторных молекул [24]. Аннергия Т-лимфоцитов легко демонстрируется в опытах invitro и invivo на некоторых животных моделях [37, 38]. Стимулирование ТкР в отсутствие костимуляционных сигналов приводит к анергии Т-лимфоцитов, однако стоит устранить это отсутствие, например, при стимулировании Т-клеток посредством ИЛ-2 развивается иммунная реакция [39].
Для поддержания толерантности к собственным антигенам и гомеостаза иммунной системы имеет значение клональная делеция Т-клеток вне тимуса, когда после активации антигеном большинство аутореактивных клеток погибают в результате апоптоза. Этот механизм служит для контроля аутоиммунных реакций и поддержания должного пула лимфоидных клеток. Процесс инициации клональной делеции запускается различными путями. Взаимодействие рецептора Fas (CD95) с его лигандом FasL запускает последующую цепь передачи сигналов, которая активирует ИЛ-1β-конвертирующие ферментоподобные протеазы, вызывающие апоптоз [40]. Молекула FasL может как экспрессироваться на активированных Т-клетках, обуславливая непосредственное межклеточное взаимодействие по принципу «братоубийства», так и находиться в растворимой форме, запуская аутокринный механизм апоптоза (рис. 6). Рецептор PD-1 имеет два лиганда PD-L1 и PD-L2, при его активации запускается двойной механизм стимулирования апаптоза, с одной стороны, вызывая гибель Т-эффекторных клеток, с другой - ингибирование апоптоза Т-супрессорных клеток [41]. Молекула CTLA-4 также играет важную роль как отрицательный регулятор, в результате чего ее взаимодействие с молекулой B7 на поверхности АПК может прервать клеточный цикл деления Т-клетки и вызвать ее гибель или анергию [42].
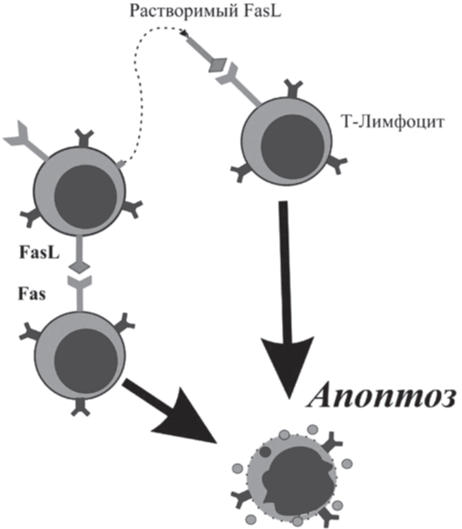
Рис. 6. Роль Fas-системы в гибели Т-клеток.
Доказательства существования специфических супрессорных или толерогенных клеток были неоднократно показаны в экспериментальных работах по адаптивному переносу, когда индукции толерантности у интактных животных удавалось добиться, вводя им клетки толерантных животных [43, 44]. Одно из предложенных объяснений для данной формы толерантности предполагает существование двух популяций Т-лимфоцитов, продуцирующих различные цитокины. Известно, что многие воспалительные аутоиммунные реакции индуцируются Т-хелперными клетками 1-го типа (Тх1-клетки), продуцирующими такие про- воспалительные цитокины, как ИЛ-2, ИФН-γ и ФНО. Цитокины, продуцируемые Т-хелперными клетками 2-го типа (Тх2-клетки), ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-9 и ИЛ-10-поддерживают антителообразование, однако, наряду с этим, подавляют эффекторные функции макрофагов, включая их презентацию антигена Тх1-лимфоцитам и нести- мулированным Т-клеткам. Активно изучаются молекулярный фенотип супрессорных клеток, их поверхностные маркеры и продуцируемые ими растворимые факторы. Регуляторные Т-клетки (Tregs) - это субпопуляции Т-хелперных клеток (CD3+CD4+), которые экспрессируют большое количество молекул CD25(hi) и фактор транскрипции Foxp3 и играют важную роль в подавлении аутоиммунных реакций [45]. Существуют предположения, что данная популяция клеток может иметь место в формировании трансплантационной толерантности [46].
Индукция толерантности аутореактивных В-клеток к собственным антигенам также может происходить через механизмы их делеции или анергии. Это зависит от аффинности антигенных рецепторов В-клеток и природы соответствующего антигена, в частности от того, является ли он интегральным белком клеточной мембраны или представляет растворимый, циркулирующий, в основном мономерный белок. Особое значение в управлении В-клеточного иммунного ответа играет роль клеток Тх2 типа [47].
Физиологические механизмы толерантности ученые пытались воспроизвести в трансплантации органов и тканей между гомологичными особями одного вида. Некоторого успеха удалось добиться при одновременной пересадке почки и костного мозга у иммунокомпрометированных больных, формируя клеточный химеризм [48, 49].
Существуют различные методы, направленные на изоляцию Tregs и их использование в формировании иммунологической толерантности при трансплантации солидных органов [50, 51]. Полагают, что формирование толерантности возможно достичь путем истощения Т-клеточной популяции, подобно формированию устойчивости к хроническому вирусному заражению, однако данное предположение остается спорным [52, 53]. Одним из методов эффективной борьбы с отторжением трансплантата и формированием частичной иммунологической толерантности является экстракорпоральная фотохимотерапия или фотоферез [54, 55].
ЗАКЛЮЧЕНИЕ
Расширение знаний о трансплантационной иммунологии способствует углубленному пониманию механизмов развития отторжения почечного аллотрансплантата. В трансплантации иммунологический конфликт обусловлен чужеродностью тканей, его антигенностью, наибольшее значение в котором играет различие в строении молекул MHC донора и реципиента. Для инициации иммунного ответа необходимо взаимодействие Т-клеточного рецептора с антигенным пептидом, погруженным в MHC. Помимо этого, для развития иммунного ответа необходима передача дополнительного сигнала с молекул коактивации, в зависимости от его результата происходят дальнейшая активация и дифференцировка или анергия и апоптоз Т- и В-лимфоцитов, а также других клеток, участвующих в развитии реакции отторжения. Процессы иммунологической толерантности тесно связаны с корецепторным взаимодействием, особое значение в котором приобретают супрессорные или толерогенные клетки, относящиеся к клеткам Т-хелперной субпопуляции (CD3+ CD4+), экспрессирующие большое количество молекул CD25(hi) и фактор транскрипции Foxp3.
Формирование иммунологической толерантности, при котором, возможно, будет избирательное отсутствие иммунного ответа к антигенам пересаженного органа, является весьма перспективным направлением в трансплантологии. Такая таргетная терапия позволит избежать губительного воздействия тотальной иммуносупрессии и улучшить результаты трансплантации почки и длительность жизни почечного аллотрансплантата.
Список литературы
1. Столяревич ЕС, Артюхина ЛЮ, Ким ИГ и др. Морфологические особенности позднего отторжения трансплантированной почки и их прогностическое значение. Вестн трансплантологии и искусственных органов. 2014; 16(2): 30-38 [Stoliarevich ES, Artiuhina LIU, Kim IG i dr. Morfologicheskie osobennosti pozdnego ottorzheniia transplantirovannoi` pochki i ikh prognosticheskoe znachenie. Vestn transplantologii i iskusstvenny`kh organov. 2014; 16(2): 30-38]
2. Лубенников АЕ, Трушкин РН, Артюхина ЛЮ. Современные взгляды на проблему удаления почечного трансплантата. Московск хирур журн 2014; 4: 49-56 [Lubennikov AE, Trushkin RN, Artyukhina LY Sovremennye vzglyady na problemu udaleniya pochechnogo transplantata. Moskovskii khirurgicheskii zhurnal. 2014; 4: 49-56]
3. Johnston O, Rose C, Landsberg D et al. Nephrectomy after transplant failure: current practice and outcomes Am J Transplant 2007; 7(8): 1961-1967. doi: 10.1111/j.1600-6143.2007.01884.x
4. Столяр АГ, Будкарь ЛН, Климушева НФ и др. Улучшение результатов трансплантации почки. Вестн трансплантологии и искусственных органов 2014; 4: 55-61 [Stoliar AG, Budkar` LN, Climusheva NF i dr. Uluchshenie rezul`tatov transplantatcii pochki. Vestn transplantologii i iskusstvenny`kh organov 2014; 4: 55-61]
5. O'Leary JG, Samaniego M, Barrio MC et al. The Influence of Immunosuppressive Agents on the Risk of De Novo DonorSpecific HLA Antibody Production in Solid Organ Transplant Recipients. Transplantation. 2016; 100(1): 39-53 [doi: 10.1097/TP.0000000000000869]
6. Thorsby E. A short history of HLA. Tissue Antigens 2009; 74(2): 101-116 doi: 10.1111/j.1399-0039.2009.01291.x
7. Дмитриева НГ, Яковчик ОН, Ватазин АВ и др. Система гистосовместимости при трансплантации почки. Альманах клинической медицины 2014; 31: 83-87 [Dmitrieva NG, Iakovchik ON, Watazin AV i dr. Sistema gistosovmestimosti pri transplantatcii pochki. Al`manakh clinicheskoi` meditciny` 2014; 31: 83-87]
8. Данович Габриэль М. Трансплантация почки. ред. ЯГ Мойсюк ГЭОТАР-Медиа, М., 2013; 23-138 [Danovitch Gabriel M Handbook of kidney transplantation. ed. YG Moisyuk GEOTARMedia, M, 2013; 23-138.]
9. Caron E, Kowalewski DJ, Chiek Koh C et al. Analysis of Major Histocompatibility Complex (MHC) Immunopeptidomes Using Mass Spectrometry. Mol Cell Proteomics 2015; 14(12): 3105-3117. doi: 10.1074/mcp.M115.052431
10. Wei RQ, Schwartz CF, Lin H et al. Anti-TNF antibody modulates cytokine and MHC expression in cardiac allografts. J Surg Res 1999; 81(2): 123-128. doi: 10.1006/jsre.1998.5303
11. Pabon MA, Navarro CE, Martin R et al. Minor histocompatibility antigens as risk factor for poor prognosis in kidney transplantation. Transplant Proc 2011; 43(9): 3319-3323. doi: 10.1016/j.transproceed.2011.09.007
12. Breman E, van Miert PP, van der Steen DM et al. HLA monomers as a tool to monitor indirect allorecognition. Transplantation 2014; 97(11): 1119-1127. doi: 10.1097/TP.0000000000000113
13. Harper SJ, Ali JM, Wlodek E et al. CD8 T-cell recognition of acquired alloantigen promotes acute allograft rejection. Proc Nati Acad Sci U S A 2015; 112(41): 12788-12793. doi: 10.1073/pnas.1513533112
14. Ali J, Bolton E, Saeb-Parsy K. et al. Targeting indirect pathway CD4 T-cell alloresponses in the prevention of chronic transplant rejection. Lancet 2015; 385(1): 17. doi: 10.1016/S01406736(15)60332-4
15. Lin CM, Gill RG. Direct and indirect allograft recognition: pathways dictating graft rejection mechanisms. Curr Opin Organ Transplant 2016; 21(1): 40-44. doi: 10.1097/MOT.0000000000000263
16. Taylor AL, Negus SL, Negus M. et al. Pathways of helper CD4 T cell allorecognition in generating alloantibody and CD8 T cell alloimmunity. Transplantation 2007; 83(7): 931-937. doi: 10.1097/01.tp.0000257960.07783.e3
17. Weist BJ, Schmueck M, Fuehrer H. et al. The role of CD4(+) T cells in BKV-specific T cell immunity. Med Microbiol Immunol 2014; 203(6): 395-408. doi: 10.1007/s00430-014-0348-z
18. Phillips S, Kapp M, Crowe D. et al. Endothelial activation, lymphangiogenesis, and humoral rejection of kidney transplants. Hum Pathol 2016;51:86-95. doi: 10.1016/j.humpath.2015.12.020
19. Esposito P, Grosjean F, Rampino T et al. Costimulatory pathways in kidney transplantation: pathogenetic role, clinical significance and new therapeutic opportunities. Int Rev Immunol 2014; 33(3): 212-233. doi: 10.3109/08830185.2013.829470
20. Vogel I, Kasran A, Cremer J. et al. CD28/CTLA-4/B7 costimulatory pathway blockade affects regulatory T-cell function in autoimmunity. Eur J Immunol 2015; 45(6): 1832-1841. doi: 10.1002/eji.201445190
21. Berg M, Zavazava N. Regulation of CD28 expression on CD8+ T cells by CTLA-4. J Leukoc Biol 2008; 83(4): 853-863. doi: 10.1189/jlb.0107065
22. Linsley PS, Brady W, Urnes M. et al. CTLA-4 is a second receptor for the B cell activation antigen B7. J Exp Med 1991; 174: 561-569. doi: 10.1084/jem.174.3.561
23. Ford ML, Larsen CP. Translating costimulation blockade to the clinic: lessons learned from three pathways. Immunol Rev 2009; 229 (1): 294-306. doi: 10.1111/j.1600-065X.2009.00776.x.
24. Pilat N, Sayegh MH, Wekerle T. Costimulatory pathways in transplantation. Semin Immunol. 2011; 23(4): 293-303. doi: 10.1016/j.smim.2011.04.002
25. Harada H, Salama AD, Sho M et al. The role of the ICOSB7h T cell costimulatory pathway in transplantation immunity. J Clin Invest 2003; 112(2): 234-243. doi: 10.1172/jci200317008
26. Dai H, Peng F, Lin M. et al. Anti-OX40L monoclonal antibody prolongs secondary heart allograft survival based on CD40/CD40L and LFA-1/ICAM-1 blockade. Transpl Immunol 2015; 32(2):84-91. doi: 10.1016/j.trim.2015.01.001
27. Wells AD, Walsh MC, Sankaran D et al. T cell effector function and anergy avoidance are quantitatively linked to cell division. J Immunol 2000; 165(5): 2432-2443. doi: 10.4049/ jimmunol.165.5.2432
28. del Rio ML, Buhler, Gibbons C et al. PD-1/PD-L1, PD-1/ PD-L2, and other co-inhibitory signaling pathways in transplantation. Transpl Int 2008; 21(11): 1015-1028. doi: 10.1111/j.14322277.2008.00726.x
29. Masson P, Henderson L, Chapman JR et al. Belatacept for kidney transplant recipients. Cochrane Database Syst Rev 2014; 11: 1-65. doi: 10.1002/14651858.CD010699.pub2
30. Rančić N., Dragojević-Simić V., Vavić N et al. Tacrolimus concentration/dose ratio as a therapeutic drug monitoring strategy: the influence of gender and comedication. Vojnosanitetski Pregl 2015; 72(9): 813-822. doi:10.2298/VSP140905005R
31. Sarwal MM. Fingerprints of transplant tolerance suggest opportunities for immunosuppression minimization. Clin Biochem 2016; 49(4-5): 404-410. doi: 10.1016/j.clinbiochem.2016.01.007
32. Gracon AS, Wilkes DS. Lung transplantation: chronic allograft dysfunction and establishing immune tolerance. Hum Immunol 2014; 75(8): 887-894. doi: 10.1016/j.humimm.2014.06.015
33. LaFlam TN, Seumois G, Miller CN et al. Identification of a novel cis-regulatory element essential for immune tolerance. J Exp Med 2015; 212(12): 1993-2002. doi: 10.1084/jem.20151069
34. Yamano T, Steinert M, Klein L. Thymic B Cells and Central T Cell Tolerance. Front Immunol 2015; 6: 376. doi: 10.3389/ fimmu.2015.00376
35. Laan M, Peterson P. The many faces of aire in central tolerance. Front Immunol 2013; 4: 326. doi: 10.3389/ fimmu.2013.00326
36. Delgoffe GM, Powell JD. Feeding an army: The metabolism of T cells in activation, anergy, and exhaustion. Mol Immunol 2015; 68: 492-496. doi: 10.1016/j.molimm.2015.07.026
37. Asashima H, Tsuboi H, Takahashi H et al. The anergy induction of M3 muscarinic acetylcholine receptor-reactive CD4+ T cells suppresses experimental sialadenitis-like Sjogren’s syndrome. Arthritis Rheumatol 2015; 67(8): 2213-2225. doi: 10.1002/art.39163
38. O’Konek JJ, Kato S, Takao S et al. β-mannosylceramide activates type I natural killer t cells to induce tumor immunity without inducing long-term functional anergy. Clin Cancer Res 2013; 19(16): 4404-4411. doi: 10.1158/1078-0432.CCR-12-2169
39. Bandyopadhyay S, Montagna C, Macian F. Silencing of the Il2 gene transcription is regulated by epigenetic changes in anergic T cells. Eur J Immunol 2012; 42(9): 2471-2483. doi: 10.1002/eji.201142307
40. Akiyama K, Chen C, Wang D et al. Mesenchymal-stemcellinduced immunoregulation involves FAS-ligand-/FAS-mediated T cell apoptosis. Cell Stem Cell 2012; 10(5): 544-555. doi: 10.1016/j.stem.2012.03.007
41. Fife BT, Pauken KE. The role of the PD-1 pathway in autoimmunity and peripheral tolerance. Ann N Y Acad Sci 2011; 1217: 45-59. doi: 10.1111/j.1749-6632.2010.05919.x
42. Francisco LM, Sage PT, Sharpe AH. The PD-1 pathway in tolerance and autoimmunity Immunol Rev 2010; 236: 219-242. doi: 10.1111/j.1600-065X.2010.00923.x
43. McCarthy DP, Bryant J, Galvin JP. Tempering allorecognition to induce transplant tolerance with chemically modified apoptotic donor cells. Am J Transplant 2015; 15(6): 1475-1483. doi: 10.1111/ajt.13237
44. Moreau A, Varey E, Beriou G et al. Tolerogenic dendritic cells and negative vaccination in transplantation: from rodents to clinical trials. Front Immunol 2012; 3: 218. doi: 10.3389/ fimmu.2012.00218
45. Hall BM, Tran GT, Robinson CM et al. Induction of antigen specific CD4(+)CD25(+)Foxp3(+)T regulatory cells from naive natural thymic derived T regulatory cells. Int Immunopharmacol 2015; 28(2): 875-886. doi: 10.1016/j.intimp.2015.03.049
46. Vela-Ojeda J, Montiel-Cervantes L, Granados-Lara P et al. Role of CD4+CD25+highFoxp3+CD62L+ regulatory T cells and invariant NKT cells in human allogeneic hematopoietic stem cell transplantation. Stem Cells Dev 2010; 19(3): 333-340. doi: 10.1089/scd.2009.0216
47. Lal G, Kulkarni N, Nakayama Y et al. Bromberg J.S. IL-10 from marginal zone precursor B cells controls the differentiation of Th17, Tfh and Tfr cells in transplantation tolerance. Immunol Lett 2016; 170: 52-63. doi: 10.1016/j.imlet.2016.01.002
48. Kawai T, Cosimi AB, Wee SL et al. Effect of mixed hematopoietic chimerism on cardiac allograft survival in cynomolgus monkeys. Transplantation 2002; 73(11): 1757-1764. doi: 10.1097/00007890-200206150-00011
49. Nadazdin O, Abrahamian G, Boskovic S et al. Stem cell mobilization and collection for induction of mixed chimerism and renal allograft tolerance in cynomolgus monkeys. J Surg Res 2011; 168(2): 294-300. doi: 10.1016/j.jss.2010.02.027
50. Peters JH, Hilbrands LB, Koenen HJ et al. Ex vivo generation of human alloantigen-specific regulatory T cells from CD4(pos)CD25(high) T cells for immunotherapy. PLoS One 2008; 3(5): e2233. doi: 10.1371/journal.pone.0002233
51. Safinia N, Vaikunthanathan T, Fraser H et al. Successful expansion of functional and stable regulatory T cells for immunotherapy in liver transplantation. Oncotarget 2016; 7(7): 75637577. doi: 10.18632/oncotarget.6927
52. Thorp EB, Stehlik C, Ansari MJ. T-cell exhaustion in allograft rejection and tolerance. Curr Opin Organ Transplant 2015; 20(1): 37-42. doi: 10.1097/MOT.0000000000000153
53. Valujskikh A, Li XC. Memory T cells and their exhaustive differentiation in allograft tolerance and rejection. Curr Opin Organ Transplant 2012; 17(1): 15-19. doi: 10.1097/ MOT.0b013e32834ee443
54. Xia CQ, Campbell KA, Clare-Salzler MJ. Extracorporeal photopheresis-induced immune tolerance: a focus on modulation of antigen-presenting cells and induction of regulatory T cells by apoptotic cells. Curr Opin Organ Transplant 2009; 14(4): 338343. doi: 10.1097/MOT.0b013e32832ce943
55. Кильдюшевский АВ, Федулкина ВА, Фомина ОА, Фомин АМ. Применение экстракорпоральной фотохимиотерапии при лимфомах кожи и трансплантации солидных органов. Альманах клин мед 2014; 30: 61-69 [Kil`diushevskii` AV, Fedulkina VA, Fomina OA, Fomin AM. Primenenie e`kstrakorporal`noi` fotohimioterapii pri limfomakh kozhi i transplantatcii solidny`kh organov. Al`manakh clin med 2014; 30: 61-69]
Об авторах
А. В. ВатазинРоссия
Ватазин Андрей Владимирович, доктор медицинских наук, профессор.
Руководитель отдела трансплантологии, нефрологии и хирургической гемокоррекции.
129110, Москва, ул. Щепкина, д. 61/2, корп. 6.
А. В. Кильдюшевский
Россия
Кильдюшевский Александр Вадимович, доктор медицинских наук, профессор.
Ведущий научный сотрудник отделения хирургической гемокоррекции и детоксикации.
129110, Россия, Москва, ул. Щепкина, д. 61/2, корп. 11.
В. А. Федулкина
Россия
Федулкина Вероника Андреевна, кандидат медицинских наук.
Старший научный сотрудник хирургического отделения трансплантологии и диализа.
129110, Россия, Москва, ул. Щепкина, д. 61/2, корп. 6
А. П Фаенко
Россия
Фаенко Александр Павлович - Старший лаборант курса клинической трансфузиологии.
129110, Россия, Москва, ул. Щепкина, д. 61/2, корп. 8.
Рецензия
Для цитирования:
Ватазин А.В., Кильдюшевский А.В., Федулкина В.А., Фаенко А.П. МЕХАНИЗМЫ ОТТОРЖЕНИЯ ПОЧЕЧНОГО АЛЛОТРАНСПЛАНТАТА И ИММУНОЛОГИЧЕСКАЯ ТОЛЕРАНТНОСТЬ. Нефрология. 2016;20(6):33-41.
For citation:
Vatazin A.V., Kildjushevskiy, A.V., Fedulkina V.A., Faenko A.P. RENAL ALLOGRAFT REJECTION MECHANISMS AND IMMUNOTOLERANCE. Nephrology (Saint-Petersburg). 2016;20(6):33-41. (In Russ.)
JATS XML








































