Перейти к:
ПРОТОКОЛЬНАЯ БИОПСИЯ ПОЧЕЧНОГО АЛЛОТРАНСПЛАНТАТА КАК КРИТЕРИЙ ЭФФЕКТИВНОСТИ ЭКСТРАКОРПОРАЛЬНОЙ ФОТОХИМИОТЕРАПИИ
Аннотация
ЦЕЛЬ ИССЛЕДОВАНИЯ. Проанализировать гистологические результаты применения метода экстракорпоральной фотохимиотерапии при аллотрансплантации трупной почки. ПАЦИЕНТЫ И МЕТОДЫ. Экстракорпоральная фотохимиотерапия была применена для предупреждения острого отторжения почечного аллотрансплантата в раннем послеоперационном периоде у 20 пациентов. Контрольную группу составили 20 пациентов с парными основной группе трансплантатами без применения данного метода. Пациентам обеих групп проводили протокольную биопсию трансплантата на 30-е и 180-е сутки после трансплантации или при наличии показаний с последующим гистологическим заключением согласно классификации Banff 2007 года. Также приведен клинический случай использования экстракорпоральной фотохимиотерапии в качестве терапии гломерулонефрита трансплантата. РЕЗУЛЬТАТЫ. Установлено, что в основной группе по результатам биопсии ни у одного пациента не выявлено признаков отторжения трансплантата, в то же время у 4 пациентов группы сравнения гистологически подтверждено отторжение пересаженного органа различной степени по Banff 2007, два из которых в результате привели к потере трансплантата. Применение экстракорпоральной фотохимиотерапии в качестве терапии гломерулонефрита трансплантата показало, что метод может быть использован с целью нормализации функции трансплантата и способен остановить процесс развития фокального и сегментарного гломерулосклероза, что подтверждено данными гистологического исследования биоптата до и после проведения процедур. ЗАКЛЮЧЕНИЕ. Экстракорпоральная фотохимиотерапия обладает эффективностью и может быть использована в качестве адьювантной терапии для предупреждения отторжения почечного аллотрансплантата и в качестве терапии возвратного гломерулонефрита трансплантата.
Ключевые слова
Для цитирования:
Федулкина В.А., Ватазин А.В., Кильдюшевский А.В., Столяревич Е.С., Круглов Е.Е., Кантария Р.О. ПРОТОКОЛЬНАЯ БИОПСИЯ ПОЧЕЧНОГО АЛЛОТРАНСПЛАНТАТА КАК КРИТЕРИЙ ЭФФЕКТИВНОСТИ ЭКСТРАКОРПОРАЛЬНОЙ ФОТОХИМИОТЕРАПИИ. Нефрология. 2016;20(6):57-66.
For citation:
Fedulkina V.A., Vatazin A.V., Kildjushevskiy A.V., Stolyarevich E.S., Kruglov E.E., Kantariya R.O. PROTOCOL RENAL ALLOGRAFT BIOPSY AS A CRITERION OF EXTRACORPOREAL PHOTOCHEMOTHERAPY EFFICIENCY. Nephrology (Saint-Petersburg). 2016;20(6):57-66. (In Russ.)
ВВЕДЕНИЕ
Частота развития острого отторжения почечного аллотрансплантата (ПАТ) остается весьма значительной и составляет по нашим данным от 23,1 до 32,5%, некупируемые кризы отторжения почечного аллотрансплантата составляют от 3,2 до 12,4% [1]. Почти 50% всех неудач в процессе трансплантации обусловлены отторжением, и большая часть реципиентов трупной почки имеют, по крайней мере, один эпизод острого отторжения в течение первых 2 лет после аллотрансплантации трупной почки (АТТП) [2]. Известно, что немедленная функция трансплантата и отсутствие острой реакции отторжения в первые 6 мес после трансплантации почки практически в 2 раза увеличивают период полужизни ПАТ [3]. Патогенетической основой острого отторжения является повреждение ПАТ, обусловленное клеточным и/ или гуморальным аллоиммунным механизмом с лимфоцитарной, моноцитарной и нейтрофильной инфильтрацией интерстиция. Морфологическими признаками являются гломерулит, капиллярит и тубулит. При этом у 80% пациентов отторжение происходит с привлечением гуморальных механизмов, причем у 65% пациентов имеет место сочетание гуморального и клеточного механизмов [4].
В том, что эпизоды острого отторжения трансплантата неблагоприятно влияют на результаты ТП, сходятся все исследователи. Пяти- и десятилетняя выживаемость ПАТ составляет 75 и 17% в группе больных, перенесших кризы отторжения, а в группе больных без кризов - 93 и 87% соответственно. Кризы отторжения способствуют развитию активного хронического отторжения и формированию хронической дисфункции ПАТ [5-7].
В этой связи дальнейшая разработка и внедрение в клиническую практику новых иммуномодулирующих методик остаются в настоящее время главной стратегией предупреждения и лечения острого отторжения и продления жизни трансплантата [8-10].
Нами исследован новый адоптивный (от англ. adoptive - в данном контексте - восприимчивый) метод предупреждения и лечения острого отторжения почечного трансплантата - экстракорпоральная фотохимиотерапия (ЭФХТ). В его основе лежит воздействие активированных ультрафиолетовым светом молекул специфического фотосенсибилизатора на лимфоциты крови. Эффективность ЭФХТ была доказана на основании проведения многоцентровых исследований при различных вариантах аутоиммунных дерматозов [11-14], при реакции трансплантат против хозяина при трансплантации аллогенных стволовых гемопоэтических клеток у больных с гемобластозами [15-17], в том числе у детей [18], и при трансплантации сердца, легких и печени [19-22].
Известны результаты нескольких исследований с участием в общей сложности до 50 пациентов после аллотрансплантации трупной почки, где курсы ЭФХТ были с успехом использованы для купирования устойчивых эпизодов острого отторжения [23-29]. При этом авторы пришли к заключению, что ЭФХТ может иметь значение в качестве адъювантной терапии или как метод выбора для предотвращения отторжения при пересадке солидного органа [27]. Имеются также единичные публикации о применении данного метода в качестве профилактики острого отторжения почечного аллотрансплантата [30, 31].
Помимо признанного клинического преимущества экстракорпоральной фотохимиотерапии, необходимым является предоставление гистологических доказательств эффективности метода. На 11-й Банфф - конференции в 2011 году, посвященной актуальным вопросам патологии аллотрансплантатов солидных органов, широко обсуждалась роль протокольных биопсий в трансплантологии. Большое внимание коллектив доктора D. Seron уделил установлению прогностического значения субклинических изменений в трансплантате, поскольку, по имеющимся данным, частота субклинического острого отторжения составляет 60,8; 45,7; 25,8 и 17,7% через 1, 3, 12 и более 12 мес после трансплантации соответственно [32].
Целью исследования является сравнительное проспективное изучение гистологических результатов протокольной биопсии почечного аллотрансплантата при включении в протокол медикаментозной иммуносупрессивной терапии метода экстракорпоральной фотохимиотерапии в качестве профилактики острого отторжения трансплантата и терапии возвратного гломерулонефрита.
ПАЦИЕНТЫ И МЕТОДЫ
В число пациентов основной (первой) группы (n=20) вошли 12 мужчин в возрасте от 31 года до 56 лет и 8 женщин в возрасте от 27 до 50 лет (40,4±11,2), которые получали стандартную медикаментозную иммуносупрессивную терапию в сочетании с экстракорпоральной фотохимиотерапией. Группу сравнения (вторую) (n=20) составили 12 мужчин в возрасте от 21 года до 55 лет и 8 женщин в возрасте от 37 до 48 лет (39,1±12,1), которые являлись реципиентами парных основной группе трансплантатов и получали только общепринятую медикаментозную иммуносупрессию. Процедуры экстракорпоральной фотохимиотерапии в качестве терапии возвратного гломерулонефрита получал 1 мужчина в возрасте 38 лет.
Причинами ХБП у реципиентов почечных аллотрансплантатов в двух группах больных явились практически идентичные заболевания: хронический гломерулонефрит (у 19), поликистоз почек (у 9), артериолосклеротичский нефросклероз (у 4), хронический пиелонефрит (у 7). У 1 больного группы сравнения диагностирован антифосфо- липидный синдром. Длительность заместительной почечной терапии перед трансплантацией у пациентов первой группы составила, в среднем, 23,2 ± 8,2 мес, в группе сравнения - 24,6 ± 7,4 мес. Индекс совместимости в двух группах оказался сопоставим и составил 9 (5;13) и 8 (4;13) в основной и контрольной группах соответственно. Рандомизация пациентов осуществлялась методом слепой случайной выборки.
Процедуры ЭФХТ проводились пациентам первой группы в первые 2 нед после трансплантации почки с кратностью 2 раза в неделю, в последующие 2 нед - 1 раз в неделю, в течение 2-го месяца - 1 раз в 2 нед, 1 раз в течение 3-го месяца и завершались одной процедурой на 180-е сутки после трансплантации почки. Пациенту с целью терапии фокального и сегментарного гломеруло- склероза проведено 7 сеансов с кратностью 2-3 раза в неделю.
В качестве фотосенсибилизатора использовали Аммифурин в дозе 0,6 мг/кг массы тела, который принимал пациент за 2 ч до проведения процедуры. Методика ЭФХТ заключалась в сепарации и накоплении в экстракорпоральном контуре мононуклеарных клеток с помощью аппарата для цитоплазмафереза «MSC+ «Heamonetics» с последующим их облучением ультрафиолетовым светом (А-спектр 365 нм) в течение 90 мин со скоростью 10 мл/мин. Далее клетки подвергались инкубации в течение 90 мин при температуре 37°С, после чего проводилась реинфузия клеток пациенту.
Протокольное морфологическое исследование биоптатов трансплантированных почек проводилось на 30-е и 180-е сутки после аллотрансплантации или при наличии показаний в ГБУЗ «Городская клиническая больница №52 Департамента здравоохранения г. Москвы», Московский городской нефрологический центр (Е.С. Столяревич). Гистологическое исследование биоптатов трансплантата почки включало в себя световую микроскопию и иммунофлюоресцентное исследование на замороженных срезах. При проведении световой микроскопии проводили окраску гематоксилином и эозином, ШИК-реакцию и окраску трихромом по Массону. Морфологическую диагностику проводили в соответствии с классификацией острого отторжения трансплантата Banff 2007 [33]. Морфолог не имел информации о том, к какой группе относится пациент.
РЕЗУЛЬТАТЫ
Необходимо отметить, что все пациенты первой группы выписаны после аллотрансплантации трупной почки в удовлетворительном состоянии с достаточным диурезом и средним уровнем сывороточного креатинина 0,15±0,02 ммоль/л, сохранили удовлетворительную функцию почечного аллотрансплантата до 6 мес после АТТП со средней скоростью клубочковой фильтрации 59,7±3,2 мл/мин против 31,5±4,1 мл/мин в контрольной группе (р<0,05). Анализ клинических и лабораторных данных позволяет выявить незначительно более раннее восстановление функции почечного трансплантата в основной группе, о чем свидетельствуют меньшая продолжительность олигоанурии (5,3±1,1 против 7,8±1,2 сут), более уверенные темпы снижения цифр азотемии (23±3,1 против 26,4±4,2 сут) и меньшая длительность проведения заместительной почечной терапии (10,6±1,2 против 14,6±2,4 сут) у пациентов группы с применением ЭФХТ.
По данным гистологического исследования биоптатов почечных аллотрансплантатов морфологические изменения, характерные для остаточных явлений ишемического и реперфузионного повреждения трансплантата, были выявлены у 12 реципиентов основной группы и у 3 реципиентов контрольной: гиалиново-капельная и гидропическая дистрофия эпителия проксимальных извитых канальцев, единичные очаги некроза эпителия канальцев, признаки регенеративного процесса канальцах (наличие митозов в эпителиальных клетках), расширение просвета канальцев с белковыми цилиндрами и десквамированными эпителиальными клетками в их просвете, а также минимальная мононуклеарная инфильтрация интерстиция (i1).
Таблица 1
Результаты протокольной биопсии ПАТ у пациентов основной и контрольной группы на 30-е и 180-е сутки после АТТП
Диагностические категории | Первая группа(n=20) | Вторая группа (n=20) | ||
|---|---|---|---|---|
30-е сутки | 180-е сутки | 30-е сутки | 180-е сутки | |
Патологии не выявлено | 6 | 18 | 7 | 13 |
Острый канальцевый некроз | 12 | 0 | 9 | 0 |
IA Banff 2007 | 0 | 0 | 1* | 0 |
IB Banff 2007 | 0 | 0 | 0 | 1* |
IIA Banff 2007 | 0 | 0 | 0 | 0 |
IIB Banff 2007 | 0 | 0 | 1** | 0 |
III Banff 2007 | 0 | 0 | 1** | 0 |
Фокальный сегментарный гломерулосклероз | 0 | 0 | 0 | 1** |
Хроническая трансплантационная нефропатия 1-2 ст. | 2 | 2 | 1 | 2 |
Хроническая трансплантационная нефропатия 3 ст. | 0 | 0 | 0 | 3* |
* Результаты, угрожавшие функциональному состоянию почечного трансплантата и потребовавшие дополнительной терапии; ** результаты, приведшие к трансплантатэктомии.
У одного пациента группы сравнения через 6 мес после АТТП при биопсии диагностирован фокальный сегментарный гломерулосклероз, а еще у троих - хроническая трансплантационная нефропатия III степени: выраженный склероз интерстиция и атрофия канальцев, склероз клубочков (ci 3, ct 2-3, cg 2).
Ни у одного пациента основной группы не было выявлено признаков острого отторжения трансплантата. Изменения, обнаруженные в трансплантате через 1 мес после операции, соответствовали остаточным явлениям острого канальцевого некроза, а через 6 мес - начальным проявлениям хронической трансплантационной нефропатии: ci 1-2, ct 1, cg 1.
У 4 реципиентов пациентов группы сравнения было диагностировано острое отторжение трансплантата, подтвержденное морфологическим исследованием биоптатов. У троих реципиентов группы сравнения криз отторжения диагностирован при протокольной биопсии через 1 мес после АТП, а у одного реципиента - через 6 мес после операции (табл. 1).
В первом случае отторжению ПАТ присвоена IA категория согласно Banff07 (рис. 1А). Помимо явлений клеточного интерстициального отторжения (i2—3, t2, v0), отмечались также признаки микроциркуляторного воспаления (перитубуляррит), однако свечение C4d на перитубулярных капиллярах отсутствовало. При этом отторжение имело субклиническое течение и не сопровождалось яркой клинической симптоматикой. Этому пациенту группы сравнения проведена пульс-терапия метилпреднизолоном. При контрольной биопсии трансплантата изменения соответствовали остаточным явлениям острого отторжения и хронической трансплантационной нефропатии II степени, а на 180-е сутки после АТТП — хронической трансплантационной нефропатии III степени.
При исследовании биоптата парной почки (у реципиента основной группы) обнаружена лишь небольшая очаговая инфильтрация интерстиция лимфоцитами без явлений тубулита (i1, t0), имелись также незначительные признаки острого повреждения канальцевого эпителия (см. рис. 1Б).
Сосудистая форма острой реакции отторжения имела место у одного из пациентов группы сравнения (III категория по классификации Banff07). У этого больного отторжение сопровождалось яркой клинической симптоматикой: резкие боли в области трансплантата, повышение температуры тела, при пальпации — плотный, увеличенный в размерах трансплантат, в анализе крови —лейкоцитоз, который имел тенденцию к нарастанию (13, затем 15*109/л). Помимо этого, отмечено снижение гемоглобина с 110 до 75 г/л. В связи с подозрением на разрыв трансплантата выполнена экстренная ревизия забрюшинного пространства, в ходе которой обнаружены линейные разрывы капсулы трансплантата, паранефральная гематома объемом до 300 мл и обширная имбибиция забрюшинной клетчатки. Произведены эвакуация гематомы, ушивание линейных разрывов трансплантата. Интраоперационно выполнена биопсия ПАТ. Биопсийный материал был представлен практически полностью разрушенной тканью почки, некоторые клубочки склерозированы, а оставшиеся выглядели гиперклеточными за счет явлений гломерулита. В одном клубочке капиллярные петли частично разрушены, окружены сегментарным клеточным полулунием, еще в двух клубочках определяются более старые фиброзно-клеточные полулуния. Отмечалась также диффузная инфильтрация интерстиция лимфоцитами с примесью нейтрофилов, многие канальцы полностью разрушены. В участках относительно сохранной паренхимы - тяжелое повреждение канальцевого эпителия, явления тубулита до 6-8 клеток на срез канальца. В просвете канальцев многочисленные воспалительные клетки и слущенные клетки канальцевого эпителия. Перитубулярные капилляры резко расширены, содержат стазы крови. Артерии с трансмуральным артериитом (рис. 2) расширены, содержат стазы крови. Артерии с трансмуральным артериитом (см. рис. 2А, Б).
Этому пациенту назначена терапия антити- моцитарным глобулином в дозе 4 мг/кг (введено 300 мг препарата). На следующий день у больного появились признаки пневмонии: жалобы на малопродуктивный кашель, подъем температуры тела до 37,8 °С, одышка при минимальной физической нагрузке, при аускультации жесткое дыхание и сухие хрипы в базальных отделах правого легкого. Диагноз был подтвержден рентгенологически. От дальнейшего введения препарата пришлось отказаться. В дальнейшем на фоне пульс-терапии метилпреднизолоном в суммарной дозе 1,5 г за неделю этому больному группы сравнения проведено 4 сеанса каскадной плазмофильтрации, после которых внутривенно вводился иммуноглобулин. Назначена антимикробная, противогрибковая и противовирусная терапия, на фоне чего явления пневмонии были купированы. Пациент был выписан в удовлетворительном состоянии на 53-и сутки после АТП, креатинин крови составил 100 мкмоль/л.
Однако через полгода пациент был вновь госпитализирован в связи с тяжелой дисфункцией трансплантата: креатинин крови - 1100 мкмоль/л, мочевина - 52 ммоль/л, суточная протеинурия - 32 г/сут, скорость клубочковой фильтрации составила до 6 мл/мин. По данным биопсии ПАТ был диагностирован фокальный сегментарный гломерулосклероз (коллабирующий вариант): спавшиеся капиллярные петли 2 из 7 клубочков, окруженные гипертрофированными подоцитами с вакуолизированной цитоплазмой, в двух клубочках - ишемия капиллярных петель. Отмечены небольшой очаговый склероз интерстиция и атрофия канальцев, занимающие около 10-15% площади паренхимы, с сопутствующей интерстициальной инфильтрацией без явлений тубулита, артериосклероз. Были проведены пульс-терапия метилпреднизолоном в суммарной дозе 2,25 г, 4 сеанса плазмафереза. Однако терапия была неэффективна. В связи с тяжелым нефротическим синдромом была выполнена трансплантатэктомия и сформирована артериовенозная фистула, после чего больной вернулся на гемодиализ.
На протокольной биопсии парного трансплантата на 30-е сутки у больного основной группы выявлены небольшой очаговый склероз интерстиция и атрофия канальцев, занимающие менее 5% почечной паренхимы, умеренная очаговая инфильтрация интерстиция лимфоцитами без явлений тубулита. В отдельных канальцах отмечалось расширение просвета, в других канальцах - частичная утрата «щеточной каймы» с образованием фестончатого контура канальцевого эпителия. Имеются канальцы с явлениями регенерации и образованием многорядного эпителия. Данные изменения соответствовали остаточным явлениям острого канальцевого некроза (см. рис. 2В).
На протокольной биопсии трансплантата на 180-е сутки после трансплантации отмечены диффузно-очаговый склероз интерстиция и атрофия канальцев, занимающие около 25-30% паренхимы почки, что соответствует хронической трансплантационной нефропатии II степени.
У третьего реципиента группы сравнения с кризом отторжения в раннем послеоперационном периоде отсутствовала функция ПАТ на протяжении двух недель. При этом в анализах крови сохранялись лейкоцитоз до 14*109/л, отек трансплантата, обедненный сосудистый рисунок, стабильно повышенный индекс резистивности, отсутствие диастолического кровотока в сосудах трансплантата по данным допплерографии. Проведены пульс-терапия метилпреднизолоном в общей дозе 1,5 г, 4 сеанса каскадной плазмафильтрации с внутривенным введением иммуноглобулина. Несмотря на проводимую терапию, функция трансплантата не восстановилась, в связи с чем была выполнена биопсия, по результатам которой диагностировано острое отторжение ПАТ (Banff07 IIB) по смешанному типу (клеточное и гуморальное). При гистологическом исследовании трансплантата - картина микроциркуляторного воспаления (гломерулит с преобладпнием нейтрофилов) с элементами тромботической микроангиопатии (тромбоз приносящей артериолы одного из клубочков) и участками ишемического инфаркта почки, а также признаки тяжелого интимального артериита с выраженным сужением просвета. По данным иммунофлюоресценции - свечение C4d-компонента комплемента в капиллярах клубочков и перитубулярных капиллярах (рис. 3А).
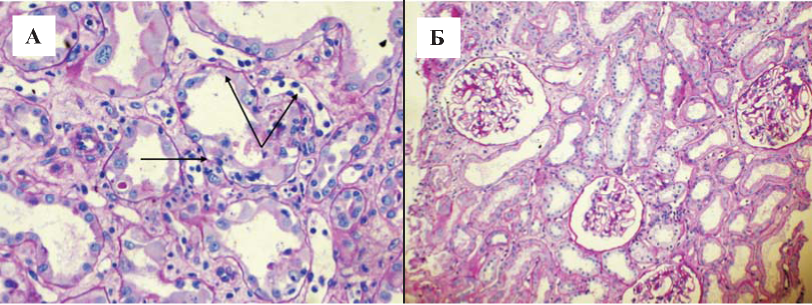
Рис. 1. Морфологическое исследование парных аллографтов у репипиента контрольной группы (А) и реципиента основной группы (Б). А - результаты биопсии ПАТ реципиента группы сравнения (ЭФХТ-) на 38-е сутки после АТТП . Признаки отторжения IA по Banff (окраска PAS. Ув. 100): отек интерстиция с его инфильтрацией лимфоцитами и явлениями тубулита до 5-7 клеток на сечение канальца (стрелка ), перитубулярные капилляры расширены, содержат воспалительные клетки (двойная стрелка ). Б - результаты биопсии ПАТ реципиента основной группы (ЭФХТ+) на 30-е сутки после АТТП. Признаков отторжения нет, остаточные явления острого канальцевого некроза (окраска PAS. Ув. 100). Интерстициальная инфильтрация практически отсутствует, снижение высоты канальцевого эпителия за счет диффузной/частичной утраты «щеточной каймы».

Рис. 2. Морфологическое исследование парных аллографтов у репипиента контрольной группы (А,Б) и реципиента основной группы (В). А - биопсия ПАТ пациента группы сравнения (ЭФХТ-) с отторжением III по Banff (38-е сутки после АТТП): интерстициальная инфильтрация с явлениями тубулита, интерстициальные геморрагии (окраска PAS. Ув. 100). Б - биопсия пАт пациента группы сравнения (ЭФХТ-) с отторжением III по Banff (38-е сутки после АТТП): артерия малого калибра с явлениями трансмурального некротизирующего артериита (депозиты фибрина в стенке сосуда - стрелка) (окраска Трихром по Массону. Ув. 200). В - результаты биопсии ПАТ пациента основной группы (ЭФХТ+) с остаточными явлениями острого канальцевого некроза (30-е сутки после АТТП) (окраска PAS. Ув. 200). Канальцы с частичной утратой «щеточной каймы» и образованием фестончатого контура канальцевого эпителия. Имеются канальцы с явлениями регенерации и образованием многорядного эпителия (стрелка).
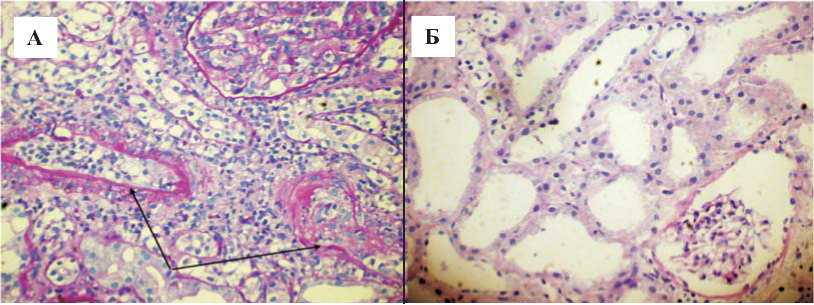
Рис. 3. Морфологическое исследование парных аллографтов у репипиента контрольной группы (А) и реципиента основной группы (Б). А - биопсия ПАТ пациента группы сравнения (ЭФХТ-) с отторжением IIB по Banff (7-е сутки после АТТП) (окраска PAS. Ув. 100). Стрелками указаны артерии с выраженным интимальным артериитом и выраженным сужением просвета сосудов. Б - результаты биопсии ПАТ пациента основной группы (ЭФХТ+) с остаточными явлениями острого канальцевого некроза (30-е сутки после АТТП) (гематоксилин-эозин. Ув. 100). Просвет канальцев расширен за счет снижения высоты канальцевого эпителия с диффузной утратой «щеточной каймы.

Рис. 4. Морфологическое исследование парных аллографтов у репипиента контрольной группы (А) и реципиента основной группы (Б). А - результаты биопсии ПАТ пациента контрольной группы (ЭФХТ-) с отторжением IB по Banff (180-е сутки после АТТП) (окраска PAS. Ув. 100). Видны диффузно-очаговый интерстициальный склероз и атрофия канальцев, отек, лимфоцитарная инфильтрация с явлениями тубулита до 10 клеток и более на сечение канальца как в атрофичных, так и в относительно сохранных канальцах. Б - результаты биопсии ПАТ пациента основной группы (ЭФХТ+) с хронической трансплантационной нефропатией I степени (180-е сутки после АТТП) (окраска PAS. Ув. 100). Видны очаговый интерстициальный склероз, очаговая инфильтрация в зонах склероза без явлений тубулита.

Рис. 5. Динамика показателей функции трансплантата на фоне процедур ЭФХТ.
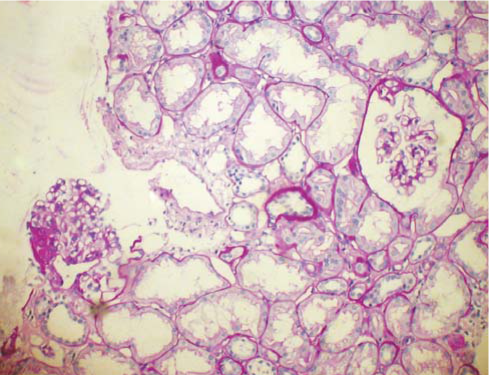
Рис. 6. Результаты биопсии ПАТ пациента с гломерулонефритом трансплантата через 1 год после АТТП (окраска PAS. Ув. 100). Клубочки с участками сегментарного склероза капиллярных петель. Интерстиций не изменен.
Назначена терапия ритуксимабом, однако, функция трансплантата не восстановилась, и трансплантат был удален.
У реципиента основной группы, получившего парный орган, при проведении протокольной биопсии трансплантата на 30-е сутки изменения соответствовали остаточным явлениям острого канальцевого некроза (см. рис. 3Б).
Четвертый случай криза отторжения у реципиента группы сравнения был выявлен случайно, при протокольной биопсии через полгода после АТТП, по данным которой было диагностировано острое отторжение ПАТ (Banff07 IB) на фоне хронической трансплантационной нефропатии II— III степени (рис. 4А). Пациенту проведена пульстерапия метилпреднизолоном в общей дозе 1,5 г. При контрольной биопсии после курса лечения признаки отторжения отсутствовали. Функция ПАТ восстановилась.
У парного реципиента основной группы в биоптате на 180-е сутки после АТТП выявлена хроническая трансплантационная нефропатия I степени: умеренный очаговый интерстициальный склероз, занимающий около 20% паренхимы почки, очаговая интерстициальная инфильтрация в зонах склероза без явлений тубулита (см. рис. 4Б).
Клинический пример терапии возвратного гломерулонефрита у пациента после трансплантации почки.
Пациент через 1 год после АТТП на амбулаторном приеме отметил повышение АД, прибавку массы тела на 3 кг, отеки голеней, стоп. Лабораторно выявлена протеинурия до 12 г/сут, повышение уровня сывороточного креатинина до 0,23 ммоль/л и мочевины до 17,9 ммоль/л, снижение СКФ до 33,8 мл/мин. Пациент был госпитализирован, сделана биопсия. По результатам: в препарате 13 клубочков, в одном из них капиллярные петли коллабированы, окружены гипертрофированными подоцитами. Еще в двух клубочках определяются участки сегментарного склероза капиллярных петель с пенистыми клетками в этих участках и образованием сращений с капсулой Боумена. Оставшиеся клубочки увеличены в размерах, пролиферативных изменений нет. Стенки капиллярных петель не утолщены, одноконтурные. Очаговый фиброз интерстиция и атрофия канальцев, занимающие около 10% почечной паренхимы. Интерстициальная инфильтрация практически отсутствует. Артерии и артериолы — без особенностей. Заключение: гломерулонефрит трансплантата (фокальный и сегментарный гломерулосклероз).
Проводилась пульс-терапия метилпреднизоло- ном в суммарной дозе 2 г. Проведен 1 сеанс плазмафереза, после которого усилилась протеинурия (до 15 г/сут), появилась гипопротеинемия (альбумин 22 г/л). В связи с отсутствием положительного эффекта принято решение провести курс ЭФХТ по стандартному протоколу 2 раза в неделю.
На фоне проведенной терапии отмечена положительная динамика: суточная протеинурия после 4 сеансов составила 12 г/сут, отмечено снижение креатинина крови до 0,15 ммоль/л, мочевины до 13,4 ммоль/л, улучшение кровотока до коры почки по данным УЗИ, индексы сопротивления — в пределах нормальных значений. Пациент выписан на амбулаторное наблюдение, однако при динамическом наблюдении сохранялись умеренные отеки ног, артериальная гипертензия до 160/90 мм рт. ст., суточная протеинурия колебалась около значения 8 г/сут. В связи с недостаточно выраженным эффектом решено продолжить лечение ЭФХТ и пациенту проведено еще 4 сеанса в течение 2 нед. По окончании лечения суточная про- теинурия снизилась до 5 г/сут, нормализовались цифры азотемии (креатинин 0,12 ммоль/л, мочевина 10,4 ммоль/л, СКФ 61,8 мл/мин), параллельно стабилизировалось АД и к моменту выписки не требовало коррекции гипотензивными препаратами, пропали пастозность голеней и стоп. Динамика снижения показателей уремии, протеинурии и нормализации скорости клубочковой фильтрации на фоне проведения процедур ЭФХТ представлена на рис. 5.
Через 6 мес после лечения выполнена контрольная биопсия трансплантата, выявившая гломерулонефрит трансплантата (фокальный и сегментарный гломерулосклероз) без признаков прогрессирования (рис. 6).
Через 4 года после АТТП состояние пациента остается удовлетворительным. АД не выше 140/90 мм рт. ст., отеков не отмечается, креатинин крови — 0,09 ммоль/л, мочевина — 10 ммоль/л, СКФ — 80,5 мл/мин, суточная протеинурия — 0,69 г/сут.
Таким образом, показано, что ЭФХТ способна привести к нормализации функции трансплантата без прогрессирования возвратного гломерулонефрита.
ОБСУЖДЕНИЕ
Полученные гистологические результаты протокольной биопсии ПАТ на 30-е и 180-е сутки после АТТП не оставляют сомнения в преимуществе включения метода ЭФХТ в общепринятый медикаментозный протокол иммуносупрессивной терапии для предупреждения острого отторжения почечного аллотрансплантата в ранние сроки после операции, что подтверждено полным отсутствием эпизодов острого отторжения в группе с применением ЭФХТ с одновременным наличием их в трансплантатах, парных исследуемой группе.
Полученные результаты применения метода в качестве терапии возвратного гломерулонефрита позволяют охарактеризовать ЭФХТ как метод, способный предотвратить прогрессирование признаков фокального и сегментарного гломеруло- склероза и стабилизировать функцию трансплантата без применения дополнительной медикаментозной иммуносупрессивной терапии.
Однако, если иммунологические механизмы предотвращения отторжения трансплантата методом ЭФХТ уже немного изучены [34, 35], вместе с тем остается не совсем ясным механизм действия ЭФХТ при лечении возвратного гломерулонеф- рита, подобных случаев не встречается ни в зарубежных, ни в отечественных публикациях.
И наконец, наиболее важным выводом проведенного исследования является необходимость отметить, что протокольная биопсия способна не только показать значимые отличия в ткани пересаженной почки между исследуемыми, но также и помогает предотвратить субклинические изменения в трансплантате и способствует, таким образом, раннему выявлению патологии почечного трансплантата [4, 6, 36, 37].
Список литературы
1. Ватазин АВ, Василенко ИА, Валов АЛ и др. Витальная компьютерная морфометрия лимфоцитов в диагностике острого отторжения почечного аллотрансплантата. Вестн трансплантол и искусственных органов 2009; 11(4): 18-26. [Vatazin AV, Vasilenko IA, Valov AL i dr. Vital'naja komp'juternaja morfometrija limfocitov v diagnostike ostrogo ottorzhenija pochechnogo allotransplantata. Vestnik transplantologii i iskusstvennyh organov 2009; 11(4): 18-26]
2. Cornell LD, Smith RN, Colvin RB. Kidney Transplantation: Mechanisms of Rejection and Acceptance. Annu Rev Pathol Mech Dis 2008;(3):189–220. doi: 10.1146/annurev.pathmechdis.
3. 121806.151508 3. Halloran PF, de Freitas DG, Einecke G et al. An integrated view of molecular changes, histopathology and outcomes in kidney transplants. Am J Transplant 2010. (10):2223-2230. doi: 10.1111/j.1600-6143.2010.03268.x
4. Cornell LD, Smith RN, Colvin RB. Kidney Transplantation: Mechanisms of Rejection and Acceptance. Annu Rev Pathol Mech Dis 2008;(3):189–220. doi: 10.1146/annurev.pathmechdis. 3.121806.151508
5. Волынчик ЕП, Каабак ММ, Стенина ИИ и др. Некоторые аспекты изучения качества жизни реципиентов после трансплантации почки. Вестн трансплантол и искусственных органов 2009;11(4):26-30 [Volynchik EP, Kaabak MM, Stenina II i dr. Nekotorye aspekty izuchenija kachestva zhizni recipientov posle transplantacii pochki. Vestnik transplantologii i iskusstvennyh organov 2009;11(4):26-30]
6. Halloran PF, de Freitas DG, Einecke G et al. An integrated view of molecular changes, histopathology and outcomes in kidney transplants. Am J Transplant 2010;(10):2223-2230. doi: 10.1111/j.1600-6143.2010.03268.x
7. Nafar M, Farrokhi F, Vaezi M et al. Pre-transplant and posttransplant soluble CD30 for prediction and diagnosis of acute kidney allograft rejection. Int Urol Nephrol 2008;(12):2114-2115. doi: 10.1007/s11255-008-9505-x
8. Cattaneo D, Baldelli S, Perico N. Pharmacogenetics of immunosuppressants: progress, pitfalls and promises. Am J Transplant 2008;(8):1374. doi: 10.1111/j.1600-6143.2008.02263.x
9. Sahin G, Akay OM, Bal C et al. The effect of calcineurin inhibitors on endothelial and plateled function in renal transplant patients. Clinical Nephrology 2011;76(3):218-225. doi: 10.5414/ CN106931
10. Mohamed H, Sayegh MD, Laurence A et al. The role of T-cell costimulatory activation pathways in transplant rejection. N Engl J Med 1998;338:1813-1821. doi: 10.1056/ NEJM199806183382506
11. Adamski J, Kinard T, Ipe T, Cooling L. Extracorporeal photopheresis for the treatment of autoimmune diseases. Transfus Apher Sci 2015;52(2):171-82. doi: 10.1016/j.transci.2015.02.005
12. Kenna KE, Whittaker S, Rhodes LE et al. Evidence – baced practice of photopheresis 1987 – 2001: a report of a workshop of the British Photodermatology group and the U.K. skin lymphoma group. Br J Dermatol 2006;154(1):7-20
13. Bulat V, Situm M, Dediol I et al. The mechanisms of action of phototherapy in the treatment of the most common dermatoses. Coll Antropol 2011;35(2):147-151
14. Кильдюшевский АВ, Федулкина ВА, Фомина ОА, Фомин АМ. Применение экстракорпоральной фотохимиотерапии при лимфомах кожи и трансплантации солидных органов. Альманах клин мед 2014; (30): 61-69. [Kil'djushevskij AV, Fedulkina VA, Fomina OA, Fomin AM. Primenenie jekstrakorporal'noj fotohimioterapii pri limfomah kozhi i transplantacii solidnyh organov. Al'manah klinicheskoj mediciny 2014;( 30): 61-69]
15. Jung AG, Bertsch HP, Schoen MP, Lippert U. A rare case of a sclerodermoid chronic graft versus host disease. Successful treatment with extracorporeal photopheresis (ECP). Hautarzt 2010;61(6):514-517. doi: 10.1007/s00105-010-1924-9
16. Kitko CL, Levine JE. Extracorporeal photopheresis in prevention and treatment of acute GVHD. Transfus Apher Sci 2015;52(2):151-156. doi: 10.1016/j.transci.2015.02.001
17. Radojcic V, Pletneva MA, Couriel DR. The role of extracorporeal photopheresis in chronic graft-versus-host disease Transfus Apher Sci 2015;52(2):157-161. doi: 10.1016/j.transci. 2015.02.002
18. Calore E, Marson P, Pillon M et al. Treatment of Acute Graft-versus-Host Disease in Childhood with Extracorporeal Photochemotherapy/Photopheresis: The Padova Experience. Biol Blood Marrow Transplant 2015; Nov;21(11):1963-1972. doi: 10.1016/j.bbmt.2015.07.007
19. Dieterlen MT, Bittner HB, Pierzchalski A et al. Immunological monitoring of extracorporeal photopheresis after heart transplantation. Clin Exp Immunol 2014 Apr;176(1):120-128. doi: 10.1111/cei.12254
20. Barten MJ, Dieterlen MT. Extracorporeal photopheresis after heart transplantation. Immunotherapy 2014;6(8):927-944. doi: 10.2217/imt.14.69
21. Rummler S, Barz D. Extracorporeal photopheresis – a benefical treatment for cardiac and lung transplant rejection. Transplant international 2011;(24):5. doi: 10.2217/imt.14.69
22. Urbani L, Mazzoni A, Colombatto P et al. Potential applications of extracorporeal photopheresis in liver transplantation Transplant Proc 2008 May;40(4):1175-1178. doi: 10.1016/j. transproceed.2008.03.071
23. Roberto Dall’ et al. Successful Treatmentof Recurrent Rejection in Renal Transplant Patients with Photopheresis. J Am Soc Nephrol 1998 Jan;9(1):121-127
24. Baron ED, Heeger PS, Hricik DE et al. Immunomodulatory effect of extracorporeal photopheresis after successful treatment of resistant renal allograft rejection. Photodermatol Photoimmunol Photomed 2001;(17):79–82
25. Fernandez EJ, Lopez C, Ramirez A et al. Role of photopheresis in the treatment of refractory cellular rejection in kidney transplantation. Nefrologia 2016 May-Jun;36(3):327-328. doi: 10.1016/j.nefro.2015.06.023
26. Lai Q, Pretagostini R, Gozzer M et al. Multimodal treatment for acute antibody-mediated renal transplant rejection: successful rescue therapy with combined plasmapheresis, photopheresis and intravenous immunoglobulin. G Ital Nefrol 2012 Jan-Feb;29(54):S31-35
27. Jardine MJ, Bhandari S, Wyburn KR et al. Photopheresis Therapy for Problematic Renal Allograft Regection. J Clin Apher 2009;24(4):161-169. doi: 10.1002/jca.20199
28. Lamioni A, Carsetti R, Legato A et al. Induction of regulatory T cells after prophylactic treatment with photopheresis in renal transplant recipient. Transplantation 2007 May 27;83(10):13931396
29. Genberg H, Kumlien G, Shanwell A, Tyden G. Refractory acute renal allograft rejection successfully treated with photopheresis. Transplant Proc 2005 Oct;37(8):3288-3289
30. Kusztal M, Kościelska-Kasprzak K, Gdowska W et al. Extracorporeal photopheresis as an antirejection prophylaxis in kidney transplant recipients: preliminary results. Transplant Proc 2011 Oct;43(8):2938-2940. doi: 10.1016/j.transproceed.2011.08.061
31. Kusztal M, Kłak R, Krajewska M et al. Application of extracorporeal photopheresis in kidney transplant recipients: technical considerations and procedure tolerance. Transplant Proc 2011 Oct;43(8):2941-2942. doi: 10.1016/j.transproceed.2011.08.034
32. Траилин АВ, Никоненко ТН, Никоненко АС. Обзор материалов Банфф-конференции 2011 года. Вестн трансплантол и искусственных органов 2012;(1):114-122 [Trailin AV, Nikonenko TN, Nikonenko AS. Obzor materialov Banff – konferencii 2011 goda. Vestnik transplantologii i iskusstvennyh organov 2012;(1):114-122]
33. Solez K, Colvin RB, Racusen LS et al. Banff 07 Classification of Renal Allograft Pathology: Updates and Future Directions. Am J Transplant 2008 Apr;8(4):753-760. doi: 10.1111/j.16006143.2008.02159.x
34. Schmid D, Grabmer C, Streif D et al. T-cell death, phosphatidylserine exposure and reduced proliferation rate to validate extracorporeal photochemotherapy. Vox Sang. 2015 Jan;108(1):82-88. doi: 10.1111/vox.12200
35. Ватазин АВ, Зулькарнаев АБ, Кильдюшевский АВ и др. Некоторые механизмы дей ствия экстракорпоральной фотохимиотерапии при трансплантации солидных органов. Вестн трансплантол и искусственных органов 2014;16(1):7684. [Vatazin AV, Zul'karnaev AB, Kil'djushevskij AV i dr. Nekotorye mehanizmy dejstvija jekstrakorporal'noj fotohimioterapii pri transplantacii solidnyh organov. Vestnik transplantologii i iskusstvennyh organov 2014;16(1):76-84]
36. Ibernon M, Goma M, Moreso F. et al. Subclinical rejection impairs glomerular adaptation after renal transplantation. Kidney Int 2006 Aug;70(3):557-561 37. Сухоруков ВА, Юшинскис ЯЛ, Штрумфа И, Розенталь РЛ. Значение протокольных биопсий в раннем периоде после трансплантации почки. Вестн трансплантол и искусственных органов 2010;12(4):33-36 [Suhorukov VA, Jushinskis JaL, Shtrumfa I, Rozental' RL. Znachenie protokol'nyh biopsij v rannem periode posle transplantacii pochki. Vestnik transplantologii i iskusstvennyh organov 2010;12(4):33-36]
Об авторах
В. А. ФедулкинаРоссия
Федулкина Вероника Андреевна, кандидат медицинских наук.
Старший научный сотрудник хирургического отделения трансплантологии и диализа.
129110, Россия, Москва, ул. Щепкина, д. 61/2, корп. 6
А. В. Ватазин
Россия
Ватазин Андрей Владимирович, доктор медицинских наук, профессор.
Руководитель отдела трансплантологии, нефрологии и хирургической гемокоррекции.
129110, Москва, ул. Щепкина, д. 61/2, корп. 6.
А. В. Кильдюшевский
Россия
Кильдюшевский Александр Вадимович, доктор медицинских наук, профессор.
Ведущий научный сотрудник отделения хирургической гемокоррекции и детоксикации.
129110, Россия, Москва, ул. Щепкина, д. 61/2, корп. 11.
Е. С. Столяревич
Россия
Столяревич Екатерина Сергеевна, доктор медицинских наукю
123182, Москва, ул. Пехотная, д. 3.
Е. Е. Круглов
Россия
Круглов Евгений Ефимович, доктор медицинских наук, профессор.
Главный врач.
129110, Россия, Москва, ул. Щепкина, д. 61/2, корп. 1.
Р. О. Кантария
Россия
Кантария Русудана Отаровна, кандидат медицинских наук.
Врач-нефролог хирургического отделения трансплантологии и диализа.
129110, Россия, Москва, ул. Щепкина, д. 61/2, корп. 6
Рецензия
Для цитирования:
Федулкина В.А., Ватазин А.В., Кильдюшевский А.В., Столяревич Е.С., Круглов Е.Е., Кантария Р.О. ПРОТОКОЛЬНАЯ БИОПСИЯ ПОЧЕЧНОГО АЛЛОТРАНСПЛАНТАТА КАК КРИТЕРИЙ ЭФФЕКТИВНОСТИ ЭКСТРАКОРПОРАЛЬНОЙ ФОТОХИМИОТЕРАПИИ. Нефрология. 2016;20(6):57-66.
For citation:
Fedulkina V.A., Vatazin A.V., Kildjushevskiy A.V., Stolyarevich E.S., Kruglov E.E., Kantariya R.O. PROTOCOL RENAL ALLOGRAFT BIOPSY AS A CRITERION OF EXTRACORPOREAL PHOTOCHEMOTHERAPY EFFICIENCY. Nephrology (Saint-Petersburg). 2016;20(6):57-66. (In Russ.)
JATS XML








































