Перейти к:
ИСПОЛЬЗОВАНИЕ КОМБИНИРОВАННОЙ ТЕРАПИИ ПЛАЗМАФЕРЕЗОМ, ВНУТРИВЕННЫМ ЧЕЛОВЕЧЕСКИМ ИММУНОГЛОБУЛИНОМ И РИТУКСИМАБОМ ДЛЯ ЛЕЧЕНИЯ ХРОНИЧЕСКОГО ОТТОРЖЕНИЯ ТРАНСПЛАНТИРОВАННОЙ ПОЧКИ
Аннотация
ЦЕЛЬ – оценить эффективность использования комбинации внутривенного человеческого иммуноглобулина (ВВИГ) с плазмаферезом и ритуксимабом для лечения трансплантационной гломерулопатии в поздние сроки после трансплантации почки. ПАЦИЕНТЫ И МЕТОДЫ. В исследование было включено 50 пациентов с морфологически верифицированным диагнозом трансплантационной гломерулопатии, 24 из которых получали лечение плазмаферезом в сочетании с ВВИГ и ритуксимабом. Контрольную группу составили 26 пациентов, не получавших антигуморального лечения. РЕЗУЛЬТАТЫ. На момент постановки диагноза СКФ в исследуемой и контрольной группах не различалась (44,9 Ѓ} 21,3 и 41,2 Ѓ} 14,6 мл/мин, р =0,47), однако последующие темпы снижения функции трансплантата были ниже в группе получавших лечение по сравнению с контролем: –0,47 Ѓ} 0,6 мл/мин/мес и 1,31 Ѓ} 1,6 мл/мин/мес (p = 0,02). 3-летняя выживаемость трансплантатов, таким образом, составила 21,3% и 64,8% у пациентов, получавших лечение (р=0,01). ЗАКЛЮЧЕНИЕ. Наше исследование показало, что трансплантационная гломерулопатия, будучи наиболее частым вариантом хронического гуморального отторжения, характеризуется неблагоприятным прогнозом, который мало зависит от особенностей морфологической картины и активности процесса на момент постановки диагноза. Комплексное лечение, включающее сеансы плазмафереза, внутривенный человеческий иммуноглобулин и ритуксимаб, позволяет замедлить темпы прогрессирования хронического отторжения по крайней мере у части пациентов с хроническим гуморальным отторжением, выявленным в поздние сроки после АТП.
Ключевые слова
Для цитирования:
Столяревич Е.С., Артюхина Л.Ю., Иванова Е.С., Томилина Н.А. ИСПОЛЬЗОВАНИЕ КОМБИНИРОВАННОЙ ТЕРАПИИ ПЛАЗМАФЕРЕЗОМ, ВНУТРИВЕННЫМ ЧЕЛОВЕЧЕСКИМ ИММУНОГЛОБУЛИНОМ И РИТУКСИМАБОМ ДЛЯ ЛЕЧЕНИЯ ХРОНИЧЕСКОГО ОТТОРЖЕНИЯ ТРАНСПЛАНТИРОВАННОЙ ПОЧКИ. Нефрология. 2016;20(6):67-74.
For citation:
Stolyarevich E.S., Artyukhina L.Yu., Ivanova E.S., Tomilina N.A. USE OF COMBINED THERAPY BY PLASMAPHERESIS, HUMAN INTRAVENOUS IMMUNOGLOBULIN AND RITUXIMAB FOR CHRONIC RENAL ALLOGRAFT REJECTION. Nephrology (Saint-Petersburg). 2016;20(6):67-74. (In Russ.)
ВВЕДЕНИЕ
Исследования последних лет показали, что основной причиной потерь почечного трансплантата в поздние сроки после аллотрансплантации почки (АТП) является гуморальное отторжение, наиболее частым вариантом которого принято считать трансплантационную гломерулопатию (ТГ). На ранней стадии гуморальное отторжение проявляется признаками микроциркуляторного воспаления с задержкой воспалительных клеток в капиллярах клубочков и перитубулярных капиллярах (ПТК), ведущего к повреждению клеток эндотелия и последующему ремоделированию капиллярной стенки с формированием двойных контуров капилляров клубочка и расслоением базальной мембраны ПТК, характерных уже для хронического гуморального отторжения [1, 2]. Вышеперечисленные морфологические признаки в сочетании со свечением 04d и выявлением DSA составляют спектр изменений, характерных для гуморального отторжения, при этом признаки микроциркуляторного воспаления могут предшествовать либо сосуществовать с хроническими изменениями [3-6]. Тем не менее, выявление даже единичных двойных контуров капиллярных петель позволяет диагностировать хроническое отторжение, которое считается активным в случаях свечения C4d на ПТК. Таким образом, острое гуморальное отторжение, наряду с активным и неактивным хроническим отторжением, представляет разные стадии одного и того же процесса, ведущего к дисфункции почечного трансплантата и, в конечном счете, его потере. При этом эффективность лечения и прогноз нефропатии при остром и хроническом гуморальном отторжении в значительной степени различаются. Для лечения гуморального отторжения традиционно используется терапия, направленная на элиминацию донорспецифических антител (ДСА) и предупреждение их продукции, Действительно, комбинированная терапия, включавшая высокие дозы человеческого иммуноглобулина (ВВИГ) в сочетании с плазмаферезом и ритуксимабом, оказалась достаточно эффективной для лечения эпизодов острого гуморального отторжения, что было продемонстрировано в ряде исследований [7-10]. В случаях же хронического отторжения результаты лечения, как правило, неудовлетворительны. На сегодняшний день опубликованы данные лишь несколькольких небольших исследований, результаты которых крайне противоречивы [11-15]. Несмотря на не вполне очевидный эффект лечения в целом, авторы отмечают стабилизацию функции почечного трансплантата у некоторых пациентов даже в случаях сформировавшихся хронических изменений, в том числе по типу трансплантационной гломерулопатии.
Целью настоящего исследования было оценить эффективность использования комбинации человеческого иммуноглобулина с плазмаферезом и ритуксимабом для лечения трансплантационной гломерулопатии в поздние сроки после трансплантации почки.
ПАЦИЕНТЫ И МЕТОДЫ
В исследование включены 50 пациентов с морфологически подтвержденной хронической трансплантационной гломерулопатией, выявленной в поздние сроки после АТП. Срок с момента трансплантации составлял от 7,3 до 285 мес (в среднем 81,4 мес). У всех пациентов показанием к биопсии почек была дисфункция почечного трансплантата (средний уровень креатинина крови - 0,21±0,08 ммоль/л), изолированно либо в сочетании с протеинурией (в среднем 2,1±1,9 г/сут). Диагноз хронического гуморального отторжения ставился в случах выявления морфологических признаков ТГ и хотя бы одного из следующих условий: свечение C4d-фрагмента комплемента на ПТК и выявление анти-HLA-антител. Пациенты с изолированной ТГ из исследования были исключены [6].
Средний возраст пациентов составлял 40,6±12,5 лет (М : Ж / 60 : 40%). Большинство из них (n=44) получали 3-компонентную ИСТ, включавшую циклоспорин (n=28) либо такролимус (n=16) в сочетании с кортикостероидами (у всех), микофенолатами (n=41) или азатиоприном (n=3), 2 пациента получали 3-компонентную терапию на базе ингибиторов пролиферативного сигнала (сертикан) и 4 были на 2-компонентной терапии СуА и кортикостероидами (табл. 1).
В зависимости от проводимого лечения была выделена группа исследования, включавшая 24 пациентов, получивших лечение плазмаферезом, внутривенным человеческим иммуноглобулином и ритуксимабом (ПФ+ВВИГ+Рит), контрольную группу составили 26 пациентов, не получавших специфическую терапию.
Гистологическое исследование биоптатов трансплантата почки включало в себя световую микроскопию и иммунофлюоресценцентное исследование на замороженных срезах. При проведении световой микроскопии проводились окраски гематоксилином и эозином, ШИК-реакция и окраска трихромом по Массону. Морфологическая диагностика отторжения проводилась в соответствии с Banff классификацией [3]. Трансплантационная гломерулопатия диагностировалась при выявлении двойных контуров в >10% капиллярных петель хотя бы в одном клубочке (Banff cg1).
Определение C4d выполнялось на замороженных срезах методом непрямой иммунофлюоресценции с использованием FITC-меченых моноклональных антител к C4d-фрагменту комплемента (Quidel Corporation, San Diego, CA). Свечение оценивалось как диффузное в случаях выявления экспрессии более чем в 50% перитубулярных капилляров либо как фокальное при вовлечении в процесс 10-50% ПТК [3].
Всем пациентам выполнялось также определение анти-НЬА-антител I и II класса методом ELISA (у 78% пациентов) либо Luminex (у 50% пациентов). В 28% случаев для определения анти- HLA-антител выполнялись оба метода.
Характеристика пациентов с трансплантационной гломерулопатией
Из 50 пациентов, включенных в исследование, 31 имели все три признака (ТГ+ C4d+ анти-HLA- антитела), что позволило говорить об активном хроническом гуморальном отторжении. У 15 пациентов имело место C4d-негативное хроническое отторжение, еще в 4 случаях нам не удалось выявить анти-HLA-антитела на момент биопсии несмотря на очевидную картину ТГ и диффузное свечение C4d-фрагмента комплемента на ПТК.
Тяжесть ТГ расценивалась как минимальная, умеренная и выраженная в 24, 20 и 6 случаях соответственно. Свечение C4d-фрагмента комплемента на ПТК было диффузным у 26 человек и фокальным - у 9. У 13 пациентов, наряду с ТГ, имелись также признаки острого клеточного отторжения, интерстициального (7 случаев) либо сосудистого (6 случаев). Анти-HLA-антитела были представлены преимущественно II классом, выявлявшимся изолированно у 30 человек и в сочетании с антителами I класса - еще у 12. Лишь в 4 случаях антитела I класса выявлялись изолированно. Клинико-лабораторные и морфологические характеристики пациентов приведены в табл. 1. Как видно из таблицы, эти показатели на момент диагностики отторжения не различались в подгруппах, выделенных в зависимости от проводимого лечения.
Протокол лечения
После верификации диагноза хронического гуморального отторжения все пациенты, получавшие двухкомпонентную ИСТ либо иммуносупрессию на базе циклоспорина или эверолимуса, были переведены на трехкомпонентную терапию, включавшую такролимус, препараты микофено- ловой кислоты и кортикостероиды. В случаях сопутствующего клеточного отторжения, имевшего место у 13 пациентов интерстициального (7 случаев) либо сосудистого (6 случаев) (см. табл. 1) проводилась пульс-терапия метилпреднизолоном по 250-500 мг №3. В последующем 22 пациента исследуемой группы получили комплексное лечение плазмаферезом (№4-6), внутривенным человеческим иммуноглобулином (0,5-1 г/кг) и ритук- симабом (однократно 500 мг). У двух пациентов, имевших C4d-негативное отторжение, проявлявшееся изолированной протеинурией, проводилось лечение только внутривенным человеческим иммуноглобулином в дозе 0,5 мг/кг. Контрольную группу составили 26 пациентов, не получавших специфического антигуморального лечения.
Оценка эффективности лечения проводилась в сравнении с контрольной группой по выживаемости почечных трансплантатов к 2 годам наблюдения с момента диагностики ХОТ, вычисленной методом Каплана-Майера. Функция трансплантата оценивалась по уровню креатинина крови и скорости клубочковой фильтрации (СКФ) по Кокрафту-Голту. Темпы снижения функции трансплантата рассчитывались по изменению СКФ за месяц (СКФ к концу наблюдения - СКФ исходная / длительность наблюдения в месяцах). Относительный риск потери трансплантата оценивался в многофакторной регрессионной модели Кокса.
При статистическом анализе данных использовали «SPSS Statistics 17.0» («SPSS Inc: An IBM Company», США) переменные, имеющие нормальное распределение, описывались как среднее ± среднее квадратичное отклонение. При сравнении средних значений использовали критерий Стьюдента. Для оценки достоверности различий качественных признаков применялся точный критерий Фишера и χ2 -критерий. Для переменных с распределением, отличным от нормального, вычислялись медиана и интерквартильный размах. Для сравнения этих переменных использовались критерии Манна-Уитни и Краскела-Уолиса. Нулевую статистическую гипотезу об отсутствии различий и связей отвергали при p<0,05.
РЕЗУЛЬТАТЫ
В целом выживаемость трансплантатов при хроническом отторжении оказалась низкой, составляя 41,2% к трем годам после верификации диагноза, причем этот показатель значимо не различался в зависимости от характера свечения C4d и признаков сопутствующего острого клеточного отторжения, которое наблюдалось у 13 пациентов [в 7 случаях - интерстициальное (Banff 1 a-b) и в 6 - сосудистое (Banff 2a)] (рис.1).
Таблица 1
Клинико-лабораторные и морфологические характеристики пациентов на момент диагностики отторжения
Показатель | Всего (n=50) | ПФ/IВВИГ/Рит (n=24) | Контроль(n=26) | р |
|---|---|---|---|---|
Возраст (среднее+SD, годы) | 40,6±12,5 | 42,7±12,0 | 38,7±12,9 | NS |
Срок после АТП (среднее ±SD, мес) | 81,4±51,8 | 82,6±67,5 | 80,4±49,1 | NS |
Креатинин крови (среднее ±SD ммоль/л) | 0,21±0,08 | 0,2±0,06 | 0,2±0,09 | NS |
СКФ (среднее ±SD, мл/мин) | 43,1±18,3 | 41,2±14,6 | 44,9±21,3 | NS |
Протеинурия (среднее ±SD, г/сут) | 2,07±1,9 | 2,6±2,1 | 1,7±1,7 | NS |
Антиi-HLA-антитела |
|
|
|
|
I класса | 4 (8) | 2 (8) | 2 (8) |
|
II класса | 30 (60) | 16(67) | 14 (54) | NS |
I+II класса | 12 (24) | 5 (21) | 7 (27) |
|
Негативно | 4 (8) | 1 (4) | 3 (11) |
|
Выраженность ТГ (cg) |
|
|
|
|
1 | 24 (48) | 12 (50) | 12 (46) |
|
2 | 20 (40) | 8 (33) | 12 (46) |
|
3 | 6 (12) | 4 (17) | 2 (8) |
|
(Banff score) | 1,6±0,7 | 1,7±0,8 | 1,6±0,6 | NS |
C4d на ПТК, n (%) |
|
|
|
|
негативно | 15 (30) | 6 (25) | 9 (35%) |
|
фокально | 9 (18) | 3 (13) | 6 (23%) | NS |
диффузно | 26 (52) | 15 (62) | 11(42%) |
|
Перитубуллярит (ptc) |
|
|
|
|
0 | 19 (38) | 8 (33) | 11 (42) |
|
1 | 19 (38) | 11 (46) | 8 (31) | NS |
2 | 9 (18) | 4 (17) | 5 (19) |
|
3 | 3 (6) | 1 (4) | 2 (8) |
|
(Banff score) | 0,92±0,9 | 0,92±0,9 | 0,92±1,0 |
|
Гломерулит |
|
|
|
|
0 | 8 (16) | 3 (13) | 5 (19) |
|
1 | 25 (50) | 13 (54) | 12 (46) |
|
2 | 10 (20) | 6 (25) | 4 (16) | NS |
3 | 7 (14) | 2 (8) | 5 (19) |
|
(Banff score) | 1,32±0,9 | 1,29±0,8 | 1,35±1,0 |
|
Интимальный артерии, n (%) |
|
|
|
|
0 | 44 (88) | 22 (92%) | 22 (85) |
|
1 | 6 (12) | 2 (8%) | 4 (15) | NS |
2 | 0 | 0 | 0 |
|
3 | 0 | 0 | 0 |
|
Тубулит |
|
|
|
|
0 | 26 (52) | 16 (67) | 10 (39) |
|
1 | 13 (26) | 4 (16) | 9 (34) |
|
2 | 9 (18) | 3 (13) | 6 (23) | NS |
3 | 2 (4) | 1 (4) | 1 (4) |
|
| 0,74±0,9 | 0,54±0,9 | 0,92±0,9 |
|
Гломерулосклероз, s (%) | 22,4±25,3 | 14,8±20,1 | 28,8±27,6 | 0,05 |
Интерстициальный фиброз (%) | 25,6±18,3 | 23,8±14,9 | 27,4±21,2 |
|
(Banff score) | 1,54±0,9 | 1,54±0,8 | 1,54±0,9 | NS |
Примечание. NS - различия недостоверны.
За время наблюдения в группе в целом отмечалось прогрессирующее снижение функции трансплантата: СКФ снизилась с 43,1±18,3 мл/ мин на момент верификации диагноза до 33,6±18,9 мл/ мин к концу исследования.
На момент постановки диагноза СКФ в исследуемой и контрольной группах не различалась (44,9 ± 21,3 и 41,2 ± 14,6 мл/мин, р =0,47) и последующее снижение функции трансплантата также отмечалось в обеих группах. Тем не менее, темпы снижения СКФ были значительно ниже в группе получавших лечение по сравнению с контролем: -0,47 ± 0,6 и -1,31 ± 1,6 мл/мин/мес соответственно (р = 0,02) (рис. 2).
В целом на протяжении всего периода наблюдения было отмечено 22 потери почечного трансплантата, 15 из них были в группе контроля и 7 - в исследуемой группе. Таким образом, 3-летняя выживаемость трансплантатов составила 21,3 и 64,8% у пациентов, получавших лечение (р=0,01).

Рис. 1. Выживаемость трансплантатов в зависимости от характера свечения C4d (А) и признаков сопутствующего острого клеточного отторжения (В).
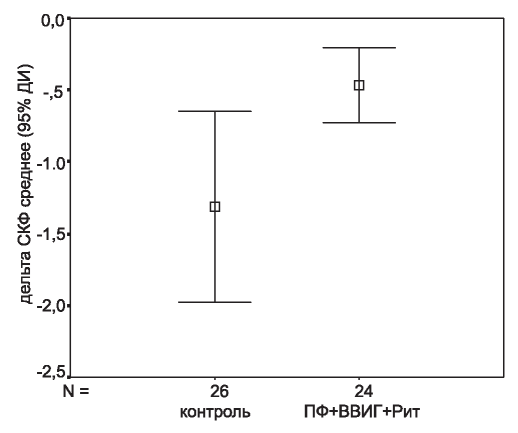
Рис. 2. Темпы снижения СКФ, оцененные как (СКФконечн- СКФисх)/ длительность наблюдения (мес).
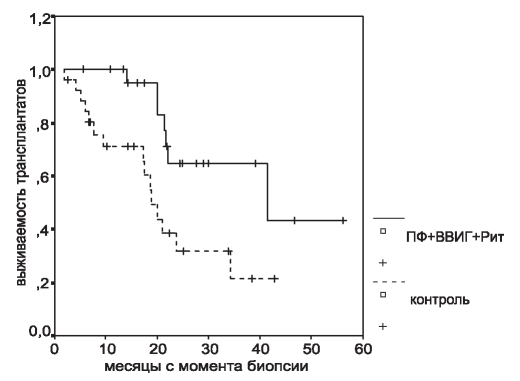
Рис. 3. Выживаемость трансплантатов в зависимости от проводимого лечения.
При оценке прогностического значения отдельных клинико-лабораторных и морфологических факторов в многофакторной регрессионной модели Кокса оказалось, что самостоятельное влияние на прогноз нефропатии оказывали лишь выраженность выраженность дисфункции на момент постановки диагноза и характер проводимого лечения (табл. 2).
Среди побочных эффектов терапии преобладали инфекционные осложнения, отмечавшиеся у 8 пациентов из 24 (33%), в том числе бактериальные либо вирусные пневмонии, имевшие место у 6 человек. В контрольной группе инфекционные осложнения отмечались реже (16%), однако эти различия не достигали статистической значимости (р=0,06). Неинфекционные осложнения проводимого лечения включали в себя аллергические реакции на свежезамороженную плазму (у 3 человек) и изменения со стороны системы крови (анемия, лейкопения), отмечавшиеся у 2 человек. В целом частота побочных эффектов составила 33% в исследуемой группе, тогда как в группе контроля этот показатель составил 16% (p<0,05).
ОБСУЖДЕНИЕ
Исследования последних лет показали, что трансплантационная гломерулопатия является наиболее часто встречающимся вариантом хронического гуморального отторжения и характеризуется плохим прогнозом с быстрым прогрессированием до терминальной ХПН.
Наши данные о выживаемости трансплантатов при ХТГ согласуются с существующими представлениями о течении данной патологии, так 2-летняя выживаемость составила лишь 42,9%. Этот показатель оказался несколько более низким, чем было представлено J.M. Gloor и соавт. [16], описавшими естественное течение ТГ на материале 55 пациентов с этой патологией, может объясняться меньшей тяжестью исходного повреждения за счет преобладания субклинических форм. В других же исследованиях, включавших клинически манифестные случаи ТГ, выживаемость трансплантатов оказалась столь же низкой, как и в нашем наблюдении, и не превышала 50% к 2 годам наблюдения [15,17]. В целом же особенности течения этой патологии могут в значительной степени различаться за счет гетерогенности морфологической картины.
Таблица 2
Прогностическое значение отдельных клинико-лабораторных и морфологических факторов в многофакторной модели Кокса, морфологических факторов в многофакторной модели Кокса
Показатель | P | ОШ | 95,0% ДИ | |
|---|---|---|---|---|
min | max | |||
Лечение | 0,002 | 0,106 | 0,026 | 0,439 |
ТГ | 0,398 | 0,644 | 0,232 | 10,787 |
ИФ (%) | 0,263 | 10,020 | 0,985 | 10,056 |
ГС (%) | 0,120 | 0,972 | 0,937 | 10,008 |
C4D | 0,765 | 0,899 | 0,446 | 10,811 |
Возраст | 0,789 | 10,007 | 0,955 | 10,062 |
Срок после АТП | 0,749 | 10,002 | 0,990 | 10,015 |
Клеточный компонент | 0,270 | 10,552 | 0,711 | 30,389 |
Протеинурия | 0,557 | 10,095 | 0,809 | 10,482 |
СКФ | 0,010 | 0,947 | 0,909 | 0,987 |
Примечание. ТГ - выраженность трансплантационной гломе- рулопатии (степень); ИФ - распространенность интерстициального фиброза (%); ГС - выраженность гломерулосклероза (% полностью склерозированных клубочков); C4D - наличие и характер свечения C4D; ДИ - доверительный интервал; ОШ - отношение шансов.
Несмотря на четко определенные морфологические критерии диагноза, морфологическая картина при ХОТ может существенно различаться в зависимости как от стадии самой ТГ, так и от распространенности интерстициального фиброза, от присутствия и характера свечения C4d на ПТК, а также от выраженности сопутствующего клеточного компонента отторжения. Несмотря на то, что эти особенности коррелировали с клиническими проявлениями отторжения, в нашем исследовании не удалось обнаружить ни одного морфологического фактора, оказывающего влияние на течение ТГ и ее отдаленный прогноз. Так, выявление сопутствующего клеточного отторжения, наблюдавшееся у 14 пациентов, потребовало дополнительного лечения высокими дозами кортикостероидов, но в конечном счете не оказало значимого влияния на прогноз нефропатии. Не различалась выживаемость трансплантата и в зависимости от активности процесса, оценивавшейся по характеру экспрессии C4d.
Согласно Banff-классификации, для диагностики гуморального отторжения рассматривается лишь диффузное свечение C4d на ПТК [3], как наиболее тесно коррелирующее с продукцией ДСА и прогнозом нефропатии. Однако эта взаимосвязь была убедительно продемонстрирована прежде всего для случаев острого гуморального отторжения, тогда как в случаях ХОТ C4d в целом выявляется реже и оказывает меньшее влияние на течение заболевания. Так, в исследовании A. Haririan и соавт. не наблюдалось значимых различий в течении отторжения в зависимости от характера свечения [18], другие исследователи отмечают несколько более благоприятный прогноз при фокальном характере экспрессии C4d [19, 20]. В нашем исследовании прогноз ТГ практически не различался в зависимости от характера свечения C4d, что заставило нас рассматривать различные варианты его экспрессии как проявление различных стадий одного и того же процесса, а не как самостоятельные формы отторжения. Таким образом, прогноз ХОТ практически не зависел от особенностей морфологической картины, что требовало сходных подходов к терапии этого заболевания независимо от его стадии и активности процесса.
Существующие представления о возможном лечении гуморального отторжения включают в себя целый комплекс мер, направленных на удаление имеющихся антидонорских антител и на предупреждение их образования в последующем. Наиболее часто с этой целью используются сеансы плазмафереза, человеческий иммуноглобулин и анти- CD20-антитела (ритуксимаб), применяемые в различных комбинациях и режимах. Эта стратегия уже доказала свою эффективность в лечении эпизодов острого гуморального отторжения [710]. Напротив, сформировавшаяся хроническая трансплантационная гломерулопатия отличается резистентностью к проводимой терапии. На сегодняшний день опубликованы результаты лишь нескольких подобных исследований, и результаты их крайне противоречивы. Как правило, речь идет о небольших сериях наблюдений, описывающих частичный эффект от проводимого лечения, приводящего к стабилизации функции трансплантата у части пациентов. Так, по данным Billing, применение комбинированной терапии ВВИГ в дозе 1 г/кг с последующим введением ритуксимаба (325 мг/м2) привело к стабилизации функции трансплантата у 14 из 20 детей с активным ХОТ [12]. Сходную эффективность подобного лечения продемонстрировал и Т. Fehr и соавт. у 4 пациентов взрослого возраста [13]. В другом исследовании было отмечено замедление темпов снижения СКФ в течение 6 мес после лечения ВВИГ и Ритуксимабом у 12 из 18 пациентов с ХОТ в сравнении с динамикой СКФ у этих же пациентов на протяжении 6 месяцев до начала лечения [21, 22]. Большинство авторов, применявших различные методы лечения ХОТ, отмечают эффект от лечения лишь у части пациентов, однако ни в одном из исследованией не удалось достоверно определить факторы, ассоциирующиеся с ответом на лечение. При этом существуют и объективные причины, объясняющие резистентность пациентов с ХОТ к лечению. Так, выраженные структурные изменения стенок капилляров, характерные для поздней стадии ХОТ и проявляющиеся клинически массивной протеинурией, прогрессируют в направлении терминальной ХПН даже в отсутствие иммунологической активности [21, 22]. С другой стороны - преобладание В-клеток памяти и плазматических клеток у взрослых в сравнении с детьми делает их менее восприимчивыми к лечению ритуксимабом [23].
Несмотря на то, что большинство авторов склоняются к целесообразности антигуморального лечения при ХОТ, в отсутствие контрольной группы оценить истинную эффективность такого лечения в представленных исследованиях представляется затруднительным, поскольку естественное течение ТГ может характеризоваться чередованием периодов прогрессирования с периодами относительной стабилизации процесса.
В пользу такого предположения говорят и данные недавно опубликованного исследования Bachelet и соавт., не продемонстрировавшее значимых различий в 2-летней выживаемости между пациентами, получавшими терапию ВВИГ и ритуксимабом по сравнению с контрольной группой (47 и 40% соответственно, р=0,69) [16]. Наше исследование имело сходный дизайн исследования и схожие клинико-морфологические характеристики пациентов, напротив продемонстрировало различия в выживаемости между группами - 64,8 и 21,3% (р = 0,01). Одним из возможных объяснений может быть включение в протокол лечения сеансов плазмафереза, которые позволяют быстро вывести уже имеющиеся антидонорские антитела и потенциируют эффект ВВИГ. Несмотря на то, что использование плазмафереза по Cedars-Sinai Medical Center протоколу [7] плазмафереза считается необходимым лишь в случаях, когда картина гуморального отторжения сопровождается признаками тромботической микроангиопатии, исследования Lefaucheur и соавт. показали преимущество протоколов лечения гуморального отторжения, включавших плазмаферез с применением только ВВИГ и ритуксимаба [24].
Интересно, что критическим сроком в лечении ХОТ представляется двухлетний период: так в 3 случаях из 4 потеря трансплантата в исследуемой группе произошла в период от 20 до 22 мес с момента начала лечения. Это наблюдение позволяет предположить, что двухлетний период наблюдения является недостаточным для точной оценки эффективности лечения хронического гуморального отторжения.
ЗАКЛЮЧЕНИЕ
Наше исследование показало, что трансплантационная гломерулопатия, будучи наиболее частым вариантом хронического гуморального отторжения, характеризуется неблагоприятным прогнозом, который мало зависит от особенностей морфологической картины и активности процесса на момент постановки диагноза. Комплексное лечение, включающее сеансы плазмафереза, внутривенный человеческий иммуноглобулин и ритуксимаб, позволяет замедлить темпы прогрессирования хронического отторжения по крайней мере у части пациентов с хроническим гуморальным отторжением, выявленным в поздние сроки после АТП.
Список литературы
1. Colvin RB et al. Diagnostic Pathology: Kidney Diseases. Amirsys; Salt Lake City: 2011
2. Colvin RB, Nickeleit V. Heptinstall’s Pathology of the Kidney. Jennette JC, Olson JL, Schwartz MM, Silva FG editors. Vol. 2. Lippincott-Raven; Philadelphia: 2006. Р.1347-1490
3. Racusen LC, Colvin RB, Solez K et al. Antibody-mediated rejection criteria – an addition to the Banff 97 classification of renal allograft rejection. Am J Transplant 2003; 3: 708–714
4. Sis B, Mengel M, Haas M et al. Banff ‘09 meeting report: antibody mediated graft deterioration and implementation of Banff working groups. Am J Transplant 2010;10(3):464-471
5. Gloor J, Cosio F, Lager DJ et al. The spectrum of antibodymediated renal allograft injury: Implications for treatment. Am J Transplant 2008; 8: 1367–1373
6. Sis B, Campbell PM, Mueller T et al Transplant glomerulopathy, late antibody-mediated rejection and the ABCD tetrad in kidney allograft biopsies for cause. Am J Transplant 2007 Jul;7(7):1743-1752
7. Jordan SC, Quartel AW, Czer LS et al. Posttransplant therapy using high-dose human immunoglobulin (intravenous gammaglobulin) to control acute humoral rejection in renal and cardiac allograft recipients and potential mechanism of action. Transplantation 1998 Sep 27;66(6):800-805
8. Everly MJ, Everly JJ, Arend LJ et al. Reducing De Novo Donor-Specific Antibody Levels during Acute Rejection Diminishes Renal Allograft Loss. American Journal of Transplantation 2009; 9(5): 1063–1071
9. Montgomery RA, Zachary AA, Racusen LC et al. Plasmapheresis and intravenous immune globulin provides effective rescue therapy for refractory humoral rejection and allows kidneys to be successfully transplanted into cross-match-positive recipients. Transplantation 2000 Sep 27;70(6):887-895
10. Rocha PN, Butterly DW, Greenberg A et al. Beneficial effect of plasmapheresis and intravenous immunoglobulin on renal allograft survival of patients with acute humoral rejection. Transplantation 2003; 75: 1490–1495
11. Smith RN, Malik F, Goes N et al Partial therapeutic response to Rituximab for the treatment of chronic alloantibody mediated rejection of kidney allografts. Transpl Immunol 2012;27(2-3):107-113. doi: 10.1016/j.trim.2012.08.005. Epub 2012 Aug 30
12. Billing H, Rieger S, Susal C et al. IVIG and rituximab for treatment of chronic antibody-mediated rejection: a prospective study in paediatric renal transplantation with a 2-year follow-up. Transpl Int 2012; 25: 1165
13. Fehr T1, Rusi B, Fischer A et al. Rituximab and intravenous immunoglobulin treatment of chronic antibodymediated kidney allograft rejection. Transplantation 2009 Jun 27;87(12):1837-1841
14. Rostaing L, Guilbeau-Frugier C, Fort M et al. Treatment of symptomatic transplant glomerulopathy with rituximab. Transpl Int 2009; 22: 906
15. Bachelet T, Nodimar C, Taupin J-L. Intravenous immunoglobulins and rituximab therapy for severe transplant glomerulopathy in chronic antibody-mediated rejection: a pilot study. Clin Transpl 2015; 29 (5): 439–446
16. Gloor JM, Sethi S, Stegall MD et al. Transplant glomerulopathy: subclinical incidence and association with alloantibody. Am J Transplant 2007; 7: 2124
17. Kieran N, Wang X, Perkins J et al Combination of Peritubular C4d and Transplant Glomerulopathy Predicts Late Renal Allograft Failure. J Am Soc Nephrol 2009 October; 20(10): 2260–2268
18. Haririan A, Kiangkitiwan B, Kukuruga D et al. The impact of c4d pattern and donor-specific antibody on graft survival in recipients requiring indication renal allograft biopsy. Am J Transplant 2009; 9: 2758
19. Kedainis RL, Koch MJ, Brennan DC et al. Focal C4d+ in renal allografts is associated with the presence of donor-specific antibodies and decreased allograft survival. Am J Transplant 2009; 9: 812–819
20. Kayler LK, Kiss L, Sharma V et al. Acute renal allograft rejection: diagnostic significance of focal peritubular capillary C4d. Transplantation 2008;85(6):813-820
21. Hong YA, Kim HG, Choi SR et al. Effec tiveness of rituximab and intravenous immunoglobulin therapy in renal transplant recipients with chronic active antibody-mediated rejection. Transplant Proc 2012;44:182-184
22. An GH, Yun J, Hong YA. The effect of combination therapy with rituximab and intravenous immunoglobulin on the progression of chronic antibody mediated rejection in renal transplant recipients. J Immunol Res 2014;2014:828732. doi: 10.1155/2014/828732. Epub 2014 Jan 29
23. Zarkhin V, Lovelace PA, Li L et al. Phenotypic evaluation of B-cell subsets after rituximab for treatment of acute renal allograft rejection in pediatric recipients. Transplantation 2011;91(9):1010–1018
24. Lefaucheur C, Nochy D, Andrade J et al. Comparison of Combination Plasmapheresis/IVIg/Anti-CD20 Versus HighDose IVIg in the Treatment of Antibody-Mediated Rejection. Am J Transplant 2009; 9 (5): 1099-1107
Об авторах
Е. С. СтоляревичРоссия
Столяревич Екатерина Сергеевна, доктор медицинских наук
123182, Москва, Щукинская ул., д. 1.
Л. Ю. Артюхина
Россия
Артюхина Людмила Юрьевна
123182, Москва, ул. Пехотная, д. 3.
Е. С. Иванова
Россия
Иванова Екатерина Сергеевна
123182, Москва, ул. Пехотная, д. 3.
Н. А. Томилина
Россия
Томилина Наталья Аркадьевна, доктор медицинских наук, профессор
123182, Москва, Щукинская ул., д. 1.
Рецензия
Для цитирования:
Столяревич Е.С., Артюхина Л.Ю., Иванова Е.С., Томилина Н.А. ИСПОЛЬЗОВАНИЕ КОМБИНИРОВАННОЙ ТЕРАПИИ ПЛАЗМАФЕРЕЗОМ, ВНУТРИВЕННЫМ ЧЕЛОВЕЧЕСКИМ ИММУНОГЛОБУЛИНОМ И РИТУКСИМАБОМ ДЛЯ ЛЕЧЕНИЯ ХРОНИЧЕСКОГО ОТТОРЖЕНИЯ ТРАНСПЛАНТИРОВАННОЙ ПОЧКИ. Нефрология. 2016;20(6):67-74.
For citation:
Stolyarevich E.S., Artyukhina L.Yu., Ivanova E.S., Tomilina N.A. USE OF COMBINED THERAPY BY PLASMAPHERESIS, HUMAN INTRAVENOUS IMMUNOGLOBULIN AND RITUXIMAB FOR CHRONIC RENAL ALLOGRAFT REJECTION. Nephrology (Saint-Petersburg). 2016;20(6):67-74. (In Russ.)








































