Перейти к:
ПОСЛЕРОДОВОЙ АТИПИЧНЫЙ ГЕМОЛИТИКО-УРЕМИЧЕСКИЙ СИНДРОМ. КЛИНИЧЕСКИЕ НАБЛЮДЕНИЯ И ГИСТОЛОГИЧЕСКИЕ ОСОБЕННОСТИ
https://doi.org/10.24884/1561-6274-2017-2-98-106
Аннотация
Описаны два клинических наблюдения атипичного гемолитико-уремического синдрома (аГУС) у пациенток во II и III триместрах беременностей. Представленные случаи характеризуют тяжелое течение аГУСа, которые, несмотря на своевременную диагностику, раннее начало терапии, имели неблагоприятный клинический исход. Впервые в отечественной литературе описаны морфологические изменения ткани почек по результатам гистологического исследования аутопсийного материала, полученного у пациенток с аГУС.
Ключевые слова
Для цитирования:
Руденко Л.И., Батюшин М.М., Мационис А.Э., Каминский М.Ю., Резникова Г.П., Макаренко Ю.М. ПОСЛЕРОДОВОЙ АТИПИЧНЫЙ ГЕМОЛИТИКО-УРЕМИЧЕСКИЙ СИНДРОМ. КЛИНИЧЕСКИЕ НАБЛЮДЕНИЯ И ГИСТОЛОГИЧЕСКИЕ ОСОБЕННОСТИ. Нефрология. 2017;21(2):98-106. https://doi.org/10.24884/1561-6274-2017-2-98-106
For citation:
Rudenko L.I., Batiushin M.M., Matcionis A.E., Kaminskii M.Yu., Reznikova G.L., Makarenko Yu.M. POSTPARTUM ATYPICAL HEMOLYTIC UREMIC SYNDROME. CLINICAL OBSERVATIONS AND HISTOLOGICAL FEATURES. Nephrology (Saint-Petersburg). 2017;21(2):98-106. (In Russ.) https://doi.org/10.24884/1561-6274-2017-2-98-106
ВСТУПЛЕНИЕ
Атипичный гемолитико-уремический синдром (аГУС) - это редкое жизнеугрожающее заболевание, характеризующееся микроангиопатической гемолитической анемией, тромбоцитопенией и острым почечным повреждением, не связанным с инфицированием кишечной палочкой. На долю аГУС приходится до 10% всех случаев гемолитико-уремического синдрома [1]. аГУС у беременных женщин и пациенток в послеродовом периоде (так называемый «беременность- ассоциированный» или «акушерский» аГУС) регистрируются в 10-15% всех случаев аГУС [2] и связан с неблагоприятным клиническим прогнозом [3].
аГУС относится к группе тромботических микроангиопатий (ТМА), для которых характерно повреждение эндотелия сосудов микроциркуляторного русла с генерализованным тромбообразованием, что приводит к ишемии внутренних органов. В основе развития аГУСа лежит нерегулируемая активация альтернативного пути комплемента, обусловленная мутацией генов complement factor H (CFH), complement factor I (CFI), membrane cofactor protein (MCP) или complement С3 [4].
Почки особенно уязвимы к комплементопосредованному воспалительному повреждению, происходящему в результате отложения циркулирующих фрагментов комплемента вдоль клубочковых капилляров и на эндотелии артериол и влияния местных факторов воспаления. Кроме того, помимо почечных проявлений аГУС, у пациентов развиваются экстраренальные признаки заболевания, включая вовлечение дыхательной, сердечно-сосудистой, центральной нервной системы, желудочно-кишечного тракта и др. [5] По- лиорганное поражение обусловлено утолщением артериол и капилляров с отеком и отслоением эндотелия, субэндотелиальным накоплением белков и клеток [6].
Помимо аГУС, к числу ТМА также относится типичный ГУС, связанный с Шига-токсин продуцирующей Escherichia сoli, тромботическая тромбоцитопеническая пурпура (ТТП), обусловленная дефицитом ADAMTS-13, HELLP-синдромом, являющимися тяжелым осложнением гестоза.
Длительное время основным методом лечения являлась плазмотерапия, позволяющая вводить нормальные CFH, CFI, C3 и др., на сегодняшний день перспективным является введение человеческих моноклональных антител к С5-комплимента [7].
Приводим клинические наблюдения развития аГУС у двух пациенток в послеродовом периоде, завершившиеся их гибелью.
Клинический случай 1.
Пациентка П., 30 лет, поступила 4 июля 2014 года в МБУЗ ГБСМП №2 г. Ростова-на-Дону. В анамнезе - нейросенсорная тугоухость, артериальная гипертензия, тубулоинтерстициальный нефрит, ранее при первой беременности гибель младенца от асфиксии на 3-и сутки после самостоятельных преждевременных родов в сроке 35 нед.
При настоящей беременности в сроке 21 нед появилась угроза прерывания беременности, выявлено многоводие, плацентарная недостаточность, тяжелый гипертензионный синдром, сочетанный гестоз 2-й половины беременности тяжелой степени. В сроке 33 нед беременности в связи с развившимся острым почечным повреждением 3 июля 2014 года пациентке выполнено кесарево сечение в нижнем маточном сегменте.
Объективно на момент поступления: пациентка активных жалоб не предъявляла, находилась в ясном сознании, контакт затруднен в связи с нейросенсорной тугоухостью. При осмотре кожные покровы бледные, периферических отеков нет, артериальное давление (АД) 190/100 мм рт. ст., со стороны органов дыхания, желудочнокишечного тракта без патологических изменений, снижен темп диуреза до 20 мл/ч. Лабораторно - в общем анализе крови (ОАК) лейкоцитоз (лейкоциты 20*109/л, палочко-ядерный сдвиг до 29%), анемия (эритроциты 2,5*1012/л, гемоглобин 81 г/л), тромбоцитопения (тромбоциты 48*109/л); по данным биохимического исследования крови азотемия (мочевина - 20,6 ммоль/л, креатинин - 338 мкмоль/л), гипопротеинемия (общий белок 45 г/л), АСТ 67 ЕД/л, АЛТ 34 ЕД/л; в коагулограмме - нормокоагуляция; по данным общего анализа мочи (ОАМ) - протеинурия до 1 г/л, эритро- цитурия до 10 в поле зрения. Инструментально: при ультразвуковом исследовании (УЗИ) органов брюшной полости (ОБП) и забрюшинного пространства паренхима почек до 20 мм, повышенной эхогенности; при эхокардиографии (ЭхоКГ) - перикардит, определяется до 200 мл жидкости в перикарде; при рентгенографии органов грудной клетки (ОГК) - патологии не выявлено.
За первые сутки на фоне проводимой инфузионной терапии кристаллоидными растворами, 10% альбумином, без стимуляции салуретиками диурез увеличился и составил 3300 мл. Также пациентке проводилась антибактериальная, гипотензивная, седативная терапия, выполнялись трансфузии тромбоцитарного концентрата, свежезамороженной плазмы, эритроцитсодержащие среды. Отмечалась положительная динамика в виде тенденции к нормализации артериального давления (140/90 мм рт. ст.), в биохимических анализах крови - уменьшение азотемии, увеличение уровня общего белка, однако, по данным ОАК, отмечалось прогрессирование анемии - гемоглобин до 66 г/л, при этом развитие гемолиза, формирование патологические форм эритроцитов не было обнаружено.
Через двое суток после поступления 6 июля 2014 года пациентка предъявляла жалобы на резко выраженное головокружение, развивается гипертонический криз с подъемом АД до 205/110 мм рт. ст., происходит угнетение сознания, вплоть до комы с нарушением дыхания, что требует проведения респираторной поддержки, регистрируется анизокория D<S.
При компьютерной томографии (КТ) головного мозга в левой височной области определяется гиподенсивная зона размером 22*5 мм и подобная зона 9*14*6 мм в мосту слева - выявлено острое нарушение мозгового кровообращения (ОНМК) по ишемическому типу в вертебробазилярном бассейне левой средней мозговой артерии (СМА). По результатам экстракраниальной допплерографии (ЭКДГ) определяется выраженный ангиоспазм артерий головного мозга на фоне компрессии обеих позвоночных артерий в канале поперечных отростков шейных позвонков. По лабораторным данным—сохраняется тромбоцитопения, анемия, патологических форм эритроцитов не обнаружено, гемолиза нет; определен уровень лактатдегидргеназы (ЛДГ), составляющий 620,5 ЕД/л. 7 июля 2014 года консилиум предполагает наличие у пациентки тромботической микроангиопатии (ТМА), аГУС.
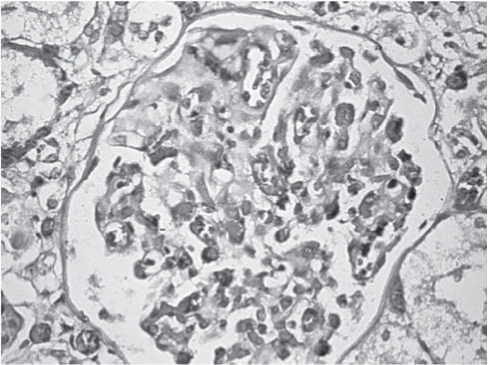
Рис. 1. Почка. Клубочек увеличен, капилляры растянуты клетками крови и тромбами, в капиллярах клубочка некроз эндотелия сосудов. Окраска гематоксилином и эозином. Ув. 400.
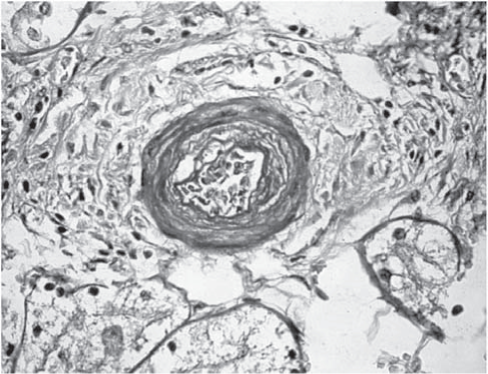
Рис. 2. Почка. Просвет междольковой артерии частично закрыт. Утолщение стенки сосуда в большей степени за счет интимы. Окраска гематоксилином и эозином. Ув. 400.
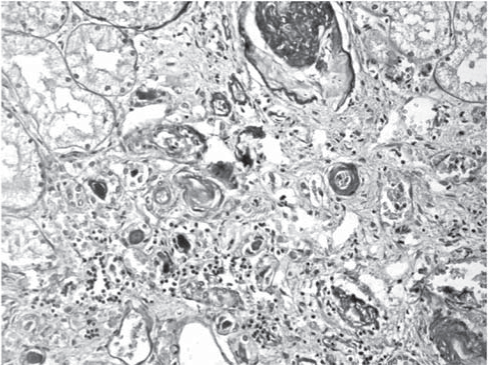
Рис. 3. Почка. Тромбоз капилляров клубочка, тромбы в просвете мелких артерий, ремоделирование стенок артерий с фенестрацией и утолщением интимы, выраженные дистрофические изменения эпителия канальцев. Окраска гематоксилином и эозином. Ув. 200.
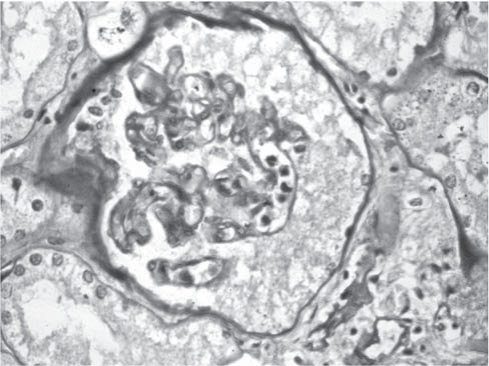
Рис. 4. Почка. Коллапс капиллярных петель клубочка с экссудацией в просвет капсулы. Окраска гематоксилином и эозином. Ув. 600.
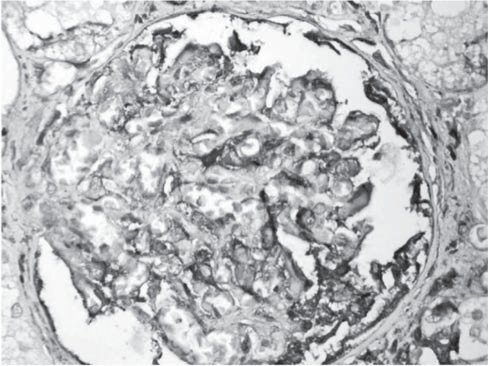
Рис. 5. Почка. Отложение СЗ-комплимента в мезангиуме, эндотелии капилляров и в просвете капсулы Шумляского. Имму- ногистохимическая реакция против СЗ-комплимента. Ув. 400.
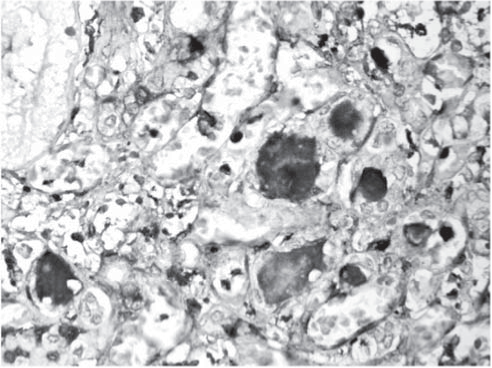
Рис. 6. Почка. Отложение СЗ-комплимента в просвете канальцев. Иммуногистохимическая реакция против СЗ- комплимента. Ув. 400.
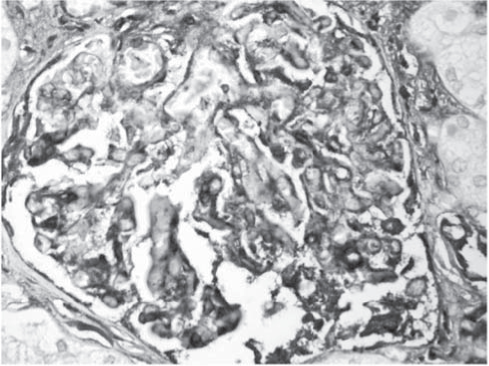
Рис. 7. Почка. Массивные отложения фибриогена в стенке капилляров и мезангиуме. Иммуногистохимическая реакция против фибриногена. Ув. 400.
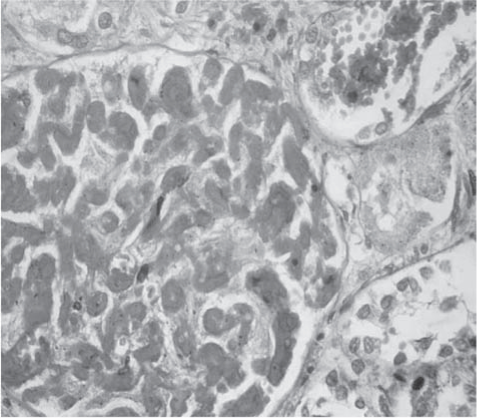
Рис. 8. Почка. В капиллярах клубочка тотальный некроз эндотелия сосудов и 100% тромбоз их просветов. В прилегающей строме кровоизлияния, почечный каналец с тотальным некрозом эпителия. Окраска гематоксилином и эозином. Ув. 400.
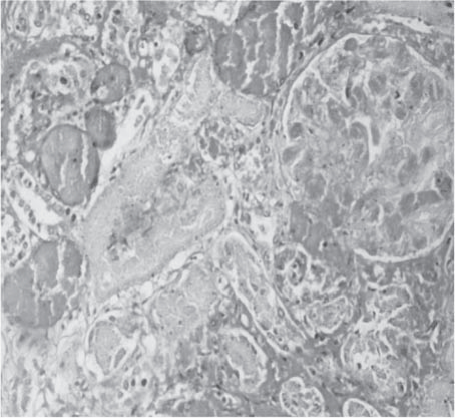
Рис. 9. Почка. В сосудах микроциркуляторного русла стромы обтурирующая тромботическая микроангиопатия. В капиллярах клубочков тотальный некроз эндотелия и диффузный тромбоз их просветов. В строме кровоизлияния. В эпителии канальцевого аппарата субтотальный некроз. Окраска гематоксилином и эозином. Ув. 200.
На фоне проводимой терапии поддерживался адекватный диурез, отмечалась тенденция в снижении показателей азотемии (креатинин 162 мкмоль/л), улучшались параметры гемоглобина 92 г/л и эритроцитов, увеличивалось количество тромбоцитов до 156*109/л (на фоне трансфузии компонентов крови). Однако сохранялось нарушение сознания на уровне комы 2 (4-5 баллов по шкале ком Глазго), стал нарастать уровень ЛДГ до 1020,5 ЕД/л. По данным магнитнорезонансной томографии (МРТ) головного мозга, выполненной 9 июля 2014 года, патологические изменения вещества головного мозга не выявлены. Предположено, что определенный вклад в развитии коматозного состояния у данной пациентки принадлежит проводимой терапией магнезией (магний 0,72-1,2 мкмоль/л) либо тяжелым течением гестоза, и 10 июля 2014 года принято решение о проведении продленной вено-венозной гемодиафильтрации (ПВВГДФ).
На фоне проведения заместительной почечной терапии (ЗПТ) отмечается положительная динамика со стороны сознания пациентки - оглушение сознания (13-14 баллов по шкале ком Глазго). Однако в связи с периодически появляющимися тонико-клоническими судорогами было принято решение о необходимости проведения глубокой седации. Учитывая анамнез заболевания, ОПП, наличие тромбоцитопении, анемии, повышенного уровня ЛДГ, предположенное развитие у больной ТМА с поражением почек и головного мозга, помимо антигипертензивной, антибактерильной терапии, медикаментозной седации, искусственной вентиляции легких (ИВЛ) и ЗПТ, проводятся ежедневные трансфузии свежезамороженной плазмы.
16 июля 2014 года продолжается ИВЛ, вне се- дации уровень сознания - сопор (12 баллов по шкале ком Глазго), сохраняется судорожный синдром, тем не менее, гемодинамически пациентка стабильна, диурез адекватен водной нагрузке. Лабораторно отмечалась положительная динамика в виде некоторого повышения уровня эритроцитов (эритроциты 2,63*1012/л), существенного увеличения уровня тромбоцитов (тромбоциты 200*109/л). По данным коагулограммы - повышение маркеров тромбинемии (РФМК - 6 мкг/л, D-dimer - 1252 нг/мл) и значительное снижение антитромбина III - 28%.
По данным биохимического исследования крови по-прежнему сохранялся высоким уровень ЛДГ - 860 ЕД/л, креатинин - 216 мкмоль/л, С-реактивный белок - 115,6 мг/л. Тогда же получены результаты исследования уровня антител к фактору Н, составляющие 102% от уровня антител к фактору Н в контрольной сыворотке, и активности металлопротеиназы ADAMTS-13 в плазме пациентки - 25% от уровня активности ADAMTS-13 в контрольной плазме, по данным генетического исследования выявлена генетическая тромбофилия (мутация в генах FGB и PAI-1).
19 июля 2014 года развилась клиническая картина кишечного кровотечения, в связи с чем выполнены ФГДС, видеоколоноскопия (ВКС). Так как источник кровотечения не удалось установить, пациентке была выполнена лапаротомия, обнаружено кровотечение из дивертикуля Меккеля, выполнена резекция дивертикула, наложен анастомоз. Несмотря на проводимые трансфузионные, гемостатические мероприятия, рецидивируют кровотечения из ЖКТ. При этом у пациентки снизился диурез, появился отечный синдром, стали нарастать показатели азотемии, прогрессировал метаболический ацидоз, что потребовало возобновления ЗПТ.
23 июля 2014 года - рецидив массивного кровотечения из просвета ЖКТ, при ВКС выявлены кровоточащие эрозии в просвете толстой кишки, кровотечение было остановлено эндоскопически.
26 июля 2014 года, рецидив массивного кровотечения, однако источник кровотечения, по данным ФГДС, ВКС, не установлен, в связи с чем экстренно выполнена релапаротомия, произведена резекция подвздошной кишки с анастомозом. Послеоперационный период протекал крайне тяжело с рецидивами кровотечений из ЖКТ, при выполненных ФГДС и ВКС констатировано диффузное эрозивное поражение слизистой оболочки ЖКТ. Продолжены ЗПТ, трансфузия компонентов крови, гемо статическая терапия, однако состояние пациентки ухудшалось: усугублялось нарушение сознания, прогрессировала дыхательная, сердечно-сосудистая и почечная недостаточность, нарастали воспалительные изменения в ОАК.
7 августа 2014 года развилась клиника несостоятельности энтероэнтероанастомоза, по поводу чего пациентка экстренно оперирована, при релапаротомии выявлена несостоятельность анастомоза, диагностирован разлитой каловый перитонит, толстокишечное кровотечение, выполнены правосторонняя гемиколэктомия, илеостомия. Состояние пациентки прогрессивно ухудшалось, на фоне рецидивирующих кровотечений, прогрессирования септического процесса и полиорганной недостаточности 9 августа 2014 года констатирована смерть.
Анализ гистологического материала позволил выявить наличие ТМА, для которой характерны отек и отслойка эндотелия сосудов, увеличение субэндотелиального пространства с формированием в нем аморфного материала и окклюзией просвета сосудов тромбами, содержащими тромбоциты и фибрин (рис. 1-6).
В капиллярах клубочков множественные зоны повреждения эндотелия в виде отека эндотелия, множественные тромбы и сладжи эритроцитов. В прилегающей строме кровоизлияния, почечные канальцы с выраженными дистрофическими изменения, зонами некрозов.
Клинический случай 2.
Пациентка К., 35 лет, поступила 11 февраля 2016 года в АРО ГБУ РО ОКБ №2.
В анамнезе - одни роды в срок, данная беременность протекала на фоне гестоза с повышением АД до 140/100 мм рт. ст.
2 февраля 2016 года в сроке 28 нед беременности пациентка была доставлена скорой помощью по месту жительства с жалобами на кровянистые выделения из половых путей (продолжающиеся около 50 мин), головную боль, повышение АД до 140/100 мм рт. ст., отеки нижних конечностей (в течение последней недели). Учитывая данные осмотра, продолжающееся кровотечение, наличие признаков нежизнеспособности плода, консилиумом было принято решение об экстренном родоразрешении путем выполнения кесарева сечения. Интраоперационно отмечался подъем АД до 200/100 мм рт. ст., кровопотеря до 2000 мл, зарегистрирована тотальная отслойка плаценты, антенатальная гибель плода. За время наблюдения состояние пациентки ухудшалось, расценивалось как крайне тяжелое, отмечалась анурия, нарастали водно-электролитные нарушения, дыхательная недостаточность, появились признаки отека мозга.
Пациентка была консультирована по линии санитарной авиации врачами ГБУ РО ОКБ №2, транспортирована в МБУЗ ГБСМП №2 для проведения заместительной почечной терапии. На момент осмотра состояние пациентки крайне тяжелое, уровень сознания без медицинской седации - оглушение. Отмечалась кровоточивость в постинъекционных местах. Тоны сердца ритмичные, приглушены, АД до 160/100 мм рт. ст., тахикардия - частота сердечных сокращений (ЧСС 100 ударов в 1 мин). Самостоятельное дыхание неэффективно, проводилась респираторная поддержка. Живот при пальпации вздут, перистальтика не выслушивалась. Мочеотделение по уретральном катетеру, сохранялась анурия. Лабораторно при поступлении в ОАК лейкоцитоз (лейкоциты 24,6*109/л, сегментоядерный сдвиг до 90%), анемия (эритроциты 2,9*1012/л, гемоглобин 83 г/л), тромбоцитопения (тромбоциты 136*109/л).
3 февраля 2016 года усугубились анемия (эритроциты 2,2*1012/л, гемоглобин 64 г/л), тромбоцитопения (тромбоциты 67*109/л); по данным биохимии крови азотемия (мочевина - 11,8 ммоль/л, креатинин - 346 мкмоль/л), гипопротеинемия (общий белок 49 г/л), повышение уровня печеночных ферментов (АСТ 329 ЕД/л, АЛТ 173 ЕД/л), резкое увеличение ЛДГ до 11360 ЕД/л.
Пациентке проводилась заместительная почечная терапия в объеме вено-венозной гемодиафильтрации, за весь период лечения пациентке было выполнено шесть операций гемодиафильтрации, по 24 ч каждая с объемом замещения от 50 до 70 л/сут.
4 февраля 2016 года лабораторно отмечалась положительная динамика в виде нарастания числа эритроцитов до 3,52*1012/л, увеличения гемоглобина до 96 г/л, тромбоцитов до 163*109/л; по данным биохимии крови нормализация уровня мочевины - 3,5 ммоль/л, креатинин - 109 мкмоль/л, тенденция к снижению уровня печеночных ферментов (АСТ 222 ЕД/л, АЛТ 149 ЕД/л), ЛДГ 7530 ЕД/л). Было отмечено незначительное снижение активности металлопротеиназы ADAMTS-13 - 54%.
4 февраля 2016 года консилиумом совместно с ФГБУ «НИИ акушерства, гинекологии и пери- натологии им. В.И. Кулакова» был установлен аГУС. 11 февраля 2016 года больная переведена в ГБУ PO ОКБ №2 для дальнейшего лечения, в ОАК выявлена анемия (гемоглобин 77 г/л, эритроциты - 2,92*1012/л), лейкоцитоз (лейкоциты 13,4*109/л), в ОАМ протеинурия до 1 г/л, гематурия - 30-40 эритроцитов в поле зрения. В стационаре больной была продолжена ЗПТ, усилена антибактериальная терапия (меропенем, ванкомицин, метро- низадол), гормонотерапия, проводилась терапия экулизумабом (солирис, введение 08.02.2016 г.) в дозе 900 мг.
11 февраля 2016 года в 14.00 началось обильное маточное кровотечение, в экстренном порядке произведены нижнесрединная релапаротомия, экстирпация матки с маточными трубами, перевязка внутренних подвздошных артерий, дренирование брюшной полости, проведена аутотрансфузия крови.
11 февраля 2016 года в 18.15 больная доставлена в палату АРО, состояние крайне тяжелое, тяжесть состояния была обусловлена сроками и объемом оперативного вмешательства, нестабильностью кардиогемодинамики, в послеоперационном периоде состояние больной крайне тяжелое с отрицательной динамикой, нарастали явления кардиореспираторной недостаточности.
11 февраля 2016 года в 23.35 произошли остановка сердечной деятельности, тотальная атония и арефлексия. Начаты реанимационные мероприятия в полном объеме в течение 40 мин, положительного результата не дали - сердечная деятельность во время проведения реанимационных мероприятий не восстановилась. 12 февраля 2016 года в 00.15 констатирована биологическая смерть.
При гистологическом исследовании аутопсийного материала в сосудах внутренних органов отмечаются признаки ТМА, обусловленной отеком эндотелиальных клеток с их отслойкой от базальной мембраны, расширением субэндотелиально- го пространства с накоплением в нем аморфного мембраноподобного материала и образованием тромбов, содержащих тромбоциты, фибрин, эритроциты с окклюзией просветов сосудов. В гипофизе был обнаружен субтотальный некроз, тканевой детрит обильно инфильтрирован лейкоцитами. В сосудах микроциркуляторного русла почек множество очагов повреждения эндотелия в виде резкого набухания, очагового некроза и фрагментации. В зонах повреждения эндотелия сосудов обнаружены тромбоцитарные и фибриновые обтурирующие тромбы, пристеночные сладжи эритроцитов в сосудах, в том числе в капиллярах клубочков. В области коры множественные сливные кровоизлияния, обширные некротические изменения. Выявлены некроз многих клубочков, очаговые выраженные периваскулярные кровоизлияния. Небольшая очаговая инфильтрация лимфоцитами и гранулоцитами как в строме, так и в стенках лоханок. Эпителий извитых канальцев местами полностью некротизирован, в эпителии прямых канальцев резкие дистрофические изменения (рис. 8, 9).
ОБСУЖДЕНИЕ
Представленные наблюдения демонстрируют особенности клинической картины «акушерского» аГУС, настороженность врачей в отношении аГУС, о чем свидетельствует быстрая диагностика и старт лечения данного заболевания во втором случае (что говорит о положительной тенденции в накоплении знаний о аГУС и ТМА), тяжесть течения и полиорганные проявления аГУСа, несмотря на активно проводимые лечебные мероприятия, включая плазматерапию в первом случае, плазматерапию и введение экулизумаба на шестые сутки после старта заболевания во втором случае. Развитие анемии, тромбоцитопении, острого почечного повреждения и полиорганной недостаточности требовало проведения дифференциальной диагностики между различными вариантами ТМА. Так, ТТП была исключена, ввиду значений АDAMTS-13 - 25% у первой пациентки и 54% у второй пациентки. Об отсутствии HELLP-синдрома свидетельствовали нормальные значения АСТ и АЛТ в первом клиническом случае, выраженное нарушение функции почек в двух клинических наблюдениях и отсутствие положительной динамики после родоразрешения. Клинико-лабораторные проявления ТМА, некоторое снижение ADAMTS-13 и быстрое развитие ПОН позволило поставить диагноз аГУС в двух клинических наблюдениях.
По данным зарубежных авторов, развитие аГУС в большинстве случаев происходит в послеродовом периоде, что может быть обусловлено удалением плаценты, кровопотерей, воспалением [3]. По результатам исследований Н.Л. Козловской, в 65% случаев аГУС развивался во II-III триместрах, при этом у ряда пациенток были выявлены пусковые механизмы развитием клиники аГУС [8], в предоставленных клинических наблюдениях триггеры установить не удалось.
Гиперактивация альтернативного пути комплемента приводит к диффузному повреждению эндотелия с последующим образованием фибрина и тромбоцитарных микротромбов в сосудах, что ведет к развитию гемолиза, тромбоцитопении и развитию дисфункции внутренних органа (главным образом в виде острого повреждения почек). В большинстве случаев аГУС возникает в послеродовой период, однако появляется все больше информации о развитии аГУСа во II-III триместрах беременности [9]. Различные триггеры, такие как воспаление, система «мать-плацента-плод», преэклампсия, кровотечение и инфекции, могут способствовать нарушению регуляции альтернативного пути активации системы комплемента особенно среди лиц с выявленной мутацией генов регуляторных белков комплимента [10]. Вследствие высокой распространенности генных мутаций [11], всем пациентам рекомендовано выполнение генетических исследований альтернативного пути комплемента для верификации диагноза, однако на данный момент исследования такого рода остаются труднодоступными.
В целом, среди пациентов с аГУС морфологически в ткани почек могут определяться три вида поражения. Эти изменения не являются взаимоисключающими и предполагают гломерулярное повреждение. Наиболее распространены следующие изменения, характеризующиеся утолщением стенок капилляров почечных клубочков, расширением субэндотелиального пространства. При этом происходит отек эндотелиальных клеток с отслоением от базальной мембраны, препятствующий капиллярному кровотоку. Подобные патологические наблюдения обнаруживаются преимущественно в капиллярах клубочков и афферентных артериолах, тогда как в крупных артериях подобные изменения не обнаруживаются.
Иным морфологическим проявлением аГУС является изменение структуры афферентных и эфферентных артериол и междольковых артерий, отек и пролиферация интимы, некроз артериальной стенки, сужение просвета, тромбоз приносящей и выносящей артериол и междольковых артерий, при этом могут быть обнаружены сморщенные клубочки.
Для третьего типа поражения характерно формирование очаговых или диффузных зон некроза коры, обусловленное острой ишемией коркового слоя почек в результате нарушения микроциркуляции.
аГУС - «трудный» диагноз, так как это состояние имеет общие признаки с рядом других заболеваний, которые необходимо исключить при постановке диагноза. ОПП, тромбоцитопения и микроангиопатическая гемолитическая анемия наблюдаются также при тяжелой преэклампсии с HELLP-синдромом, тромботической тромбоцито- пенической пурпуре и ГУС [12]. Некоторые клинические особенности этих различных синдромов схожи, тем не менее различные лабораторные исследования могут помочь клиницисту поставить правильный диагноз [13].
При предположении диагноза аГУС, ввиду тяжести состояния пациентов, необходим быстрый старт проведения плазматерапии, не дожидаясь результатов дополнительных лабораторных исследований, при установлении диагноза аГУС, развитии плазмазависимости необходимо назначение экулизумаба [14, 15], а в ведении такой категории пациентов должны принимать участие различные специалисты. Однако во многих случаях, несмотря на мультидисциплинарный подход, своевременное назначение плазмы и экулизумаба, не происходит улучшения в состоянии пациентов, что требует еще большей настороженности и углубления знаний в механизмах развития, диагностике и лечении аГУС.
Список литературы
1. Antonio FS, Roman J, Wyble A et al. Pregnancy-Associated Atypical Hemolytic-Uremic Syndrome. AJP 2016;6(1):125–128
2. Батюшин ММ. Атипичный гемолитико-уремический синдром при беременности и hellp-синдром. Вопросы дифференциальной диагностики. Клин нефрол 2014;(2-3):46–52 [Batiushin MM. Atypical hemolytic-uremic syndrome in pregnancy and hellp syndrome. Issues of differential diagnosis. Klinicheskaja nefrologija. 2014;(2-3):46–52]
3. Fakhouri F, Roumenina L, Provot F et al. Pregnancy-associated hemolytic uremic syndrome revisited in the era of complement gene mutations. J Am Soc Nephrol 2010;21(5):859–867
4. Waters AM, Licht C. aHUS caused by complement dysregulation: new therapies on the horizon. Pediatr Nephrol 2011;26(1):41–57
5. Campistol JM, Arias M, Ariceta G, et al. An update for atypical haemolytic uraemic syndrome: diagnosis and treatment. A consensus document. Nefrologia 2013;33(1):27–45
6. Nester CM, Thomas CP. Atypical hemolytic uremic syndrome: what is it, how is it diagnosed, and how is it treated? Hematology Am Soc Hematol Educ Program 2012(1):617-25
7. Макарова ТП, Давлетбаева ГР, Поладова ЛВ и др. Опыт приминения экулизумаба у ребенка с атипичным гемолитикоуремическим синдромом. Нефрология 2014;18(3):84–88 [Makarova TP, Davletbaeva GR, Poladova LV i dr. Experience the use of eculizumab in a child with atypical hemolytic-uremic syndrome. Nefrologija. 2014;18(3):84–88]
8. Козловская НЛ, Коротчаева ЮВ, Боброва ЛА, Шилов ЕМ. Акушерский атипичный гемолитико-уремическоий синдром: первый российский опыт диагностики и лечения. Нефрология 2016;20(2):68–80. [Kozlovskaja NL, Korotchaeva JuV, Bobrova LA, Shilov EM. Obstetric atypical hemolytic-urameshi syndrome: the first Russian experience of diagnosis and treatment. Nefrologija. 2016;20(2):68–80]
9. Коротчаева ЮВ, Козловская НЛ, Бондаренко ТВ, Веселова ГА. Особенности течения и лечения «акушерского» атипичного гемолитико-уремического синдрома. Нефрология 2015;19(2):76–81. [Korotchaeva JuV, Kozlovskaja NL, Bondarenko TV, Veselova GA. Peculiarities of course and treatment of «obstetric» atypical hemolytic-uremic syndrome. Nefrologija. 2015;19(2):76–81]
10. Tsai HM. A Mechanistic Approach to the Diagnosis and Management of Atypical Hemolytic Uremic Syndrome Transfusion. Med Reviews 2014;28:187–97
11. Caprioli J, Noris M, Brioschi S. et al. Genetics of HUS: the impact of MCP, CFH, and IF mutations on clinical presentation, response to treatment, and outcome. Blood 2006;108(4):1267–1279
12. Michael M, Elliott EJ, Ridley GF. Interventions for hemolytic uremic syndrome and thrombotic thrombocytopenic purpura. Cochrane Database Syst Rev 2009;1:CD003595
13. Kappler S, Ronan-Bentle S, Graham A. Thrombotic Microangiopathies (TTP,HUS, HELLP). Emerg Med Clin N Am 2014; 32:649–671
14. Legendre CM, Licht C, Muus P et al. Terminal complement inhibitor eculizumab in atypical hemolytic-uremic syndrome. N Engl J Med 2013;368(23):2169–2181
15. Mackaness C, Fleszler F. Eculizumab in the successful treatment of postpartum atypical hemolytic uremic syndrome – a case report. NKF 2014 Spring Clinical Meetings Abstracts. Am J Kidney Dis 2014;63(5):75
Об авторах
Л. И. РуденкоРоссия
Руденко Лилия Игоревна, кандидат медицинских наук.
Отделение нефрологии.
344022, г. Ростов-на-Дону, пер. Нахичеванский, д. 29.
М. М. Батюшин
Россия
Профессор Батюшин Михаил Михайлович.
Кафедра внутренних болезней № 2.
344022, г. Ростов-на-Дону, пер. Нахичеванский, д. 29.
А. Э. Мационис
Россия
Мационис Александр Эдуардович, докторр медицинских наук
344015, г. Ростов-на-Дону, ул. Благодатная, д. 170А.
М. Ю. Каминский
Россия
Каминский Михаил Юрьевич, кандидат медицинских наук.
Кафедра анестезиологии и реаниматологии с курсом токсикологии.
344022, г. Ростов-на-Дону, пер. Нахичеванский, д. 29.
Г. П. Резникова
Россия
Резникова Галина Леонидовна, кандидат медицинских наук.
344015, г. Ростов-на-Дону, ул. Благодатная, д. 170А.
Ю. М. Макаренко
Россия
Макаренко Юрий Маркович, кандидат медицинских наук
344015, г. Ростов-на-Дону, ул. Благодатная, д. 170А.
Рецензия
Для цитирования:
Руденко Л.И., Батюшин М.М., Мационис А.Э., Каминский М.Ю., Резникова Г.П., Макаренко Ю.М. ПОСЛЕРОДОВОЙ АТИПИЧНЫЙ ГЕМОЛИТИКО-УРЕМИЧЕСКИЙ СИНДРОМ. КЛИНИЧЕСКИЕ НАБЛЮДЕНИЯ И ГИСТОЛОГИЧЕСКИЕ ОСОБЕННОСТИ. Нефрология. 2017;21(2):98-106. https://doi.org/10.24884/1561-6274-2017-2-98-106
For citation:
Rudenko L.I., Batiushin M.M., Matcionis A.E., Kaminskii M.Yu., Reznikova G.L., Makarenko Yu.M. POSTPARTUM ATYPICAL HEMOLYTIC UREMIC SYNDROME. CLINICAL OBSERVATIONS AND HISTOLOGICAL FEATURES. Nephrology (Saint-Petersburg). 2017;21(2):98-106. (In Russ.) https://doi.org/10.24884/1561-6274-2017-2-98-106
JATS XML








































