Перейти к:
ИММУНОМОРФОЛОГИЧЕСКИЕ ФЕНОТИПЫ ПОВРЕЖДЕНИЯ АЛЛОГРАФТА ПОЧКИ
https://doi.org/10.24884/1561-6274-2017-21-6-9-19
Аннотация
Существенным ограничением метода аллотрансплантации почки является развитие реакций отторжения в результате активации и реализации Ти В-клеточного иммунного ответа, а также иммунных реакций, опосредованных иными механизмами. В статье приводятся классические и новые представления о развитии различных иммуноморфологических фенотипов иммунных реакций, происходящих в трансплантированной почке. Основное внимание уделено обсуждению механизмов микроваскулярного воспаления в отсутствие детектируемых донор-специфических антител как самостоятельного фенотипа иммунного повреждения аллографта.
Ключевые слова
Для цитирования:
Добронравов В.А., Храброва М.С. ИММУНОМОРФОЛОГИЧЕСКИЕ ФЕНОТИПЫ ПОВРЕЖДЕНИЯ АЛЛОГРАФТА ПОЧКИ. Нефрология. 2017;21(6):9-19. https://doi.org/10.24884/1561-6274-2017-21-6-9-19
For citation:
Dobronravov V.A., Khrabrova M.S. IMMUNE AND MORPHOLOGICAL PHENOTYPES OF KIDNEY ALLOGRAFT INJURY. Nephrology (Saint-Petersburg). 2017;21(6):9-19. (In Russ.) https://doi.org/10.24884/1561-6274-2017-21-6-9-19
ВВЕДЕНИЕ
Аллотрансплантация почки (АТП) - наиболее эффективный метод заместительной почечной терапии в отношении продолжительности жизни реципиента [1-3]. Существенным ограничением данного метода является потеря аллографта почки (АП), главным образом, в связи с развитием реакций отторжения [4]. Под последними понимают активацию и реализацию ответа иммунной системы реципиента при взаимодействии с антигенами донора [5, 6]. Основными антигенами, на которые направлен иммунный ответ, являются лейкоцитарные антигены человека (HLA, human leucocytes antigens) системы генов главного комплекса гистосовместимости (MHC, major histocompatibility complex). Главная проблема трансплантологии заключается в крайне выраженном полиморфизме HLA, что делает полное совпадение по этой системе генов между реципиентом и донором невозможным [7]. В результате в большинстве случаев неизбежно развивается той или иной степени выраженности иммуноопосредованное повреждение трансплантированного органа с последующими нарушением его функции и утратой. Иммунные реакции, развивающиеся в АП, исходя из классических представлений, связывают с двумя архетипами отторжения: Т-клеточным (TCMR, T-cell mediated rejection) и В-клеточным (AMR, антительно-опосредованное, гуморальное; antibody mediated rejection) [5]. Первый обусловлен доминирующей активацией цитотоксических Т-лимфоцитов, второй - В-лимфоцитов и плазма-
тических клеток (ПК) с последующим образованием донор-специфических антител (ДСА), которые играют основную роль в запуске механизмов повреждения и гибели АП. Эти два типа MHC- ассоциированного иммунного ответа представлены разными морфологическими изменениями АП, отраженными в классификации Banff [8-11]. Различными могут быть текущая выраженность и темпы прогрессирования клинических проявлений иммунных реакций отторжения АП - от субклинического (без признаков дисфункции АП) до сверхострой потери органа. Помимо вариабельности в клинической манифестации, внутри каждого типа отторжения можно выделить несколько иммуноморфологических фенотипов, имеющих разное прогностическое значение и подходы к терапии [5, 6]. К настоящему времени накоплены данные, касающиеся прогноза АТП, подходов к своевременной диагностике и лечению при некоторых морфологических фенотипах иммунной реакции, пока остающихся за рамками общепринятой классификации [12]. Это касается и микроваскулярного воспаления (МВВ) в отсутствие детектируемых ДСА. В данной публикации обсуждены механизмы развития такого варианта МВВ как самостоятельного фенотипа иммунного повреждения АП, а также приводятся классические и текущие представления о развитии различных фенотипов иммунных реакций. Предлагаемый нами взгляд на происхождение, пути взаимодействия и последствия различных иммуноморфологических фенотипов повреждения АП отражены на рисунке.
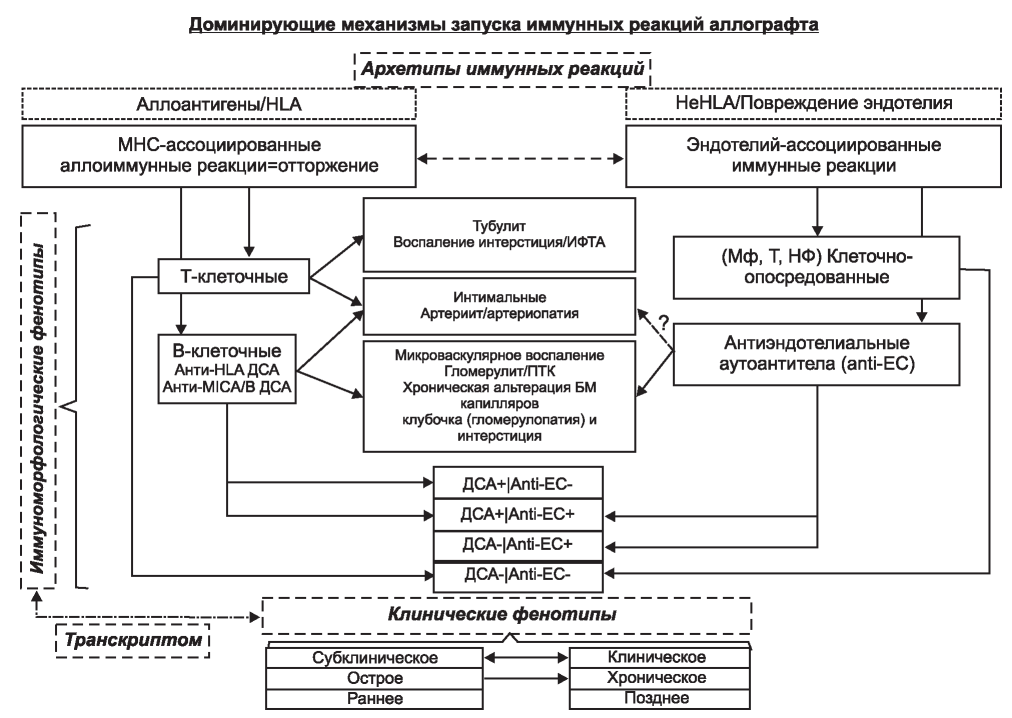
Рисунок. Доминирующие механизмы запуска иммунных реакций аллографта. AMR - антительно-опосредованное отторжение; Anti-EC - анти-эндотелиальные аутоантитела; MHC - антигены главного комплекса гистосовместимости; TCMR - Т-клеточное отторжение; анти-HLA - антитела к лейкоцитарным антигенам человека; анти-MICA/B - антитела к минорным антигенам классов А и В; АП - аллографт почки; БМ - базальная мембрана; ДСА - донор-специфические антитела; ИФТА - интерстициальный фиброз и тубулярная атрофия; Мф - макрофаги; НФ - нейтрофилы; Т - Т-клетки; ПТК - перитубулярный капиллярит. Сплошными стрелками обозначены известные пути реализации иммунного повреждения, пунктирной стрелкой - вероятные механизмы.
MHC-ассоциированные аллоиммунные реакции
Т-клеточное отторжение (TCMR)
В основе TCMR лежат активация и пролиферация Т-клеток, развивающиеся в результате прямого и непрямого распознавания антигенов донора иммунными клетками реципиента при взаимодействии Т-клеточного рецептора и MHC II класса с обязательным участием рецепторной кости- муляции [5, 13, 14]. Вкратце, активированный Т-лимфоцит, Т-хелпер 1-го типа, обеспечивает провоспалительный ответ за счет продукции интерлейкинов 2 и 12, фактора некроза опухолей α, интерферона γ (IFN-γ). Эти цитокины приводят к активации эффекторных Т-лимфоцитов - CD8+ и натуральных киллеров, которые, мигрируя в очаг воспаления, вызывают цитолитическое повреждение резидентных клеток АП. Взаимодействие между антиген-специфичной эффекторной Т-клеткой и антиген-представляющей клеткой (АПК) донора или реципиента вызывает экспрессию факторов, обеспечивающих миграцию эффекторных Т-лимфоцитов через эндотелий перитубулярных капилляров и образование интерстициального инфильтрата, состоящего, главным образом, из макрофагов, дендритных клеток, натуральных киллеров и ПК. Дедифференцировка тубулярного эпителия, опосредованная IFN-γ и заключающаяся в снижении экспрессии кадгерина и нарушении межклеточных соединений, облегчает миграцию Т-лимфоцитов через базальную мембрану канальцев АП [15]. Морфологическими эквивалентами описанных событий являются интерстициальное воспаление и тубулит - известные критерии интерстициального фенотипа TCMR (тип I) по классификации Banff [8-11]. В зависимости от их выраженности выделяют подтипы А и В, а также так называемый «пограничный» (borderline) вариант TCMR. Клинически интерстициальный фенотип Т-клеточного отторжения АП характеризуется достаточно мягким, часто бессимптомным течением, даже при выраженном интерстициальном воспалении [16]. Роль Т-клеточного интерстициального фенотипа иммунного конфликта в прогнозе АТП остается до конца неопределенной. Хотя в ряде исследований показана негативная связь TCMR с риском потери АП [17-19], которая, очевидно, касается случаев несвоевременного выявления, неадекватного лечения, приводящих к хронификации иммунного процесса. В целом прогноз при TCMR благоприятнее, чем при AMR [20, 21], а при своевременной диагностике и оптимизации иммуносупрессивной терапии существенно не изменяется [12, 22]. Вместе с тем, выраженность и сроки развития тубулоинтерстициального воспаления, по-видимому, имеют значение для оценки тяжести TCMR и прогноза АТП [18, 19]. В настоящий момент морфологи рабочей группы Banff по мере накопления научных данных предлагают пересмотреть подходы к критериальной оценке тубулита и интерстициального воспаления, включить новые критерии для морфологической верификации TCMR, например, степень отека интерстиция, как критерия активности Т-клеточного отторжения [11]. Обсуждается вопрос об исключении такого морфологического фенотипа TCMR, как «пограничное» отторжение, в связи с его несущественной прогностической значимостью [11]. Интересно, что до недавнего времени интерстициальное воспаление в зонах фиброза интерстиция не рассматривали как признак отторжения. Однако накопленные данные о связи этого фенотипа с негативным прогнозом [23, 24] послужили основанием включения этих морфологических изменений в классификацию Banff, как критерия хронического иммунного ответа по Т-клеточному пути [11]. В отличие от интерстициального, сосудистый фенотип TCMR (II тип), сопровождающийся воспалительными изменениями интимы артерий (интимальный артериит), определенно является более клинически значимым. Быстрое развитие дисфункции АП при этом фенотипе TCMR может быть обусловлено окклюзирующим поражением артерий/ артериол на фоне воспаления и закономерно ассоциировано со снижением выживаемости АП [19, 21, 25, 26]. В течение посттрансплантационного периода в результате постоянного взаимодействия АПК реципиента и антигенов донора при непрямом распознавании Т-клеточный ответ, имея торпидное, модифицированное иммуносу- прессивной терапией течение, может принимать хронифицированные формы. Морфологически такой фенотип хронического TCMR проявляется в виде артериопатии АП - фиброзом и мононуклеарной инфильтрацией интимы артерий и формированием неоинтимы [8-11]. В то же время, подобные хронические изменения могут быть и последствием активации В-клеточного пути в рамках AMR [11].
Антительно-опосредованное отторжение (AMR)
В-клеточное отторжение является наиболее грозным вариантом иммунного конфликта и основной причиной потери трансплантированного органа [4, 5, 20, 21, 27, 28]. Патогенез AMR достаточно хорошо изучен [5, 28, 29]. Кратко в результате активации наивного Т-лимфоцита образуется Т-хелпер 2-го типа, который продуцирует интерлейкины 2, 4, 5, 6, 12, вызывающие активацию и дифференцировку антиген-специфичных В-клеток [5, 28]. Т-хелперы-2 путем продукции цитокинов BAFF (B-cell activated factor) и APRIL (a proliferation-inducing ligand), необходимых для созревания В-лимфоцита, способствуют диффе- ренцировке В-клеток в В-клетки памяти и ПК.
В-клетки памяти при повторной встрече с тем же антигеном запускают продукцию ДСА. Связывание ДСА с антигеном на поверхности эндотелия аллографта вызывает активацию комплемента по классическому пути с образованием мембраноатакующего комплекса и повреждение эндотелия. В активированных повреждением клетках эндотелия реализуются патофизиологические механизмы, наиболее существенным результатом которых являются рекрутирование лимфоцитов моноцитарно-макрофагального ряда из циркуляции, а также нейтрофильных клеток с развитием воспаления, альтерации эндотелия, некроза и тромбоза капилляров АП [29, 30]. Соответствующими морфологическими признаками развития гуморального иммунного ответа являются МВВ, отек эндотелия, тромботическая микроангиопатия, интимальный артериит - критерии AMR [11]. Важно, что на этапе образования С3а и С5а- фракций комплемента процесс альтерации эндотелия продолжает протекать независимо от антител. Эти две фракции являются хемоаттрактантами для макрофагов, нейтрофилов и натуральных киллеров, вызывающих дальнейшее повреждение АП. Механизм ДСА-опосредованной клеточной токсичности задействован в прямом повреждении эндотелия без участия комплемента [31]. В случае связывания ДСА с эндотелием может происходить активация последнего с развитием механизмов аккомодации. Возможно, в основе аккомодации лежит активация в эндотелиальной клетке генов антиапоптотических белков, благодаря экспрессии которых эндотелий оказывается защищен от действия комплемента и других повреждающих молекул [30]. Таким образом, повреждение стенки микрососудов может быть обусловлено доминирущей активацией системы комплемента или антительно-опосредованной клеточной токсичностью или обоими механизмами одновременно.
Выраженность иммунологических реакций и время их возникновения относительно сроков АТП по В-клеточному механизму обусловлены событиями, сенсибилизировавшими организм реципиента в пред- и посттрансплантационном периодах. В этой связи в 2011 году было предложено выделять два клинико-иммунологических фенотипа AMR [32]. Первый фенотип - «раннее AMR» - обусловлен действием предсуществующих ДСА (ПРА), образовавшихся в организме реципиента до АТП в результате аллоиммунизации (гемотрансфузии, беременность, предшествующие АТП). При достаточно большом титре ПРА в циркуляции на момент пересадки реакция отторжения возникает в раннем посттрансплантаци- онном периоде в форме так называемого сверхострого гуморального отторжения. Если активация В-клеток памяти и акселерации гуморального пути несколько отсрочены - клинически развивается острое отторжение в первые недели по- странсплантационного периода [33]. Второй фенотип - «позднее AMR» - опосредован действием вновь сформированных ДСА, специфичных к антигенам донорского органа, в отдаленные сроки после АТП. De novo ДСА являются основной причиной развития таких клинико-морфологических фенотипов, как позднее острое и хроническое активное гуморальное отторжение, и обязательным критерием для диагностики AMR [10]. В последнее время в результате активного изучения структурных особенностей ДСА появились данные, что не все изотипы иммуноглобулина G эквиваленты по своей повреждающей способности [34], что, вероятно, потребует дополнительной стратификации ДСА+AMR по этому признаку с выделением иммунологических фенотипов гуморального отторжения.
Результаты воздействия ДСА на эндотелий капилляров морфологически проявляются МВВ: гломерулитом и/или перитубулярным капилля- ритом, являющимися критериями AMR по классификации Banff [8-11]. Ранее сочетание МВВ и депозиции продукта активации каскада системы комплемента фракции С4ё в базальных мембранах перитубулярных капилляров считалось критериальным признаком В-клеточного отторжения [8, 9]. Однако в последующем этот критерий при наличии явного МВВ стал необязательным в связи с появившимися данными о сравнимом прогностическом значении С4ё-отрицательного и С4ё-позитивного фенотипов AMR [10, 35-37]. В последнее время при наличии морфологических признаков воспаления микрососудов АП ультимативность такого критерия AMR, как ДСА, в отношении рутинной клинической диагностики стала подвергаться сомнению со стороны нефрологов- клиницистов и морфологов [11]. Объяснение этому, казалось бы алогичному мнению, заключается в том, что становятся известными все больше «новых» антигенов, к которым могут образовываться антитела [30], но детекция их в рутинной практике технически лимитирована. Многие авторы называют такие антитела не-анти-HLA-ДСА и связывают их с типичной ситуацией развития гуморального отторжения [38, 39], что, на наш взгляд, не соответствует классическим представлениям о природе аллораспознавания, базирующейся исключительно на системе MHC. Разумеется, что существуют гипотезы развития МВВ без детектируемых анти-HLA/MICA/B-ДСА, пытающиеся объяснить повреждение АП в рамках гуморального отторжения. Так, предложены варианты AMR, опосредованного ДСА «субдетектируемого уровня», которые без активации каскада комплемента могут приводить к альтерации эндотелия в результате антительно-опосредованной клеточной цитотоксичности [31] или при которых ДСА «адсорбируются» на эндотелии с реализацией стандартного каскада иммунных реакций, но без существенного титра аллоантител в циркуляции [40]. С другой стороны - очевидно, что не-анти- HLA-антитела могут иметь иное происхождение, обсуждение механизмов которого изложено ниже. На текущий момент, по мнению создателей классификации Banff, случаи МВВ, протекающие без детектируемых анти-HLA-ДСА, следует считать «подозрительными» в отношении гуморального отторжения и требующими незамедлительных более тщательного иммунологического анализа и начала лечения [11]. С нашей точки зрения, к случаям, «подозрительным» в отношении AMR в связи с их отчетливым негативным значением в прогнозе АТП, должны быть отнесены также те, в которых выполнение полноценного анализа анти- HLA-ДСА технически ограничено [41].
Смешанные варианты отторжения.
Возможность одновременной реализации Т- и В-опосредованного иммунного ответа и развития смешанного варианта отторжения является очевидной и с теоретической, и с практической точек зрения. Таким фенотипам отторжения в последнее время уделяют все большее внимание [11, 21, 42-44], отчасти в связи с необходимостью определения терапевтической тактики [20]. Часто морфологические признаки активации и Т-, и В-опосредованного иммунного ответа обнаруживают в более поздние сроки посттранспланта- ционного периода, когда выявляют и одинаковую степень экспрессии генов, ответственных за реализацию обоих компонентов иммунной системы [42]. В прогностическом отношении воздействие обоих иммунных звеньев на АП ассоциировано с более неблагоприятным прогнозом [43, 44]. Это справедливо и для интимального артериита.
Интимальный артериит, хотя и остается в классификационных рамках TCMR, очевидно, представляет собой отдельный иммуно- морфологический фенотип - один из примеров одновременной активации и пересечения Т- и В- клеточных механизмов отторжения АП [23, 45].
В последнее время появились данные об участии антительно-опосредованного иммунного ответа в развитии этого фенотипа TCMR [15, 21]. В связи с критичностью гуморального компонента для формирования интимального артериита АП некоторые авторы предлагают выделять иммуноморфологические фенотипы сосудистого TCMR: без ДСА, ключевого звена гуморального иммунного ответа, и ДСА-ассоциированный артериит [21, 27]. Последний фенотип следует рассматривать как проявление AMR, что уже было учтено в модифицированной классификации Banff 2013 [10]. В случае TCMR прогноз остается благоприятным, если впоследствии не образовались de novo ДСА [46]. В настоящее время обсуждается вопрос о триггерном эффекте TCMR в отношении развития AMR в последующем [47]. Вероятно, результатом первоначальной активации Т-клеточного звена может быть экспрессия различных молекул, воспринимаемых иммунной системой как аллоантигены, к которым в дальнейшем вырабатываются аутоантитела [48]. Этот механизм может быть реализован при воспалении интимы артерий/артериол АП, помимо непосредственного участия цитотоксических Т-лимфоцитов и ДСА- опосредованной иммунной реакции.
Эндотелий-опосредованные иммунные реакции
Классическим фенотипом МВВ является моноцитарно-макрофагальное воспаление капилляров клубочка (гломерулит) и/или интерстиция (перитубулярный капиллярит) при наличии ДСА в рамках гуморального отторжения. Однако в группе реципиентов АП, селекционированных по гломерулиту, значительная доля случаев воспаления капилляров клубочка протекает в отсутствие анти-HLA и анти-MICA/B ДСА [12, 41]. Продемонстрировано неблагоприятное прогностическое значение гломерулита в отсутствие ДСА [12], что позволило рассматривать воспалительную интракапиллярную реакцию как отдельный фенотип отторжения АП («изолированный гломе- рулит»). Под изолированным гломерулитом следует понимать иммунное, но не опосредованное анти-HLA или анти-MICA/B ДСА моноцитарно- макрофагальное воспаление капилляров клубочка, морфологически проявляющееся полной окклюзией хотя бы одного клубочкового капилляра за счет лейкоцитарной инфильтрации и отека эндотелия [10]. Изолированный гломерулит пока не признан в качестве самостоятельного варианта иммунного повреждения АП, в основном в связи с ограниченными и противоречивыми данными по связи с прогнозом АТП [12, 49, 50]. Длительное наблюдение достаточно большой группы реципиентов АП с иммуноморфологическим мониторингом позволило отчетливо продемонстрировать связь ДСА-негативного воспаления капилляров клубочка с формированием гломерулопатии и неблагоприятным прогнозом АТП [12].
Детальные механизмы развития гломерулита/ перитубулярного капиллярита при отсутствии ДСА не изучены. Можно предполагать, что эндотелий per se, обладающий частичными свойствами АПК и способный активировать CD8+- и CD4+-Т-клетки [30], может быть основным звеном, инициирующим МВВ. Не исключено, что именно активация или повреждение эндотелия капилляров в результате действия самых разнообразных иммунных (TCMR/AMR) и неиммунных, например, ишемии/реперфузии, клубочковой гипертензии/гиперфильтрации и, вероятно, других многочисленных факторов - является пусковым этапом формирования гломерулита и воспаления перитубулярных сосудов [38]. В результате повреждения эндотелия могут развиваться клеточно-опосредованные иммунные реакции и/ или формироваться не-HLA антиэндотелиальные антитела.
Не-HLA зависимые, клеточно-опосредованные иммунные реакции в формировании МВВ
Известно, что активация эндотелия в ответ на какое-либо повреждающее воздействие может быть реализована двумя основными типами - быстрым без участия транскрипции генов и отсроченным, итогом которого является экспрессия в эндотелиоцитах генов различных молекул адгезии - E-селектина, ICAM-1 (intercellular adhesion molecule 1), VCAM-1 (vascular cell adhesion molecule 1), MCP-1 (monocyte chemoattractant protein 1) и других [51]. Как известно, эти молекулы обеспечивают взаимодействие воспалительных клеток - нейтрофилов, натуральных киллеров, моноцитов и макрофагов - с эндотелием, включая их роллинг, адгезию и трансэндотелиальную миграцию [52].
Можно предположить и другой сценарий развития эндотелий-опосредованного МВВ. Антигены, представляемые подвергшимся воздействию эндотелием, могут активировать CD4+- Т-лимфоциты, которые, в свою очередь, рекрутируют из циркуляции специализированные патрулирующие клетки моноцитарно-макрофагального ряда. Взаимодействие этой субпопуляции макрофагов с нейтрофилами приводит к прогрессированию дальнейшего повреждения эндотелия [53, 54] и риску развития типичного AMR. В отсутствие последнего морфологически этот процесс проявляется не чем иным как гломерулитом с преимущественной инфильтрацией капилляров CD68+-моноцитами, CD3+-Т-лимфоцитами и нейтрофилами. Именно такое сочетание иммунных клеток в клубочке было превалирующим при иммуногистохимическом исследовании случаев гломерулита АП без детектируемых ДСА, проведенном нами (данные опубликованы ниже). Вовлечение клеточного звена иммунного ответа в формировании МВВ подтверждено экспериментальными и клиническими данными [55, 56]. Так, A.B.Magil предположил роль Т-клеточного механизма в развитии микроваскулярного воспаления клубочка на основании преобладания CD3+-Т лейкоцитов среди случаев гломерулита без депозиции C4d в перитубулярных капиллярах [57]. В другой работе было продемонстрировано преобладание экспрессии генных транскриптов, характерных для Т-клеточного иммунного ответа, при ДСА-негативных случаях гломерулопатии [55]. Напротив, с развитием AMR ассоциирован иной профиль транскриптома [58]. Характер активации генов при эндотелий-опосредованных иммунных реакциях АП требует дальнейших исследований и может быть ключом для понимания последовательности патологического процесса.
Эндотелий - активный участник процессов повреждения в результате аллоиммунных механизмов, способный не только привлекать иммунные клетки, но и, возможно, непосредственно пре- зентировать антигены Т-хелперам, индуцируя В-клеточный ответ [30]. Поэтому повреждение эндотелия является определенным фактором риска присоединения AMR. Недавние экспериментальные данные показали роль активированного эндотелия в привлечении в микроциркуляторное русло АП Т-регуляторных клеток [59], обеспечивающих механизмы аккомодации и иммунной толерантности. В отличие от CD68+-клеток [60], присутствие регуляторной субпопуляции лимфоцитов ассоциировано с более благоприятным прогнозом АТП [61, 62]. В последующем, представления о клинических значимых субфенотипах МВВ могут формироваться на основе иммуноморфоло- гических данных о составе воспалительного инфильтрата.
МВВ, опосредованное антиэндотелиальными аутоантителами
Свойства эндотелия как АПК в случае его повреждения реализуются путем представления Т-лимфоцитам других молекул эндотелиоцита в виде антигенно-подобных эпитопов [30]. В качестве таких молекул описаны, например, рецептор ангиотензина 1 типа, рецептор эндотелина-1 типа А, виментин, перлекан, эндоглин, презентация которых иммунной системе вызывает активацию В-клеток и продукцию антиэндотели- альных не-HLA-аутоантител [30, 63]. Другими существенными факторами стимулирующими образование антител, являются процессы апоп- тоза эндотелия, когда в результате нарушенной элиминации апоптотических микрочастиц происходят их антигенная презентация эндотелием и активация гуморального иммунного ответа, как это описано при системной красной волчанке и других аутоиммунных процессах [64, 65]. Итогом этого процесса может быть образование in situ и/ или циркулирующих иммунных комплексов с их последующей депозицией в клубочках АП с активацией комплемента и развитием МВВ, подобно этапам развития иммунокомплексных гломерулопатий, что подтверждается выявлением соответствующих депозитов в капиллярах АП при электронной микроскопии [66]. В целом вопрос о депозиции иммунных комплексов, образованных антиэндотелиальными антителами, остается открытым. Известные особенности локализации эндотелиальных антигенов по отношению к базальной мембране объясняют ситуации, в которых при таком виде иммунной реакции депозиты иммунных комплексов не выявляются [66]. В случае расположения мишени аутоантител - на поверхности эндотелиальной клетки (рецепторы ангиотензина 1 типа или эндотелина-1 типа А) именно там и будет сформирован иммунный комплекс с последующим развитием апоптоза эндотелиоцита и его слущиванием с базальной мембраны без предпосылок для депозиции иммунного комплекса в структуре последней. Напротив, в случае преимущественно интрамембранной локализации аутоантигена (например перлекана) иммунные комплексы будут образовываться in situ там же. Подобные варианты развития иммунокомплексного эндотелий-ассоциированного процесса являются на текущий момент лишь предположениями [66] и требуют дальнейшего изучения. Таким образом, по сути эндотелий-ассоциированный путь иммунного повреждения АП не является реакцией отторжения в общепринятом смысле, а скорее представляет собой аутоиммунный воспалительный ответ.
Вполне вероятно, что такой существенный в отношении прогноза фенотип отторжения, как изолированной гломерулит, займет свое отдельное место в классификации иммунных реакций повреждения АП. Очевидно, что механизмы развития этого особого варианта МВВ не ограничиваются только классическими реакциями отторжения - TCMR и/или AMR, а могут быть следствием структурно-функциональной модификации эндотелия. Отчасти предположение о том или ином пути формирования гломерулита может быть основано на результатах иммуногистохимического исследования, как продемонстрировано в представленном ниже оригинальном исследовании. Изучение прогностического значения различных субпопуляций иммунных клеток при гломерулите - моноцитарно-макрофагального ряда (CD68+) в частности патрулирующих клеток CD16+CD14++, Т-лимфоцитов (CD3+), включая цитотоксические (CD8+), Т-хелперы (CD4+), регуляторные (CD4+CD25+FOXP3+) субпопуляции, В-лимфоцитов (CD20+), натуральных киллеров, нейтрофилов - в перспективе позволит выделить отдельные фенотипы гломерулита, требующие дифференцированного подхода к лечению. Следует сказать, что все описанные выше возможные эндотелий-опосредованные механизмы формирования МВВ в целом, в частности справедливы и для «изолированного» перитубулярного капиллярита, клиническое значение которого нуждается в уточнении [38].
Гломерулопатия как исход МВВ
Хроническое повреждение базальной мембраны капилляров клубочка и перитубулярных капилляров в виде ее утолщения и расщепления является закономерным исходом воздействия любого варианта МВВ [47, 67]. Гломерулопатию в сочетании с ДСА, альтерацию капилляров клубочка, традиционно считают критерием хронического фенотипа AMR, встречающимся достаточно часто среди пациентов, перенесших когда-либо воздействие гуморального иммунного ответа на АП [68], и ассоциированным с крайне неблагоприятным прогнозом АТП [69-71]. О фенотипе хронического активного гуморального отторжения, согласно классификации Banff, можно говорить при сочетании МВВ и гломерулопатии [10, 11]. При этом авторы классификации патоморфологических изменений АП подразумевают единственный механизм формирования гломерулопатии, а именно, опосредованный гуморальным иммунным ответом [8-11, 72, 73]. Напротив, приведенные выше рассуждения позволяют нам с известной долей уверенности предполагать, что гломерулопатия, как терминальная фаза развития МВВ, может иметь разные иммуноморфологические субфенотипы [55, 66] (см. рисунок). Косвенным аргументом в пользу этого является существенное сходство трансплантационной гломерулопатии и хронифицированных повреждений базальных мембран клубочков нативных почек. В последнем случае дупликация базальных мембран с интерпозицией мезангия может быть следствием разнообразных иммунокомплексных и комплементзависимых болезней.
Подходы к диагностике и лечению
Традиционно реакция отторжения АП представляется как процесс, протекающий с явными клиническими проявлениями - прогрессированием дисфункции АП и/или протеинурией. Однако любой иммуноморфологический фенотип повреждения, включая изолированный гломерулит и гломерулопатию, может протекать субклинически и быть доступным для диагностики только в случае мониторирования морфологической и иммунологической ситуации [46, 68, 69]. При этом показано, что прогноз АТП при субклинических вариантах AMR, не подвергшихся своевременному лечению, такой же плохой, как и при клинических формах [46, 74]. В целом, значение хронифицированных отсроченных субклинических вариантов В-клеточного отторжения как причины утраты АП до последнего времени недооценивалось. Основная масса таких случаев скрывалась за маской «трансплантационной нефропатии» [75], исключенной из классификации Banff в 2005 году [9]. Единственным подходом к максимально ранней диагностике субклинических вариантов отторжения является иммунологический и морфологический мониторинг - регулярный контроль ДСА, антиэндотелиальных антител и протокольные/ранние индикационные биопсии. Применение подобного подхода позволяет добиваться улучшения выживаемости АП при своевременной терапии [16, 68]. Для уточнения преимущественного вовлечения в процесс отторжения того или иного пути иммунного ответа может быть полезно иммуногистохимическое определение субпопуляций иммунных клеток, в частности CD68+ (моноцитарно-макрофагального ряда), CD3+ (Т-лимфоцитов), CD20+ (В-лимфоцитов).
Основные классы иммуносупрессивных препаратов, применяемых в трансплантации почек, позволяют эффективно контролировать активацию и пролиферацию Т-клеток, поэтому лечение TCMR, как правило, не представляет существенной клинической проблемы по сравнению с В-клеточным отторжением [22]. Исключением может быть васкулярный фенотип TCMR, зачастую требующий более глубокой деплеции лимфоцитов. Терапевтические подходы в случае AMR включают элиминацию антител, селективную деплецию В-клеток и ПК, блокаду активации комплемента [5, 33], однако, их эффективность часто ограничена поздней диагностикой и сопутствующей гломерулопатией. Неблагоприятный прогноз гломерулопатии объясняется наличием необратимых фибропластических изменений в АП и их прогрессированием при отсутствии эффективного лечения [70, 71]. Очевидно, что лечебному воздействию должны быть подвергнуты более ранние стадии активации ДСА-зависимых и эндотелий-опо средованных иммунных механизмов - МВВ/гломерулит АП, предшественники необратимых изменений АП. В первом случае подходы к лечению такие же, как и при AMR. Терапия МВВ в отсутствие ДСА не разработана и требует дальнейших исследований. Ключом к выбору эффективного лечения может быть идентификация механизмов развития конкретного иммуноморфо- логического фенотипа повреждения. С точки зрения последовательности иммунных реакций при эндотелий-опосредованном механизме МВВ, очевидно, терапевтическое воздействие может быть направлено на любой из этапов патологического процесса и включать: устранение повреждающих эндотелий воздействий, элиминацию циркулирющих антиэндотелиальных антител, блокаду рецепторов эффекторных молекул (ангиотензина-2, эндотелина-1), ингибирования молекул адгезии (натализумаб, аликафорсен), селективную деплецию В-клеток и ПК и другие варианты иммуносупрессии, применяемые при аутоиммунных процессах.
ЗАКЛЮЧЕНИЕ
Расширение представлений о реализации механизмов иммунных реакций в аллографте почки позволяет выделять клинические и иммуноморфологические фенотипы его повреждения. Такая детализация может стать основой для развития подходов к ранней диагностике, адекватной терапии и улучшению результатов трансплантации почки.
Список литературы
1. Бикбов БТ, Томилина НА. Заместительная терапия больных с хронической почечной недостаточностью методами перитонеального диализа и трансплантации почки в Российской Федерации в 1998-2011 г. (Отчет по данным Российского регистра заместительной почечной терапии. Часть вторая). Нефрология и диализ 2014; 16(2): 192-227 [BikbovBT, TomilinaNA. ZamestitelnayaterapiyabolnichskhronicheskoypochechnoynedostatochnostiumetodamiperitonealnogodializaitransplantaciipochkivRossiyskoyFederaciiv 1998-2011 g. (OtchetpodannimRossiyskogoregistrazamestitelnoypochechnoyterapii. Chast vtoraya). Nefrologiya i dializ 2014; 16 (2): 192-227]
2. Jain P, Cockwell P, Little J et al. Survival and transplantation in end-stage renal disease: a prospective study of a multiethnic population. Nephrol Dial Transplant 2009; 24(12): 3840-3846. doi: 10.1093/ndt/gfp455
3. Tonelli M, Wiebe N, Knoll G et al. Systematic review: kidney transplantation compared with dialysis in clinically relevant outcomes. Am J Transplant 2011; 11(10): 2093-2109. doi: 10.1111/j.1600-6143.2011.03686.x
4. El-Zoghby ZM, Stegall MD, Lager DJ et al. Identifying Specific Causes of Kidney Allograft Loss. Am J Transplant 2009; 9(3): 527-535. doi: 10.1111/j.1600-6143.2008.02519.x
5. Davis CL, Hricik DE. Transplant: immunology and treatment of rejection. Am J Kidney Dis 2004; 43(6): 1116-1137
6. Wood KJ, Goto R. Mechanisms of rejection: current perspectives. Transplantation 2012; 93(1): 1-10. doi: 10.1097/TP.0b013e31823cab44
7. Robinson J, Halliwell JD, Hayhurst JD et al. The IPD and IMGT/HLA database: allele variant databases. Nucleic Acids Res 2015; 43: D423-431. doi: 10.1093/nar/gku1161
8. Racusen LC, Colvin RB, Solez K et al. Antibody-mediated rejection criteria – an addition to the Banff 97 classification of renal allograft rejection. Am J Transplant 2003; 3(6): 708-714. doi: 10.1034/j.1600-6143.2003.00072.x
9. Solez K, Colvin RB, Racusen LC et al. Banff ‘05 Meeting Report: differential diagnosis of chronic allograft injury and elimination of chronic allograft nephropathy (‘CAN’). Am J Transplant 2007; 7(3): 518-526. doi: 10.1111/j.1600-6143.2006.01688.x
10. Haas M, Sis B, Racusen LC et al. Banff 2013 Meeting Report: Inclusion of C4d-negative antibody-mediated rejection and antibody-associated arterial lesions. Am J Transplant 2014; 14(2): 272-283. doi: 10.1111/ajt.12590
11. Loupy A, Haas M, Solez K et al. The Banff 2015 Kidney Meeting Report: Current Challenges in Rejection Classification and Prospects for Adopting Molecular Pathology. Am J Transplant 2017; 17 (1): 28-41. doi: 10.1111/ajt.14107
12. Nabokow A, Dobronravov VA, Khrabrova MS et al. Long-term kidney allograft survival in patients with transplant glomerulitis. Transplantation 2015; 99(2): 331-339. doi: 10.1097/TP.0000000000000606
13. Morris PJ, Knechtle SJ. Kidney Transplantation: principles and practice, 6th ed. Saunders Elsevier, United States of America, 2008; 9-23
14. Lim MA, Kohli J, Bloom RD. Immunosuppression for kidney transplantation: Where are we now and where are we going? Transplant Rev (Orlando) 2017; 31(1): 10-17. doi: 10.1016/j.trre.2016.10.006
15. Halloran PF. T cell-mediated rejection of kidney transplants: a personal viewpoint. Am J Transplant 2010; 10(5): 1126-1134. doi: 10.1111/j.1600-6143.2010.03053.x
16. Huang Y, Farkash E. Protocol Biopsies: Utility and Limitations. Adv Chronic Kidney Dis 2016; 23(5): 326-331. doi: 10.1053/j.ackd.2016.09.002.
17. Wu K, Budde K, Rudolph B et al. Designation of T-cellmediated rejection type Ib and IIa reflects the type of rejection rather than the severity in the Banff classification. Exp Clin Transplant 2014; 12(5): 415-423. doi: 10.6002/ect.2014.0050
18. Wu K, Budde K, Lu H et al. The severity of acute cellular rejection defined by Banff classification is associated with kidney allograft outcomes. Transplantation 2014; 97(11): 1146-1154. doi: 10.1097/01.TP.0000441094.32217.05
19. Lamarche C, Cote JM, Senecal L et al. Efficacy of Acute Cellular Rejection Treatment According to Banff Score in KidneyTransplant Recipients: A Systematic Review. Transplant Direct 2016; 15(2): e115. doi: 10.1097/TXD.0000000000000626
20. Halloran PF, Chang J, Famulski K et al. Disappearance of T Cell-Mediated Rejection Despite Continued Antibody-Mediated Rejection in Late Kidney Transplant Recipients. J Am Soc Nephrol 2015; 26(7): 1711-1720. doi: 10.1681/ASN.2014060588
21. Lefaucheur C, Loupy A, Vernerey D et al. Antibody mediated vascular rejection of kidney allografts: a populationbased study. Lancet 2013; 9863: 313-319. doi: 10.1016/S0140-6736(12)61265-3
22. Knechtle SJ, Heisey DM, Pirsch JD et al. Impact of improving immunosuppressive treatment on outcome in cadaveric kidney transplantation. Surgery 1996; 120 (4): 719-724
23. Mengel M, Reeve J, Bunnag S et al. Scoring total inflammation is superior to the current Banff inflammation score in predicting outcome and the degree of molecular disturbance in renal allografts. Am J Transplant 2009; 9(8): 1859-1867. doi: 10.1111/j.1600-6143.2009.02727.x
24. Mannon RB, Matas AJ, Grande J et al. Inflammation in areas of tubular atrophy in kidney allograft biopsies: a potent predictor of allograft failure. Am J Transplant 2010; 10(9): 2066-2073. doi: 10.1111/j.1600-6143.2010.03240.x
25. Sis B, Bagnasco SM, Cornell LD et al. Isolated endarteritis and kidney transplant survival: a multicenter collaborative study. J Am Soc Nephrol 2015; 26(5): 1216-1227. doi: 10.1681/ASN.2014020157
26. Haas M, Kraus ES, Samaniego-Picota M et al. Acute renal allograft rejection with intimal arteritis: histologic predictors of responseto therapy and graft survival. Kidney Int 2002; 61(4): 1516-1526. doi: 10.1046/j.1523-1755.2002.00254.x
27. Rodriguez Cubillo B, Perez Flores I, Calvo N et al. AntibodyMediated Acute Vascular Rejection of Kidney Allografts: FifteenYear Follow-up. Transplant Proc 2016; 48(9): 2917-2919. doi: 10.1016/j.transproceed.2016.09.015.
28. Colvin RB. Antibody-mediated renal allograft rejection: diagnosis and pathogenesis. J Am Soc Nephrol 2007; 18(4): 10461056. doi: 10.1681/ASN.2007010073
29. Drachenberg CB, Papadimitriou JC. Endothelial injury in renal antibody-mediated allograft rejection: a schematic view based on pathogenesis. Transplantation 2013; 95(9): 1073-1083. doi: 10.1097/TP.0b013e31827e6b45
30. Wang S, Zhang C, Wang J et al. Endothelial Cells in Antibody Mediated Rejection of Kidney Transplantation: Pathogenesis Mechanisms and Therapeutic Implication. J Immunol Res 2017; 2017: 8746303. doi: 10.1155/2017/8746303
31. Stegall MD, Chedid MF, Cornell LD. The role of complement in antibody-mediated rejection in kidney transplantation. Nat Rev Nephrol 2012; 8(11): 670-678. doi: 10.1038/nrneph.2012.212
32. Mengel M, Sis B, Haas M et al. Banff 2011 Meeting report: new concepts in antibody-mediated rejection. Am J Transplant 2012; 12(3): 563-570. doi: 10.1111/j.1600-6143.2011.03926.x
33. Davis S, Cooper JE. Acute antibody-mediated rejection in kidney transplant recipients. Transplant Rev (Orlando) 2017; 31(1): 47-54. doi: 10.1016/j.trre.2016.10.004
34. Butler CL, Valenzuela NM, Thomas KA, Reed EF. Not All Antibodies Are Created Equal: Factors That Influence Antibody Mediated Rejection. J Immunol Res 2017; 2017: 7903471. doi: 10.1155/2017/7903471
35. Einecke G, Sis B, Reeve J et al. Antibody-mediated microcirculation injury is the major cause of late kidney transplant failure. Am J Transplant 2009; 9(11): 2520-2531. doi: 10.1111/j.1600-6143.2009.02799.x
36. De Kort H, Willicombe MP, Brookes MP et al. Microcirculation inflammation associates with outcome in renal transplant patients with de novo donor-specific antibodies. Am J Transplant 2013; 13(2): 485-492. doi: 10.1111/j.1600-6143.2012.04325.x
37. Loupy A, Hill GS, Suberbielle C et al. Significance of C4d Banff scores in early protocol biopsies of kidney transplant recipients with preformed donor-specific antibodies (DSA). Am J Transplant 2011; 11(1): 56-65. doi: 10.1111/j.1600-6143.2010.03364.x
38. Dragun D, Hoff U, Park JK et al. Ischemia-reperfusion injury in renal transplantation is independent of the immunologic background. Kidney Int 2000; 58(5): 2166-77. doi: 10.1111/j.15231755.2000.00390.x
39. Zhang Q, Reed EF. The importance of non-HLA antibodies in transplantation. Nature reviews Nephrology 2016; 12(8): 484-495. doi: 10.1038/nrneph.2016.88
40. Marrari M, Duquesnoy RJ. Detection of donor-specific HLA antibodies before and after removal of a rejected kidney transplant. TransplImmunol 2010; 22(3-4): 105-109. doi: 10.1016/j.trim.2009.12.005
41. Храброва МС, Добронравов ВА, Набоков АВ и др. Микроваскулярное воспаление как прогностический фактор при трансплантации почки. Нефрология 2015; 19(5): 34-4 [KhrabrovaMS, DobronravovVA, NabokovAVidr. Mikrovaskulyarnoevospaleniekakprognosticheskiyfactorpritransplantaciipochki. Nefrologiya 2015; 19 (5): 34-41]
42. Petra H, Eva H, Irena B et al. Molecular profiling of acute and chronic rejections of renal allografts. Clin Dev Immunol 2013; 509259. doi: 10.1155/2013/509259
43. Willicombe M, Roufosse C, Brookes P et al. Acute cellular rejection: impact of donor-specific antibodies and C4d. Transplantation 2014; 97(4): 433-439. doi: 10.1097/01.TP.0000437431.97108.8f
44. Matignon M, Muthukumar T, Seshan SV et al. Concurrent acute cellular rejection is an independent risk factor for renal allograft failure in patients with C4d-positive antibody-mediated rejection. Transplantation 2012; 94(6): 603-611. doi: 10.1097/TP.0b013e31825def05
45. Bagnasco SM, Kraus ES. Intimal arteritis in renal allografts: new takes on an old lesion. Curr Opin Organ Transplant 2015; 20 (3): 343-347. doi: 10.1097/MOT.0000000000000186
46. Loupy A, Vernerey D, Tinel C et al. Subclinical rejection phenotypes at 1 year post-transplant and outcome of kidney allografts. J Am Soc Nephrol 2015; 26(7): 1721-1731. doi: 10.1681/ASN.2014040399
47. Wiebe C, Gibson IW, Blydt-Hansen TD et al. Evolution and clinical pathologic correlations of de novo donor-specific HLA antibody post kidney transplant. Am J Transplant 2012; 12(5): 1157-1167. doi: 10.1111/j.1600-6143.2012.04013.x
48. Randhawa P. T-cell-mediated rejection of the kidney in the era of donor-specific antibodies: diagnostic challenges and clinical significance. Curr Opin Organ Transplant 2015; 20(3): 325-332. doi: 10.1097/MOT.0000000000000189
49. Batal I, Lunz JG, Aggarwal N et al. A critical appraisal of methods to grade transplant glomerulitis in renal allograft biopsies. Am J Transplant 2010; 10(11): 2442-2452. doi: 0.1111/j.1600-6143.2010.03261.x
50. Buob D, Grimbert P, Glowacki F et al. Three-year outcome of isolated glomerulitis on 3-month protocol biopsies of donor HLA antibody negative patients. Transpl Int 2012; 25(6): 663-670. doi: 10.1111/j.1432-2277.2012.01473.x
51. Pober JS, Sessa WC. Evolving functions of endothelial cells in inflammation. Nat Rev Immunol 2007; 7(10): 803-815. DOI: 10.1038/nri2171
52. Muller WA. Leukocyte-endothelial cell interactions in the inflammatory response. Lab Invest 2002; 82(5): 521-533
53. Devi S, Li A, Westhorpe CL et al. Multiphoton imaging reveals a new leukocyte recruitment paradigm in the glomerulus. Nat Med 2013; 19(1): 107-112. doi: 10.1038/nm.3024
54. Finsterbusch M, Hall P, Li A et al. Patrolling monocytes promote intravascular neutrophil activation and glomerular injury in the acutely inflamed glomerulus. Proc Natl Acad Sci USA 2016; 113 (35): E5172-5181. doi: 10.1073/pnas.1606253113
55. Hayde N, Bao Y, Pullman J et al. The clinical and genomic significance of donor-specific antibody-positive/C4d-negative and donor-specific antibody-negative/C4d-negative transplant glomerulopathy. Clin J Am Soc Nephrol 2013; 8(12): 2141-2148. doi: 10.2215/CJN.04240413
56. Homs S, Mansour H, Desvaux D et al. Predominant Th1 and cytotoxic phenotype in biopsies from renal transplant recipients with transplant glomerulopathy. Am J Transplant 2009; 9(5): 1230-1236. doi: 10.1111/j.1600-6143.2009.02596.x
57. Magil AB. Infiltrating cell types in transplant glomerulitis: relationship to peritubular capillary C4d deposition. Am J Kidney Dis 2005; 45(6): 1084-1089. doi: -
58. Gupta A, Broin PÓ, Bao Y et al. Clinical and molecular significance of microvascular inflammation in transplant kidney biopsies. Kidney Int 2016; 89(1): 217-225. doi: 10.1038/ki.2015.276
59. Fu H, Kishore M, Gittens B et al. Self-recognition of the endothelium enables regulatory T cell trafficking and definesthe kinetics of immune regulation. Nat Commun 2014; 14(5): 3436. doi: 10.1038/ncomms4436
60. Tinckam K, Djurdjev O, Magil AB. Glomerular monocytes predict worse outcomes after acute renal allograft rejection independent of C4d status. Kidney Int 2005; 68(4): 1866-1874. doi: 10.1111/j.1523-1755.2005.00606.x
61. Giaretta F, Bussolino S, Beltramo S et al. Different regulatory and cytotoxic CD4+ T lymphocyte profiles in renal transplants with antibody-mediated chronic rejection or long-term good graft function. Transpl Immunol 2013; 28(1): 48-56. doi: 10.1016/j. trim.2012.11.003
62. Dummer CD, Carpio VN, Gonçalves LF et al. FOXP3+ regulatory T cells: from suppression of rejection to induction of renal allograft tolerance. Transpl Immunol 2012; 26(1): 1-10. doi: 10.1016/j.trim.2011.08.009
63. Rose ML. Role of anti-vimentin antibodies in allograft rejection. Hum Immunol 2013; 74(11): 1459-1462. doi: 10.1016/j.humimm.2013.06.006
64. Nielsen CT. Circulating microparticles in systemic Lupus Erythematosus. Dan Med J 2012; 59(11): B4548
65. Dye JR, Ullal AJ, Pisetsky DS. The role of microparticles in the pathogenesis of rheumatoid arthritis and systemic lupus erythematosus. Scand J Immunol 2013; 78(2): 140-148. doi: 10.1111/sji.12068.
66. Grau V, Zeuschner P, Immenschuh S. Immune ComplexType Deposits in the Fischer-344 to Lewis Rat Model of Renal Transplantation and a Subset of Human Transplant Glomerulopathy. Transplantation 2016; 100(5): 1004-1014. doi: 10.1097/TP.0000000000001068
67. Djamali A, Kaufman DB, Ellis TM et al. Diagnosis and management of antibody-mediated rejection: current status and novel approaches. Am J Transplant 2014; 14 (2): 255-271. doi: 10.1111/ajt.12589. Epub 2014 Jan 8
68. Добронравов ВА, Храброва МС, Мухаметдинова АО, Сиповский ВГ. Частотавыявленияипрогнозантительноопосредованногоотторженияприаллотрансплантациипочки. Нефрология 2016; 20(6): 82-89 [DobronravovVA, KhrabrovaMS, MukhametdinovaAO, SipovskiyVG. Chastotavyiavleniyaiprognosantitelno-oposredovannogoottorjeniapriallotransplantaciipochki. Nefrologiya 2016; 20(6): 82-89]
69. Gloor JM, Sethi S, Stegall MD et al. Transplant glomerulopathy: subclinical incidence and association with alloantibody. Am J Transplant 2007; 7(9): 2124-2132. doi: 10.1111/j.1600-6143.2007.01895.x
70. Husain S, Sis B. Advances in the understanding of transplant glomerulopathy. Am J Kidney Dis 2013; 62(2): 352-363. doi: 10.1053/j.ajkd.2012.10.026
71. Lesage J, Noël R, Lapointe I et al. Donor-specific antibodies, C4d and their relationship with the prognosis of transplant glomerulopathy. Transplantation 2015; 99(1): 69-76. doi: 10.1097/TP.0000000000000310
72. Fotheringham J, Angel CA, McKane W. Transplant glomerulopathy: morphology, associations and mechanism. Nephron Clin Pract 2009; 113(1): 1-7. doi: 0.1159/000228069
73. Remport A, Ivanyi, Z, Mathe B et al. Better understanding of transplant glomerulopathy secondary to chronic antibody-mediated rejection. Nephrol Dial Transplant 2014; 30(11): 1825-1833. doi: 10.1093/ndt/gfu371
74. Orandi BJ, Chow EH, Hsu A et al. Quantifying renal allograft loss following early antibody-mediated rejection. AmJTransplant 2015; 15(2): 489-498. doi: 10.1111/ajt.12982
75. Столяревич ЕС, Ильинский ИМ, Тырин ВВ, Томилина НА. Хроническая трансплантационная нефропатия: клиникоморфологические сопоставления. Нефрология и диализ 2001; 3 (1): 32 [StolyarevichES, IliinskiyIM, TyirinVV, Tomilina NA. Khronicheskayatransplantacionnayanefropatiya: kliniko morfologicheskiye sopostavleniya. Nefrologiya i dializ 2001; 3(1): 32]
Об авторах
В. А. ДобронравовРоссия
Добронравов Владимир Александрович - доктор медицинских наук, проф., заместитель директора.
197022, Санкт-Петербург, ул. Л. Толстого, д. 17М. С. Храброва
Россия
Храброва Мария Сергеевна - кандидат медицинских наук, кафедра пропедевтики внутренних болезней, ассистент.
197022, Санкт-Петербург, ул. Л. Толстого, д. 17, корп. 54, тел.: (812) 338-01-65
Рецензия
Для цитирования:
Добронравов В.А., Храброва М.С. ИММУНОМОРФОЛОГИЧЕСКИЕ ФЕНОТИПЫ ПОВРЕЖДЕНИЯ АЛЛОГРАФТА ПОЧКИ. Нефрология. 2017;21(6):9-19. https://doi.org/10.24884/1561-6274-2017-21-6-9-19
For citation:
Dobronravov V.A., Khrabrova M.S. IMMUNE AND MORPHOLOGICAL PHENOTYPES OF KIDNEY ALLOGRAFT INJURY. Nephrology (Saint-Petersburg). 2017;21(6):9-19. (In Russ.) https://doi.org/10.24884/1561-6274-2017-21-6-9-19








































