Перейти к:
ПОКАЗАТЕЛИ ОБМЕНА ЖЕЛЕЗА, ЭРИТРОПОЭТИНА, ГИПОКСИЕЙ ИНДУЦИРОВАННОГО ФАКТОРА ПРИ АНЕМИИ У ДЕТЕЙ С ХРОНИЧЕСКОЙ БОЛЕЗНЬЮ ПОЧЕК
https://doi.org/10.24884/1561-6274-2017-21-6-68-77
Аннотация
Цель: сопоставить показатели обмена железа, уровня гипоксией индуцированного фактора (HIF-1α) и эритропоэтина (ЭПО) у детей с анемией при ХБП С1–5.
Пациенты и методы. Выделены три группы пациентов: I – 32 детей до диализа с ХБП С1–5 без терапии, II – 18 детей до диализа с ХБП С2–5, получающие терапию препаратами железа и ЭПО, III группа – 30 диализных пациентов с ХБП С3–5, получающих терапию железом и ЭПО. Уровень сывороточного ЭПО определяли иммуноферментным анализом с использованием тест-системы BiomericaEPOELISA, CloudCloneCorpдля определения уровня HIF-1α.
Результаты: В I группе выявлено достоверное повышение уровня HIF-1α (0,089±0,011нг/мл) по сравнению нормальными (0,043 нг/мл) (p=0,0001). В II группе выявлены повышенные уровни ЭПО (63,01±14,84 MМЕ/мл) по сравнению с нормальными (17,56 MМЕ/мл) (p=0,0088) и HIF-1α (0,138±0,025 нг/мл) по сравнению с нормальными (0,043 нг/мл) (p=0,005). Сравнительное исследование ЭПО и HIF-1α у детей с ХБП показало достоверное повышение ЭПО и HIF-1α во II группе до диализа (на терапии) в сравнении с I группой до диализа (без терапии). Установлена корреляционная связь СКФ и HIF-1α у пациентов II группы.
Заключение: Выявлена прямо пропорциональная связь между уровнем СКФ и HIF-1α в крови у пациентов II группы с ХБП С2-5 до диализа, получающих препараты ЭПО и железа. У пациентов I группы до диализа (без терапии) и III группы (на диализе и терапии препаратами ЭПО, железа) сила связи СКФ и HIF-1α недостоверна.Ключевые слова
Для цитирования:
Лысова Е.В., Савенкова Н.Д. ПОКАЗАТЕЛИ ОБМЕНА ЖЕЛЕЗА, ЭРИТРОПОЭТИНА, ГИПОКСИЕЙ ИНДУЦИРОВАННОГО ФАКТОРА ПРИ АНЕМИИ У ДЕТЕЙ С ХРОНИЧЕСКОЙ БОЛЕЗНЬЮ ПОЧЕК. Нефрология. 2017;21(6):68-77. https://doi.org/10.24884/1561-6274-2017-21-6-68-77
For citation:
Lysova E.V., Savenkova N.D. IRON STATUS, ERYTHROPOIETIN, HYPOXIA INDUCTOR FACTORS IN CHILDREN WITH ANEMIA WITH CHRONIC KIDNEY DISEASE. Nephrology (Saint-Petersburg). 2017;21(6):68-77. (In Russ.) https://doi.org/10.24884/1561-6274-2017-21-6-68-77
ВВЕДЕНИЕ
Анемия является одним из основных и частых проявлений хронической болезни почек (ХБП) у детей [1-8]. В соответствии с данными KDIGO (2012), анемию диагностируют у детей с ХБП от 6 мес до 5 лет при концентрации гемоглобина ниже 110 г/л, у детей от 5-12 лет при гемоглобине менее 115 г/л; у детей от 12-15 лет при гемоглобине 120 г/л; у мальчиков старше 15 лет, при уровне гемоглобина ниже 130 г/л и ниже 120 г/л для девочек [4].
Причиной развития анемии при ХБП, в первую очередь, являются дефицит эритропоэтина (ЭПО) и железа, а также ряд других факторов [5]. Частота и тяжесть анемии нарастают по мере ухудшения функции почек в зависимости от стадии ХБП [5-7]. По данным (NAPRTCS), частота анемии у детей на 3-й стадии ХБП 73%, на 4-й стадии 87% и на 5-й стадии 93% [6].
M.A. Atkinson, С.В. Pierce, J.J. Fadrowski (2012) указывают на то, что сниженные показатели железа сыворотки в ассоциации с нормальным или повышенным ферритином и гемоглобином ниже среднего являются индикаторами для железодефицитного кроветворения [8].
Механизм, приводящий к дефициту синтеза ЭПО, объясняется прогрессирующим снижением количества перитубулярных фибробластоподобных интерстициальных клеток в почках, продуцирующих ЭПО [9]. Снижение напряжения кислорода в почках при ХБП продемонстрировано в ряде экспериментальных исследований [10, 11]. Это привело к широкому признанию того, что хроническая гипоксия почек является окончательным механизмом, ведущим к прогрессированию ХБП [10-15]. Y. Hirakawa, T. Tanaka, М. Nangaku (2017), обсуждая значение гипоксии при ХБП, считают, что в дополнение к врожденному низкому напряжению кислорода в почке при прогрессировании ХБП почечная ткань страдает от тяжелой гипоксии вследствие снижения поступления кислорода и увеличения его потребления [11].
В условиях гипоксии при низкой напряженности кислорода синтезируются факторы транскрипции, названные гипоксией индуцируемые факторы (hypoxia inductor factors - HIF's), играющие важную роль в кислородно-чувствительном механизме и репаративных реакциях [10]. Факторы, индуцированные гипоксией (hypoxia inductor factors - HIF's) HIF-1 и HIF-2, являются ключевыми медиаторами клеточного гомеостаза кислорода, контролируют передачу кислорода тканям и адаптацию к кислородному истощению путем регуляции экспрессии генных продуктов, включающихся в клеточный энергетический метаболизм, вазомоторную регуляцию, транспорт глюкозы, эритропоэз, ангиогенез, апоптоз, клеточную пролиферацию и другие процессы, влияя как на межклеточное взаимодействие (клетка - клетка), так и взаимодействие (клетка - внеклеточная структура) [16]. HIF-1α-субъединицы определены в гломерулярных и тубулоинтерстициальных клетках. Главным регулятором продукции ЭПО является HIF-1α, который открыт при изучении регуляции ЭПО [14].
E.A. Hamed, Т.В. El-Abaseri, A.O. Mohamed et al. (2012) [10] классифицируют гены, которые активируют HIF на три функциональные группы: 1) белки, участвующие в эритропоэзе, увеличивают поставку кислорода тканям, например, эритропоэтин, трансферрин, рецептор трансферрина, гем оксигеназа-1; 2) белки, которые повышают локальную доставку кислорода в ткани, например, белки синтеза оксида азота и сосудистого эндотелиального фактора роста (VEGF); 3) белки, требующиеся для адаптации к анаэробному клеточному метаболизму: глюкозотранспортер-1, большинство гликолитических ферментов.
К. Kimura et al. (2008) полагают, что постоянный синтез HIF-1α эпителиальными клетками канальцев почек способствует развитию интерстициального фиброза [13]. Публикация V.H. Haase (2012) подтверждает данные о том, что активация HIF-систем связана с развитием и прогрессированием ренального фиброза [14].
R. Luo, W. Zhang, C. Zhao (2015) [17] считают, что HIF-1α имеет значение в прогрессировании артериальной гипертензии при ХБП. Авторы полагают, что повышенный эндотелиальный HIF-I является существенным фактором для инициации повреждения и прогрессирования фиброза клубочков почек. Стимуляция экспрессии гена HIF-1α в эндотелиальных клетках индуцирует повреждение почек, артериальную гипертензию и прогрессирование ХБП [17].
Существует другое мнение. Так, T-W. Hung et al. (2013), наоборот, указывает на нарушение синтеза HIF-1α при выраженном фиброзе и снижении СКФ. Авторы выявили более высокие уровни HIF-1α при менее выраженном повреждении почек [15]. Показано, что выраженность синтеза HIF-1α пропорциональна скорости клубочковой фильтрации и степени фиброза почек. Высокий уровень HIF-1α обуславливает синтез ЭПО на ранних стадиях ХБП [15].

Рис.1. Путь гипоксией индуцированного фактора (HIF) по N. Gupta, J.B. Wish (2017) [19].
DcytB (duodenal cytochrome B) - дуоденальный цитохром B; DMT1 (divalent metal transporter 1) - транспортер двухвалентого железа 1; EPO (erythropoietin) - эритро- поэтин; PH (prolyl hydroxylase) - пролил гидроксилаза.
По мнению Z. Wang, Q. Zhu, Pl. Li (2014) [18], длительная активация HIF-1α является патогенетическим фактором при ХБП, связанным с ишемией/гипоксией [18].
На рис. 1. представлено кислород зависимое регулирование HIF с помощью пролилгидроксилаз (HIF-PH) по N. Gupta , J.B. Wish (2017) [19].
Экспрессия HIF-1α регулируется кислородом. При нормальной концентрации кислорода происходит гидроксилирование аминокислотных остатков пролина молекулы HIF-1α в результате активности O2 и/или Fe-зависимого фермента пролилгидроксилазы (PHD), который является молекулярным сенсором кислорода [20]. Измененная таким образом субъединица HIF-1α через ряд стадий подвергается протеасомной деградации. В состоянии гипоксии белковая молекула HIF-1α не гидроксилируется, остается стабильной и накапливается. Субъединицы HIF-1α и HIF-β объединяются [20].
Стало известно, что увеличение уровня HIF-1 приводит к повышению экспрессии генов, которые обеспечивают адаптацию клетки к гипоксии и стимулируют эритропоэз (гены эритропоэтина), ангиогенез (ген фактора роста эндотелия сосудов VEGF), ферменты гликолиза (ген альдолазы, лактатдегидрогеназы, фосфофруктокиназы, пируваткиназы и др.). Кроме того, HIF-1 регулирует экспрессию генов, участвующих в обмене железа, регуляции сосудистого тонуса, клеточной пролиферации, апоптоза, липогенеза, формировании каротидных клубочков, развитии B-лимфоцитов [20].
HIF регулирует транскрипцию кислородчувствительных генов, таких как ген ЭПО, активность других важных медиаторов, в частности VEGF (сосудистый эндотелиальный фактор роста), транспортеров глюкозы и синтазу окиси азота. HIF - гетеродимер, состоящий из альфа- и бета-субъединиц, его постоянно экспрессируют почки. В отсутствие гипоксии HIF-1α и HIF-2α быстро деградируют. При падении уровня гемоглобина происходит ингибирование деградации альфа-субъединиц, что создает условия димери- зации с HIF-1a. В результате активный комплекс HIF связывается комплементарным сайтом «усиливающего» участка гена ЭПО, повышая продукцию последнего [21].
Цель исследования: сопоставить показатели обмена железа, HIF-1α, ЭПО у детей с анемией при ХБП до диализа и на диализе, получающих и неполучающих терапию препаратами железа и эритропоэтина.
ПАЦИЕНТЫ И МЕТОДЫ
В исследование включено 80 детей в возрасте от 1 года до 18 лет с ХБП C1-5, протекавшей с анемией.
Из 80 детей с анемией при ХБП выделены три группы пациентов: I - 32 пациента с ХБП С1-5 в преддиализной стадии, не получавших терапию препаратами железа и эритропоэтин- стимулирующие препараты (ЭСП); II - 18 пациентов с ХБП С2-5 в преддиализной стадии, получавших терапию препаратами железа и ЭСП; III - 30 пациентов с ХБП С3-5 на диализе, из них 21 на гемодиализе (ГД), 9 на перитонеальном диализе (ПД), получавших терапию препаратами железа и ЭСП. Диагноз и стадии ХБП у детей устанавливали в соответствии с рекомендациями NKF/DOQI (2002); KDIGO (2012); Национальными рекомендациями (2012) [1-3]. СКФ по клиренсу креатини- на определяли в формуле Schwartz.
Анемию диагностировали при концентрации гемоглобина ниже 110 г/л у детей от 6 мес до 5 лет, ниже 115 г/л у детей 5-12 лет и ниже 120 г/л у детей 12-15 лет и старше в соответствии с рекомендациями KDIGO (2012) [4].
Дефицит железа устанавливали при снижении уровня ферритина ≤100 (мкг/л) и насыщения трансферрина (TSAT) ≤20% в соответствии с данными KDIGO (2012) [4]. В соответствии с обновленными российскими национальными рекомендациями по диагностике и лечению анемии при хронической болезни почек (2014), функциональный дефицит железа усанавливали при уровне ферритина > 100 мг/л, при снижении насыщения трансферрина < 20% [20].
Уровень сывороточного эритропоэтина определяли твердофазным хемилюминесцентным иммуноферментным анализом (метод «сэндвича») с использованием тест-системы «Biomerica EPO ELISA» в лаборатории клинической иммунологии НИЦ СПбГПМУ. Концентрация ЭПО в сыворотке крови в норме составляет 3,22-31,9 ММЕ/мл. При сравнении уровня ЭПО в группах использовали среднее значение нормальных показателей (17,56 ММЕ/мл). При сравнении уровня HIF-1a определяли твердофазным хемилюминесцентным иммуноферментным анализом (метод «сэндвича») с использованием комплекта для определения уровня «HIF-1α, Cloud-Clone Corp» в условиях лаборатории клинической иммунологии НИЦ СПбГПМУ.
В норме уровень HIF-1α в сыворотке крови присутствует в концентрации 0,043±0,007 нг/мл. При сравнении уровня HIF-1α использовали среднее значение нормальных показателей (0,043 нг/мл).
Статистический анализ результатов исследования проводили с использованием стандартных пакетов программ прикладного статистического анализа (Microsoft Office Excel 2010, Statistica for Windows v.6.1). Методы описательной статистики включали оценку среднего арифметического (М), ошибки среднего значения (m) и среднеквадратичного отклонения (σ) для признаков, имеющих нормальное распределение. Достоверность различий сравниваемых показателей определена по непараметрическому U-критерию Манна-Уитни, параметрическому критерию t Стьюдента. Критический уровень достоверности нулевой статистической гипотезы (p) принят за 0,05. Оценку силы связи между количественными признаками проводили с помощью рангового коэффициента корреляции (R) Спирмена.
РЕЗУЛЬТАТЫ
Среди 80 детей с ХБП, включенных в исследование, 41 девочка (51,25%) и 39 мальчиков (48,75%) (табл. 1).
Наиболее частыми причинами развития ХБП являлись врожденные и наследственные заболевания почек из 80 больных у 60 (75%), из которых CAKUT-синдром установлен у 34 (56,5 %). В структуру СAKUT у 34 пациентов вошли ПМР IV-V степени (односторонний и двусторонний) с уретерогидронефрозом (18), клапан задней уретры, инфравезикальная обструкция, нейрогенная дисфункция мочевого пузыря (гипорефлекторный, арефлекторный мочевой пузырь), полное удвоение почки, рефлюкс-нефропатия (8), гидронефроз III- IV, вследствие обструкции пиелоуретрального сегмента (6), экстрофия мочевого пузыря (1).
Из 80 пациентов с ХБП диагностирована С5 у 29 (36,25%), С4 у 28 (35%), С 3 у 12 (15%), С2 у 8 (10%), С1 у 3 (3,75%). Данные представлены на рис. 2.
Таблица 1
Распределение 80 пациентов с анемией при ХБП по возрасту и полу
Возраст детей | Количество детей | Количество девочек | Количество мальчиков | |||
|---|---|---|---|---|---|---|
(в годах) | n | % | n | % | n | % |
1 -2 года | 9 | 11,25 | 2 | 2,5 | 7 | 8,75 |
2-7 лет | 18 | 22,25 | 5 | 6,25 | 13 | 16,25 |
7-12 лет | 18 | 22,25 | 10 | 12,5 | 8 | 10 |
12-18 лет | 35 | 43,75 | 24 | 30 | 11 | 13,75 |
Итого | 80 | 100 | 41 | 51,25 | 39 | 48,75 |
Таблица 2
Распределение обследованных мальчиков и девочек по стадиям ХБП
Стадия ХБП | Количество пациентов | Величина СКФ, мл/мин/1,73 м2 | Число мальчиков | Число девочек |
|---|---|---|---|---|
1 | 3 (3,75%) | 99,44±3,73 | 2 | 1 |
2 | 8 (10%) | 72,56±3,16 | 3 | 5 |
3 | 12 (15%) | 40,43±2,56 | 7 | 5 |
4 | 28 (35%) | 21,98±0,72 | 18 | 10 |
5 | 29 (36,25%) | 10,07±0,46 | 11 | 8 |
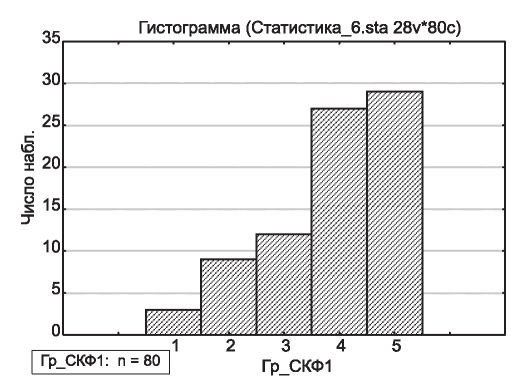
Рис. 2. Стадии ХБП у 80 пациентов.
В табл. 2 представлено распределение обследованных мальчиков и девочек с ХБП по стадиям.
Таблица 3
Основные клинические данные, показатели гемоглобина, обмена железа, ЭПО и HIF-1α у детей с ХБП в 3 группах (M±m)
Показатели (нормы) | I группа, 32 ребенка до диализа | II группа, 18 детей до диализа | III группа, 30 детей на диализе | p 1/2 | p 1/3 | p 2/3 |
|---|---|---|---|---|---|---|
Возраст, годы | 7,68±0,97 | 8,48±1,35 | 11,93±0,77 | 0,62 | 0,001 | 0,021 |
Креатинин, ммоль/л | 0,203±0,028 | 0,28±0,059 | 0,56±0,038 | 0,18 | 0,000 | 0,0002 |
СКФ, мл/мин/1,73 м2 | 42,89±4,89 | 27,46±4,82 | 13,47 ±1,15 | 0,044 | 0,000 | 0,0405 |
Hb, г/л | 103,06±1,52 | 100,05±2,38 | 85,56±2,61 | 0,271 | 0,000 | 0,0008 |
Er х10 12 /л | 3,79±0,11 | 3,59±0,12 | 2,92±0,12 | 0,276 | 0,000 | 0,001 |
Fe сыв, мкмоль/л | 11,27±0,95 | 10,68± 1,16 | 15,22±0,95 | 0,707 | 0,005 | 0,004 |
ОЖСС, % | 55,04±2,08 | 51,30±2,52 | 44,71 ±2,45 | 0,27 | 0,002 | 0,08 |
Трансферин насыщенный, % | 29,73±2,76 | 25,58±2,16 | 37,53±2,48 | 0,309 | 0,04 | 0,001 |
Трансферрин свободный, % | 39,54±2,67 | 38,13±2,98 | 30,93±1,89 | 0,74 | 0,011 | 0,037 |
Ферритин, мкг/л | 167,87±25,27 | 134,99±27,16 | 377,12±79,05 | 0,408 | 0,012 | 0,025 |
EPO, ММЕ/мл | 28,65±3,66 | 63,01±14,84 | 33,59±7,9 | 0,006 | 0,564 | 0,06 |
HIF-1a, нг/мл | 0,089±0,011 | 0,138±0,025 | 0,098±0,013 | 0,049 | 0,639 | 0,14 |
У 80 пациентов с ХБП выявлена нормоцитар- ная, нормохромная анемия. У 80 пациентов с ХБП С1-5 среднее значение гемоглобина составило 95,83±1,55 г/л без учета возраста. Из 80 пациентов с ХБП у 29 пациентов с С5 среднее значение гемоглобина составило 83,79±2,55 г/л, у 28 с С4 100, 39±1,74 г/л, у 12 пациентов с С3 104,92±1,86, у 8 с С2 105,75±1, 68 г/л, у 3 пациентов со средним возрастом (3,43±0,81 года) с ХБП С1 среднее значение гемоглобина составило 106,67±3,53 г/л.
В табл. 3 представлены основные клиниколабораторные показатели обследованных больных.
Основные клинические данные, показатели гемоглобина, обмена железа, ЭПО и HIF-1α у 32 детей с ХБП С1-5 I группы, не получающих препараты железа и эритропоэтина
У 32 пациентов с ХБП диагностированы ХБП С5 у 3 (9,4%), С4 у 12 (37,5%), С3 у 8 (25%), С2 у 6 (18,8%), С1 у 3 (9,4%).
Анемия средней степени тяжести из 32 детей выявлена у 2 (6 %), легкой степени тяжести у 30 (94%), тяжелая анемия не выявлена. Из 32 детей с ХБП у 3 с С1 среднее значение гемоглобина составило 106,67±3,53 г/л, у 6 с С2 среднее значение гемоглобина составило 106,83±1,87 г/л, у 8 с С3 среднее значение гемоглобина составило 107,38±1,08 г/л, у 12 с С4 среднее значение гемоглобина составило 101,25±1,92 г/л, у 3 с С5 среднее значение гемоглобина составило 87,67±9,56 г/л. Прослежена связь снижения гемоглобина и прогрессированием ХБП до С5.
Абсолютный дефицит железа установлен по снижению уровня ферритина (62,5±19,9 мкг/л) и насыщения трансферрина (12,1±5,3 %) у 5 (15,6%) из 32 пациентов I группы с анемией при ХБП до диализа, не получающих препараты железа и ЭСП. Абсолютный дефицит железа установлен по стадиям ХБП у 1 из 3 пациентов с С5, у 2 (16%) из 12 пациентов с С 4, у 2 (11,76%) из 14 пациентов с С2-3. Дефицит железа при ХБП С1 не установлен. Видно, что частота дефицита железа нарастала с прогрессированием ХБП до С5.
Функциональный дефицит железа у детей I группы не выявлен.
В I группе у 32 пациентов с ХБП С1-5, не получающих терапию, выявлен нормальный уровень ЭПО (28,65±3,66 ММЕ/мл). При сравнении уровня ЭПО I группы со средним значением нормальных показателей (17,56 ММЕ/мл) выявлено статистически значимое повышение уровня ЭПО у 32 пациентов с ХБП С1-5 по сравнению со средним значением нормальных значений (p=0,014) и высокий уровень HIF-I α (0,089±0,011 нг/мл) по сравнению со средним значением нормальных показателей (0,043 нг/мл), p=0,005.
При сравнении уровня ЭПО в I группе из 32 пациентов, не получаюших препараты железа и эритропоэтина, выявлено, что у 15 пациентов (19,7±3,43 ММЕ/мл) с ХБП С4-5 уровень ЭПО достоверно ниже по сравнению с таковым (36,54±5,62 ММЕ/мл) у 17 пациентов с ХБП С1-3 (p=0,024). При сравнении ЭПО (36,54±5,62 ММЕ/мл) у 17 пациентов с ХБП С1-3 и среднего нормального показателя ЭПО (17,56 ММЕ/мл) получено статистически достоверное повышение уровня ЭПО у 17 пациентов с ХБП С1-3 (p=0,003).
На рис. 3 представлен уровень ЭПО при ХБП С1-3 (17) и С4-5 (15) в I группе из 32 детей, не получающих препараты железа и эритропоэтина (p=0,024).
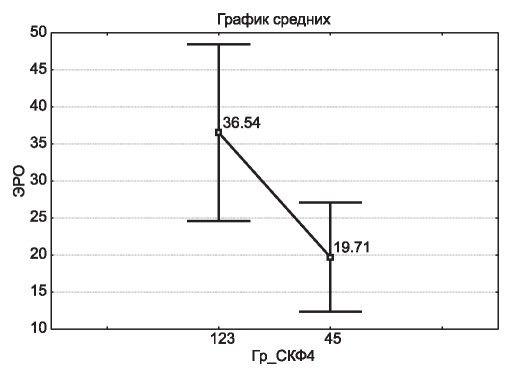
Рис. 3. Уровень ЭПО (ММЕ/мл) в крови при ХБП С1-3 у 17 и С4-5 у 15 из 32 пациентов I группы, не получающих препараты железа и эритропоэтина.
В I группе у 32 пациентов с ХБП С1-5, не получающих терапию при помощи рангового коэффициента корреляции Спирмена, выявлена прямо пропорциональная связь между уровнями СКФ и гемоглобина (R=0,536) (p=0,0015); прямо пропорциональную связь между показателями СКФ и Er (R=0,738) (p=0,00001).
Основные клинические данные, показатели гемоглобина, обмена железа, ЭПО и HIF-1α у 18 детей с ХБП С2-5 II группы, получающих препараты железа и эритропоэтина
Во II группе у 18 пациентов снижена СКФ 27, 46 ± 20,45 мл/мин/1,73 м2. Из 18 пациентов с ХБП диагностирована С5 у 4 (22,2%), С4 у 10 (55,6%), С3 у 2 (11,1%), С2 у 2 (11,1%). Анемия средней степени тяжести во II группе выявлена у 3 (16,7%), легкой степени тяжести у 15 (83,3%). Из 18 детей установлены показатели гемоглобина у 2 с ХБП С2 - 102,5±3,5 г/л, у 2 с С3 - 106±4 г/л, у 10 с С4 - 102±2,56 г/л, у 4 с С5 - 91±7,33 г/л.
Абсолютный дефицит железа установлен по снижению уровня ферритина (28,4±12,8 мкг/л) и насыщения трансферрина <12,7±5,58% у 3 (16,6%) из 18 пациентов II группы с анемией при ХБП до диализа, получающих препараты железа и ЭСП. Из них у 2 (50%) из 4 пациентов абсолютный дефицит железа установлен при ХБП С5, у 1 (10%) из 10 пациентов с ХБП С 4, у пациентов с ХБП С2-3 дефицита железа не установлено. Функциональный дефицит железа у детей не выявлен.
В II группе у 18 пациентов с ХБП С 2-5 установлено повышение уровня ЭПО (63,01±14,84 ММЕ/мл) по сравнению со средним нормальным значением ЭПО (17,56 ММЕ/мл), p=0,0088. У 18 пациентов установлено повышение уровня HIF-Ια (0,138±0,025 нг/мл) по сравнению с нормальными значениями HIF-Ια (0,043 нг/мл), p=0,005.
Во II группе у 18 пациентов с ХБП при помощи рангового коэффициента корреляции Спирмена выявлена прямо пропорциональная связь между показателями СКФ и Er (R=0,632) (p=0,004); обратно пропорциональная связь между показателями СКФ и Fe в крови (R=-0,479) (p=0,043); прямо пропорциональная связь между уровнем СКФ и HIF-1a (R=0,684) (p=0,0017).
Основные клинические данные, показатели гемоглобина, обмена железа, ЭПО и HIF-1g у 30 детей с ХБП С 3-5 III группы, получающих препараты железа и эритропоэтина
У 30 детей выявлено среднее значение СКФ 13,47 ± 1,15 мл/мин/1,73 м2. Из 30 пациентов с ХБП диагностированы С5 у 22 (73,3%), С4 у 6 (20%), С3 у 2 (6,7%). Анемия средней степени тяжести в III группе больных с ХБП выявлена у 12 (40%), легкой у 12 (40%), тяжелой у 6 (20%).
Из 30 детей III группы с ХБП выявлено снижение гемоглобина у 3 детей с С3 94±6 г/л, у 6 детей с С4 96±5,94 г/л, у 22 детей с С5 81,95±2,85 г/л. Абсолютного и функционального дефицита железа не установлено.
В III группе у детей не выявлено статистически значимых различий между уровнем ЭПО (33,59±7,9 ММЕ/мл) и нормальными значениями (17,56 ММЕ/мл); выявлен более высокий уровень HIF-1α (0,098±0,01 нг/мл) в сравнении с нормальным значением (0,043 нг/мл) (p=0,005). В III группе пациентов при помощи рангового коэффициента корреляции Спирмена не установлено связи между СКФ и ЭПО, СКФ и HIF-1a.
Результаты сравнительного исследования уровней ЭПО, HIF-1α в крови у 80 пациентов с ХБП в 3 группах
При сравнении уровней ЭПО у 32 пациентов с ХБП С1-5 из I группы (до диализа), не получающих терапию препаратами железа и эритропоэтина, и у 18 пациентов с ХБП С2-5 II группы (до диализа), получающих терапию препаратами железа и эритропоэтина, установлен более высокий его уровень у детей, получающих терапию (28,65±3,66 и 63,01±14,84 ММЕ/мл соответственно) (р=0,006).
При сравнении уровней HIF-1α в крови (0,089±0,63 нг/мл) у 32 пациентов с ХБП С1-5 I группы (до диализа), не получающих терапию препаратами железа и эритропоэтина, и HIF-1α (0,138±0,025 нг/мл) у 18 пациентов с ХБП С2-5 II группы (до диализа), получающих терапию препаратами железа и эритропоэтина, выявлен более высокий уровень HIF-1α у детей, получающих терапию (р=0,049). Не выявлено достоверных различий уровня ЭПО, HIF-1α в крови у пациентов с ХБП при сравнении I и III групп, II и III групп.
При анализе тесноты связи HIF-1α и СКФ в крови у 18 пациентов с ХБП С2-5 II группы до диализа, получающих препараты железа и эри- тропоэтина, обнаружена статистически значимая корреляционная связь Спирмена (R=0,684) (p=0,0017). В I и II группах пациентов эта связь HIF-1α и СКФ статистически незначима.
ОБСУЖДЕНИЕ
Нормоцитарная нормохромная анемия является частым проявлением ХБП у детей и имеет неблагоприятные клинические последствия, такие как повышенный риск сердечно-сосудистых заболеваний, снижение качества жизни и ограничение толерантности к физической нагрузке [5, 6, 8, 9].
Мы представили особенности показателей гемоглобина, эритроцитов, обмена железа, уровней ЭПО, HIF-1α в крови у 80 пациентов с ХБП, протекающей с анемией, в возрасте от 1 года до 18 лет, сопоставили полученные данные в 3 группах пациентов до диализа и на диализе, получающих и неполучающих терапию препаратами железа и эритропоэтина.
По данным исследования, у 80 детей с ХБП анемия при С5 диагностирована в 36,3%, ХБП С4 в 33,8%, ХБП С3 в 15%, ХБП С2 в 11,3%, ХБП С1 в 3,8%. Наши данные подтверждают результаты масштабных исследований NHANES III (2005) и A. О. Staples et al. (2009), CKiD (2008), свидетельствующих о нарастании частоты и тяжести анемии при прогрессировании ХБП у детей [22-24]. Нами, как и другими авторами [22-24], подтверждено прогрессирование тяжести анемии в зависимости от снижения СКФ при ХБП у детей.
Наши результаты соответствуют данным R. Barocco et al. (2011) [7], показавшим повышение дефицита железа у детей с анемией с 4,3% на 2 стадии ХБП до 29,6% на 3 стадии ХБП [7].
Нами абсолютный дефицит железа у 32 пациентов I группы до диализа, нелеченных препаратами эритропоэтина и железа, установлен у 1 (33%) из 3 пациентов при ХБП С5, у 2 (16%) из 12 пациентов с ХБП С4, у 2 (11,76%) из 17 пациентов с ХБП С1-3 Видно, что частота дефицита железа нарастала с прогрессированием ХБП до С5. Причинами дефицита железа на более поздних стадиях ХБП могут стать частый забор крови, кровопотери при хирургических процедурах (таких как создание сосудистого доступа), влияние на абсорбцию железа таких медикаментов, как противоязвенные, а также сниженная абсорбция железа вследствие воспаления [5-8].
По нашим данным, концентрация ЭПО у 17 пациентов с ХБП С1-3 I группы, не получающих препараты железа и ЭПО, достоверно выше по сравнению со средними значениями нормальных показателей. При сравнении уровня ЭПО в I группе из 32 пациентов, не получающих препараты железа и эритропоэтина, у 17 пациентов с ХБП С1-3 уровень ЭПО достоверно выше по сравнению с аналогичными показателями 15 пациентов с ХБП С4-5. Наши данные схожи с результатами исследования В.Б. Бордулина и соавт. (2013), которые отметили, что уровень ЭПО у больных с ХБП С1-3 статистически значимо выше, чем в группе здоровых лиц с нормальными показателями. При ХБП С4-5 авторы отметили снижение уровня ЭПО до уровня здоровых лиц [25]. В нашем исследовании отмечается снижение уровня ЭПО из 32 пациентов I группы у 15 с ХБП С4-5 по сравнению с 17 пациентами при ХБП С1-3.
Нами выявлен повышенный уровень ЭПО у 18 детей с ХБП С2-5 II группы, получающих терапию препаратами железа и ЭПО, в отличие от 32 детей I группы без терапии. В III группе у 30 пациентов с ХБП на диализе, получающих терапию препаратами ЭПО и железа, уровень ЭПО не отличался от нормальных значений.
Дети с ХБП II и III групп продолжали получать препараты ЭПО и железа, так как, в соответствии с рекомендациями KDIGO (2012), целевой уровень гемоглобина - 110 г/л оставался недостигнутым. Это можно объяснить тем, что потребности в дозе ЭСП существенно различаются для взрослых и детей. Результаты исследования NAPRTCS свидетельствуют о том, что дети младшего возраста требуют более высоких доз ЭСП: 275-350 МЕ/кг/нед для детей раннего возраста и 200-250 МЕ/кг/нед для детей старше 6 лет [6].
В.А. Warady, D.M. Silverstein (2014) [26] указывают на необходимость в более высоких дозах ЭСП у детей младшего возраста может быть связана с существованием и элиминацией негемопоэзных связей у этих пациентов. Повышенные дозы могут требоваться во время ускоренного роста тела. Еще не проведено рандомизированного контро- лируемоего исследования для создания рекомендаций по дозированию ЭСП у детей, особенно младшего возраста [26].
При оценке уровня HIF-1α в крови у пациентов I группы с анемией при ХБП С1-5 до диализа, не получающих терапию, и пациентов II группы с ХБП С2-5, находящихся на терапии препаратами эритропоэтина и железа, выявлено, что концентрация HIF-1α в крови у больных II группы, получающих препараты эритропоэтина и железа, достоверно выше нормального значения HIF-1α и уровня HIF-1α в крови у детей I группы без терапии.
При сравнении уровня ЭПО в I группе из 32 пациентов, не получающих препараты железа и эритропоэтина, у 17 пациентов с ХБП С1-3 уровень ЭПО достоверно выше по сравнению с аналогичными показателями 15 пациентов с ХБП С4-5, что свидетельствует о роли HIF-1α в синтезе эри- тропоэтина на ранних С1-3 стадиях ХБП. Наши данные подтверждают результаты исследования T-W. Hung [15], демонстирующего повышенные уровни HIF-1α у больных с ХБП, еще не имевших значительного повреждения почек [15].
В исследовании мы обнаружили прямо пропорциональную связь между уровнем СКФ и HIF-1 a в крови у пациентов II группы с ХБП С2-5 до диализа, получающих препараты эритропоэтина и железа. Наши результаты соответствуют данным T-W. Hung (2013), показавшим, что выраженность синтеза HIF-1α прямо пропорциональна СКФ при ХБП [15].
N. Gupta, J. Wish [19] отмечают ключевую роль HIF в патофизиологии ХБП как главного регулятора адаптивного ответа при гипоксии. В настоящее время дано научное обоснование новой перспективной терапии анемии при ХБП в результате фармакологической активация HIF [19, 27-30].
N. Chen et al. [29] сообщают о 2-й фазе исследования по применению перорального препарата FG-4592 - (ROXADUSTAT) для лечения анемии при ХБП. FG-4592 представляет собой ингибитор пролилгидроксилазы (HIF-PHI) гипоксией индуцируемого фактора (HIF), способствующий координированному эритропоэзу через фактор транскрипции HIF. HIF является транскрипционным фактором, который индуцирует экспрессию ЭПО, рецепторов к ЭПО и белков, которые способствуют абсорбции и рециркуляции железа из системы хранения макрофагов железа [29]. HIF регулируется семейством пролилгидроксилаз (HIF-PHS), которые индуцируются и снижают функцию HIF в нормальных кислородных условиях, но HIF- PHS ингибируются в условиях гипоксии. FG-4592 является мощным и обратимым ингибитор про- лилгидроксилазы (HIF-PHI), который временно индуцирует HIF-стабилизацию и приводит к функциональному HIF-транскрипционному эритропоэтическому ответу [27-31].
M. Bonomini et al. [28] отмечают, что терапия препаратами железа и эритропоэтина в клинической практике при анемии у пациентов с ХБП обеспечивает увеличение концентрации гемоглобина без риска повторных переливаний крови и улучшает качество жизни пациентов. Однако рекомбинантные ЭСП дороги и требуют парентерального введения. Более того в результате рандомизированных клинических испытаний показано, что более высокие дозы гемоглобина и/или высокие дозы ЭСП могут нанести значительный вред, такой как повышенный риск сердечно-сосудистых заболеваний, снижение качества жизни и ограничение толерантности к физической нагрузке [28-33]. С пониманием роли HIF в регуляции синтеза ЭПО при анемии у пациентов с ХБП открываются новые возможности лечения анемии при ХБП [29-34].
Развитие и тяжесть анемии при ХБП существенно зависит от этиологии и степени прогрессирования [5-7, 32-35]. Такая тесная связь анемии с показателями тяжести течения ХБП (выявленная у взрослых пациентов) [35] подтверждена в нашем исследовании анемии при ХБП у детей и подростков.
ЗАКЛЮЧЕНИЕ
Прослежена связь частоты снижения гемоглобина и дефицита железа при анемии с прогрессированием ХБП до С5 у детей и подростков.
В сравнении с нормальными показателями установлено повышение уровня ЭПО в общей группе у 80 пациентов с ХБП С1-5 как в I группе пациентов с С1-5 до диализа, не получающих терапию, так у пациентов II группы с С2-5 до диализа, получающих терапию железом и эритро- поэтином. В III группе пациентов с С3-5 на диализе, получающих терапию препаратами железа и эритропоэтина, уровень ЭПО статистически не отличался от нормальных показателей.
Сравнительное исследование уровней ЭПО и HIF-1α у детей с ХБП в 3 группах показало статистически достоверное повышение ЭПО и HIF-1α во II группе до диализа (на терапии) в сравнении с I группой детей до диализа (без терапии).
Результаты исследования, полученные с помощью рангового коэффициента корреляции Спирмена, показали различную силу взаимосвязи между уровнем HIF-1α и СКФ. Выявлена прямо пропорциональная связь между уровнем СКФ и HIF-1α в крови у пациентов II группы с ХБП С2-5 до диализа, получающих препараты эритропоэтина и железа. В I группе пациентов с ХБП С1-5 до диализа, не получающих терапию, и в III группе пациентов с ХБП С3-5 на диализе, получающих терапию препаратами железа и эритропоэтина, сила связи СКФ и HIF-1α недостоверна.
Список литературы
1. Hogg RJ, Furth S, Lemley KV et al. National Kidney Foundation’s Kidney Disease Outcomes Quality Initiative clinical practice guidelines for chronic kidney disease in children and adolescents: evaluation, classification, and stratification. Pediatrics 2003; 111(6 Pt 1): 1416-1421
2. Kidney Disease: Improving Global Outcomes (KDIGO) CKD work group. KDIGO 2012 clinical practice guideline for the evaluation and management of chronic kidney disease. Kidney International Supplements 2013; 3(1): 1–150
3. Смирнов АВ, Шилов ЕМ, Добронравов ВA и др. Национальные рекомендации. Хроническая болезнь почек: основные принципы скрининга, диагностики, профилактики и подходы к лечению. Национальные рекомендации. Нефрология 2012; 16(1): 89-115 [SmirnovAV, ShilovEM, DobronravovVAidr. Nacional’nyerekomendacii. Hronicheskajabolezn’ pochek: osnovnyeprincipyskrininga, diagnostiki, profilaktikiipodhodyklecheniju. Nacional’nye rekomendacii. Nefrologija 2012; 16(1): 89-115]
4. McMurray J, Parfrey PS, Adamson JW et al (KDIGO work group membership). KDIGO Clinical Practice Guideline for Anemia in Chronic Kidney Disease. Kidney International Supplements 2012; 2(4): 279–335. doi: 10.1038/kisup.2012.37
5. Avner ED, Harmon WE, Niaudet P, Yoshikawa N. Management of Chronic Kidney Disease. In: VanDeVoorde RG, Warady BA. Pediatric Nephrology. Sixth Completely Revised, Updated and Enlarged Edition, Volume 2. Springer-Verlag, Berlin, 2008;1660-1692
6. Atkinson MA, Martz K, Warady BA, Neu AM. Risk for anemia in pediatric chronic kidney disease patients: a report of NAPRTCS. Pediatr Nephrol 2010; 25(9): 1699–1706. doi: 10.1007/s00467-010-1538-6
7. Baracco R, Saadeh S, Valentini R et al. Iron deficiency in children with early chronic kidney disease. Pediatric Nephrol 2011; 26(11): 2077-2080. doi: 10.1007/s00467-011-1946-2
8. Atkinson MA, Pierce CB, Fadrowski JJ et al. Association between common iron store markers and hemoglobin in children with chronic kidney disease. Pediatr Nephrol 2012; 27(12): 2275-2283. doi: 10.1007/s00467-012-2266-x
9. Atkinson MA, Furth SL. Anemia in children with chronic kidney disease. Nat Rev Nephrol 2011; 7(11): 635–641. doi: 10.1038/nrneph.2011.115
10. Hamed EA, El-Abaseri TB, Mohamed AO et al. Hypoxia and oxidative stress markers in pediatric patients undergoing hemodialysis: cross section study. BMC Nephrol 2012; 13: 13-136. doi: 10.1186/1471-2369-13-136
11. Hirakawa Y, Tanaka T, Nangaku M. Renal Hypoxia in CKD; Pathophysiology and Detecting Methods. Front Physiol 2017; 21: 8-99. doi: 10.3389/fphys.2017.00099
12. Nangaku M, Eckardt KU. Hypoxia and the HIF system in kidney disease. J Mol Med 2007; 85(12): 1325–1330. doi: 10.1007/s00109-007-0278-y
13. Kimura K, Iwano M, Higgins DF et al. Stable expression of HIF-1alpha in tubular epithelial cells promotes interstitial fibrosis. Am J Physiol Renal Physiol 2008; 295(4): 1023-1029. doi: 10.1152/ajprenal.90209.2008
14. Haase VH. Hypoxia-inducible factors in the kidney. Am J Physiol Renal Physiol 2006; 291(2): 271–281. doi: 10.1152/ajprenal.00071.2006
15. Hung TW, Liou JH, Yeh KT et al. Renal expression of hypoxia inducible factor-1α in patients with chronic kidney disease: a clinicopathologic study from nephrectomized kidneys. Indian J Med Res 2013; 137(1): 102-110
16. Левина АА, Макешова АБ, Мамукова ЮИ и др. Регуляция гомеостаза кислорода. Фактор, индуцированный гипоксией (HIF) и его значение в гомеостазе кислорода. Педиатрия. Журн им. Г.Н. Сперанского 2009; 87(4): 92-97 [LevinaAA, MakeshovaAB, MamukovaJuIidr. Reguljacija gomeostaza kisloroda. Faktor, inducirovannyj gipoksiej (HIF) i ego znachenie v gomeostaze kisloroda. Pediatrija. Zhurnal im. G.N. Speranskogo 2009; 87(4): 92-97]
17. Luo R, Zhang W, Zhao C et al. Elevated Endothelial Hypoxia-Inducible Factor-1α Contributes to Glomerular Injury and Promotes Hypertensive Chronic Kidney Disease. Hypertension 2015; 66(1): 75-84. doi: 10.1161/HYPERTENSIONAHA.115.05578
18. Wang Z, Zhu Q, Li PL. Silencing of hypoxia-inducible factor-1α gene attenuates chronic ischemic renal injury in twokidney, one-clip rats. Am J Physiol Renal Physiol 2014; 306(10): 1236-1242. doi: 10.1152/ajprenal.00673.2013
19. Gupta N, Wish JB. Hypoxia-Inducible Factor Prolyl Hydroxylase Inhibitors: A Potential New Treatment for Anemia in Patients with CKD. Am J Kidney Dis 2017; 69(6): 815-826. doi: 10.1053/j.ajkd.2016.12.011
20. Новиков ВЕ, Левченкова ОС. Гипоксией индуцированный фактор как мишень фармакологического воздействия. Обзоры по клинической фармакологии и лекарственной терапии 2013; 11(2): 8-16 [NovikovVE, Levchenkova OS. Gipoksiej inducirovannyj faktor kak mishen' farmakologicheskogo vozdejstvija. Obzory po klinicheskoj farmakologii i lekarstvennoj terapii2013; 11(2): 8-16]
21. Шило ВЮ, Добронравов ВА, Ермоленко ВМ и др. Обновленные Российские Национальные рекомендации по диагностике и лечению анемии при хронической болезни почек в редакции 2014 года. http://www.nephro.ru/content/files/anemiaRussian2014.pdf [ShiloVJu, DobronravovVA, ErmolenkoVMidr. Obnovlennye Rossijskie Nacional’’ nye rekomendacii po diagnostike i lecheniju anemii pri hronicheskoj bolezni pochek vredakcii 2014 goda. http://www.nephro.ru/content/files/anemiaRussian2014.pdf]
22. Hollowell JG, Van Assendelft OW, Gunter EW et al. Hematological and iron-related analytes – reference data for persons aged 1 year and over: United States, 1988–94. Vital Health Stat 2005; 11(247): 1–156
23. Staples AO, Wong CS, Smith JM et al. Anemia and risk of hospitalization in pediatric chronic kidney disease. Clin J Am Soc Nephrol 2009; 4(1): 48–56. doi: 10.2215/CJN.05301107
24. Fadrowski JJ, Pierce CB, Cole SR et al. Hemoglobin decline in children with chronic kidney disease: baseline results from the chronic kidney disease in children prospective cohort study. Clin J Am Soc Nephrol 2008; 3(2): 457–462. doi: 10.2215/CJN.03020707
25. Бородулин ВБ, Бычков ЕН, Протопопов АА и др. Эритропоэтин – маркер хронической болезни почек на доклинической стадии. Фундаментальные исследования 2013; 11-1: 22-26 [BorodulinVB, BychkovEN, ProtopopovAAidr. Jeritropojetin – marker hronicheskoj bolezni pochek na doklinicheskoj stadii. Fundamental’nye issledovanija 2013; 11-1: 22-26]
26. Warady BA, Silverstein DM . Management of anemia with erythropoietic-stimulating agents in children with chronic kidney disease. Pediatr Nephrol 2014; 29(9): 1493-1505. doi: 10.1007/s00467-013-2557-x
27. Tanaka T. Expanding roles of the hypoxia-response network in chronic kidney disease. Clin Exp Nephrol 2016; 20(6): 835-844. doi: 10.1007/s10157-016-1241-4
28. Bonomini M, Del Vecchio L, Sirolli V, Locatelli F. New Treatment Approaches for the Anemia of CKD. Am J Kidney Dis 2016; 67(1): 133-142. doi: 10.1053/j.ajkd.2015.06.030
29. Chen N, Qian J, Chen J et al. Phase 2 studies of oral hypoxia-inducible factor prolyl hydroxylase inhibitor FG-4592 for treatment of anemia in China. Nephrol Dial Transplant 2017; 32(8): 1373-1386. doi: 10.1093/ndt/gfx011
30. Besarab A, Provenzano R, Hertel J et al. Randomized placebo-controlled dose-ranging and pharmacodynamics study of roxadustat (FG-4592) to treat anemia in nondialysis-dependent chronic kidney disease (NDD-CKD) patients. Nephrol Dial Transplant 2015; 30(10): 1665–1673. doi: 10.1093/ndt/gfv302
31. Provenzano R, Besarab A, Sun C et al. Oral hypoxiainducible factor prolyl hydroxylase inhibitor Roxadustat (FG-4592) for the treatment of anemia in patients with CKD. Clin J Am Soc Nephrol 2016; 11(6): 982–991. doi: 10.2215/CJN.06890615
32. Лысова ЕВ, Савенкова НД. СAKUT – синдром в этиологической структуре хронической болезни почек у детей и подростков. Нефрология 2017; 21(3): 69-74 [LysovaEV, SavenkovaND. SAKUT – sindrom v jetiologicheskoj strukture hronicheskoj bolezni pochek u detej i podrostkov. Nefrologija 2017; 21(3): 69-74] doi: 10.24884/1561-6274-2017-3-69-74
33. Лысова ЕВ, Савенкова НД. Особенности синдрома анемии при хронической болезни почек у детей (обзор литературы). Нефрология 2014; 18(3): 34-44 [LysovaEV, SavenkovaND. Osobennosti sindroma anemii pri hronicheskoj bolezni pochek u detej (obzorliteratury). Nefrologija 2014; 18(3): 34-44]
34. Лысова ЕВ, Савенкова НД. Лечение синдрома анемии у детей с хронической болезнью почек (обзор литературы). Нефрология 2015; 19(3): 20-31 [LysovaEV, SavenkovaND. Lechenie sindroma anemii u detej s hronicheskoj bolezn'ju pochek (obzorliteratury). Nefrologija 2015; 19(3): 20-31]
35. Добронравов ВА, Смирнов АВ, Безруких АМ и др. Анемия и преддиализные стадии хронической болезни почек: клиническое значение, распространенность и факторы риска. Нефрология 2006; 10(3): 7-13 [Dobronravov VA, Smirnov AV, Bezrukih AM i dr. Anemija i preddializnye stadii hronicheskoj bolezni pochek: klinicheskoe znachenie, rasprostranennost’ i faktory riska. Nefrologija 2006; 10(3): 7-13]
Об авторах
Е. В. ЛысоваРоссия
Лысова Елена Валентиновна - аспирант, кафедра факультетской педиатрии.
194100, Санкт-Петербург, ул. Литовская, д. 2, (812) 416-52-86
Н. Д. Савенкова
Россия
Савенкова Надежда Дмитриевна - доктор медицинских наук, рофессор, кафедра факультетской педиатрии.
194100, Санкт-Петербург, ул. Литовская, д. 2, (812) 416-52-86
Рецензия
Для цитирования:
Лысова Е.В., Савенкова Н.Д. ПОКАЗАТЕЛИ ОБМЕНА ЖЕЛЕЗА, ЭРИТРОПОЭТИНА, ГИПОКСИЕЙ ИНДУЦИРОВАННОГО ФАКТОРА ПРИ АНЕМИИ У ДЕТЕЙ С ХРОНИЧЕСКОЙ БОЛЕЗНЬЮ ПОЧЕК. Нефрология. 2017;21(6):68-77. https://doi.org/10.24884/1561-6274-2017-21-6-68-77
For citation:
Lysova E.V., Savenkova N.D. IRON STATUS, ERYTHROPOIETIN, HYPOXIA INDUCTOR FACTORS IN CHILDREN WITH ANEMIA WITH CHRONIC KIDNEY DISEASE. Nephrology (Saint-Petersburg). 2017;21(6):68-77. (In Russ.) https://doi.org/10.24884/1561-6274-2017-21-6-68-77
JATS XML








































