Перейти к:
ЦИТОПРОТЕКТОРНЫЙ ЭФФЕКТ АЛЬФА-1 КИСЛОГО ГЛИКОПРОТЕИНА НА МОДЕЛИ ЭКСПЕРИМЕНТАЛЬНОГО РЕПЕРФУЗИОННОГО ПОВРЕЖДЕНИЯ ПОЧКИ
https://doi.org/10.24884/1561-6274-2018-22-1-91-97
Аннотация
На экспериментальной модели реперфузионного повреждения почки (Kidney Ischemia-Reperfusion – K I/R) была изучена специфическая фармакологическая активность препарата «Орозин», действующим веществом которого является альфа-1 кислый гликопротеин. В качестве референтного препарата был выбран «Актовегин». Цель работы – изучение цитопротекторного эффекта препарата «Орозин» на модели экспериментальной ишемии–реперфузии почек. Половозрелым самцам крыс линии Wistar проводили правостороннюю нефрэктомию с последующим механическим пережатием сосудистого пучка левой почки в течение 45 мин и дальнейшей реперфузией. Препараты вводили внутривенно, в два этапа: за 10 мин до освобождения от механического пережатия сосудистого пучка почки и через 30 мин после реперфузии. В качестве критериев эффективности действия препарата оценивали биохимические показатели крови – уровень креатинина и мочевины, а также проводили гистологическое исследование ткани почек через 2 и 24 ч после реперфузии. В результате исследования экспериментальной модели острой почечной недостаточности было выявлено наличие цитопротекторного действия препарата «Орозин», подтвержденного биохимическими и гистологическими исследованиями.
Ключевые слова
Для цитирования:
Ванатиев Г.В., Буренков П.В., Лютов А.Г., Ковалева М.А., Макарова М.Н., Макаров В.Г. ЦИТОПРОТЕКТОРНЫЙ ЭФФЕКТ АЛЬФА-1 КИСЛОГО ГЛИКОПРОТЕИНА НА МОДЕЛИ ЭКСПЕРИМЕНТАЛЬНОГО РЕПЕРФУЗИОННОГО ПОВРЕЖДЕНИЯ ПОЧКИ. Нефрология. 2018;22(1):91-97. https://doi.org/10.24884/1561-6274-2018-22-1-91-97
For citation:
Vanatiev V.G., Burenkov P.V., Lutov A.G., Kovaleva M.A., Makarova М.N., Makarov V.G. CYTOPROTECTIVE EFFECT OF ALPHA-1 ACID GLYCOPROTEIN ON THE EXPERIMENTAL MODEL OF RENAL REPERFUSION INJURY. Nephrology (Saint-Petersburg). 2018;22(1):91-97. (In Russ.) https://doi.org/10.24884/1561-6274-2018-22-1-91-97
ВВЕДЕНИЕ
Острое повреждение почек (ОПП) имеет важное значение не только в краткосрочной, но и в долгосрочной перспективе. Частота ОПН в отделениях интенсивной терапии составляет от 5 до 15% [1]. При этом, у 5% пациентов для ее коррекции было необходимо проведение заместительной почечной терапии (ЗПТ) [2]. Влияние ЗПТ изменяет течение ОПП, однако, несмотря на это, даже в ведущих клиниках всего мира, летальность сохраняется на уровне 55-75% и не снижается в течение последних десятилетий [3, 4]. В клинической практике самой частой формой ОПП является преренальная форма (50-75%), которая характеризуется фазностью течения: период гипоперфузии (ишемии) сменяется периодом реперфузии [5]. Это требует обязательного мониторинга ряда показателей и адекватной коррекции выявляемых изменений. Однако серьезной задачей остается поиск и тестирование новых лекарственных средств, которые могут быть использованы не только с леченбными, но и профилактическими целями.
Альфа-1 кислый гликопротеин (АГП) является одним из главных представителей семейства острофазовых белков. Концентрация АГП повышается при многих патологических состояниях, в частности, при острых нарушениях кровообращения [6, 7], травмах и краш-синдроме [8]. Измерение его концентрации в крови в клинической практике в настоящее время используется в качестве диагностического и прогностического критерия. Показано, что АГП участвует в регуляции проницаемости сосудистой стенки, реологических свойств крови, течения воспалительных процессов, а также выступает как фактор, повышающий неспецифическую резистентность организма [9, 10]. Исследование эффективности фармакологических препаратов, улучшающих микроциркуляцию за счет воздействия на реологические свойства крови и состояние микроциркуляторного русла, является перспективным направлением лечения острой дисфункции почек.
Целью данной работы являлось выявление специфической фармакологической активности препарата «Орозин» в условиях экспериментальной модели реперфузионного повреждения почек.
МАТЕРИАЛЫ И МЕТОДЫ
План исследования был рассмотрен на заседании и одобрен к проведению. Исследование одобрено биоэтической комиссией ЗАО «Санкт-Петербургский институт фармации» и проведено на 112 крысах-самцах линии Wistar с массой тела 250-300 г, которые содержались в стандартных условиях вивария в ходе периода адаптации и последующего эксперимента. При выборе доз руководствовались литературными данными о терапевтических дозах изучаемых препаратов.
«Орозин» был протестирован в условиях экспериментальной ишемии-реперфузии в трех дозах: 233, 466 и 700 мг/кг, что соответствует 1/3 ВТД (высшая терапевтическая доза), 2/3 ВТД и 1 ВТД. В качестве референтного препарата был использован антигипоксант «Актовегин» [11] в дозе 80 мг/кг, что составляет 1 ВТД для крысы.
Экспериментальное реперфузионное повреждение почки моделировали по методу H. Rabb (1995) [12]. В соответствии с методикой в эксперименте участвовали: интактная группа - без моделирования патологии; ложнооперированная группа - только лапаротомия; контрольная группа - моделирование патологии. Для формирования патологии животное погружали в наркоз («Золетил 100», 2,6 мг/кг) и «Ксилазин» (2,6 мг/ кг, при внутривенном введении), после чего фиксировали на операционном столике. Далее проводили срединную лапаротомию, визуализировали правую почку животного, на её сосудистый пучок накладывали две перманентные лигатуры и посредством пересечения сосудистого пучка между лигатурами проводили правостороннюю нефроэктомию. После правосторонней нефроэктомии визуализировали левую почку животного и ишемизировали её путем наложения атравматичного зажима на её сосудистый пучок на 45 мин. После начала периода ишемии капсула почки приобретала серый оттенок. После 45 минут ишемии производили реперфузию путем удаления зажима. Сразу после начала реперфузии отмечали покраснение капсулы почек, что свидетельствовало о восстановлении кровообращения органа. Далее послеоперационная рана была послойно ушита, шов - обработан антисептиком. Препараты вводили внутривенно, в два этапа: за 10 мин до освобождения от механического пережатия сосудистого пучка почки и через 30 мин после реперфузии.
Эвтаназию 50% особей каждой экспериментальной группы проводили через 2 ч после начала реперфузии, оставшихся особей - через 24 ч. Во время эвтаназии производили забор венозной крови для оценки уровня креатинина и мочевины путем стерильного обескровливания из полостей сердца. Биохимические показатели крови определяли на биохимическом анализаторе «А-25» (Испания) с использованием реагентов фирмы «BioSystems» (Испания) в пробах сыворотки крови без следов гемолиза.
В процессе некропсии вычленяли левую почку у каждого животного, затем фиксировали в 10% растворе забуференного формалина. Материал для гистологического исследования фиксировали в 10% растворе нейтрального формалина в течение 24 ч, после чего по общепринятой методике заливали в парафин. Затем изготавливали срезы толщиной 5-7 мкм, которые окрашивали гематоксилином и эозином. Морфологическое исследование гистологических препаратов проводилось при помощи светооптического микроскопа «Carl Zeiss» (Германия). Критериями гистологической оценки служили: наличие поражения клубочков, канальцев, воспалительной инфильтрации и некроза.
Для оценки результатов исследования использовали пакет прикладных статистических программ «Statistica 10.0» («StatSoft», США). Результаты представлены в виде среднего арифметического ± ошибка средней. Статистическую значимость различий двух средних определяли с помощью t-критерия Стьюдента; частот - χ2- критерия Пирсона. Нулевую статистическую гипотезу об отсутствии различий и связей отвергали при p<0,05.
РЕЗУЛЬТАТЫ
В ходе проведения анализа данных, полученных через 2 ч после начала реперфузии, было выявлено достоверное увеличение уровня креа- тинина и мочевины в крови животных экспериментальных групп по сравнению с показателями интактной и ложнооперированной групп.
На рис. 1, 2 представлены данные по влиянию исследуемых препаратов на концентрации креатинина и мочевины через 24 ч после начала реперфузии.
Анализ данных, полученных через 24 ч после реперфузии, выявил достоверное увеличение уровней креатинина и мочевины экспериментальных групп, которым было проведено моделирование патологии в отличие от интактной и ложноо- перированной групп. При этом уровень креатинина и мочевины в группах, получавших исследуемые препараты, был достоверно ниже уровня таковых показателей контрольной группы.
Уровни креатинина и мочевины после введения «Орозина» были ниже на 76 и 39% соответственно по отношению к концентрациям изучаемых показателей крови в контрольной группе через 24 ч после моделирования экспериментальной патологии. В группах, получавших «Орозин», не было отмечено достоверных различий по эффективности исследованных доз препарата, что говорит о широте его терапевтического действия. Аналогичный эффект оказал и «Актовегин» - на фоне его введения отмечали снижение уровня креатинина на 69% и мочевины на 24%. На основании этого был сделан вывод о наличии нефропротек- торного действия у исследуемых препаратов.
У животных после воспроизведения патологии отмечали набухание эпителия с увеличением объема клеток, а также исчезновение щеточной каймы, явления кариопикноза, отслоение клеток от базальной мембраны, их атрофию. Формировалась «щитовидная почка» с расширением канальцев, уплощением эпителия, ядра клеток становились мелкими, гиперхромными, в просвете канальцев скапливались эозинофильные гиалиноподобные массы. Крайней степенью поражения являлись некрозы, от локальных, захватывающих небольшие участки, до обширных - глубоких, с некрозами не только канальцев, но и клубочков. Выраженность патологии зависела от группы, но не зависела от времени эвтаназии животных.
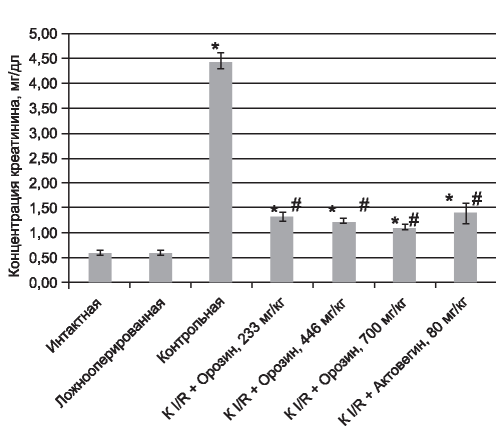
Рис. 1. Уровень креатинина крови животных через 24 ч после начала реперфузии. * Отличия статистически значимы в сравнении с интактной группой, р<0,05, критерий Тьюки. # Отличия статистически значимы в сравнении с контрольной группой, р<0,05, критерий Тьюки.
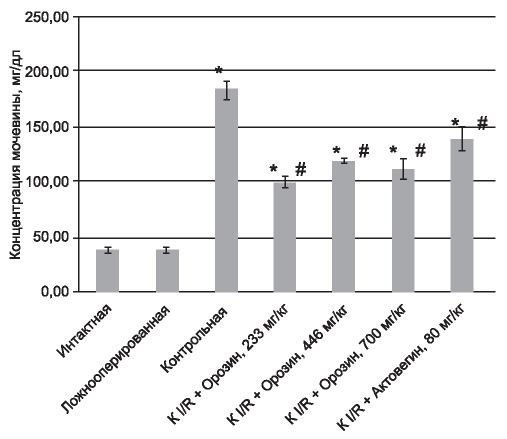
Рис. 2. Уровень мочевины крови животных через 24 ч после начала реперфузии. * Отличия статистически значимы в сравнении с интактной группой, р<0,05, критерий Тьюки. # Отличия статистически значимы в сравнении с контрольной группой, р<0,05, критерий Тьюки.
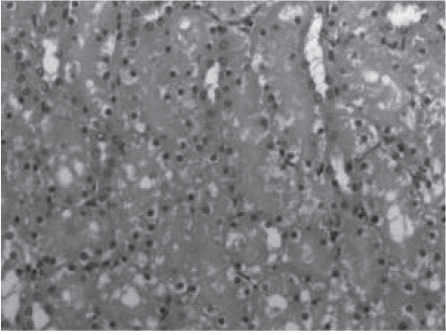
Рис. 3. Срез почки крысы контрольной группы, эвтанази- рованной через 2 ч после реперфузии. Значительная часть канальцев расширены с уплощенным дистрофичным эпителием, ядра частично с кариорексисом. Поражение более 2/3 канальцев. Окраска гематоксилином и эозином. Ув.100.

Рис. 4. Срез почки крысы контрольной группы, эвтаназированной через 24 ч после реперфузии. Массивный некроз с поражением клубочков. Поражение в виде некроза и воспалительной инфильтрации. Окраска гематоксилином и эозином. Ув.100.
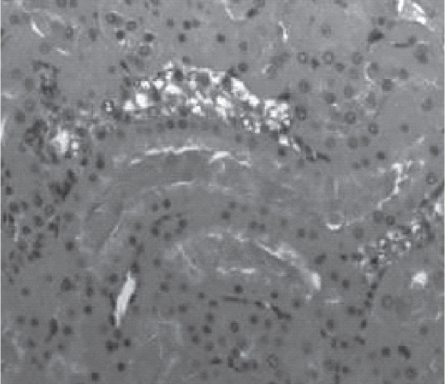
Рис. 5. Срез почки крысы, получавшей «Орозин» в дозе 446 мг/ кг, эвтаназированной через 2 ч после реперфузии. Отмечается невыраженная вакуольная дистрофия эпителия канальцевого аппарата. Часть канальцев расширены с белковыми массами в просвете, но эпителий сохранен. Поражено менее 1/3 канальцев. Окраска гематоксилином и эозином. Ув.100.
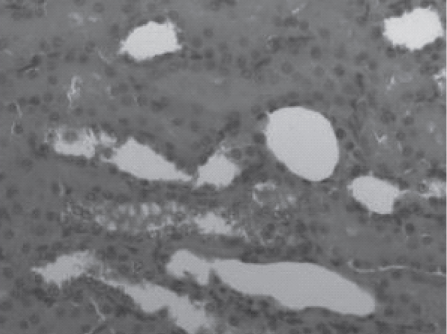
Рис. 6. Срез почки крысы, получавшей «Орозин» в дозе 700 мг/ кг, эвтаназированной через 24 ч после реперфузии. Отмечается невыраженная вакуольная дистрофия эпителия канальцевого аппарата. Часть канальцев расширены с белковыми массами в просвете, но эпителий сохранен. Поражено менее 1/3 канальцев. Окраска гематоксилином и эозином. Ув.100.
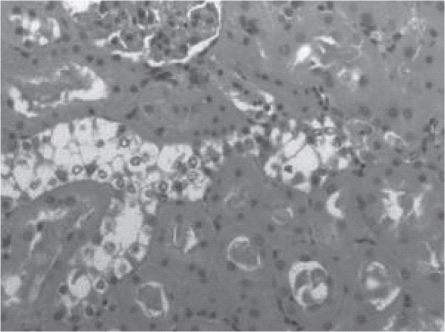
Рис. 7. Срез почки крысы, получавшей актовегин в дозе 80 мг/ кг, эвтаназированной через 2 ч после реперфузии. Значительная часть эпителия канальцев с вакуольной дистрофией. Часть расширены с белковыми массами в просвете, эпителий дистрофичен и уплощен. Поражено 1/3-2/3 канальцев. Окраска гематоксилином и эозином. Ув.100.
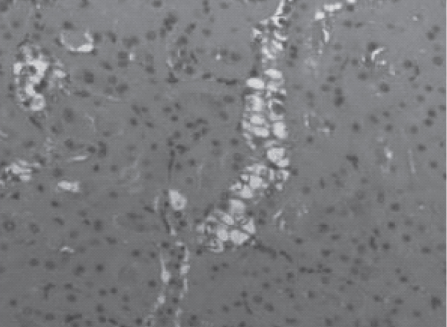
Рис. 8. Срез почки крысы, получавшей актовегин в дозе 80 мг/кг, эвтаназированной через 24 ч после реперфузии. Отмечается невыраженная вакуольная дистрофия эпителия канальцевого аппарата. Часть расширены с белковыми массами в просвете, но эпителий сохранен. Поражено менее 1/3 канальцев. Окраска гематоксилином и эозином. Ув.100.
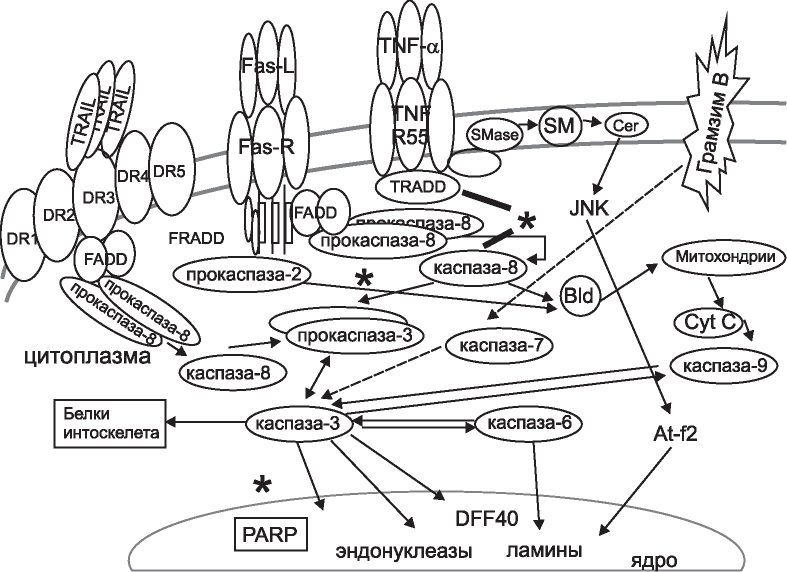
Рис. 9. Возможные механизмы антиапоптогенного действия АГП. Звездочками выделены вероятные точки приложения АГП в ферментативных реакциях апоптоза (цит. по Г.А. Яровой и др., М., 2011, с модификацией).
Внутри группы частота выраженности микроскопических изменений была схожа при эвтаназии через 2 и 24 ч после реперфузии.
Максимально выраженные изменения наблюдались в контрольной группе животных, которые характеризовались значительной дистрофией эпителия и частичным некрозом канальцев. Гистологическое строение тканей почек крыс контрольной группы представлено на рис. 3, 4.
Наиболее эффективное цитопротекторное действие отмечено у тестируемого препарата «Орозин» во всех исследованных дозах. Гистологическое строение тканей почек крыс данных экспериментальных групп представлено на рис. 5, 6.
Введение «Актовегина» оказало менее выраженное цитопротекторное действие по сравнению с «Орозином». Гистологическое строение тканей почек крыс, получавших «Актовегин», представлено на рис. 7, 8.
ОБСУЖДЕНИЕ
При исследовании специфической активности препарата «Орозин» на модели ишемического поражения почки с последующей реперфузией было установлено, что он проявляет цитопротекторные свойства в широком терапевтическом диапазоне, вне зависимости от величины использованных доз. Полученные результаты свидетельствуют о восстановлении экскреторной функции почек в сравнении с группой контроля. В ответ на ишемическое и последующее реперфузионное повреждение в последующем не наступал некроз тканей почек за счет оказанного цитопротекторного действия.
Одним из возможных механизмов цитопро- текторного действия АГП может быть их способность быть донаторами и сохранять отрицательный заряд мембран тромбоцитов, перицитов и клеток эндотелия сосудов, что в итоге приводит к снижению микротромбообразования [11]. Другими путями реализации антиагрегантного эффекта могут быть: ингибирующее влияние на протром- биназный комплекс, а также на комплекс GPIIb/ IIIa. Антиагрегантные свойства АГП могут реализовываться обособленно, а также совместно с его потенциальным антиоксидантным действием. Для подтверждения данной гипотезы необходимо углубленное изучение антиоксидантных свойств АГП и лекарственных препаратов, разрабатываемых на его основе.
Известно, что апоптоз играет немаловажное значение при реперфузионном повреждения тканей. При этом нужно иметь в виду два обстоятельства: дефицит АТФ в очаге ишемии и развитие воспалительной реакции после реперфузии [14]. АГП, вероятно, играет важную роль при репер- фузионных повреждениях органов и тканей, эффективно подавляет ранний и отсроченный апоптоз, снижая активность каспазы-1 и каспазы-3 и блокируя интрануклеосомальный распад ДНК. Тем не менее, точный механизм данного действия остается неизвестным. Цитопротекторное действие в отношении TNF-α-индуцированного апоптоза может быть связано как с блокированием клеточных TNF-α-рецепторов, так и прямым внутриклеточным действием на прокаспазу-8, 3-каспазу или стресс-активируемую протеинки- назу (JNK). Предполагаемые механизмы цитопро- текторного действия АГП за счет его влияния на активацию и взаимодействие ферментов апоптоза представлены на рис. 9.
ЗАКЛЮЧЕНИЕ
Таким образом, на модели экспериментального острого повреждения почек было установлено наличие цитопротекторных свойств препарата «Орозин». В качестве механизма действия АГП, за счет которого реализуется выявленный эффект на морфологические структуры почек, были предположены следующие гипотетические механизмы: влияние препарата на микроциркуляторное русло гломерулярного аппарата с улучшением реологических свойств крови и локального кровообращения, антиоксидантный механизм АГП, антиапоптогенное действие АГП на клеточные структуры в очагах ишемии.
Список литературы
1. Bellomo R et al. Acute renal failure–definition, outcome measures, animal models, fluid therapy and information technology needs: the Second International Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group. Critical care 2004; Т. 8 (4); 204. doi: 10.1186/cc2872
2. Johnson RF, Gustin J. Acute renal failure requiring renal replacement therapy in the intensive care unit: impact on prognostic assessment for shared decision making. J Palliat Med 2011 Jul;14(7):883-889. doi: 10.1089/jpm.2010.0452
3. Ympa Y P et al. Has mortality from acute renal failure decreased? A systematic review of the literature. Am J med 2005; 118 (8); 827-832. doi: 10.1016/j.amjmed.2005.01.069
4. Dennen P, Douglas I S, Anderson R. Acute kidney injury in the intensive care unit: an update and primer for the intensivist. Critical care medicine 2010; 38(1); 261-275. doi: 10.1097/CCM.0b013e3181bfb0b5
5. Смирнов АВ, Добронравов ВА, Румянцев АШ и др. Национальные рекомендации. острое повреждение почек: основные принципы диагностики, профилактики и терапии. Часть I. Нефрология 2016; 20(1):79-104 [Smirnov AV, Dobronravov VA, Rumyantsev ASh et al. National guidelines acute kidney injury: basic principles of diagnosis, prevention and therapy. Part I. Nephrology (Saint-Petersburg). 2016; 20(1): 79-104 (In Russ.)]
6. Чукаева ИИ. и др. Уровни показателей острофазового ответа и окислительного стресса у больных острым инфарктом миокарда и их значение в течении заболевания. Вестник РГМУ 2007; (7): 18 [Chukaeva II i dr. Urovni pokazatelei` ostrofazovogo otveta i okislitel`nogo stressa u bol`ny`kh ostry`m infarktom miokarda i ikh znachenie v techenii zabolevaniia. VESTNIK RGMU 2007; (7): 18]
7. Вельков ВВ. С-реактивный белок-в лабораторной диагностике острых воспалений и в оценке рисков сосудистых патологий. Клинико-лабораторный консилиум 2008; 2(21): 37-48 [Vel`kov VV. S-reaktivny`i` belok-v laboratornoi` diagnostike ostry`kh vospalenii` i v ocenke riskov sosudisty`kh patologii`. Cliniko-laboratorny`i` konsilium. 2008; 2(21): 37-48]
8. Попков А. В. и др. Результаты стереометрического анализа состояния передней большеберцовой мышцы при дистракционном, последовательном дистракционнокомпрессионном остеосинтезе голени, в том числе с применением «Орозина» (экспериментально-морфологическое исследование). Гений ортопедии 2002; (2) [Popkov A. V. i dr. Rezul`taty` stereometricheskogo analiza sostoianiia perednei` bol`shebertcovoi` my`shtcy` pri distraktcionnom, posledovatel`nom distraktcionno-kompressionnom osteosinteze goleni, v tom chisle s primeneniem «Orozina» (e`ksperimental`no-morfologicheskoe issledovanie). Genii` ortopedii. 2002; (2)]
9. Huang Z, Ung T. Effect of alpha-1-acid glycoprotein binding on pharmacokinetics and pharmacodynamics. Curr Drug Metab 2013;14(2):226-238
10. Нордвик Б. Механизм действия и клиническое применение препарата актовегин. Актовегин. Новые аспекты клинического применения. M., 2002; 18-24 [Nordvik B. Mehanizm dei`stviia i clinicheskoe primenenie preparata aktovegin // Aktovegin. Novy`e aspekty` clinicheskogo primeneniia. M. 2002; 18-24]
11. Макаров ЕВ, Кривохижина ЛВ. Альфа-1-кислый гликопротеин, реактант острой фазы воспаления, как важный гомеостатический фактор организма: обзор литературы. Вестн Южно-Уральск гос университета. Серия: Образование, здравоохранение, физическая культура. 2005; 4(44) [Makarov EV, Krivohizhina LV. Al`fa-1-kisly`i` glikoprotein, reaktant ostroi` fazy` vospaleniia, kak vazhny`i` gomeostaticheskii` faktor organizma: obzor literatury`. Vestneyk Iuzhno-Ural`skogo gosudarstvennogo universiteta. Seriia: Obrazovanie, zdravookhranenie, fizicheskaia kul`tura. 2005; 4(44)]
12. Rabb H et al. Antibodies to ICAM-1 protect kidneys in severe ischemic reperfusion injury. Biochemical and biophysical research communications 1995; 211(1):67-73. doi: 10.1006/bbrc.1995.1779
13. Chertow GM et al. Acute kidney injury, mortality, length of stay, and costs in hospitalized patients. Journal of the American Society of Nephrology 2005; 16(11):3365-3370. doi: 10.1681/ASN.2004090740
14. Голубев АМ и др. Апоптоз при критических состояниях. Общая реаниматология 2006;2(5-6):184-190 [Golubev AM i dr. Apoptoz pri kriticheskikh sostoianiiakh. Obshchaia reanimatologiia. 2006;2(5-6):184-190]
Об авторах
Г. В. ВанатиевРоссия
Ванатиев Гаджимагомед Витальевич - группа общей токсикологии, токсиколог.
188663, Ленинградская обл., Всеволожский р-н, п. Кузьмоловский, 245,+7(812) 603-24-33
П. В. Буренков
Россия
Буренков Павел Валерьевич - группа экспериментальной фармакологии №1, фармаколог.
188663, Ленинградская обл., Всеволожский р-н, п. Кузьмоловский, 245, +7 951-659-90-30
А. Г. Лютов
Россия
Лютов Андрей Германович - доктор биологических наук, профессор
125212, Москва, Головинское шоссе, д. 8, корп. 2А, +7(495) 232-61-74
М. А. Ковалева
Россия
Ковалева Мария Александровна - кандидат биологических наук, руководитель группы фармакодинамики.
188663, Ленинградская обл., Всеволожский р-н, п. Кузьмоловский, д. 245, +7(812) 603-24-33
М. Н. Макарова
Россия
Макарова Марина Николаевна - доктор медицинских наук, заместитель директора по науке.
188663, Ленинградская обл., Всеволожский р-н, п. Кузьмоловский, д. 245, +7(812) 603-24-33В. Г. Макаров
Россия
Макаров Валерий Геннадьевич - доктор медицинских наук, профессор, генеральный директор.
188663, Ленинградская обл., Всеволожский р-н, п. Кузьмоловский, д. 245, +7 (812) 603-24-33
Рецензия
Для цитирования:
Ванатиев Г.В., Буренков П.В., Лютов А.Г., Ковалева М.А., Макарова М.Н., Макаров В.Г. ЦИТОПРОТЕКТОРНЫЙ ЭФФЕКТ АЛЬФА-1 КИСЛОГО ГЛИКОПРОТЕИНА НА МОДЕЛИ ЭКСПЕРИМЕНТАЛЬНОГО РЕПЕРФУЗИОННОГО ПОВРЕЖДЕНИЯ ПОЧКИ. Нефрология. 2018;22(1):91-97. https://doi.org/10.24884/1561-6274-2018-22-1-91-97
For citation:
Vanatiev V.G., Burenkov P.V., Lutov A.G., Kovaleva M.A., Makarova М.N., Makarov V.G. CYTOPROTECTIVE EFFECT OF ALPHA-1 ACID GLYCOPROTEIN ON THE EXPERIMENTAL MODEL OF RENAL REPERFUSION INJURY. Nephrology (Saint-Petersburg). 2018;22(1):91-97. (In Russ.) https://doi.org/10.24884/1561-6274-2018-22-1-91-97








































