Перейти к:
МАРКЕРЫ КОЛЛАГЕНООБРАЗОВАНИЯ И СКЛЕРОЗИРОВАНИЯ В ДИАГНОСТИКЕ ПРОГРЕССИРОВАНИЯ РЕФЛЮКС-НЕФРОПАТИИ У ДЕТЕЙ
https://doi.org/10.24884/1561-6274-2018-22-3-33-42
Аннотация
ЦЕЛЬ. Выявить информативные показатели для прогнозирования прогрессирования рефлюкс-нефропатии у детей с пузырно-мочеточниковым рефлюксом на основании исследования мочевой экскреции маркеров склерозирования (трансформирующего фактора роста-β1), ангиотензина II, прокальцитонина, β2-микроглобулина) и коллагенообра- зования (пептид-связанного и свободного гидроксипролина). ПАЦИЕНТЫ И МЕТОДЫ. В группу исследования были включены 71 (52 девочки) пациент в возрасте 5,69±0,44 года с пузырно-мочеточниковым рефлюксом (ПМР). С учетом результатов ДМСА-сцинтиграфии все дети были распределены на 2 группы: группа сравнения – 9 детей с ПМР без очагов склероза и основная группа – 62 пациента с различной степенью рефлюкс-нефропатии (РН). Контрольную группу составили 20 практически здоровых детей в возрасте 6.24 ± 0.31 года. У всех детей исследовали мочевую экскрецию AngII, TGF-β1, ПКТ, β2-МГ, ПСО и СВО и пересчитывали ее на уровень креатинина в моче. РЕЗУЛЬТАТЫ. Мочевой уровень AngII, TGF-β1, ПКТ, β2-МГ, ПСО и СВО был достоверно выше в группах детей с РН при сравнении с группой контроля. Наиболее высокий уровень Ang II, TGF-β1, ПКТ был определен в основной группе (p<0,05). У больных с тяже- лой степенью РН уровень AngII, TGF-β1, ПКТ в моче был в 2 раза выше при сравнении с контрольной группой и группой детей без очагов склероза (p><0,05). ЗАКЛЮЧЕНИЕ. Установленная прямая корреляционная связь между уровнем экс- креции AngII, TGF-β1, ПКТ и степенью тяжести РН у больных с ПМР свидетельствует о целесообразности и перспектив- ности их включения в качестве диагностических маркеров прогнозирования тяжести рефлюкс-нефропатии. Ключевые слова: пузырно-мочеточниковый рефлюкс, рефлюкс-нефропатия, маркеры склерозирования, маркеры коллагенообразования, дети><0,05). У больных с тяжелой степенью РН уровень AngII, TGF-β1, ПКТ в моче был в 2 раза выше при сравнении с контрольной группой и группой детей без очагов склероза (p<0,05). ЗАКЛЮЧЕНИЕ. Установленная прямая корреляционная связь между уровнем экс- креции AngII, TGF-β1, ПКТ и степенью тяжести РН у больных с ПМР свидетельствует о целесообразности и перспектив- ности их включения в качестве диагностических маркеров прогнозирования тяжести рефлюкс-нефропатии. Ключевые слова: пузырно-мочеточниковый рефлюкс, рефлюкс-нефропатия, маркеры склерозирования, маркеры коллагенообразования, дети><0,05). ЗАКЛЮЧЕНИЕ. Установленная прямая корреляционная связь между уровнем экскреции AngII, TGF-β1, ПКТ и степенью тяжести РН у больных с ПМР свидетельствует о целесообразности и перспективности их включения в качестве диагностических маркеров прогнозирования тяжести рефлюкс-нефропатии.
Ключевые слова
Для цитирования:
Зайкова Н.М., Длин В.В., Синицына Л.А., Еремеева А.В., Ревенко Н.Е., Корсунский А.А., Юдина Ю.В. МАРКЕРЫ КОЛЛАГЕНООБРАЗОВАНИЯ И СКЛЕРОЗИРОВАНИЯ В ДИАГНОСТИКЕ ПРОГРЕССИРОВАНИЯ РЕФЛЮКС-НЕФРОПАТИИ У ДЕТЕЙ. Нефрология. 2018;22(3):33-42. https://doi.org/10.24884/1561-6274-2018-22-3-33-42
For citation:
Zaicova N.M., Dlin V.V., Sinitcina L.V., Eremeeva A.V., Revenco N.E., Korsunskii A.A., Uidina U.V. MARKERS COLLAGENOPATHY AND SCLEROSIS IN THE DIAGNOSIS OF THE PROGRESSION OF REFLUX NEPHROPATHY IN CHILDREN. Nephrology (Saint-Petersburg). 2018;22(3):33-42. (In Russ.) https://doi.org/10.24884/1561-6274-2018-22-3-33-42
ВВЕДЕНИЕ
Инфекция мочевой системы у детей особенно в сочетании с пузырно-мочеточниковым рефлюксом (ПМР) приводит к развитию рефлюкснефропатии (РН) [1-3]. При прогрессировании РН появляются протеинурия, артериальная гипертензия, постепенное снижение функции почек, вплоть до развития терминальной почечной недостаточности (тПН). Среди всех детей с тПН в 8-25% случаев причиной явилась прогрессирующая РН [4-7]. Поэтому главная цель современной нефрологии - максимальное продление собственных функций почек, что особенно актуально при РН. Следовательно, главный акцент должен быть перенесен на раннюю диагностику и предупреждение развития почечных рубцов [8, 9].
Поиск так называемых биомаркеров острого и хронического почечного повреждения, позволяющих проводить раннее выявление патологических изменений в почках и определять их характер, дифференцировать поражение разных отделов нефрона, точно установить стадию процесса, оценить выраженность воспаления и интенсивность фиброгенеза является наиболее важным [10-12]. Среди таких маркеров, которые все более активно исследуются, наибольшее значение имеют трансформирующий фактор роста (TGF-β1), интерлейкин-6,8,10, KIM-1 (kidney injury molecule -1), VEGF-А (vascular endothelial growth factor - A), L-FABP (liver type fatty-acid binding protein), NGAL (neutrophil gelatinase-associated lipocalin) и др. [10]. В то же время, в литературе недостаточно освещен вопрос о роли ангиотензина II (AngII) и маркеров коллагенообразования (пептидосвязанного и свободного гидроксипролина) в патогенезе РН и не определена их роль в прогрессировании почечного повреждения, что и послужило целью нашего исследования [8, 14, 15]. Являясь основным профиброгенным фактором, инициирующим и поддерживающим процессы фибриллогенеза, AngII повышает синтез TGF-β1, который стимулирует пролиферацию клеток и образование соединительной ткани [16, 17]. При заболеваниях, связанных с поражением соединительной ткани, увеличивается экскреция гидроксипролина вследствие ускоренного распада и синтеза коллагена. В результате распада, биосинтеза коллагена в крови и моче появляется свободный гидроксипролин (СВО). Большая часть этой аминокислоты катаболизируется под действием фермента гидроксипролиноксидазы, а часть её выводится с мочой, и поэтому гидроксипролин является маркерной аминокислотой, по которой судят о скорости распада и биосинтеза коллагена. Дефекты синтеза коллагена приводят к уменьшению поперечных связей в фибриллах и возрастанию числа легкорастворимых фракций оксипролина, таких как пептид-связанной [18].
Цель исследования: выявить информативные показатели для прогнозирования прогрессирования рефлюкс-нефропатии у детей с пузырномочеточниковым рефлюксом на основании исследования мочевой экскреции маркеров склерозирования трансформирующего фактора роста-β1, ангиотензина II, β2-микроглобулина, прокальцитонина и маркеров коллагенообразования (пептидсвязанного и свободного оксипролина).
ПАЦИЕНТЫ И МЕТОДЫ
В исследование были включены 71 пациент с различной степенью ПМР в возрасте от 1 года до 14 лет (средний возраст 5,69±0,44 года), из них 52 девочки (73,2%), которые находились на обследовании в отделениях нефрологии и урологии Института Матери и Ребенка (г. Кишинев).
Всем больным было проведено комплексное обследование, которое включало ультразвуковое исследования органов мочевой системы, УЗИ-допплер почек, микционную цистографию, экскреторную урографию и динамическую не- фросцинтиграфию, клинические анализы крови и мочи, определялись уровень мочевины и креати- нина в крови, скорость клубочковой фильтрации по формуле Шварца, изучалась концентрационная функция почек в пробе Зимницкого и проводилось бактериологическое исследование мочи.
Степень ПМР оценивали по результатам мик- ционной цистографии согласно принятой в 1985 г. Международной классификации ПМР [19].
Для выявления РН и определения ее степени всем детям с ПМР была проведена статическая нефросцинтиграфия с ДМСА (димеркаптосукци- новая кислота) в отделении ядерной медицины (зав. отделения - В.В. Карецкая) Республиканской клинической больницы (г. Кишинев), но не ранее чем через 3 мес после последнего эпизода инфекции мочевой системы. Степень рефлюкснефропатии определялась согласно классификации А. Piepsz и соавт. (2001): 1 ст. - 1-2 рубца, 2 ст. - 2-3 рубца с сохранной почечной паренхимой, 3 ст. - очагово-диффузное распространение склеротических очагов с сохраненным почечным контуром, 4 ст. - «маленькая» или атрофированная почка [20].
В зависимости от наличия и степени выраженности РН дети были разделены на 3 группы: основная группа (1-я группа) - 62 (87,3%) пациента с различной степенью РН: 1А подгруппа - 41 (66,1%) пациент с 1-2 степенью РН (легкая, средний возраст 6,17±0,55 года, 7м/34д) и 1Б подгруппа - 21 (33,9%) пациент с 3-4 степенью РН (тяжелая, средний возраст 6,43±0,86 года, 11м/10д), группа сравнения (2-я группа) - дети с ПМР без РН - 9 (12,7%) детей (средний возраст 1,78±0,36 года, 1м/8д) у которых, по данным ДМСА-сцинтиграфии, отсутствовали очаги склероза. Контрольную группу (3-я группа) составили 20 практически здоровых детей (8м/12д, средний возраст 6,24±0,31 года) без почечной патологии в анамнезе и на момент включения в исследование.
В утренней моче определяли уровни ангиотензина II (AngII), трансформирующего фактора роста (TGF-P1) и β2-микроглобулина (β2-МГ) на биохимическом анализаторе «Униплан» (США) методом иммуноферментного анализа ELISА с использованием наборов фирмы «Human TGF-beta-1 Quantikine ELISA Kit» и «Human Angiotensin II Quantikine ELISA Kit» (Великобритания), «Tina- quant a beta 2-microglobulin» (фирма «Boehring Mannhaim»), уровень прокальцитонина (ПКТ) - иммунохроматографическим методом Brachms PCT-Q. Уровень пептид-связанного оксипролина (ПСО) и свободного оксипролина (СВО) в моче определяли по методу П.Н. Шараева (1996). Метод основан на оценке плотности красного хромогена, получаемого в результате окисления и декарбоксилирования молекулы оксипролина и конденсации продукта окисления с парадимети- ламинобензальдегидом в биохимической лаборатории (зав. лабораторией - проф. В. Гудумак) Государственного медицинского университета «Н. Тестимицану» (г. Кишинев). Уровни изучаемых маркеров в моче пересчитывали на содержание креатинина в данной порции мочи (нг/ммоль креатинина). Все дети на момент исследования находились в клинико-лабораторной ремиссии инфекции мочевой системы (пиелонефрита).
Для оценки результатов исследования использовали пакет прикладных статистических программ «Statistica 6.0» («StatSoft», США). Данные представлены как частоты и проценты для категориальных и среднего арифметического ± стандартное отклонение для непрерывных показателей. Статистическую значимость различий средних по одному признаку оценивали по критерию Манна-Уитни, при сравнительном анализе трех групп и более использовался ранговый анализ вариаций по Краскелу-Уоллису; частот - Х2-критерия Пирсона. Оценку силы взаимосвязи между количественными признаками проводили с помощью коэффициента корреляции (Rs) Спирмена. Нулевую статистическую гипотезу об отсутствии различий и связей отвергали при p<0,05.
РЕЗУЛЬТАТЫ
По данным обследования ПМР I степени выявлялся у 17 детей (23,9%), ПМР II степени - у 15 детей (21,1%), ПМР III степени - у 14 (19,7%), ПМР IV степени - у 25 детей (35,3%). Односторонний ПМР был установлен у 39 детей (54,9%), двусторонний - у 32 (45,1%) (χ2=1,97, p>0,05). Изучаемые группы больных достоверно не отличались по возрасту и полу. Из анализа цистографий выяснилось, что у 25 больных (35,2%) преобладает левосторонний ПМР, у 14 пациентов (19,7%) - правосторонний, в 45,1% случаев был диагностирован двусторонний ПМР.
По данным ДМСА-сцинтиграфии, РН была выявлена у 62 (87,3%) пациентов, детей без очагов склерозирования было 9 (12,7%).
Тяжелая степень РН определялась в 28,6% случаев при I-II степени ПМР и в 71,4% случаев при III-IV степени ПМР (χ2=3,34, p>0,05). Среди обследованных детей тяжелая степень РН определялась в основном у мальчиков (52,4%, χ2=10,2, p<0,05).
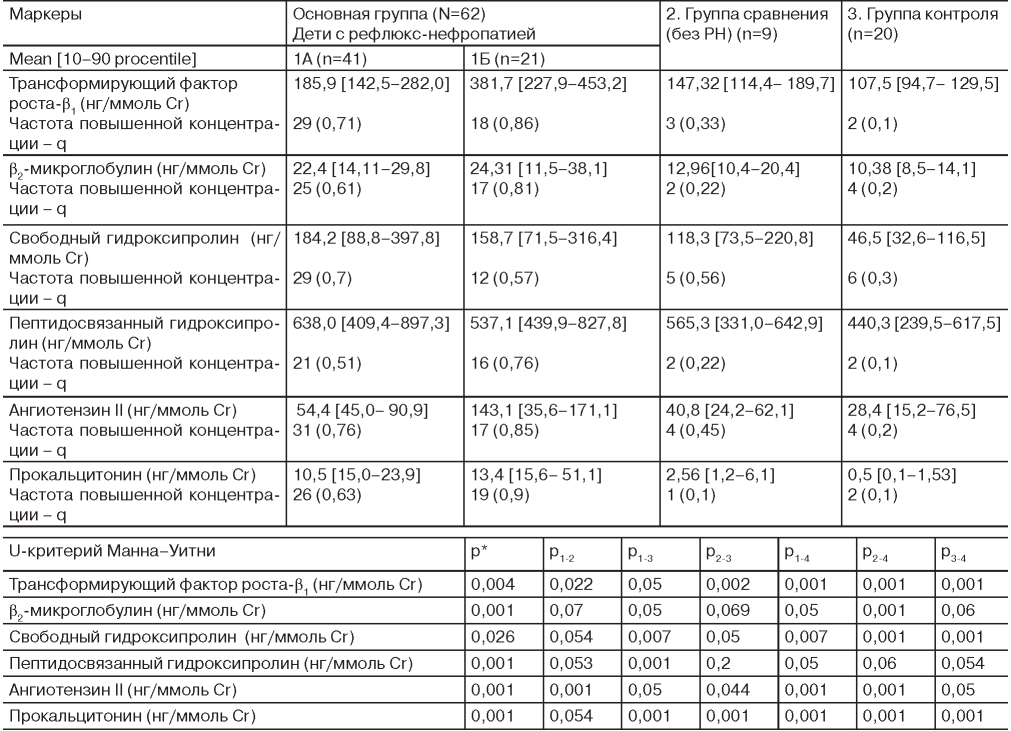
Установлено, что все дети с ПМР и РН имеют высокий уровень изучаемых маркеров по сравнению с группой контроля (табл. 1). Более высокие показатели изучаемых цитокинов были у детей 1Б группы по сравнению с 1А группой и группой сравнения. Выявлена повышенная мочевая концентрация TGF-β и AngII в среднем в 2,1 - 3 раза у детей основной группы по сравнению с контрольной группой и достоверно выше, чем в группе больных без признаков РН (p<0,001, p<0,05, см. табл. 1).
Установлено, что у всех детей с ПМР независимо от наличия и степени почечного повреждения мочевой уровень β2-МГ был достоверно выше по сравнению с контрольной группой (p<0,05). У пациентов 1А группы мочевой уровень β2-МГ был ниже, чем у лиц 1Б группы (р>0,05). Уровень β2- МГ был достоверно выше у детей основной группы, чем у пациентов группы сравнения (p<0,05).
Уровень СВО в моче был выше в 1,3 раза у детей 1Б группы по сравнению с 1А группой и группой сравнения (p<0,05). Повышенный уровень СВО выявлялся у 41 пациента основной группы (67,8%), в том числе у 29 пациентов 1А группы (70,73%) и у 12 пациентов 1Б группы (57,14%, p<0,05). Средний уровень СВО более 82,9 нг/ ммоль Cr (M ± 2δ) встречался у 3 (33,3%) детей без признаков РН (χ2=11,241, p=0,004). Можно предположить, что у этих пациентов уже имеются мелкие очаги склероза в паренхиме почек, которые подвергаются усиленному лизису, что и выражается в повышении уровня СВО в моче, но пока еще не выявляются на ДМСА-сцинтиграфии.
Таблица 1 / Table 1
Мочевая концентрация изучаемых маркеров склерозирования и коллагенообразования у обследованных больных
Urine level of markers of sclerosis and collagenopathy in studied population
*По критерию Краскела-Уоллиса.
Уровень экскреции ПСО с мочой в основной группе был выше, чем в группе контроля, особенно у детей с легкой степенью РН - в 2,8 раза (p<0,05). Не выявлено достоверных различий уровня экскреции ПСО с мочой у детей основной группы и группой сравнения (p>0,05).
Выявлена связь между степенью РН и уровнем ПКТ в моче. Так, в основной группе уровень ПКТ был достоверно выше, чем в группе сравнения (p<0,001). Можно предположить, что это связано с наличием и тяжестью повреждения паренхимы почек. Об этом свидетельствует тот факт, что у детей без признаков РН определен достоверно более низкий уровень ПКТ в моче по сравнению с детьми 1А и 1Б группой (p<0,001). У детей 1Б группы уровень ПКТ в моче был выше, чем у детей 1А группы (p>0,05).
Таблица 2 / Table 2
Чувствительность и специфичность изучаемых маркеров в основной группе (дети с РН) и в группе сравнения (дети без РН)
Sensitivity and specifity of investigated markers in studied group (children with reflux nephropathy) and control group (children without reflux nephropathy)
Маркеры, нг/ммоль Cr | AUC (%) | Оптимальное пороговое значение показателя | Чувствительность (%) | Специфичность (%) | |||
|---|---|---|---|---|---|---|---|
Основная группа | Группа сравнения | Основная группа | Группа сравнения | Основная группа | Группа сравнения | ||
TGF-β1/α | 79 | 75,8 | 172,7 | 69,4 | 67,9 | 76,9 | 77,6 |
AngII/Cr | 88 | 79 | 58,3 | 77,6 | 81,3 | 92,3 | 94,5 |
β2-МГ/а | 82 | 76 | 17,5 | 69,4 | 65,7 | 92,3 | 88,7 |
СВО/Cr | 74 | 89 | 120,5 | 64,5 | 71,9 | 57,9 | 77,9 |
ПСО/Cr | 83 | 76 | 502,3 | 77,6 | 51,6 | 76,9 | 46,4 |
ПКТ | 96 | 89 | 2,4 | 97,6 | 95,8 | 96,9 | 93,8 |
Таким образом, у больных основной группы все изучаемые показатели по сравнению с группой сравнения были повышенными. В 1Б группе по сравнению с 1А группой чаще выявлялись высокие мочевые концентрации β2-ΜΓ (q=0,81 vs 0,61), TGF-β1 (q=0,86 vs 0,71), ПСО (q=0,76 vs 0,51), AngII (q=0,85 vs 0,76), ПКТ (q=0,9 vs 0,63), за исключением СВО, повышенная концентрация которого чаще встречалась у пациентов 1А группы (q=0,7 vs 0,57). В группе сравнения, у детей без признаков склерозирования реже отмечались повышенные концентрации изучаемых показателей, в основном это TGF-β1 (q=0,33), СВО (q=0,56) и AngII (q=0,45).
Установлено минимальное пороговое значение изучаемых показателей для диагностики ранних склеротических изменений у детей с ПМР. Чувствительность и специфичность изучаемых показателей в качестве диагностических маркеров склерозирования представлена в табл. 2.
Было показано, что наибольшая чувствительность и специфичность (97,6 и 96,9% в основной группе) выявлена для ПКТ (уровень 2,4 нг/ммоль Cr); меньше (чувствительность и специфичность 77,6 и 92,3% в основной группе) выявлена для AngII (уровень 58,3 нг/ммоль Cr). Остальные изучаемые показатели имели меньшую специфичность и чувствительность.
При корреляционном анализе установлена наиболее значимая положительная достоверная связь таких маркеров как AngII и TGF-β1 с выраженностью РН у детей, что свидетельствует о прогностической значимости этих маркеров (табл. 3).
Таблица 3 / Table 3
Корреляционные связи между изучаемыми показателями и выраженностью рефлюкс-нефропатии
Correlation between the investigated variables and the degree of reflux nephropathy
Показатели | R | р |
|---|---|---|
Трансформирующий фактор роста-β1 | 0,7 | <0,001 |
β2-микроглобулин | 0,088 | 0,496 |
Свободный гидроксипролин | 0,055 | 0,669 |
Пептидосвязанный гидроксипролин | -0,053 | 0,683 |
Ангиотензин II | 0,622 | <0,001 |
Прокальцитонин | 0,066 | 0,789 |
У детей основной группы степень коллагенообразования и микроглобулинурии была более выраженной, чем у детей группы сравнения, что подтверждается установленной умеренной силы положительной корреляционной связью между мочевым уровнем β2-МГ и показателями коллагенообразования ПСО (рис. 1), а также более выраженная степень склероза в виде сильной прямой корреляции между уровнем AngII и профиброгенным маркером TGF-β1, и указывает на гиперпродукцию данных цитокинов и усиленную пролиферацию фибробластов с разрастанием соединительной ткани (рис. 2). У детей группы сравнения (дети без признаков РН) процессы склерозирования более интенсивны, чем у детей со склеротическими процессами, что подтверждается выявленной умеренной силы отрицательной корреляционной связи между СВО и AngII (рис. 3) и сильной непрямой корреляционной связью между AngII и ПСО (рис. 4).
ОБСУЖДЕНИЕ
Изучение ранних диагностических маркеров формирования и прогрессирования тубулоинтерстициального фиброза, среди которых важное место отводят профиброгенным маркерам, считают перспективным направлением в детской нефрологии. Интерес поиска диагностических маркеров возрос с появлением доступных методов определения уровня цитокинов не только в крови, но и в моче, позволяющих оценить активность и характер течения процесса в почечной ткани. Поскольку проксимальные канальцы, поврежденные ишемией, являются основным источником факторов роста, значительное повышение содержания TGF-β1 и AngII в моче по мере возрастания тяжести тубулоинтерстициального повреждения указывает на гиперпродукцию данных цитокинов и усиленную пролиферацию фибробластов с разрастанием соединительной ткани, что подтверждается данными литературы [21-23]. В нашем исследовании повышение уровня AngII и TGF-β1 у части детей с ПМР без признаков РН возможно обусловлена инфильтрацией почечного интерстиция макрофагами и лимфоцитами в очаге воспаления, что можно расценить как пресклеротическую стадию развития РН. Выявлена прямая сильная корреляционная связь между мочевыми показателями TGF-β1 и AngII у больных с РН, и именно у этих больных были обнаружены высокие показатели изучаемых маркеров, что может служить дополнительным диагностическим критерием тубулоинтерстициального повреждения и уменьшения нормально функционирующей почечной ткани, что было отмечено и другими авторами. Так, схожие результаты были получены А. Sabasinsca и соавт. (2008), обнаружившие высокую прямую корреляционную связь между мочевой экскрецией TGF-β1 у детей с ПМР, тяжестью самого рефлюкса и почечным повреждением [24]. Рядом авторов было отмечено наличие тесной связи между уровнем TGF-β1 в моче и степенью тяжести повреждения почечной ткани у детей с ПМР, осложненным РН [25].
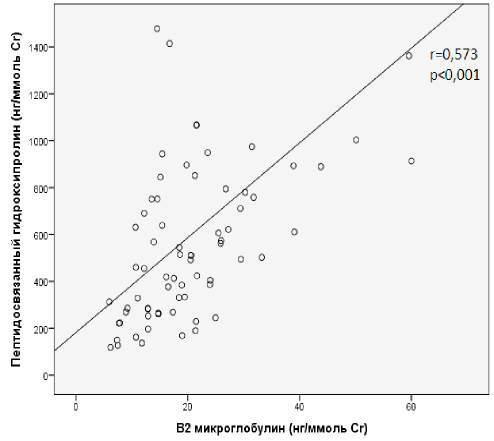
Рис. 1. Корреляционные связи между мочевым уровнем β2- МГ и показателями коллагенообразования (ПСО) у детей основной группы.
Figure 1. Correlation between urine β2-microglobulin and collagenopathy markers in children of studied group.

Рис. 2. Корреляционные связи между мочевым уровнем AngII и профиброгенным маркером TGF-β1, у детей основной группы.
Figure 2. Correlation between urine angiotensin II and profibrogenic marker TGF-β1 in children of studied group
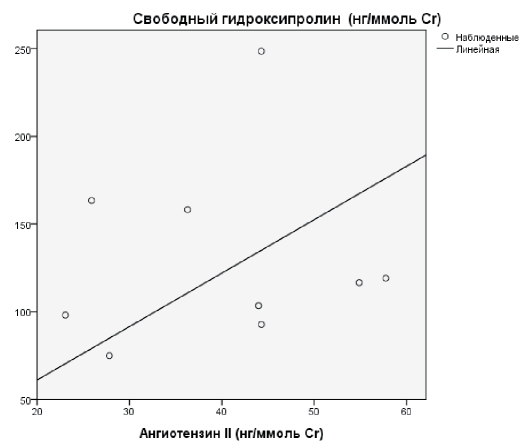
Figure 3. Correlation between urine collagenopathy marker (free hydroxyprolin) and angiotensin II in children of control group
Рис. 3. Корреляционные связи между мочевым уровнем показателями коллагенообразования (СВО) и AngII у детей группы сравнения.
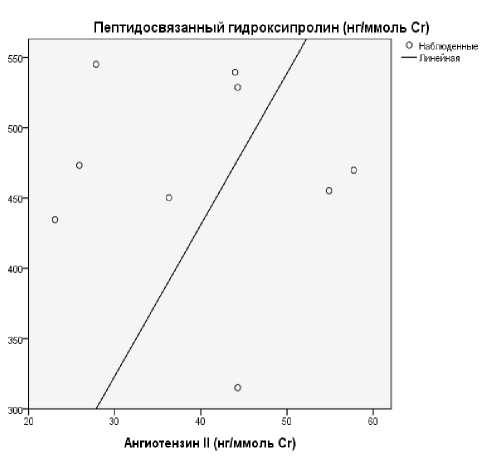
Рис. 4. Корреляционные связи между мочевым уровнем показателями коллагенообразования (ПСО) и AngII у детей группы сравнения.
Figure 4. Correlation between urine collagenopathy marker (protein binding hydroxyproline) and angiotensin II in children of control group
О значении β2-ΜΓ, как одного из ранних маркеров повреждения тубулоинтерстициальной ткани, свидетельствуют выявленные средней силы корреляционные связи между мочевым уровнем β2- МГ и показателями коллагенообразования ПСО (r=0,578, р<0,001). Повышенный мочевой уровень β2-ΜΓ у пациентов с тяжелой степенью РН отражает, прежде всего, тяжесть повреждения эпителия проксимальных канальцев, прежде всего, за счет деструкции и нарушения процессов реабсорбции в них. При наличии латентно-текущего интерстициального воспаления повреждения тубулоинтерстиция почечными белками приводит к усилению гипоксии канальцевых клеток с формированием тубулярной атрофии и разрушением в них лизосом [26]. Указанные механизмы поражения канальцевых клеток, по-видимому, имеют место как в начале развития тубулоинтерстициального процесса, так и в последующем, усугубляясь по мере формирования склероза [10, 26-29]. У пациентов с ПМР, осложненным РН, повышенная мочевая экскреция β2-ΜΓ выявлялась чаще, чем в группе детей с ПМР без РН, что позволяет его предложить в качестве маркера для раннего выявления среди детей с ПМР больных с РН. Полученные данные согласуются с результатами, полученными А. Kaminska и соавт. (2000), которые показали, что повышенный уровень микроглобулинов в моче отражает степень интерстициального повреждения у детей с ПМР [30].
Результаты исследования установили, что у всех больных с тяжелой степенью РН выявлялся выраженный дисбаланс между разрушением сформированного коллагена и его синтезом, что проявлялось высокой мочевой экскрецией СВО и относительно более низкой экскрецией ПСО с мочой. В отличие от этого при легкой степени РН преобладала экскреция ПСО с мочой, а выделение СВО не отличалось от его выделения у детей с ПМР, но без развития РН. Мы предполагаем, что выделяемый с мочой СВО, который является продуктом распада коллагена, может служить показателем интенсивности данного процесса при РН. Это соответствует результатам, представленным в работе K.I. Kivirikko (1970), где было показано, что грануляционно-фиброзная ткань, наряду с усилением биосинтеза коллагена, характеризуется и усиленным его распадом, особенно в стадии окончательной организации рубца [31]. Учитывая, что СВО в моче является чувствительным индикатором как распада коллагена, так и коллагенообразования, он может использоваться в клинической практике для выявления склеротических процессов в почечной ткани у детей с ПМР [32].
Выявлены высокая специфичность и чувствительность мочевой экскреции провоспалительного цитокина ПКТ для мониторирования степени склероза при ПМР. Было показано, что уровень ПКТ в моче зависит от степени почечного повреждения и канальцевой дисфункции. Возможно, при рецидивирующей ИМС у детей с ПМР и РН развивается хронический воспалительный процесс в почках, который приводит к повышенному синтезу эндотоксинов и провоспалительных цитокинов в результате их воздействия на щитовидную железу, что, в свою очередь, приводит к усилению синтеза ПКТ и повышению его уровня в крови. При этом в моче наблюдается повышение уровня ПКТ как за счет фильтрации через гломерулярный фильтр его большего количества, так и за счет нарушения его реабсорбции, обусловленного повреждением проксимальных канальцев нефрона [33]. Наиболее высокий уровень ПКТ в моче наблюдался у детей с III-IV степенями РН и был почти в 6 раз выше, чем у детей без РН. Несмотря на то, что роль ПКТ в воспалительной реакции и цитокиновом каскаде при почечном повреждении остается неизвестной, его использование в диагностике инфекции мочевой системы оценивается различными авторами чрезвычайно высоко [34-39]. S. Leroy и соавт. (2011) определили стабильную зависимость между концентрацией ПКТ в крови и степенью ПМР и предложили использование ПКТ при обследовании больных с ИМС [34]. В то же время, на положительную корреляцию между уровнем ПКТ в крови, острофазовыми показателями и ПМР у 52 детей с острым пиелонефритом отметили S. Bressan и соавт. (2009), но не нашли зависимость его от степени ПМР [39]. Нам представляется, что выявленная связь со степенью РН косвенная, и уровень ПКТ в моче зависит, прежде всего, от тяжести РН и выраженности воспалительного, в том числе и латентно протекающего, процесса в почечной ткани. Наши исследования косвенно согласуются с исследованиями А. Kotoula и соавт. (2009). Авторы определили высокую корреляцию между ПКТ в крови у больных с почечными рубцами при сравнении с больными без рубцов и предложили использовать его как ранний маркер рубцевания почечной ткани [40].
ЗАКЛЮЧЕНИЕ
Суммируя полученные данные, можно предположить, что основной причиной, приводящей к прогрессированию РН у больных детей с ПМР, является повышенная продукция факторов роста в условиях формирующейся РН. Установленная прямая корреляционная связь между уровнем экскреции изучаемых профиброгенных факторов и степенью тяжести РН у больных с ПМР свидетельствует о целесообразности и перспективности их включения в качестве диагностических маркеров прогнозирования тяжести рефлюкс-нефропатии.
Установлена выраженная корреляционная связь мочевого уровня трансформирующего фактора роста-β1 и ангиотензина II с почечным повреждением, что отражает прогрессирующий воспалительный и склерозирующий тубулоинтерстициальный процесс.
Уровень прокальцитонина в моче был в 3,5 раза выше у детей с РН, чем у детей без повреждения почечной ткани, что позволяет предложить определение этого показателя в качестве неинвазивного диагностического маркера в определении почечного повреждения при наблюдении за детьми с ПМР и инфекцией мочевой системы до проведения ДМСА-сцинтиграфии.
Мочевой уровень β2-микроглобулина у детей основной группы был почти в 2 раза выше, чем в группе детей без очагов склероза в почечной ткани, и отражает более тяжелое повреждение эпителия проксимальных канальцев.
Установлена зависимость между образованием и разрушением коллагена и степенью тубулоинтерстициального фиброза в виде повышения фракций свободного оксипролина.
Определение в моче уровня ангиотензина II, трансформирующего фактора роста-β1 прокальцитонина с последующим пересчетом показателей на креатинин мочи целесообразно использовать в качестве дополнительных диагностических критериев формирования и прогрессирования хронического воспалительного процесса в почечной ткани у детей с ПМР. Установленная прямая корреляционная связь между уровнем экскреции AngII, TGF-β1, ПКТ и степенью тяжести РН у больных с ПМР свидетельствует о целесообразности и перспективности их включения в качестве диагностических маркеров прогнозирования тяжести рефлюкс-нефропатии.
Список литературы
1. Аничкова ИВ, Папаян АВ. Рефлюкс-нефропатия. Клиническая нефрология детского возраста. Левша. Санкт-петербург, СПб., 2008; 452–457
2. Папаян АВ, Савенкова НД. Клиническая нефрология детского возраста. Левша. Санкт-Петербург, СПб., 2008: 600
3. Tej K. Mattoo. Vesicoureteral Reflux and Reflux Nephropa-thy. Adv Chronic Kidney Dis 2011; 18(5): 348–354
4. Даминова МА. Хроническая болезнь почек у детей: этиология, классификация и факторы прогрессирования. Вестник современной клинической медицины 2016;9(2):36–41
5. Giovanni M, Kjell T, Hewitt I. Febrile Urinary Tract Infections in Children. New Engl J of Medicine 2011; 365:239–250
6. Мачехина ЛЮ. Современные взгляды на патогенетические механизмы, течение, прогноз и методы лечения рефлюкс-нефропатии. Автореф. дис. ... канд. мед. наук.
7. М., 2010: 38
8. North American Pediatric Renal Transplant Cooperative Study (NAPRTCS). Annual report. 2010. The EMMES Corporation, Rockville, MD.
9. Salo J, Ikäheimo R, Tapiainen T. Childhood urinary tract infections as a cause of chronic kidney disease. Pediatrics 2011;128(5):840
10. Massanyi EZ, Preece J, Gupta A et al. Utility of screening ultrasound after first febrile UTI among patients with clinically significant vesicoureteral reflux. Urology 2013; 82(4):905–910
11. Liang, X.L. Beyond Early Diagnosis: Prognostic Biomarkers for Monitoring Acute Kidney Injury: X.-L. Liang, W. Shi. Hong Kong J. Nephrol. 2010; 12(2):45–49
12. Зорин ИВ, Вялкова АА. Прогнозирование прогрессирования тубуло-интерстициального поражения почек у детей с рефлюкс-нефропатией. Нефрология 2015;19(3): 65–71
13. Чичуга ЕМ, Настаушева ТЛ, Звягина ТГ. Маркеры хронической болезни почек у детей с обструкцией мочевых путей и пузырно-мочеточниковым рефлюксом. Педиатрическая фармакология 2015;12 (4): 407–413
14. Уразаева ЛИ, Максудова АН. Биомаркеры раннего повреждения почек: Нефрология, практическая медицина, инновационные технологии в медицине. Редактор 2014;1:125– 130
15. Lee RS. Biomarkers for peadiatric urological disease. Curr Opin Urol 2009;19 (4): 397–401
16. Chertin B, Rolle U, Cascio S. Upregulation of angiotensin II receptors in reflux nephropathy. Pediatr Surg 2002; 37(2):251–255
17. Morales MG, Vazquez Y, Acuña MJ et al. Angiotensin II-induced pro-fibrotic effects require p38MAPK activity and transforming growth factor beta 1 expression in skeletal muscle cells. Int J Biochem Cell Biol 2012;44(11):1993–2002
18. Fouzas S, Krikelli E, Vassilakos P et al. DMSA scan for revealing vesicoureteral reflux in young children with urinary tract infection. Pediatrics 2010;126:513–519
19. Стрелкова ТН. Клиническое значение оценки метаболитов обмена коллагена при пиелонефритах у детей. Медицинский альмонах: ГБОУ ВПО «Ижевская государственная медицинская академия» 2012; 2:(21):217
20. Lebowitz RL, Olbing H, Parkkulainen KV et al. International system of radiographic grading of vesicoureteric reflux. International Reflux Study in Children. Pediatr Radiol 1985; 15:105–109
21. Piepsz A, Colarinha P, Gordon I, Hahn K. Peadiatric Committee of the European Association of Nuclear Medicine. Guidelines for 99-mTc-DMSA scintigraphy in children. Eur J Nucl Med 2001; 28:BP37–BP41
22. Hussein A, Askar E, Elsaeid M, Schaefer F. Functional polymorphisms in transforming growth factor-beta-1 (TGFbeta-1) and vascular endothelial growth factor (VEGF) genes modify risk of renal parenchymal scarring following childhood urinary tract infection. Nephrol Dial Transplant 2010; 25:779–785
23. Ruiz-Ortego M, Lorenso O, Suzuki Y, Ruperes M. Proinflamatory actions of angiotensin II. Curr Opin Nephrol Hypertens 2001; 10:321–329
24. Биохимия: учебник для вузов. Е.С. Северин, ред.; 2009 (5):768
25. Sabasinsca A, Zoch-Zwierz V, Wasilevsca A, Porowski T. Laminin and transforming growth factor beta-1 in children with vesicoureteric reflux. Pediatr Nephrol 2008; 23:769–774
26. Peter J. Margetts, Catherine Hoff, Limin Liu. Transforming growth factor β-induced peritoneal fibrosis is mouse strain dependent. Oxford Journals Medicine Nephrology Dialysis Transplantation 2012; 28(8): 2015–2027
27. Махачев ВМ, Корсунский АА, Османов ИМ, Длин В.В. Клиническое значение определения белков в моче для ранней диагностики рефлюкс-нефропатии у детей. Нефрология и диализ 2005; 7(1):41–45
28. Chiou YY, Chiu NT, Chen MJ, Cheng HL. Role of beta 2-mi-croglobulinuria and microalbuminuria in pediatric febrile urinary tract infection. Acta Paediatr Taiwan 2001;42(2):84–89
29. Sali V. Importanţa diagnostică a determinării α-glicozidazei neutre şi a β2-microglobulinei în pilonefrita cronică. Arta Medică, 2007:5 (26):41–44
30. Karlen J, Linne T, Wikstad I, Aperia A. Incidence of mi-croalbuminuria in children with pyelonephritic scarring. Pediatr Nephrol 1996;10(6):705–708
31. Kaminska A, Jung A, Olszewski S. β2-microglobulinuria in children with vesico-ureteral reflux and recurrent urinary tract infections. Pol Merkuriusz Lek 2000; 8 (46):240–241
32. Kivirikko KI. Urinary excretion of hydroxyproline in health and disease. Int rev Connect Tiss Res 1970; 5:93–163
33. Phang JM, Hu CA, Valle D. Disorders of profile and hydroxyproline metabolism. In: Scriver CR, Beaudet AL, SLY ws, Vallee D. The metabolic and molecular bases of inherited disease.
34. McGraw – Hill: New York 2001:1821–1938
35. Nikfar R, Khotaee G, Ataee N, Shams S. Usefulness of procalcitonin rapid test for the diagnosis of acute pyelonephritis in children in the emergency department. Pediatrics International 2010;52(2):196–198
36. Leroy S, Gervaix A. Procaltitonin: A key marker in children with urinary tract unfection. Advances in urology 2011; 1–7
37. Захарова ИН, Кучерова ВВ. Роль прокальцитонина в дифференциальной диагностике микробно-воспалительных заболеваний почек. Актуальные проблемы детской нефрологии. В: Материалы Международной школы и научно-практической конференции по детской нефрологии, Оренбург, 2010;130
38. Mantadakis E, Plessa E, Vouloumanou EK, Karageorgopoulos DE, Chatzimichael A. Serum procalcitonin for prediction of renal parenchymal involvement in children with urinary tract infections: a meta-analysis of prospective clinical studies. The Journal of Pediatrics 2009; 155: (6): 875–881
39. Benador N, Siegrist C-A, Gendrel D et al. Procalcitonin is a marker of severity of renal lesions in pyelonephritis. Pediatrics1998; 102:1422–1425
40. Nikfar R, Khotaee G, Ataee N, Shams S. Usefulness of procalcitonin rapid test for the diagnosis of acute pyelonephritis in children in the emergency department. Pediatrics International 2010; 52:(2):196–198
41. Bressan S, Andreola B, Zucchetta P, Montini G. Procaltitonin as a predictor of renal scarring in infants and young children. Pediatr Nephrology 2009; 24: 1199–1204
42. Kotoula A, Gardikis S, Tsalkidis A. Procaltitonin for the early prediction of renal parenchymal involvement in the children with UTI: preliminary results. International Urology and Nephrology 2009; 41 (2):393–399
Об авторах
Н. М. ЗайковаРоссия
канд. мед. наук Россия, 119991, Москва, ул. Трубецкая, д. 8, стр. 2. Кафедра педиатрии и инфекционных болезней педиатрического факультета Первого МГМУ им. И.М. Сеченова, Москва; Институт Матери и Ребенка, г. Кишинев, Молдова, ассистент кафедры
В. В. Длин
Россия
проф., д-р мед. наук Научно-исследовательский клинический институт педиатрии ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздрава России, Москва
Л. А. Синицына
Молдова
канд. мед. наук 2060, Молдова, г. Кишинев, ул. Буребиста, д. 93. Институт Матери и Ребенка, старший научный сотрудник, зав. патоморфологической лабораторией
А. В. Еремеева
Россия
канд. мед. наук Россия, 119991, Москва, ул. Трубецкая, д. 8, стр. 2. Кафедра педиатрии и инфекционных болезней педиатрического факультета Первого МГМУ им. И.М. Сеченова, ассистент кафедры
Н. Е. Ревенко
Молдова
Проф., д-р мед. наук 2060, Молдова, г. Кишинев, ул. Буребиста, д. 93. Институт Матери и Ребенка, зам. директора по науке
А. А. Корсунский
Россия
проф., д-р мед. наук Россия, 119991, Москва, ул. Трубецкая, д. 8, стр. 2. Кафедра педиатрии и инфекционных болезней педиатрического факультета Первого МГМУ им. И.М. Сеченова
Ю. В. Юдина
Россия
кафедра педиатрии и инфекционных болезней педиатрического факультета Первого МГМУ им. И.М. Сеченова, врач-интерн
Рецензия
Для цитирования:
Зайкова Н.М., Длин В.В., Синицына Л.А., Еремеева А.В., Ревенко Н.Е., Корсунский А.А., Юдина Ю.В. МАРКЕРЫ КОЛЛАГЕНООБРАЗОВАНИЯ И СКЛЕРОЗИРОВАНИЯ В ДИАГНОСТИКЕ ПРОГРЕССИРОВАНИЯ РЕФЛЮКС-НЕФРОПАТИИ У ДЕТЕЙ. Нефрология. 2018;22(3):33-42. https://doi.org/10.24884/1561-6274-2018-22-3-33-42
For citation:
Zaicova N.M., Dlin V.V., Sinitcina L.V., Eremeeva A.V., Revenco N.E., Korsunskii A.A., Uidina U.V. MARKERS COLLAGENOPATHY AND SCLEROSIS IN THE DIAGNOSIS OF THE PROGRESSION OF REFLUX NEPHROPATHY IN CHILDREN. Nephrology (Saint-Petersburg). 2018;22(3):33-42. (In Russ.) https://doi.org/10.24884/1561-6274-2018-22-3-33-42








































