Перейти к:
Активность ренин-альдостероновой системы и формирование артериальной гипертензии у больных с врождённым пузырно-мочеточниковым рефлюксом и рефлюкс-нефропатией
Аннотация
Ключевые слова
Для цитирования:
Мамбетова А.М., Инарокова А.М., Шабалова Н.Н. Активность ренин-альдостероновой системы и формирование артериальной гипертензии у больных с врождённым пузырно-мочеточниковым рефлюксом и рефлюкс-нефропатией. Нефрология. 2016;20(5):30-35.
For citation:
Mambetova A.M., Inarokova A.M., Shabalova N.N. The activity of the renin-aldosterone system and arterial hypertension creation in patients with congenital vesicoureteral reflux and reflux nephropathy. Nephrology (Saint-Petersburg). 2016;20(5):30-35. (In Russ.)
ВВЕДЕНИЕ
Рефлюкс-нефропатия (РН) — заболевание, возникающее при наличии пузырно-мочеточникового рефлюкса (ПМР) и характеризующееся развитием фокального склероза в почечной паренхиме. РН занимает в структуре терминальной хронической почечной недостаточности у детей одно из ведущих мест [1, 2, 6], является фактором риска формирования хронической болезни почек (ХБП) [3-5]. Внимание к проблеме обусловлено высокой распространённостью данной патологии. Риск образования рубца в почечной ткани наиболее высок у детей первых лет жизни (19,8% - до 2 лет). Частота склеротических изменений в почках, при наличии ПМР, увеличивается с возрастом больного: 10% случаев - у новорождённых, 26% - у детей до 8 лет, 47% - у детей старше 8 лет и 94% - среди взрослых [6].
Исследования последних лет свидетельствуют о фундаментальном значении ренин-ангиотензин- альдостероновой системы (РААС) в склерозировании почечной ткани у больных с пузырномочеточниковым рефлюксом [1, 2, 6].
РААС - комплекс вазоактивных соединений, участвующих в регуляции сосудистого тонуса, системной и местной гемодинамики, артериального давления (АД). Ангиотензин II - основной эффектор РААС - оказывает влияние на многие физиологические системы, в том числе систему регуляции АД, функцию почек, обладает собственной мощной прессорной активностью. Функциональная активность РААС регулируется ангиотензином на основе механизма отрицательной обратной связи. Если этот механизм нарушается, то продуцируется избыточное количество ренина и, как следствие, - ангиотензина II, что сопровождается вазоконстрикцией, повышением синтеза альдостерона и задержкой натрия в организме. Последствия активации РААС - стабильное повышение АД, гипернатриемия, склонность к гипокалиемии, повышение объёма циркулирующей жидкости [7-9]. Артериальная гипертензия (АГ) может носить как гиперрениновый, так и гипорениновый характер, причём эти различия не рассматриваются в качестве разных вариантов гипертензии, а квалифицируются как разные фазы течения болезни [10].
Согласно экспериментальным и клиническим данным, ангиотензин II, помимо классического сосудосуживающего действия, вызывает ряд негемодинамических эффектов, способствуя развитию профибротических реакций. Ангиотензин II подавляет синтез оксида азота, стимулирует экспрессию молекул адгезии на клетках эндотелия с последующим привлечением мононуклеаров в интерстиций, способствует развитию оксидативного стресса, служащего универсальным патологическим механизмом прогрессирования ХБП [11]. Альдостерон не только регулирует объём внеклеточной жидкости, но и способствует гиперэкспрессии трансформирующего фактора роста - β и коллагена I типа [12, 13].
Частота артериальной гипертензии при почечных заболеваниях различна. Наиболее её частыми причинами в детском возрасте являются врождённые аномалии мочевой системы [14]. При рефлюкс-нефропатии артериальная гипертензия развивается в среднем у 10% детей и является одним из факторов ее прогрессирования [6]. Артериальная гипертензия приводит к повышению внутриклубочкового давления, гиперперфузии нефронов с последующим склерозированием почечной паренхимы [8].
В основу данного исследования легли результаты многолетних наблюдений больных с врождённым пузырно-мочеточниковым рефлюксом в детском нефрологическом отделении ГКБ №1 г. Нальчика и на кафедре патологической физиологии Санкт-Петербургского государственного педиатрического медицинского университета, целью которого явилась оценка содержания ренина и альдостерона у детей с врождённым пузырномочеточниковым рефлюксом без структурнофункциональных изменений и рефлюкснефропатией, вклада ренина и альдостерона в развитие артериальной гипертензии.
ПАЦИЕНТЫ И МЕТОДЫ
Проведено комплексное клинико-лабораторное обследование 75 больных с ПМР в возрасте от 3 до 18 лет. Контрольную группу составили 30 здоровых детей того же возраста.
Всем больным проведено полное нефро- урологическое обследование с использованием клинических, лабораторных и инструментальных методов: УЗИ мочевой системы, эхокардиография, суточное мониторирование артериального давления (СМАД), экскреторная урография и микционная цистография, радионуклидные исследования с DMSA.
В зависимости от наличия структурнофункциональных изменений при ПМР на основании эхографических и радиологических данных выделены 3 группы. В 1-ю группу включены 23 ребёнка с ПМР без структурно-функциональных изменений; 2-ю группу составили 29 детей с рефлюкс-нефропатией без синдрома АГ. В 3-ю группу вошли 23 больных с рефлюкс-нефропатией и АГ.
У всех больных на основании клинических проявлений и данных лабораторных показателей определена стадия клинико-лабораторной ремиссии вторичного пиелонефрита. В момент включения в исследование ПМР был устранён у всех детей. Давность (средняя) коррекции ПМР в 1-й группе составила 12 мес, во 2-й группе - 24 мес, в 3-й группе - 24 мес. Статическая сцинтиграфия выполнена не менее чем через 6 мес после обострения пиелонефрита. СМАД проводили на аппарате «BP Lab 2.0. a20W». АД измерялось 1 раз в 30 мин в дневное время и 1 раз в 45 мин в ночное время. При анализе оценивались средние значения АД, индексы времени, суточный индекс АД. За АГ приняты значения АД выше 95-го перцентиля для длины тела ребёнка. Расчёт величины скорости клубочковой фильтрации (СКФ) производили по формуле Шварца.
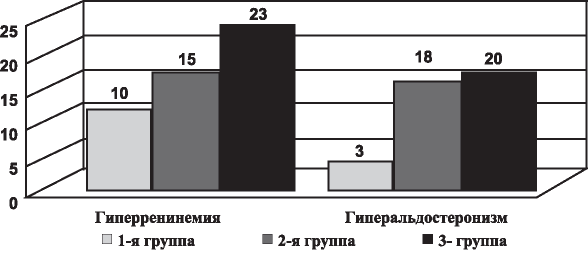
Рис. 1. Число детей с гиперренинемией и гиперальдостеронизмом соответственно группам.
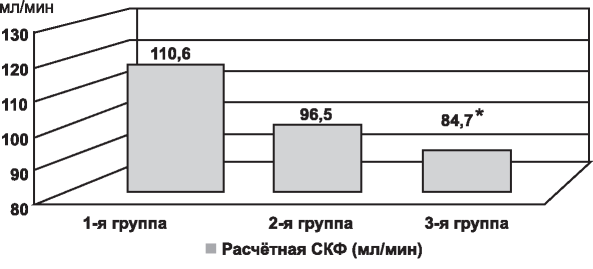
Рис. 2. Расчётная СКФ по формуле Шварца соответственно группам. Достоверность различия показателей р3-1=0,001.
Содержание в плазме крови ренина и альдосте- рона (в положении лежа) определяли иммуноферментным методом. Уровни ренина и альдостерона сопоставлены с возрастными колебаниями гормонов. У 26 больных с артериальной гипертензией гормоны исследованы на фоне терапии эналаприлом на протяжении 6 мес (дети до 14 лет в дозе 0,2 мг/кг/24 ч в 1 приём, подростки - 5-10 мг/24 ч в 1 приём). Результаты проводимой терапии оценивали на основании клинических данных, СМАД, показателей функционального состояния почек, концентрации ренина, альдостерона.
Статистический анализ результатов выполняли с использованием пакета прикладных статистических программ «Statistica v5.77» («StatSoft Inc», США). Количественные переменные представлены в виде среднего значения ± стандартная ошибка среднего значения. Для попарного сравнения независимых групп использовали t-критерий Стьюдента. Для оценки силы связи между изучаемыми переменными вычитсляли коэффициент ранговой корреляции Спирмена. Нулевую статистическую гипотезу об отсутствии различий и связей отвергали при p<0,05.
РЕЗУЛЬТАТЫ
Активация ренин-альдостероновой системы выявлена у 51 ребенка (68%) из 75 больных с пузырно-мочеточниковым рефлюксом.
ПМР без структуно-функциональных изменений у 43,5% детей не сопровождается активацией РААС, при рефлюкс-нефропатии с артериальной гипертензией имеется стимуляция продукции гормонов у всех детей.
Частота гиперренинемии и гиперальдостеронизма также оказалась различной (рис.1).
В 3-й группе рефлюкс-нефропатия с артериальной гипертензией сопровождается гиперренинемией у всех больных, гиперальдостеронизм отмечен у значительного большинства (86,9%). У больных с ПМР без структурно-функциональных изменений гиперренинемия выявлена у 43,4% больных, гиперальдостеронизм лишь у 13%.
Содержание в плазме крови ренина и альдостерона у детей соответственно группам представлено в табл. 1.
Максимальные концентрации ренина и альдостерона наблюдались в группе детей со структурно-функциональными изменениями и АГ. Между больными с рефлюкс-нефропатией и ПМР без структурно-функциональных изменений выявлены достоверные различия в степени гиперпродукции ренина и альдостерона.
В 3-й группе у больных с рефлюкснефропатией и артериальной гипертензией установлены достоверно более низкие значения СКФ (рис. 2).
Таблица 1
Концентрация ренина и альдостерона соответственно группам
Группы | Число детей | Ренин | Альдостерон | ||
|---|---|---|---|---|---|
нг/мл | Достоверность различий между группами | пг/мл | Достоверность различий между группами | ||
1-я | n=23 | 1,5±0,2 | P 1-3<0,001 | 118,9±33,0 | p 1–3<0,05 |
2-я | n=29 | 2,6±0,2* | p 2-3<0,05 | 260,3±25,3* | - |
3-я | n=23 | 5,9±1,6** | p 1-3<0,001 p 2-3<0,05 | 365,9±75,5** | p 1–3<0,05 |
Контрольная группа(n=30) | 1,1±0,03 | 89,3±14,1 | |||
Различия достоверны с данными контрольной группы: * p<0,01; ** p<0,001.
Таблица 2
Содержание электролитов в сыворотке крови соответственно группам
Группы | Число детей | Калий | Натрий | ||
|---|---|---|---|---|---|
ммоль/л | Достоверность различий между группами | ммоль/л | Достоверность различий между группами | ||
1-я | n=23 | 4,2±0,1 | - | 140,5±3,7 | p 1–3<0,05 |
2-я | n=29 | 4,1±0,1 | - | 144,2±3,5 | - |
3-я | n=23 | 3,9±0,15* | - | 148,4±2,5* | p 1–3<0,05 |
Контрольная группа (n=30) | 4,4±0,06 | 139,5±0,9 | |||
Различия достоверны с данными контрольной группы: * p<0,01.
Таблица 3
Влияние терапии эналаприлом на скорость клубочковой фильтрации, концентрацию в плазме крови ренина, альдостерона и электролитов у больных с артериальной гипертензией
Показатели | Группа с синдромом АГ (n=26) | Контрольная группа(n=30) | ||
|---|---|---|---|---|
До лечения (n=26) | После лечения (n=26) | Достоверность различий между группами р | ||
Ренин (нг/мл) | 4,4±0,8*** | 2,4±0,4* | <0,05 | 1,1±0,03 |
Альдостерон (пг/мл) | 240,1±35,5 * | 69,3±9,3 | <0,001 | 89,3±14,1 |
СКФ (мл/мин) | 84,5±2,3 *** | 106,0±2,5 | <0,001 | 118,3±2,5 |
Натрий (ммоль/л) | 148,5±2,1** | 139,7±3,5 | <0,05 | 139,5±0,9 |
Калий (ммоль/л) | 3,9±0,1** | 4,4±0,05 | <0,05 | 4,4±0,06 |
Различия достоверны с данными контрольной группы: * p<0,05; ** p<0,01; *** p<0,001.
В этой же группе больных имеется отрицательная корреляционная связь между ренином и СКФ (r=-0,6, p<0,001).
Артериальная гипертензия выявлена только при гиперпродукции одного или обоих гормонов в 34,7% у 26 детей с ПМР. У 5 больных (19%) имелась изолированная гиперпродукция ренина, у 21 ребёнка (81%) повышены оба гормона. Таким образом, у всех больных с ПМР имел место гиперренинемический вариант артериальной гипертензии.
Вместе с тем, активация РААС не всегда сопровождалась синдромом АГ. У 25 детей с ПМР (49%) на фоне гиперпродукции одного или обоих гормонов отсутствовал синдром артериальной гипертензии, что заслуживает особого внимания.
Анализ электролитного баланса у детей обследованных групп представлен в табл. 2.
Как видно из табл. 2, только между 1-й и 3-й группами выявлены достоверные различия по степени гипернатриемии. Частота гипернатриемии также зависит от наличия структурнофункциональных изменений и АГ и увеличивается от 8,6% в 1-й группе до 56,5% в 3-й группе. Гипокалиемия выявлена лишь в 13,3% у 10 больных и максимальна в 3-й группе (22,0%).
Таким образом, рефлюкс-нефропатия с артериальной гипертензией ассоциируется с достоверно более высокими концентрациями ренина и альдостерона, снижением СКФ, артериальная гипертензия у 56,5% сопровождается гипернатриемией.
Анализ влияния терапии эналаприлом на СКФ, концентрацию ренина, альдостерона и электролитов у больных с артериальной гипертензией представлен в табл. 3.
На фоне лечения отмечены стабилизация артериального давления и повышение СКФ. Выявлено достоверное снижение концентрации ренина, однако, его уровень не достигает значений в группе контроля. Отмечена нормализация уровня альдостерона и электролитов.
ОБСУЖДЕНИЕ
Обструктивный синдром и связанный с ним процесс ремоделирования тубулоинтерстициальной ткани почки при врожденном пузырномочеточниковом рефлюксе, по-видимому, является пусковым механизмом активации РААС как инструмента внутрипочечной адаптации.
Учитывая роль ангиотензина II и альдостерона в стимуляции пролиферации фибробластов, гладкомышечных клеток и развитии интерстициального фиброза в почках, мы проанализировали продукцию ренина и альдостерона и сопоставили полученные результаты с наличием структурнофункциональных изменений почечной ткани у больных с ПМР.
У 68% больных с врождённым ПМР, несмотря на хирургическую коррекцию порока, выявлена гиперпродукция ренина и альдостерона, т.е. имеются условия для развития и прогрессирования нефросклероза. Рефлюкс-нефропатия ассоциируется с более высокими концентрациями обоих гормонов.
Согласно данным литературы, обструкция мочеточников при врождённом ПМР вызывает каскад взаимодействий, включающих изменения в канальцевых ферментах, ответственных за секрецию и синтез вазоактивных веществ, в частности ангиотензина II, тромбоксана А2, которые приводят к прегломерулярной констрикции и ишемическим повреждениям [1, 2, 6].
Повышение давления в мозговом слое почки увеличивает реабсорбцию натрия в восходящем сегменте петли Генле и, соответственно, стимулирует продукцию ренина через осморецепторы плотного пятна. В условиях сниженной СКФ продукция ангиотензина II, вызывающего преимущественную констрикцию отводящей артериолы, может рассматриваться как приспособительный механизм, способствующий повышению фильтрации. Однако высокие концентрации ангиотензина II приводят к прегломерулярной вазоконстрикции, вторичной стимуляции РААС через барорецепторы юкстагломерулярного аппарата и повторному снижению СКФ. Таким образом формируется порочный круг. Гиперпродукция ангиотензина II включает новый каскад ишемических повреждений в почке, гиперпродукцию альдостерона и вносит в патогенез новые звенья в виде гипернатриемии, повышения объёма циркулирующей крови и формирования АГ [7, 10, 15].
В нашем исследовании артериальная гипертензия выявлена только при гиперпродукции одного или обоих гормонов - у 34,7% больных. В патогенезе АГ принимают участие оба гормона, но вклад каждого из них у конкретного ребенка различен. Преобладание гиперренинемии указывает на констрикторный механизм гипертензии. Альдостерон, повышая уровень натрия в плазме, с одной стороны, сенсибилизирует сосудистую стенку к нервным влияниям, а с другой - повышает объём циркулирующей крови при участии антидиуретического гормона. Нельзя исключить недостаточность вазодилататорных механизмов (простагландинов, кининов) в развитии артериальной гипертензии.
Исследование показало, что между больными с ПМР без структурно-функциональных изменений и рефлюкс-нафропатией с артериальной гипертензией имеются достоверные различия по степени гипернатриемии.
Согласно данным литературы, стимуляция реабсорбции натрия может быть обусловлена и паракринным эффектом ангиотензина II. На уровень натрия в крови также влияет потребление натрия с пищей и СКФ. Даже незначительное снижение СКФ снижает фильтрационный заряд натрия, при этом его реабсорбция возрастает даже при нормальном уровне альдостерона [16, 17].
Активация РААС не всегда сопровождалась синдромом АГ. По-видимому, этот факт можно объяснить длительной сохранностью механизмов регуляции АД на системном уровне, активацией кининовой системы и синтеза простагландинов.
ЗАКЛЮЧЕНИЕ
Выявлены различия в частоте и степени гипер- ренинемии и гиперальдостеронизма в зависимости от наличия структурно-функциональных изменений и артериальной гипертензии. Рефлюкснефропатия ассоциируется с более высокими концентрациями ренина и альдостерона, выступающих в роли патогенетических механизмов формирования нефросклероза и артериальной гипертензии.
Синдром артериальной гипертензии развивается не у всех детей с повышенной продукцией ренина и альдостерона. Частота АГ определяется структурно-функциональными изменениями почечной ткани. Установлен гиперренинемический характер артериальной гипертензии как при ПМР без структурно-функциональных изменений, так и при рефлюкс-нефропатии.
Терапия иАПФ оказывает положительное влияние на течение хронических болезней почек, способствует стабилизации артериального давления, улучшает клубочковую фильтрацию, предупреждает экспрессию воспалительных медиаторов.
Список литературы
1. Эрман МВ. Нефрология детского возраста: руководство для врачей. 2-е издание, Спец.Лит., СПб., 2010; 683
2. Папаян АВ, Савенкова НД. Клиническая нефрология детского возраста. Руководство для врачей. Левша, СПб., 2008; 600
3. Шилов ЕМ. Хроническая болезнь почек и нефропротективная терапия: метод. руководство для врачей. ЕМ Шилов, МЮ Швецов, ИН Бобкова [и др.]; под ред. ЕМ Шилова. М., 2012; 76
4. Национальные рекомендации. Хроническая болезнь почек: основные принципы скрининга, диагностики, профилактики и подходы к лечению. Под ред. АВ. Смирнова. Нефрология 2012; 16 (1): 15-89
5. Батюшин ММ, Повилайтите ПЕ. Клиническая нефрология. Руководство. Джангар, Элиста, 2009; 656
6. Игнатова МС. Детская нефрология: Руководство для врачей. 3 изд. ООО «Медицинское информационное агентство», М., 2011; 696
7. Есаян АМ. Тканевая ренин-ангиотензиновая система почки. Новая стратегия нефропротекции. Нефрология 2008; 6(3): 8-16
8. London G, Marchais S, Guérin A, Métivier F. Arterial hypertension, chronic renal insufficiency and dialysis. Nephrol Ther 2007; 3(Suppl. 3): S156-S161
9. Нефрология. Национальное руководство. Под ред. НА Мухина. ГЭОТАР- Медиа, М., 2009, 720
10. Чазова ИЕ, Ратова ЛГ. Современные клинические рекомендации по артериальной гипертензии. Сердце 2008; 7 (3): 136-138
11. Whaley-Connell A, Choudhury NA, Hayden MR et al. Oxidative stress and glomerular filtration barrier injury: the role of the rennin-angiotensin system in the Ren2 transgenic rat. Am J Physiol Renal Physiol 2006; 291: F1308-F1314
12. Del Vecchio L, Procaccio M, Vigano S et al. The role of aldosterone in kidney damage and clinical benefits of its blockade. Nat Clin Pract Nephrol 2007; 3; 342-347
13. Nagase M, Yoshida S, Shibata S et al. Enhanced aldosterone signaling in the early nephropathy of rats with metabolic syndrome: possible contribution of fat - derived factors. J Am Soc Nephrol 2006; 17: 3438-3446
14. Пугачёв АГ. Детская урология. Геотар-Медиа, М., 2009; 831
15. Ochodnicky P, Henning RH, van Dokkum RP et al. Microalbuminuria and endothelial dysfunction: emerging targets for primary prevention of endorgan damage. Cardiovasc Pharmacol 2006; 47 (Suppl. 2): S151-S162
16. Go AS, Mozaffarian D, Roger VL et al. AHA Statistical Update. Heart Disease and Stroke Statistics-2013 Update. A Report From the American Heart Association. Circulation 2013; 127:e6-e245
17. Appel LJ, Frohlich ED, Hall JE et al. AHA Presidential Advisory. The Importance of Population-Wide Sodium Reduction as a Means to Prevent Cardiovascular Disease and Stroke. A Call to Action From the American Heart Association. Circulation 2011; 123:1138-1143
Об авторах
А. М. МамбетоваРоссия
А. М. Инарокова
Россия
Н. Н. Шабалова
Россия
Рецензия
Для цитирования:
Мамбетова А.М., Инарокова А.М., Шабалова Н.Н. Активность ренин-альдостероновой системы и формирование артериальной гипертензии у больных с врождённым пузырно-мочеточниковым рефлюксом и рефлюкс-нефропатией. Нефрология. 2016;20(5):30-35.
For citation:
Mambetova A.M., Inarokova A.M., Shabalova N.N. The activity of the renin-aldosterone system and arterial hypertension creation in patients with congenital vesicoureteral reflux and reflux nephropathy. Nephrology (Saint-Petersburg). 2016;20(5):30-35. (In Russ.)
JATS XML








































