Перейти к:
Нефропротекторные эффекты ацизола на фоне токсического действия сульфата кадмия
Аннотация
Для цитирования:
Кокаев Р.И., Брин В.Б. Нефропротекторные эффекты ацизола на фоне токсического действия сульфата кадмия. Нефрология. 2016;20(5):90-96.
For citation:
Kokaev R.I., Brin V.B. Nephroprotective effects of acizol on the background of cadmium sulphate intoxication. Nephrology (Saint-Petersburg). 2016;20(5):90-96. (In Russ.)
ВВЕДЕНИЕ
Антропогенное загрязнение окружающей среды кадмием ведет к кумуляции в организме и стимулирует возникновение ряда патологических процессов. Патологические эффекты кадмия реализуются благодаря его влиянию на процессы окислительного фосфорилирования [1, 2], конкурентное замещение цинка в ряде металлоэнзимов, участвующих в процессе клеточного дыхания, и изменение их активности [3], усиление активности перекисного окисления липидов [4-6], а также нарушение обмена жизненно важных электролитов [7]. Перечисленные механизмы могут приводить к развитию тяжелых острых и хронических процессов, поражению практически всех органов и систем, включая почки [8-11].
В наших предыдущих экспериментах была выявлена способность кадмия вызывать уменьшение осмотической стойкости мембран эритроцитов и развитие выраженной анемии с прогрессивным снижением уровня гемоглобина [12], что может быть связано как с гемолизом эритроцитов, так и с влиянием кадмия на обмен меди и железа, непосредственно участвующих в процессе кроветворения. Указанные изменения могут усиливать прооксидантное действие избытка кадмия, равно как и угнетение ферментов антиоксидантной защиты, что также отмечалось ранее в наших исследованиях [12].
Препарат ацизол (металлокомплекс соли цинка с 1-винилимидазолом), являясь антигипоксантом, показал эффективность в снижении патологического влияния кадмия на гематологические проявления и систему перекисного окисления липидов в условиях хронической кадмиевой интоксикации.
Целью данного исследования было изучение патогенетических механизмов нарушения функции почек при длительном введении сульфата кадмия и анализ возможных профилактических эффектов ацизола.
МАТЕРИАЛ И МЕТОДЫ
В проведении экспериментов руководствовались статьёй 11-й Хельсинской декларации Всемирной медицинской ассоциации (1964), «Международными рекомендациями по проведению медико-биологических исследований с использованием животных» (1985) и Правилами лабораторной практики в Российской Федерации (приказ МЗ РФ от 19.06.2003 г. № 267).
Работа проведена на 60 крысах-самцах линии Вистар массой 200-300 г, разделенных на три группы: 1-я - интактные крысы, 2-я - крысы с введением кадмия (Cd), 3-я - опытные крысы с введением с ацизола (Cd+Ац). Животным двух групп вводили подкожно раствор сульфата кадмия в дозе 0,1 мг/кг (в пересчете на металл) каждый день в течение двух месяцев. Животным опытной группы 3 одновременно с кадмием вводили раствор ацизола через зонд в желудок ежедневно в дозе 30 мг/кг, также в течение двух месяцев.
Через 1 мес и через 2 мес эксперимента исследовали у контрольных, опытных и интактных животных показатели выделительной функции почек при спонтанном шестичасовом диурезе. Для сбора мочи животные помещались в обменные клетки на 6 ч. После этого в условиях спонтанного диуреза определялись объём диуреза, скорость клубочковой фильтрации по клиренсу эндогенного креатинина, канальцевая реабсорбция воды. Концентрацию белка, креатинина в биологических жидкостях (моче и плазме крови) определяли с помощью спектрофотометра «Apel PD-303» (Япония), концентрацию натрия - методом пламенной фотометрии («ФПА-2», Россия).
В конце эксперимента животных забивали с использованием тиопенталового наркоза, и в гомогенатах тканей почек послойно определяли концентрацию натрия и мочевины, а также активность Na+/К+ -АТФазы по методу J.C. Scow (1957).
Для гистологических исследований образцы ткани почек фиксировали в 10% нейтральном формалине, после чего подвергали заливке в парафин с последующим приготовлением срезов толщиной 7-8 мкм. Срезы окрашивали гематоксилином и эозином. Изучение срезов проводилось в проходящем свете при помощи микроскопа Микмед-1 под увеличением 80*200*400.
Статистический анализ результатов исследования проводили с использованием программы «GraphPad Prizm 6.1» (США). Данные приведены в форме средней арифметической величины (М) и ошибки средней (±m). Учитывая нормальное распределение исследуемых показателей, применяли параметрические статистические методы. Для попарного сравнения независимых групп использовался t-критерий Стьюдента, для выявления взаимосвязей рассчитывали коэффициент корреляции r Пирсона. Нулевую статистическую гипотезу об отсутствии различий и связей отвергали при p<0,05.
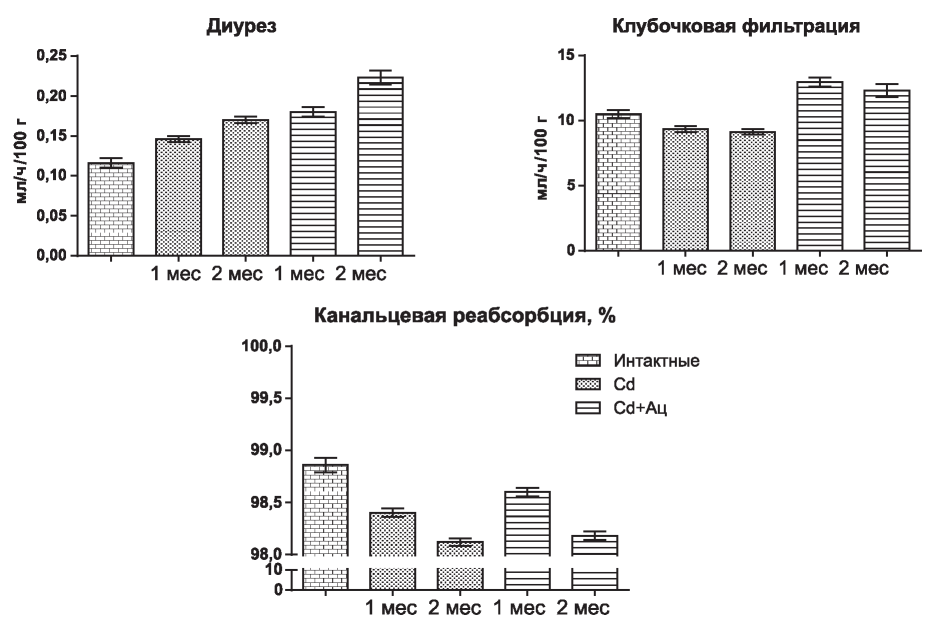
Рис. 1. Влияние ацизола на показатели водовыделительной функции почек при подкожном введении сульфата кадмия в дозе 0,1 мг/кг
РЕЗУЛЬТАТЫ
Подкожное введение сульфата кадмия через один месяц интоксикации (рис. 1) приводит к достоверному увеличению относительно интактных животных, спонтанного шестичасового диуреза за счет существенного снижения канальцевой реабсорбции (p<0,001). Через два месяца эксперимента при мало меняющейся клубочковой фильтрации (p<0,1) диурез увеличивался (p<0,001) еще в большей степени за счет прогрессивного снижения канальцевой реабсорбции (p<0,001).
В группе животных с одновременным введением ацизола (см. рис. 1) также отмечается увеличение спонтанного диуреза (p<0,001) уже через один месяц, что, однако, обусловлено значительным увеличением клубочковой фильтрации (p<0,01) и меньшей степенью снижения канальцевой реабсорбции [p<0,01; достоверное отличие от контроля (Cd) - р<0,001]. В конце второго месяца эксперимента увеличение спонтанного диуреза и снижение канальцевой реабсорбции стали более выраженными (р<0,001), повышение клубочковой фильтрации стало носить менее выраженный характер (р<0,05).
Уровень экскреции натрия достоверно увеличился (рис. 2) при изолированном введении соли кадмия только в конце второго месяца эксперимента (р<0,001), что было обусловлено снижением его канальцевой реабсорбции (р<0,001), несмотря на достоверное снижение фильтрационного заряда катиона (р<0,05).
У животных с профилактическим введением ацизола (см. рис. 2) через один месяц эксперимента было отмечено увеличение экскреции натрия с мочой (р<0,01), за счет увеличения фильтрационного заряда (р<0,01), без снижения показателя относительной канальцевой реабсорбции, что отличало эти изменения от таковых в группе с введением только кадмия. Через два месяца сочетанного введения соли кадмия и ацизола увеличение экскреции натрия относительно фона (р<0,001) было вызвано как увеличением фильтрационного заряда этих ионов (р<0,05), так и снижением канальцевой реабсорбции (р<0,05). Однако снижение уровня канальцевой реабсорбции ионов относительно фона носит менее выраженный характер, чем в группе с изолированным введением сульфата кадмия (р<0,05).
С целью изучения механизма нарушения воды и электролитов определяли концентрацию натрия и мочевины в гомогенатах почечной ткани послойно. Как представлено в табл. 1, у животных с введением сульфата кадмия концентрация натрия во всех слоях почек была достоверно ниже таковой относительно интактных (кора: р<0,02; медулла и сосочек: р<0,001). Такое же достоверное снижение концентрации мочевины (табл. 2) отмечается в медуллярном и папиллярном слоях почек (медулла и сосочек: p<0,001) у животных с изолированным введением кадмия.
У группы животных с сочетанным введением ацизола и тяжелого металла содержание как натрия, так и мочевины (см. табл. 1, 2) в слоях почек также достоверно было ниже значений у интактных животных, однако концентрации их в мозговом и сосочковом слоях были достоверно выше таковых у контрольных животных (медулла и сосочек p<0,001).
Изменения функции почек имеют статистически значимые корреляционные взаимосвязи с содержанием осмотически активных веществ в слоях ткани почек, по оси сравнения: интактные - контроль (Cd) - опыт (Cd+Ац). К примеру, снижение канальцевой реабсорбции воды у животных групп сравнения имеет положительную корреляционную взаимосвязь со снижением концентрации, натрия в корковом (r=0,94), мозговом (r=0,92, p<0,01) и сосочковом (r=0,91, p<0,01) слоях, а также мочевины в корковом (r=0,90 p<0,01), мозговом (r=0,97 p<0,01) и сосочковом (r=0,98, p<0,01) слоях. Таким образом, можно полагать, что увеличение объема диуреза является результатом снижения канальцевой реабсорбции воды из-за уменьшения действия вазопрессина в условиях недостаточного осмотического градиента слоев почек.
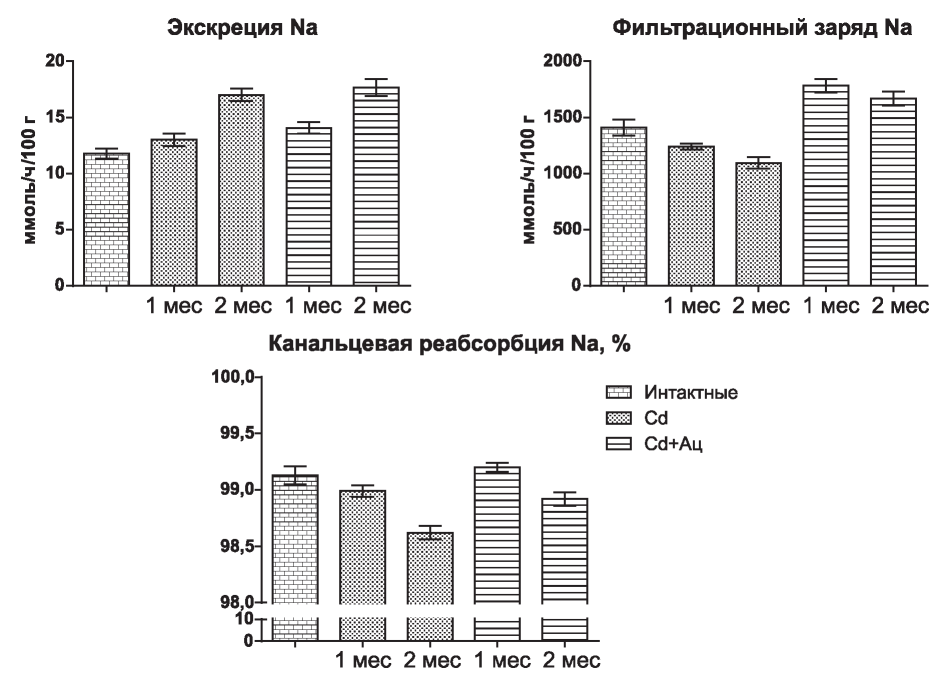
Рис. 2. Влияние ацизола на почечную обработку натрия при подкожном введении сульфата кадмия в дозе 0,1 мг/кг.
Таблица 1
Влияние ацизола на концентрацию натрия (ммоль/кг сухой массы) в слоях ткани почек при подкожном введении сульфата кадмия в дозе 0,1 мг/кг М±m)
Слои ткани | Группы животных | ||
|---|---|---|---|
почек | Интактные | Cd | Cd+Ац |
Кора | 25,12±0,16 | 21,88±0,24 ↕ | 23,2±0,29 ↕ |
Медулла | 40,23±0,70 | 31,5±0,54 ↕ | 35,53±0,33 ↕ Δ |
Папилла | 94,45±0,60 | 81,11±0,92 ↕ | 87,6±0,55 ↕ Δ |
Примечание. ↕ - достоверное отличие от фона; Δ - достоверное отличие от контроля.
Таблица 2
Влияние ацизола на концентрацию мочевины (ммоль/кг влажной массы) в слоях ткани почек при подкожном введении сульфата кадмия в дозе 0,1 мг/кг М±m)
Слои ткани почек | Группы животных | ||
|---|---|---|---|
Интактные | Cd | Cd+Ац | |
Кора | 19,1 ±0,22 | 18,3±0,21 | 18,7±0,35 |
Медулла | 53,6±0,84 | 46,5±0,67 ↕ | 48,6±0,75 ↕ Δ |
Папилла | 159,4±1,14 | 138,1±1,50 ↕ | 143,2±0,95 ↕ Δ |
Примечание. ↕ - достоверное отличие от фона; Δ - достоверное отличие от контроля.
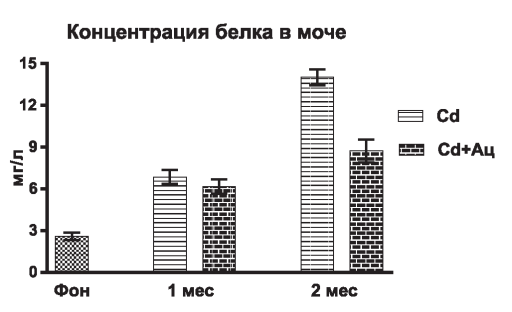
Рис. 3. Влияние ацизола на концентрацию белка в моче при подкожном введении сульфата кадмия в дозе 0,1 мг/кг
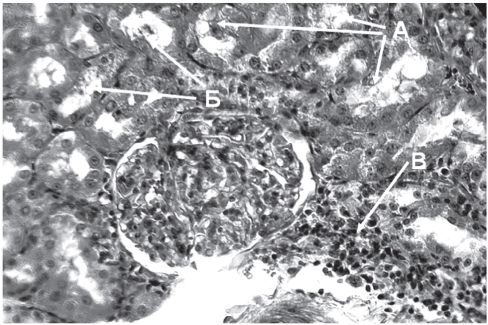
Рис. 4. Кадмиевая нефропатия при подкожном введении соли кадмия в дозе 0,1 мг/кг. Вакуолизация цитоплазмы эпителия канальцев и эндотелия капилляров с тотальным колликвационным некрозом клеток (А); вакуолизированный просвет канальцев (Б); периваскулярные инфильтраты (В). Ув. 400.
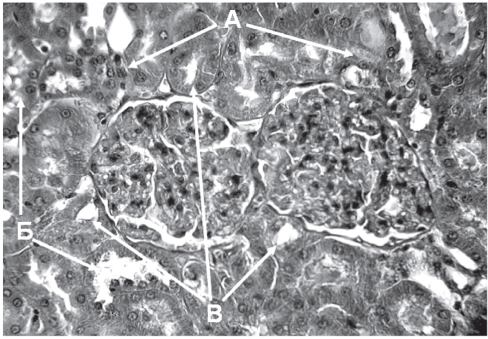
Рис. 5. Профилактическое влияние интрагастрального введения ацизола на кадмиевую нефропатию при подкожном введении соли кадмия в дозе 0,1 мг/кг. Уменьшение признаков кариолизиса по сравнению с группой с изолированным введением соли кадмия (А); уменьшено количество клеток с тотальным колликвационным некрозом (Б); большее количество канальцев с сохраненным просветом (В). Ув. 400.
Отмеченные изменения функционального состояния почек и изменения осмотического концентрирования ткани почек не раскрывают в полной мере механизмов, приводящих к вышеописанным проявлениям. Учитывая тропность многих тяжелых металлов, в частности кадмия, к нарушению дыхательных систем клеток и, следовательно, энергообразования, а также возможность прямого токсического воздействия кадмия на многие ферментные системы, нами была исследована активность фермента Na+/К+-АТФазы в слоях ткани почек. Активность Na+/К+-АТФазы у животных с хронической кадмиевой интоксикацией была снижена относительно таковой у интактных животных: в корковом слое - на 11,5% относительно интактных (с 2,6±0,11 до 2,3±0,15 мкмоль Рн/ мг белка/ч, р<0,05); в мозговом слое - на 27,4% (с 7,18±0,28 до 5,21±0,33 мкмоль Рн/мг белка/ч, р<0,001). На фоне профилактического введения ацизола уменьшение активности фермента было не столь выраженным. Так, уменьшение активности Na+/К+-АТФазы в корковом слое произошло на 7,7% относительно интактных (с 2,6±0,11 до 2,4±0,08 мкмоль Рн/мг белка/ч, р<0,1), что на 4,1% меньше, чем у контрольных животных, а в медуллярном - на 11,6% (с 7,18±0,28 до 6,35±0,28 мкмоль Рн/мг белка/ч, р<0,01), что также отражает меньшую степень угнетения активности фермента на 17,9% относительно контроля с изолированным введением сульфата кадмия. Изменение активности Na+/К+-АТФазы в слоях ткани почек у животных групп сравнения коррелирует с приведенными выше соответствующими значениями концентрации натрия как в корковом, так и мозговом веществе почек (r=0,99, р<0,01).
Повреждающее действие тяжелого металла подтверждается увеличением концентрации белка в моче (рис. 3) уже через 1 мес изолированного введения соли кадмия (р<0,001), а через два месяца прирост был почти в пять раз (р<0,001). В группе с сочетанным введением соли кадмия и ацизола достоверное увеличение концентрации белка в моче отмечалось только через два месяца эксперимента, выраженность чего была в значительно меньшей степени (р<0,01), чем в контрольной группе.
Отмеченные нами как в этом, так и предыдущих исследованиях, функциональные изменения в деятельности почек находят своё отражение в картине гистологических исследований ткани почек. Так, введение животным соли кадмия в дозе 0,1 мг/кг в течение 2 мес привело к значительным изменениям (рис. 4), представленным проявлениями дистрофии, некроза, дисциркуляторных процессов и воспалительной реакции. Превалируют патогистологические признаки повреждения канальцев.
Структурные отличия между группами с изолированным введением соли кадмия и сочетанным введением сульфата кадмия и ацизола заключаются в уменьшении степени выраженности проявлений всех вышеуказанных патологических процессов (рис. 5). Также уменьшено количество клеток эпителия канальцев, в которых гидропическая дистрофия достигает перехода в тотальный колликвационный некроз. Количество канальцев с сохраненным просветом также значительно больше, чем в группе с изолированным введением сульфата кадмия.
ОБСУЖДЕНИЕ
Отмеченные под влиянием сульфата кадмия изменения выделительной функции почек, проявившиеся в увеличении диуреза и экскреции натрия вследствие снижения канальцевой реабсорбции как воды, так и катиона натрия, могут быть обусловлены рядом факторов. Одним из возможных механизмов, приводящих к нарушению процесса реабсорбции в нефронах, можно считать прямое избирательное действие кадмия на эпителий проксимальных отделов канальцев. Снижение содержания натрия и мочевины в слоях ткани почек, приводящее к падению осмотического градиента, наличие выраженных корреляционных связей между функциональными показателями деятельности почки и концентрацией осмотически активных молекул в слоях ткани почек, позволяет думать о сниженной эффективности вазопресси- нового механизма концентрирования мочи в связи с токсическим действием кадмия.
Нефропротекторная эффективность ацизола проявилась в основном в уменьшении выраженности дисфункции канальцевого аппарата нефронов. Увеличенный диурез у крыс опытной группы с введением кадмия и ацизола был обусловлен в большей степени приростом клубочковой фильтрации, чем снижением канальцевой реабсорбции. Такой прирост скорости клубочковой фильтрации может быть объяснен гемодинамическими эффектами ацизола [13]. Еще одним важным благоприятным эффектом ацизола можно считать снижение степени выраженности протеинурии при воздействии кадмия.
Протективное действие ацизола нашло свое отражение в гистологической картине ткани почек, где на фоне введения препарата отмечено снижение выраженности дистрофического и некробиотического действия кадмия.
ЗАКЛЮЧЕНИЕ
Таким образом, применение ацизола, обладающего антигипоксическими свойствами, снижает выраженность структурно-функциональных изменений канальцевого аппарата почек.
Список литературы
1. Wang T, Wang Q, Song R et al. Cadmium induced inhibition of autophagy is associated with microtubule disruption and mitochondrial dysfunction in primary rat cerebral cortical neurons. Neurotoxicol Teratol 2016; 53:11-18
2. Yuan XБ Jiang CXБ Xu H et al. Cadmium-induced apoptosis in primary rat cerebral cortical neurons culture is mediated by a calcium signaling pathway. PLoS One 2013; 8(5):e64330
3. Pinter TB, Stillman MJ. Kinetics of zinc and cadmium exchanges between metallothionein and carbonic anhydrase. Biochemistry 2015; 54(40):6284-6293
4. Merra E, Calzaretti G, Bobba A et al. Antioxidant role of hydroxytyrosol on oxidative stress in cadmium-intoxicated rats: different effect in spleen and testes. Drug Chem Toxicol 2014; 37(4):420-426
5. Cosic DD, Bulat ZP, Ninkovic M et al. Effect of subacute cadmium intoxication on iron and lipid peroxidation in mouse liver. Toxicol Lett 2007; 172: S209
6. Nazima B, Manoharan V, Miltonprabu S. Oxidative stress induced by cadmium in the plasma, erythrocytes and lymphocytes of rats: Attenuation by grape seed proanthocyanidins. Hum Exp Toxicol 2016; 35(4): 428-447
7. Брин ВБ, Кокаев РИ, Бабаниязов ХХ, Пронина НВ. Влияние ацизола на нефротоксическое действие соли кадмия у крыс. Кубанск науч мед вестн 2008; (5): 33-37
8. Mori H, Sasaki G, Nishikawa M, Hara M. Effects of subcytotoxic cadmium on morphology of glial fibrillary acidic protein network in astrocytes derived from murine neural stem/progenitor cells. Environ Toxicol Pharmacol 2015; 40(2): 639-644
9. Lee WK, Torchalski B, Thévenod F. Cadmium-induced ceramide formation triggers calpain-dependent apoptosis in cultured kidney proximal tubule cells. Am J Physiol Cell Physiol 2007; 293(3):839-847
10. Zhao H, Liu W, Wang Y et al. Cadmium induces apoptosis in primary rat osteoblasts through caspase and mitogen-activated protein kinase pathways. J Vet Sci 2015; 16(3): 297-306
11. Reyes JL, Molina-Jijon E, Rodrfguez-Mufioz R et al. Tight junction proteins and oxidative stress in heavy metals-induced nephrotoxicity. Biomed Res Int 2013; 2013: 730789
12. Брин ВБ, Кокаев РИ, Бабаниязов ХХ, Пронина НВ. Возможности профилактики токсических эффектов кадмия металлокомплексом соли цинка - ацизолом. Вестн Нов Мед Техн 2008; 15 (4): 213-216
13. Брин ВБ, Бабаниязов ХХ, Кабисов ОТ и др. Влияние ацизола на показатели системной гемодинамики в условиях хронической свинцовой интоксикации. Вестн Нов Мед Техн 2008; 15 (3): 21-22
Об авторах
Р. И. КокаевРоссия
В. Б. Брин
Россия
Рецензия
Для цитирования:
Кокаев Р.И., Брин В.Б. Нефропротекторные эффекты ацизола на фоне токсического действия сульфата кадмия. Нефрология. 2016;20(5):90-96.
For citation:
Kokaev R.I., Brin V.B. Nephroprotective effects of acizol on the background of cadmium sulphate intoxication. Nephrology (Saint-Petersburg). 2016;20(5):90-96. (In Russ.)
JATS XML








































