Перейти к:
НОВЫЕ ПОДХОДЫ К ДОКЛИНИЧЕСКОЙ ДИАГНОСТИКЕ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
https://doi.org/10.24884/1561-6274-2017-21-5-86-99
Аннотация
ЦЕЛЬ: оценить клиническую значимость использования простатспецифического антигена (ПСА), его фракций и индексов для раннего выявления рака предстательной железы (РПЖ) у мужчин с уровнем общего ПСА (оПСА) в диапазоне 2–10 нг/мл при отрицательном пальцевом ректальном исследовании (ПРИ).
МАТЕРИАЛЫ И МЕТОДЫ. Обследовали 904 мужчин в возрасте 45–80 лет с оПСА от 2–10 нг/мл (по калибровке «Hybritech») и отрицательным результатом ПРИ. При морфологическом исследовании у 628 человек была выявлена ДГПЖ и у 276 – РПЖ. У всех больных проведено ультразвуковое исследование предстательной железы, определена концентрация ПСА, его фракций и индексов.
РЕЗУЛЬТАТЫ. При РПЖ относительная концентрация в сыворотке крови свободного ПСА была на 19% ниже, а абсолютное содержание [–2] проПСА – на 42% выше и показатель индекса здоровья простаты (ИЗП) – на 49% выше. При низких значениях оПСА РПЖ не был бы диагностирован у 9%, а при нормальных значениях – еще у 28% больных. Чувствительность метода при ПСА 4,0–10,0 нг/мл составляет 0,630, а специфичность – 0,519. оПСА, %свПСА были негативно, а [–2]проПСА, %[–2]проПСА и ИЗП – позитивно коррелированы с суммой Глисона. Все показатели при II стадии РПЖ статистически значимо отличались от величин, характерных для I стадии заболевания. Однако для обычно используемых показателей – оПСА, свПСА и %свПСА различия не превышали 22–27%. Вместе с тем, [–2]проПСА, % [–2]проПСА и ИЗП при IIа стадии возрастали на 20–53%, а при IIb стадии – на 55–77%.
ЗАКЛЮЧЕНИЕ. Наиболее информативными показателями для ранней диагностики РПЖ оказались ИЗП, [–2]проПСА. Определение ИЗП в динамике в рамках скрининга может существенно улучшить раннюю диагностику РПЖ.
Ключевые слова
Для цитирования:
Невирович Е.С., Борискин А.Г. НОВЫЕ ПОДХОДЫ К ДОКЛИНИЧЕСКОЙ ДИАГНОСТИКЕ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ. Нефрология. 2017;21(5):65-70. https://doi.org/10.24884/1561-6274-2017-21-5-86-99
For citation:
Nevirovich E.S., Boriskin A.G. NEW APPROACHES TO PRECLINICAL DIAGNOSIS OF PROSTATE CANCER. Nephrology (Saint-Petersburg). 2017;21(5):65-70. (In Russ.) https://doi.org/10.24884/1561-6274-2017-21-5-86-99
ВВЕДЕНИЕ
Во всем мире рак предстательной железы (РПЖ) является наиболее распространенным новообразованием и занимает второе место среди причин смерти от онкологических причин среди мужского населения [1, 2]. Согласно данным акад. В.И. Чиссова, прирост заболеваемости РПЖ в Российской Федерации за период 2000-2010 гг. составил 155 % [2].
Раннее выявление РПЖ в настоящее время основано, преимущественно, на положительном результате пальцевого ректального исследования (ПРИ), данных трансректального ультразвукового сканирования (ТРУЗИ), исследовании уровня общего ПСА (оПСА), соотношении свободного ПСА к общему ПСА (%свПСА). Положительные результаты ПРИ и ТРУЗИ являются методами поздней диагностики, так как практически всегда выявляют местно-распространенную форму РПЖ и не способны диагностировать локализованные формы РПЖ. При этом положительная предсказательная ценность оПСА и %свПСА остается достаточно низкой, особенно у мужчин с уровнем оПСА 2-10 нг/мл (по калибровке Hybritech). По данным рандомизированных исследований, при уровне оПСА 2,1-4,0 нг/мл у 23,9-26,9 % пациентов обнаруживается РПЖ, при этом до 10 % приходится на агрессивные формы рака. При уровне 4,1-10,0 нг/мл РПЖ выявляют лишь в 31% случаев [3]. Также следует отметить, что определение только уровня оПСА и %свПСА малоинформативно в плане оценки степени агрессивности РПЖ [4, 5]. Поэтому поиск более чувствительного и специфичного лабораторного маркера РПЖ, который позволил бы значительно улучшить раннюю диагностику РПЖ и с большей определенностью выявить пациентов с агрессивными формами РПЖ, остается весьма актуальной задачей.
Большие надежды в плане ранней диагностики РПЖ возлагают на изоформу свободного ПСА - [-2]проПСА (п2ПСА) и его производную, процентное соотношение п2ПСА к свободному ПСА% [-2]проПСА (%п2ПСА). Изоформа проПСА была открыта вначале 2000 г., максимальная ее концентрация определяется в ткани периферической зоны предстательной железы, где наиболее часто выявляют агрессивные формы РПЖ [6]. Нативная форма проПСА содержит пролидерный пептид, состоящий из 7 аминокислотных остатков ([-7]проПСА). Также имеются формы с укороченными пролидерными пептидами, состоящие преимущественно из проПСА с пролидерным пептидом из 5 аминокислот ([-5]проПСА), 4 аминокислот ([-4]проПСА) и 2 аминокислот ([-2]проПСА).
Наибольшего внимания заслуживает [-2] проПСА, поскольку именно эту форму впервые обнаружили в экстрактах из опухолевой ткани, и она дает наиболее интенсивное окрашивание иммунохимическими красителями в тканях опухоли предстательной железы [7]. Кроме того, из всех обнаруженных форм проПСА [-2]проПСА является самой стабильной формой in vitro [8].
Также отдельного внимания заслуживает уточнение целесообразности клинического использования в скрининге РПЖ многофакторного подхода, заключающегося в совместном одномоментном использовании всей совокупности лабораторных маркеров РПЖ. На наш взгляд, особого внимания заслуживает изучение предсказательной ценности трехкомпонентного расчетного показателя, включающего в себя изоформу свободного ПСА - [-2]проПСА (п2ПСА), оПСА и свПСА - индекс здоровья простаты (Prostate Health Index) (ИЗП) = (п211СА/св11СА)х7о11СА) [9].
Цель исследования: оценить клиническую значимость использования ПСА, его фракций и индексов для раннего выявления рака предстательной железы (РПЖ) у мужчин с уровнем общего оПСА в диапазоне 2-10 нг/мл при отрицательном ПРИ.
ПАЦИЕНТЫ И МЕТОДЫ
В период с 2012 по 2015 год обследовали 904 мужчин с уровнем общего ПСА от 2 до 10 нг/мл (по калибровке «Hybritech») и отрицательным результатом ПРИ в возрасте от 45 до 80 лет. Критериями исключения было наличие острого или обострение хронического простатита, инфекционновоспалительных заболеваний мочевыводящих путей, прием лекарственных препаратов, влияющих на уровень общего ПСА.
После включения в исследование всем пациентам методом иммунохемилюминесцентного анализа («Beckman Coulter») определяли уровень общего ПСА, свободного ПСА (свПСА), п2ПСА в сыворотке крови, рассчитывали соотношение свПСА к оПСА (%свПСА) и %п2ПСА. Обязательным условием перед забором крови считали исключение всех возможные механические причины, приводящие к повышению уровня оПСА: ПРИ, ТРУЗИ, массаж предстательной железы за 7 дней, эякуляцию за 48 ч до взятия анализов крови. Всем пациентам выполнено МРТ малого таза с целью определения объема предстательной железы и объема опухоли предстательной железы, а также 12-точечная биопсия предстательной железы.
Статистический анализ полученных результатов проводили с использованием пакета прикладных статистических программ «Statistica 6,0» («StatSoft Inc.» США). При нормальном распределении изучаемого показателя рассчитывали значение среднего арифметического и его среднеквадратического отклонения (Μ±σ), при несимметричном распределении - медиану (Ме) и интерк- вартильный размах. Статистическую значимость междугрупповых различий количественных переменных определяли с помощью дисперсионного анализа (ANOVA), бинарных переменных - с помощью х2-критерия. Для оценки взаимосвязи двух переменных использовали корреляционный анализ с расчетом непараметрического коэффициента корреляции Спирмена (Rs). Для сравнения диагностической значимости изучаемых показателей проводили логистический анализ с определением чувствительности и специфичности, а также выполняли построение ROC-кривых. Нулевую гипотезу об отсутствии различий и связей (ошибка первого рода) отвергали при p<0,05.
РЕЗУЛЬТАТЫ
При комплексном обследовании пациентов у 628 человек была выявлена ДГПЖ и у 276 - РПЖ. Средний возраст больных с РПЖ составил 63,4±7,0 лет, ДГПЖ - 63,3±7,1 года, p>0,05. Результаты ПРИ при ДГПЖ и РПЖ не выявляли отклонений от нормы. При ТРУЗИ ПЖ у пациентов с ДГПЖ и РПЖ имела сходный объем: 46,9±20,4 мл и 47,2±16,6 мл соответственно, p=0,855. У 102 человек установлена I стадия РПЖ, у 111 - 11а, у 63 - IIb. На рис. 1 представлен объем РПЖ в зависимости от стадии заболевания.
При 11а стадии объем опухоли был на 24% больше по сравнению с I стадией (р=0,005, а при IIb стадии - на 38%, р=0,0001). В то же время, статистически значимых различий по объему РПЖ между IIa и IIb стадиями выявлено не было.
В табл. 1 представлены средние концентрации ПСА, его фракций и индексов в зависимости от основного заболевания предстательной железы.
Абсолютная концентрация свПСА в сыворотке крови статистически не различалась между больными с ДГПЖ и РПЖ. В то же время, доля свПСА от оПСА при РПЖ была на 19% ниже. Весьма показательными оказались различия в абсолютном содержании п2ПСА в сыворотке крови (на 42% выше при РПЖ) и ИЗП (на 49% выше при РПЖ).
Таблица 1
Средние концентрации ПСА, его фракций и индексов в зависимости от основного заболевания предстательной железы, Ме (интерквартильный размах)
Показатель | ДГПЖ, n=628 | РПЖ, n=276 | p |
|---|---|---|---|
оПСА | 4,37 (3,13; 5,77) | 5,00 (4,02; 6,41) | 0,0001 |
свПСА | 0,605 (0,410; 0,900) | 0,600 (0,410; 0,850) | 0,277 |
%свПСА | 15,05 (10,83; 20,25) | 12,56 (8,80; 16,47) | 0,0001 |
п2ПСА | 10,87 (7,83; 15,55) | 14,30 (10,61; 20,98) | 0,0001 |
%п2ПСА | 1,84 (1,39; 2,43) | 2,47 (1,93; 3,17) | 0,0001 |
ИЗП | 37,01 (28,44; 49,61) | 54,78 (42,55; 71,99) | 0,0001 |

Рис. 1. Объем РПЖ в зависимости от стадии заболевания, см3.
Традиционным скрининговым биохимическим методом для выявления РПЖ остается определение оПСА. В табл. 2 приведено распределение пациентов в зависимости от уровня оПСА и основного заболевания предстательной железы.
Очевидно, что при низких значениях оПСА РПЖ не был бы диагностирован у 9%, а при нормальных значениях - еще у 28% больных. Даже если ориентироваться на концентрацию оПСА в пределах 4,0-10,0 нг/мл, то чувствительность метода составит 0,630, а специфичность - 0,519. Дополнительное определение свПСА не решает проблему диагностики: чувствительность 0,385, специфичность 0,740.
Важнейшим гистологическим показателем агрессивности морфологически подтвержденного РПЖ является сумма Глисона. В табл. 3 приведены результаты непараметрического корреляционного анализа между концентрациями ПСА, его фракций и индексов и суммой Глисона.
Среди исследуемых показателей свПСА не был взаимосвязан с суммой Глисона. В то же время, оПСА, %свПСА были негативно, а п2ПСА, %п2ПСА и ИЗП - позитивно коррелированы с суммой Глисона. Следует отметить, что наиболее значимые корреляции были выявлены для %п2ПСА и ИЗП.
В табл. 4 представлены средние концентрации ПСА, его фракций и индексов в зависимости от стадии РПЖ.
Таблица 2
Распределение пациентов в зависимости от уровня оПСА и основного заболевания предстательной железы (точный метод Фишера: χ2=29,724, р=0,0001)
оПСА, нг/мл | ДГПЖ | РПЖ | Всего |
|---|---|---|---|
<2,5 | 88 (90,72%) | 9 (9,28%) | 97 |
2,5-4,0 | 238 (71,90%) | 93 (28,10%) | 331 |
4,0-10,0 | 302 (63,45%) | 174 (36,55%) | 476 |
Всего | 628 | 276 | 904 |
Таблица 3
Результаты корреляционного анализа концентрации ПСА, его фракций и индексов с суммой Глисона
Показатели | n | Rs | p |
оПСА & Глисон | 276 | 0,216 | 0,0002 |
свПСА & Глисон | 276 | -0,117 | 0,051 |
%свПСА & Глисон | 276 | -0,284 | 0,0001 |
п2ПСА & Глисон | 276 | 0,312 | 0,0001 |
%п2ПСА & Глисон | 276 | 0,585 | 0,0001 |
ИЗП & Глисон | 276 | 0,623 | 0,0001 |
Все показатели при II стадии РПЖ статистически значимо отличались от величин, характерных для Ш стадии заболевания. Однако для обычно используемых показателей - оПСА, свПСА и %свПСА различия не превышали 22-27%, а свПСА статистически значимо была снижена на 17,5% только при На стадии РПЖ. Вместе с тем, п2ПСА, %п2ПСА и ИЗП при На стадии возрастали на 20-53%, а при IIb стадии - на 55-77%.
На рис. 2. и в табл. 5 представлены результаты ROC-анализа для концентрации ПСА, его фракций и индексов.
Наиболее информативными показателями для диагностики РПЖ оказались ИЗП, а также [-2] проПСА, тогда как для ДГПЖ - %свПСА.
Для определения референтной величины ИЗП мы рассчитали показатели чувствительности и специфичности. При величине ИЗП 20 единиц чувствительность составил 0,986, а специфичность - 0,07; для 40 единиц - 0,786 и 0,568 соответственно; для 60 единиц - 0,417 и 0,866 соответственно. Очевидно, что при увеличении пороговой величины чувствительность снижается, а специфичность возрастает.
ОБСУЖДЕНИЕ
Увеличение распространенности РПЖ в РФ связано не только с увеличением удельного веса самого заболевания, но и с возможностями его диагностики. Так, удельный вес больных с данной патологией, выявленных активно, от числа больных с впервые в жизни установленным диагнозом злокачественного новообразования увеличился с 6 до 23%. Однако впервые выявленный РПЖ в 38% соответствовал III стадии, а в 18% - IV стадии заболевания. Вряд ли можно считать успешной ситуацию, при которой правильный диагноз устанавливают только у каждого четвертого пациента. Неудивительно, что онкологическая смертность на первом году жизни после установления диагноза остается высокой и составляет 10% [10].
Таблица 4
Средние концентрации ПСА, его фракций и индексов в зависимости от стадии РПЖ, Ме (интерквартильный размах)
Показатель | I стадия, n=102 | На стадия, n=111 | IIb стадия, n=63 |
|---|---|---|---|
оПСА | 4,63 (3,74; 5,67) | 5,21 (4,00; 6,56)* | 5,67 (4,48; 7,11)*** |
свПСА | 0,655 (0,440; 0,980) | 0,540 (0,360; 0,840)* | 0,580 (0,420; 0,800) |
%свПСА | 15,17 (10,94; 19,40) | 10,97 (8,15; 15,08)*** | 11,07 (8,19; 14,28)*** |
п2ПСА | 12,03 (8,61; 17,22) | 14,43 (10,82; 20,93)** | 18,66 (12,72; 25,45)*** |
%п2ПСА | 1,88 (1,53; 2,31) | 2,75 (2,18; 3,41)*** | 3,07 (2,51; 4,37)*** |
ИЗП | 39,22 (31,05; 50,57) | 59,94 (49,64; 78,42)*** | 69,56 (59,88; 98,91)*** |
Статистическая значимость различий с I стадией * p<0,01, ** p<0,001, *** p<0,0001.
Таблица 5
Числовые результаты ROC-анализа для концентрации ПСА, его фракций и индексов
Тестовая переменная | Площадь | Стандартная ошибка | р | 95% доверительный интервал | |
|---|---|---|---|---|---|
Нижняя граница | Верхняя граница | ||||
оПСА | 0,618 | 0,019 | 0,0001 | 0,580 | 0,656 |
свПСА | 0,489 | 0,020 | 0,585 | 0,449 | 0,529 |
% свПСА | 0,383 | 0,020 | 0,0001 | 0,343 | 0,422 |
[-2]проПСА | 0,650 | 0,020 | 0,0001 | 0,611 | 0,688 |
% [-2]проПСА | 0,696 | 0,019 | 0,0001 | 0,660 | 0,733 |
ИЗП | 0,742 | 0,018 | 0,0001 | 0,708 | 0,777 |
Нулевая гипотеза: истинная площадь = 0,5; значения «р» представлены с учетом непараметрического распределения показателей.
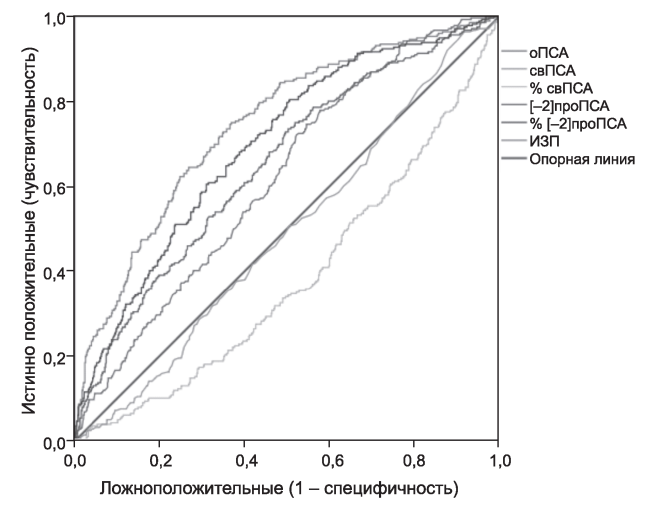
Рис. 2. Результаты ROC-анализа для концентрации ПСА, его фракций и индексов.
Американское онкологическое общество рекомендует проводить скрининг у мужчин для выявления РПЖ в следующих случаях [11]:
- В возрасте 50 лет со средним риском развития РПЖ и предполагаемой дополнительной продожительностью жизни не менее 10 лет.
- В возрасте 45 лет с высоким риском развития РПЖ (афроамериканцы; наличие родственников первой степени - отец, брат или сын - у одного из которых РПЖ был выявлен в возрасте моложе 65 лет).
- В возрасте 40 лет при выявлении РПЖ в возрасте моложе 65 лет у более чем одного родственника первой степени.
Скрининг включает определение оПСА и ПРИ. Для пациентов с уровнем оПСА менее 2,5 нг/мл рекомендуется повторный скрининг 1 раз в 2 года, а при уровне 2,5-4,0 нг/мл - ежегодно.
Представленные нами данные свидетельствуют о том, что, если скрининг проводить в соответствии с этими рекомендациями, то у 37% пациентов диагноз не будет установлен своевременно, и мы по-прежнему сможем выявлять только поздние стадии заболевания.
При сравнении диагностической ценности концентрации ПСА, его фракций и индексов мы отдаем предпочтение определению ИЗП. По результатам ROC-анализа этот метод соответствует наибольшей площади под кривой (0,742). Кроме того, величина ИЗП прямо коррелирует с суммой Глисона (Rs=0,623, р=0,0001). Следовательно, по уровню ИЗП можно не только предполагать высокую вероятность РПЖ, но и проводить претестовую оценку ее злокачественности.
Наши данные соответствуют результатам отечественных и зарубежных исследований на эту тему [12-14].
Мы полагаем, что для улучшения ранней диагностики РПЖ целесообразно использовать следующий алгоритм использования ИЗП.
У мужчин в возрасте 40 лет (при выявлении РПЖ в возрасте моложе 65 лет у более чем одного родственника первой степени) при величине ИЗП 20-40 единиц проводить ПРИ и ТРУЗИ и определение ИЗП каждые 6 мес. Увеличение показателя более 40 единиц - показание для биопсии предстательной железы.
У мужчин в возрасте 45 лет с высоким риском развития РПЖ (афроамериканцы; наличие родственников первой степени - отец, брат или сын - у одного из которых РПЖ был выявлен в возрасте моложе 65 лет) при величине ИЗП 20-40 единиц проводить ПРИ и ТРУЗИ и определение ИЗП каждые 6 мес. Увеличение показателя более 60 единиц - показание для биопсии предстательной железы.
У мужчин в возрасте 50 лет со средним риском развития РПЖ и предполагаемой дополнительной продолжительностью жизни не менее 10 лет при величине ИЗП 20-40 единиц проводить ПРИ и ТРУЗИ и определение ИЗП каждые 12 мес. Увеличение показателя более 60 единиц - показание для биопсии предстательной железы.
ЗАКЛЮЧЕНИЕ
Определение ИЗП является тестом, удовлетворяющим требования к скрининговым методикам выявления ранних стадий РПЖ. Его применение в соответствии с рекомендуемым алгоритмом позволит существенно улучшить выявляемость данной патологии, снизить количество необязательных биопсий. В перспективе использование ИЗП может способствовать изменению подходов к тактике лечения РПЖ и улучшению качества жизни и снижению смертности больных с данной онкопатологией.
Список литературы
1. Siegel R, Naishadman D, Jemal A. Cancer statistics, 2013. CA Cancer J Clin 2013; 63 (1): 11-30
2. Чиссов ВИ, Русаков ИГ. Заболеваемость раком предстательной железы в Российской Федерации. Экспериментальная и клиническая урология 2011; 2–3: 6–7 [Chissov VI, Rusakov IG. Zabolevaemost’ rakom predstatel’noj zhelezy v Rossiyskoy Federacii. Jeksperimental’naja i klinicheskaja urologiya 2011; 2–3: 6–7]
3. Schroder FH, Hugosson J, Roobol MJ et al. Screening and prostate cancer mortality: results of the European Randomised Study of Screening for Prostate Cancer (ERSPC) at 13 years of follow-up. Lancet 2014; 384 (9959): 2027-2035
4. Невирович ЕС, Яковенко АА, Румянцев АШ и др. Новые возможности в лабораторной диагностике рака предстательной железы. Дальневосточный медицинский журнал 2017; 1: 38-40 [Nevirovich ES, Jakovenko AA, Rumyantsev ASh i dr. Novye vozmozhnosti v laboratornoj diagnostike raka predstatel’noj zhelezy. Dal’nevostochnyj medicinskiy zhurnal 2017; 1: 38-40]
5. Невирович ЕС, Яковенко АА, Румянцев АШ и др. Клиническое применение индекса здоровья предстательной железы для раннего выявления рака предстательной железы у мужчин с уровнем общего ПСА 2-10 нг/мл. Врач 2015; 6: 63-65 [Nevirovich ES, Jakovenko AA, Rumyantsev ASh et al. Klinicheskoe primenenie indeksa zdorov’ya predstatel’noj zhelezy dlya rannego viyavleniya raka predstatel’noy zhelezy u muzhchin s urovnem obshhego PSA 2-10 ng/ml. Vrach 2015; 6: 63-65]
6. Chan TY, Mikolajczyk SD, Lecksell K et al. Immunohistochemical staining of prostate cancer with monoclonal antibodies to the precursor of prostate-specific antigen. Urology 2003; 62 (1): 177-181
7. Mikolajczyk SD, Marker KM, Millar LS et al. A truncated precursor form of prostate-specific antigen is a more specific serum marker of prostate cancer. Cancer Res 2001; 61 (18): 6958-6963
8. Jansen FH, Roobol MJ, Jenster G et al. Screening for prostate cancer in 2008 II: the importance of molecular subforms of prostate-specific antigen and tissue kallikreins. Eur Urol 2009; 55 (3): 563-574
9. Le BV, Griffin CR, Loeb S et al. [-2] Proenzyme prostate specific antigen is more accurate than total and free prostate specific antigen in differentiating prostate cancer from benign disease in a prospective prostate cancer screening study. J Urol 2010; 183 (4): 1355-1359
10. Давыдов МИ, Аксель ЕМ ред. Статистика злокачественных новообразований в России и странах СНГ в 2012г. ФГБУ «МНИОИ им. П.А. Герцена» Минздрава России, М., 2013: 232 с [Davydov MI, Aksel' EM, red. Statistika zlokachestvennyh novoobrazovanij v Rossii i stranah SNG v 2012g. M.: FGBU «MNIOI im. P.A. Gercena» Minzdrava Rossii, 2013: 232s]
11. Skolarus TA, Wolf AM, Nicole L. Erb NL et al. American Cancer Society Prostate Cancer Survivorship Care Guidelines. CA Cancer J Clin 2014; 64 (4): 225-249
12. Невирович ЕС, Аль-Шукри АС, Борискин АГ и др. Роль определения уровня устойчивых изоформ простатспецифического антигена и расчета индекса здоровья простаты в ранней диагностике рака предстательной железы. Урологические ведомости 2015; 5 (1): 21-22 [Nevirovich ES, Al'-Shukri AS, Boriskin AG i dr. Rol' opredeleniya urovnya ustoychivyh izoform prostatspecificheskogo antigena i rascheta indeksa zdorov'ya prostaty v ranney diagnostike raka predstatel'noy zhelezy. Urologicheskie vedomosti 2015; 5 (1): 21-22]
13. Будылев СА, Невирович ЕС, Яковенко АА и др. Опыт применения безгазовой лапароскопии в урологии. Современные проблемы науки и образования 2015; 5: 27 [Budylev SA, Nevirovich ES, Jakovenko AA et al. Opyt primeneniya bezgazovoy laparoskopii v urologii. Sovremennye problemy nauki i obrazovaniya 2015; 5: 27]
14. Abrate A, Lughezzani G, Gadda GM et al. Clinical use of [-2]proPSA (p2PSA) and its derivatives (%p2PSA and Prostate Health Index) for the detection of prostate cancer: a review of the literature. Korean J Urol 2014; 55 (7): 436-445
Об авторах
Е. С. НевировичРоссия
канд. мед. наук, кафедра урологии с курсом урологии с клиникой,
197022, Россия, Санкт-Петербург, ул. Льва Толстого, д. 6–8
А. Г. Борискин
Россия
доц., канд. мед. наук, кафедра урологии с курсом урологии с клиникой,
197022, Санкт-Петербург, ул. Льва Толстого, д. 6–8
Рецензия
Для цитирования:
Невирович Е.С., Борискин А.Г. НОВЫЕ ПОДХОДЫ К ДОКЛИНИЧЕСКОЙ ДИАГНОСТИКЕ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ. Нефрология. 2017;21(5):65-70. https://doi.org/10.24884/1561-6274-2017-21-5-86-99
For citation:
Nevirovich E.S., Boriskin A.G. NEW APPROACHES TO PRECLINICAL DIAGNOSIS OF PROSTATE CANCER. Nephrology (Saint-Petersburg). 2017;21(5):65-70. (In Russ.) https://doi.org/10.24884/1561-6274-2017-21-5-86-99








































