Перейти к:
ПРОТЕИНЫ МОЧИ И ФИБРОПЛАСТИЧЕСКИЕ ИЗМЕНЕНИЯ КОМПАРТМЕНТОВ ПОЧКИ ПРИ ИММУННЫХ ГЛОМЕРУЛОПАТИЯХ
https://doi.org/10.24884/1561-6274-2017-21-6-54-59
Аннотация
Количественное определение типов экскретируемых с мочой белков при существенной протеинурии может быть полезным для оценки выраженности морфологических изменений, ответа на лечение и прогноз.
Целью исследования являлся анализ взаимосвязи мочевой экскреции высокои низкомолекулярных белков с выраженностью фибропластических изменений клубочков, канальцев, интерстиция и сосудов.
Пациенты и методы. В исследование были включены 97 пациентов с первичными иммунными гломерулопатиями: мембранозной нефропатией (n=22), болезнью минимальных изменений (n =13), фокально-сегментарным гломерулосклерозом (n =30), IgA нефропатией (n =32) с выполненной биопсией почек. Измерения общего белка, иммуноглобулина G (IgG), трансферрина (Trf), α1микроглобулина (α1-МГ), β2-микроглобулина (β2-МГ) проводили нефелометрическим методом в образцах утренней мочи, результаты стандартизировали по концентрации креатинина (Cr) в моче.
Результаты. Выявлена корреляция протеинурии и профиля исследуемых белков – β2-МГ (r=0,24, р=0,025), α1-МГ (r=0,38, р<0,001), Trf (r=0,78, р<0,001), IgG (r=0,67, р<0,001), а также корреляция между высоко(r=0,82, р<0,001) и низкомолекулярными (r=0,30, p=0,004) белками. Экскреция низкомолекулярных белков (β2-МГ, α1-МГ) коррелировала с глобальным склерозом клубочков (r=0,28, р=0,010 и r=0,21, р=0,049 соответственно), связь общей протеинурии и экскреции высокомолекулярных белков с фибропластическими гломерулярными изменениями отсутствовала. Выраженность тубулоинтерстициального повреждения была ассоциирована только с экскрецией β2-микроглобулина (p<0,020).
Заключение. β2-МГ может рассматриваться как кандидатный интегральный биомаркер, указывающий на выраженность фибропластических изменений клубочков, тубулоинтерстиция и сосудов.
Ключевые слова
Для цитирования:
Богданова Е.О., Галкина О.В., Зубина И.М., Добронравов В.А. ПРОТЕИНЫ МОЧИ И ФИБРОПЛАСТИЧЕСКИЕ ИЗМЕНЕНИЯ КОМПАРТМЕНТОВ ПОЧКИ ПРИ ИММУННЫХ ГЛОМЕРУЛОПАТИЯХ. Нефрология. 2017;21(6):54-59. https://doi.org/10.24884/1561-6274-2017-21-6-54-59
For citation:
Bogdanova E.O., Galkina O.V., Zubina I.M., Dobronravov V.A. URINE PROTEINS AND FIBROTIC LESIONS OF RENAL COMPARTMENTS IN IMMUNE GLOMERULOPATHIES. Nephrology (Saint-Petersburg). 2017;21(6):54-59. (In Russ.) https://doi.org/10.24884/1561-6274-2017-21-6-54-59
ВВЕДЕНИЕ
Мочевой протеом является потенциальным источником информации при заболеваниях почек [1]. По данным протеомного анализа в образце мочи может присутствовать от 900 до 2500 различных белков и полипептидов [2]. В лабораторной практике принято оценивать суммарную экскрецию всех белков с мочой - протеинурию. Суммарная концентрация белков в моче - важный диагностический показатель, который входит в рутинный анализ мочи, в то же время, оценка протеинурии не дает ответа на некоторые вопросы, например, о локализации повреждения нефрона. В настоящей работе мы дополнили анализ протеинурии идентификацией высокомолекулярных [трансферрин (Trf), иммуноглобулин G (IgG)] и низкомолекулярных [α1-микроглобулин (а1-МГ), Р2-микроглобулин (β2-ΜΓ)] белков, мочевая экскреция которых может отражать два основных варианта протеинурии - нарушение проницаемости гломерулярного фильтра и снижение реабсорбции в канальцах [3, 4]. Целью работы было исследование взаимосвязи между мочевой экскрецией высокомолекулярных и низкомолекулярных белков и необратимыми фибропластическими изменениями в клубочках и тубулоинтерстиции у пациентов с иммунными гломерулопатиями.
ПАЦИЕНТЫ И МЕТОДЫ
В исследование были включены 97 пациентов старше 18 лет с первичными иммунными гломе- рулопатиями, подтвержденными морфологически (мужчин - 49, женщин - 48, средний возраст 43±16 лет). Обследование проведено до начала иммуносупрессивной терапии (ИСТ). Основные клиникодемографические показатели исследуемой группы представлены в табл. 1. Критериями исключения были острое повреждение почек, инфекционные заболевания, сердечная/легочная недостаточность, онкологические заболевания, ИСТ. В контрольную группу вошли 20 здоровых добровольцев (мужчин - 9, женщин - 11, средний возраст 35±12 лет). Исследование было одобрено локальным этическим комитетом ПСПбГМУ им. акад. И.П. Павлова.
Накануне проведения биопсии почки пациентам назначали взятие образца венозной крови и утренней мочи. Кровь и мочу центрифугировали при 1500 g в течение 10 мин, после чего биоматериал аликвотировали и хранили при температуре -80 °С до проведения исследований. Биоптат почки фиксировали в 5% нейтральном формалине при температуре 22 °С в течение 16 ч. Гистологическую проводку осуществляли с помощью автоматического процессора Tissue-Tek Vip 5Jr («Sakura Finetek Inc.», США) с применением раствора IsoPREP («БиоВитрум», Россия). Для пропитывания обезвоженной ткани и приготовления гистологических блоков применяли среду для заключения HISTOMIX («БиоВитрум», Россия). Срезы толщиной не более 4 мкм изготавливали на ротационном микротоме Accu-cut SRM («Sakura Finetek Inc.», США). Для всех микропрепаратов применяли окрашивание гемотоксилином и эозином, трихромную окраску по Массону, окраску конго красным, PAS-реакцию, серебрение по Джонсу. При световой микроскопии количественно оценивали долю склерозированных клубочков с признаками сегментарного и глобального склероза. Выраженность фибропластических изменений тубулоинтерстиция оценивали полуколичественно в баллах (0 - <10%; 1 балл - 10-25%; 2 балла - 26-50%; 3 балла ->50%) (морфолог В.Г. Сиповский).
Биохимические исследования
Концентрацию низко- и высокомолекулярных белков измеряли в образцах утренней мочи. Концентрацию альфа1-микроглобулина (а1-МГ), бета2-микроглобулина ф2-МГ), иммуноглобулина G (IgG), трансферрина (Trf) в моче определяли на иммунохимическом анализаторе специфических белков «Immage 800» («Beckman Coulter», США) с двойной системой детекции - кинетическая нефелометрия и турбидиметрия в ближнем инфракрасном диапазоне (NIPIA). Определение протеинурии проводили методом с пирогаллоло- вым красным на автоматическом биохимическом анализаторе «Synchron CX9» («Beckman Coulter», США). Для стандартизации результатов рассчитывали мочевую экскрецию белков как отношение белок/креатинин (мг/ммоль). Определение креатинина проводили модифицированным методом Яффе путем регистрации кинетики реакции, прослеживаемость калибратора до NIST SRM914a. Расчет СКФ производили по формуле CKD EPI [5], клиренса креатинина (CCr) - по пробе Реберга.
Таблица 1
Основные клинико-демографические показатели исследуемой группы (n=97)
|
Пол (мужчины:женщины) |
49:48 |
|---|---|
|
Возраст, лет |
42 (28-56) |
|
Диагноз (мембранозная нефропатия:болезнь минимальных изменений:фокально-сегментарный гломерулосклероз:IgA-нефропатия) |
22:13:30:32 |
|
Креатинин в сыворотке, ммоль/л |
0,100 (0,072-0,136) |
|
Альбумин в сыворотке, г/л |
31,8 (17,0-36,0) |
|
pСКФ, мл/мин/1,73 м2 |
76 (49-97) |
Примечание. Данные представлены как медиана с интерквар- тильным размахом [m (25-75%)], рСКФ - расчетная скорость клубочковой фильтрации (CKD-EPI)
Таблица 2
Исследуемые протеины мочи у пациентов с первичными иммунными гломерулопатиями [m (25-75%)]
|
Группы |
Prot/Cr, мг/ммоль |
IgG/Cr, мг/ммоль |
Trf/Cr, мг/ммоль |
IgG/Trf |
а1-МГ/а, мг/ммоль |
β2-МГ/Cr, мг/ммоль |
|---|---|---|---|---|---|---|
|
Контрольная |
5,0 (0,0-17,8)1 |
0,2 (0,1;0,3)1 |
0,1 (0,08;0,1)1 |
Н/П |
0,38 (0,26;0,53)1 |
0,002 (0,00;0,004)1 |
|
МН |
507,3 (169,4;756,1) |
4,8 (0,7;10,7) |
11,8 (3,5;18,2) |
0,57 (0,37;1,24) |
0,77 (0,43;1,27) |
0,014 (0,00;0,062) |
|
БМИ |
604,3 (238,1;1608,9) |
5,8 (2,0;15,3) |
20,1 (6,8;23,8) |
0,56 (0,27;1,48) |
1,00 (0,68;23,8) |
0,033 (0,00;0,24) |
|
ФСГС |
427,6 (253,1;871,5) |
5,0 (1,8;13,7) |
8,2 (3,6;16,3) |
0,74 (0,45;1,94) |
0,80 (0,55;1,45) |
0,049 (0,005;0,61) |
|
IgA- нефропатия |
200,9 (101,5;347,1)2 |
1,7 (0,8;4,3) |
3,5 (0,8;7,9)3 |
0,66 (0,44;1,21) |
0,54 (0,19;1,00)4 |
0,013 (0,00;0,104)5 |
Примечание. Здесь и в табл. 3: МН - мембранозная нефропатия, БМИ - болезнь минимальных изменений, ФСГС - фокальносегментарный гломерулосклероз, IgA - IgA-нефропатия, Prot - общий белок в моче; Cr - креатинин в моче; IgG - иммуноглобулин G в моче; Trf - трансферрин в моче; а1-МГ - а1-микроглобулин в моче; β2-ΜΓ - β2-микроглобулин в моче; 1 p<0,001 при сравнении с группами пациентов; 2 p<0,025 при сравнении с МН, БМИ и ФСГС, 3 p<0,014 при сравнении с МН, БМИ, ФСГС, 4 p=0,045 при сравнении с ФСГС, 5 p=0,023 при сравнении с ФСГС (указаны значения p при статистически значимых межгрупповых различиях); Н/П - параметр не был применен.
Статистический анализ
Данные представлены в виде медианы и интерквартильного размаха. Для сравнения средних значений в двух выборках применяли критерий Манна-Уитни. Для исследования связей между переменными рассчитывали коэффициент корреляции Спирмена. Межгрупповые различия и регрессионные коэффициенты считали статистически достоверными при значении p<0,05.
РЕЗУЛЬТАТЫ
У всех пациентов с первичными иммунными гломерулопатиями выявлены выраженная протеинурия и высокая мочевая экскреция специфических белков (табл. 2).
Для пациентов с подоцитопатиями (МН, БМИ и ФСГС) были характерны более высокая протеинурия, мочевая экскреция трансферрина и низкомолекулярных белков (β2-ΜΓ и αΙ-МГ) в сравнении с IgA-нефропатией. Уровень IgG в моче в исследуемых группах достоверно не различался. В группах БМИ, МН и ФСГС не было выявлено существенных различий между исследуемыми протеинами, а также соотношением IgG/Trf, отражающим селективность протеинурии.
Таблица 3
Анализ корреляционных связей между белками мочи; указаны коэффициенты корреляции Спирмена и значения р
|
Показатель |
β2-МГ/Cr, мг/ммоль |
α1-МГ/Cr, мг/ммоль |
Trf/Cr, мг/ммоль |
IgG/Cr, мг/ммоль |
|---|---|---|---|---|
|
Prot/Cr, мг/ммоль |
0,24 р=0,025 |
0,38 р<0,001 |
0,78 р<0,001 |
0,67 р<0,001 |
|
IgG/Cr, мг/ммоль |
0,33 р=0,002 |
0,53 р<0,001 |
0,82 р<0,001 |
- |
|
Trf/Cr, мг/ммоль |
0,24 р=0,025 |
0,54 p<0,001 |
- |
- |
|
а-ШГ/Cr, мг/ммоль |
0,30 p=0,004 |
- |
- |
- |
Между уровнем протеинурии и экскрецией крупномолекулярных белков - Trf, IgG и низкомолекулярных белков - α1-МГ и β2-МГ выявлены высокодостоверные прямые взаимосвязи (табл. 3).
В отличие от Trf и IgG низкомолекулярные белки мочи (β2-МГ и αΙ-МГ) были обратно связаны с индексами клубочковой фильтрации (табл. 4). Ни уровень протеинурии, ни мочевая экскреция высокомолекулярных протеинов (Trf и IgG) не имели достоверных связей с выраженностью фибропластических гломерулярных изменений. Напротив, β2-МГ и αΙ-МГ прямо коррелировали с выраженностью глобального склероза клубочков (см. табл. 4).
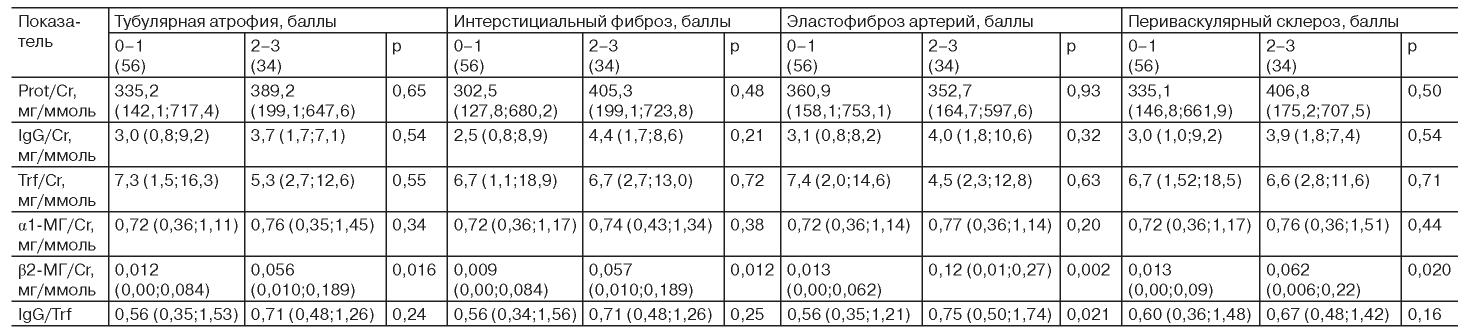
Экскреция β2-МГ была значительно выше в подгруппах с умеренной и выраженной тубулярной атрофией, интерстициальным фиброзом, эластофиброзом артерий, периваскулярным склерозом (табл. 5). В тех же подгруппах уровни протеинурии и остальных исследуемых белков достоверно не отличались.
ОБСУЖДЕНИЕ
В нашем исследовании уровень протеинурии и концентрации исследуемых специфических белков, стандартизированных по креатинину мочи, коррелировали друг с другом и были значительно повышены у пациентов во всех исследуемых группах (см. табл. 2). Высокие уровни IgG и Trf свидетельствовали о выраженном нарушении проницаемости гломерулярного фильтра с потерей селективности по размеру белковых молекул во всех группах, что характерно для протеинурических гломерулопатий [6-8]. Небезынтересно, что при БМИ, для которой, согласно классическим представлениям, должна быть характерна селективная альбуминурия, значения мочевой экскреции IgG, Trf и их отношение достоверно не отличались от других вариантов гломерулопатий.
Таблица 4
Анализ корреляционных связей между значениями белков мочи и характеристиками гломерулярного повреждения; указаны коэффициенты корреляции Спирмена и р

Примечание. Здесь и в табл. 5: Prot - общий белок в моче; Cr - креатинин в моче; IgG - иммуноглобулин G; Trf - трансферрин; а1-МГ - а1-микроглобулин; β2-МГ - β2-микроглобулин; CCr - клиренс креатинина; рСКФ - расчетная скорость клубочковой фильтрации.
Нами не было обнаружено корреляции высокомолекулярных белков с глобальным или сегментарным склерозом клубочков, при этом экскреция IgG была отрицательно ассоциирована с индексами клубочковой фильтрации - клиренсом креатинина и рСКФ. Интересно, что в отличие от классических представлений, нами была обнаружена связь уровней а1-МГ, β2-МГ, общепринятых маркеров канальцевого повреждения, с глобальным склерозом клубочков (см. табл. 4). Полученные нами результаты согласуются с недавними экспериментальными данными, свидетельствующими о том, что концентрация β2-МГ в моче связана с гломерулярным повреждением [9]. Реабсорбция а1-МГ, β2-МГ, как и многих других белков в проксимальных канальцах осуществляется, главным образом, посредством рецептор-опосредованного эндоцитоза, что предполагает возможность конкуренции за связывание с рецепторами комплекса мегалин-кубилин [10, 11]. При достаточном количестве рецепторов путем канальцевой реабсорбции поддерживается невысокий уровень а1-МГ и β2-МГ в моче. При повреждении клубочков, потеря альбумина и других плазменных белков приводит к перенасыщению и дефициту рецепторов, что может объяснять рост уровней низкомолекулярных белков при гломерулопатиях и корреляцию их экскреции с гломерулярным повреждением [10].
N. Pallet и соавт. указывают на отсутствие связи между уровнями высокомолекулярных белков и повреждением тубулоинтерстиция (ТИ) у пациентов с хронической болезнью почек при ассоциации интерстициального фиброза с уровнями низкомолекулярных белков - а1-МГ, β2-МГ [12]. Мы также не нашли связи между уровнями высокомолекулярных белков (IgG, Trf) и выраженностью повреждения ТИ и более высокую мочевую экскрецию β2-МГ у пациентов с умеренными и выраженными фибропластическими изменениями ТИ и атрофией канальцев. Кроме того, впервые показано, что уровень β2-МГ в моче повышен при существенной фиброплазии артериальных сосудов почки (см. табл. 5).
В норме β2-МГ свободно фильтруется в клубочках, реабсорбируется и катаболизируется в проксимальных канальцах (ПК), в то время как при тубулярном повреждении ТИ уровень β2-МГ в моче повышается [7]. Вместе с тем, объяснения патогенетического и прогностического значения β2-МГ при иммунных гломерулопатиях могут выходить за пределы механистических представлений о его возможности быть маркером процесса тубулярного проксимального транспорта. β2-МГ имеет многообразные функции, среди которых: межклеточные взаимодействия с участием молекул главного комплекса гистосовместимости (major histocompatibility complex, МНС) и МНС- подобных молекул, активации Т- и В-клеточных иммунных реакций и фиброгенеза, трансцеллю- лярного транспорта и увеличения периода полужизни альбумина и IgG с участием неонатального Fc-рецептора (FcRn) [13]. В контексте патогенеза гломерулопатий эти функции β2-ΜΓ могут иметь отношение к процессам транспорта, активации и межклеточных взаимодействий тубулярного эпителия и подоцитов [9]. Согласно результатам J.P. Haymann и соавт., FcRn экспрессируется в эпителиальных клетках гломерул и щеточной кайме клеток ПК [14]. β2-МГ способен нековалентно связываться с FcRn, экспрессирующимся в почках [15]. Авторы предполагают, что в ПК FcRn опосредует эндоцитоз IgG в комплексе с β2-MГ, в результате чего может происходить удаление этих белков из первичной мочи [14, 16]. При этом транспорт глобулинов FcRn носит рН-зависимый характер [16]. При повреждении почек и воспалительном процессе происходит смещение pH, образование комплекса нарушается, что, вероятно, приводит к снижению канальцевой реабсорбции и повышению уровней β2-МГ и IgG в моче. Имеются некоторые свидетельства того, что система FcRn подоцитов функционирует как иммунный сенсор, связанный с активирующим фосфорилированием p38 MAPK (р38 mitogen-activated protein kinases) и воспалительной реакцией, наблюдаемой при некоторых гломерулопатиях [17]. По-видимому, p38 MAPK является основным профибротическим сигнальным путем при диабетической нефропатии [18], нефротическом синдроме [19], почечной гипертензии [20], торможение которого приводит к снижению артериального давления, склероза, повреждения и апоптоза подоцитов [21]. Следовательно, β2-MГ-ассоциированная активация FcRn при гломеру- лопатиях может иметь отношение к патогенетическим механизмам развития фиброза клубочков, ТИ и сосудов. Подобные предположения, очевидно, нуждаются в дополнительной проверке.
Таблица 5
Мочевая экскреция белков при различной выраженности тубулоинтерстициального повреждения
ЗАКЛЮЧЕНИЕ
Таким образом, показано, что β2-МГ может рассматриваться как кандидатный интегральный биомаркер, указывающий на выраженность фибропластических изменений клубочков, тубулоинтерстиция и сосудов при гломерулопатиях.
Авторы выражают признательность за техническую помощь в подготовке публикации Елене Николаевне Левыкиной.
Список литературы
1. SantucciL, BruschiM, CandianoGetal. Urine Proteome Biomarkers in Kidney Diseases. Limits, Perspectives, and First Focus on Normal Urine. Biomark Insights 2016; 11: 41–48
2. Weissinger EM, Wittke S, Kaiser T et al. Proteomic patterns established with capillary electrophoresis and mass spectrometry for diagnostic purposes. KidneyInt 2004; 65(6): 2426–2434
3. Пролетов ЯЮ, Саганова ЕС, Галкина ОВ и др. Роль некоторых биомаркеров в оценке характера хронического повреждения почек у пациентов с первичными гломерулопатиями. Нефрология 2013;1:60 – 69 [ProletovYAYU, SaganovaES, GalkinaOVidr. Rol’ nekotoryhbiomarkerovvocenkeharakterahronicheskogopovrezhdeniyapochekupacientovspervichnymiglomerulopatiyami. Nefrologiya 2013; 1: 60 – 69]
4. Fiseha T, Tamir Z. Urinary markers of Tubular Injury in Early Diabetic Nephropathy. Int J Nephrol 2016; 2016: 4647685. doi: 10.1155/2016/4647685
5. Levey AS, Stevens LA, Schmid CH et al. A new equation to estimate glomerular filtration rate. Ann Intern Med 2009; 150(9): 604–612
6. Du Buf-Vereijken PW, Wetzels JF. Treatment-related changes in urinary excretion of high and low molecular weight proteins in patients with idiopathic membranous nephropathy and renal insufficiency. Nephrol Dial Transplant 2006; 21(2): 389–396 doi 10.1093/ndt/gfi219
7. Shin JR, Kim SM, Yoo JS et al. Urinary excretion of β2microglobulin as a prognostic marker in immunoglobulin A nephropathy. Nephropathy Korean J Intern Med 2014; 29(3): 334-340. doi: 10.3904/kjim.2014.29.3.334
8. Branten AJW, Du Buf-Vereijken PW, Klasen IS et al. Urinary excretion of beta2-microglobulin and IgG predict prognosis in idiopathic membranous nephropathy: a validation study. J Am Soc Nephrol 2005; 16(1): 169–174 doi: 10.1681/ASN.2004040287
9. Gluhovschi C, Gluhovschi G, Christos C et al. Rediscovering Beta-2 Microglobulin As a Biomarker across the Spectrum of Kidney Diseases. Frontiers in Medicine 2017; 4 (73): doi.org/10.3389/fmed.2017.000
10. Christensen EI, Birn H, Storm T et al. Endocytic receptors in the renal proximal tubule. Physiology (Bethesda) 2012; 27: 223–236:doi:10.1152/physiol.00022.2012
11. Nielsen R, Christensen EI, Birn H. Megalin and cubilin in proximal tubule protein reabsorption: from experimental models to human disease. Kidney Int 2016; 89: 58–67; doi:10.1016/j.kint.2015.11.007
12. Pallet N, Chauvet S, Chasse JF et al. Urinary Retinol Binding Protein Is a Marker of the Extent of Interstitial Kidney Fibrosis. PLoS One 2014; Jan 8;9(1):e84708. doi: 10.1371/journal.pone.0084708
13. Li L, Dong M, Wang XG. The Implication and Significance of Beta 2 Microglobulin: A Conservative Multifunctional Regulator. Chin Med J (Engl) 2016;129(4): 448-455
14. Haymann JP, Levraud JP, Bouet S et al. Characterization and localization of the neonatal Fc receptor in adult human kidney. J Am Soc Nephrol 2000; 11: 632–639
15. Dobrinskikh E, Okamura K, Kopp JB et al. Human podocytes perform polarized, caveolae-dependent albumin endocytosis. Am J Physiol Renal Physiol 2014; 306: 941–951. doi:10.1152/ajprenal.00532.2013
16. Kobayashi N, Suzuki Y, Tsuge T et al. FcRn-mediated transcytosis of immunoglobulin G in human renal proximal tubular epithelial cells. American Journal of Physiology 2002; 282(2): 358-365. doi: 10.1152/ajprenal.0164.2001
17. Gan H, Feng S, Wu H et al. Neonatal Fc receptor stimulation induces ubiquitin c-terminal hydrolase-1 overexpression in podocytes through activation of p38 mitogen-activated protein kinase. Hum Pathol 2012; 43: 1482–1490. doi:10.1016/j.humpath.2011.10.025
18. Kang S-W, Natarajan R, Shahed A et al. Role of 12-lipoxygenase in the stimulation of p38 mitogen-activated protein kinase and collagen α5(IV) in experimental diabetic nephropathy and in glucose-stimulated podocytes. J Am Soc Nephrol 2003; 14:3178–3187. doi:10.1097/01.ASN.0000099702.16315.DE
19. Koshikawa M, Mukoyama M, Mori K et al. Role of p38 mitogen-activated protein kinase activation in podocyte injury and proteinuria in experimental nephrotic syndrome. J Am Soc Nephrol 2005; 16: 2690–2701. doi:10.1681/ASN.200412108
20. Kavvadas P, Weis L, Abed AB et al. Renin inhibition reverses renal disease in transgenic mice by shifting the balance between profibrotic and antifibrotic agentsnovelty and significance. Hypertension 2013; 61: 901–907. doi:10.1161/HYPERTENSIONAHA.111.00639
21. Kato Y, Mori K, Kasahara M et al. Natriuretic peptide receptor guanylyl cyclase-A pathway counteracts glomerular injury evoked by aldosterone through p38 mitogen-activated protein kinase inhibition. SciRep 2017; 7:46624. doi:10.1038/srep4662
Об авторах
Е. О. БогдановаРоссия
Богданова Евдокия Олеговна - лаборатория биохимического гомеостаза.
197022, Росия, Санкт-Петербург, ул. Л. Толстого, д. 17, корп. 54, (812) 338-69-01
О. В. Галкина
Россия
Галкина Ольга Владимировна - кандидат биологических наук, лаборатория биохимического гомеостаза.
197022, Санкт-Петербург, ул. Л. Толстого, д. 17, корп. 54, (812) 338-69-01
И. М. Зубина
Россия
Зубина Ирина Михайловна - кандидат биологических наук, лаборатория биохимического гомеостаза.
197022, Санкт-Петербург, ул. Л. Толстого, д. 17, корп. 54, (812) 338-69-01
В. А. Добронравов
Россия
Добронравов Владимир Александрович - доктор медицинских наук, профессор, заместитель директора.
197022, Санкт-Петербург, ул. Л. Толстого, д. 17, корп. 54, (812) 338-69-01
Рецензия
Для цитирования:
Богданова Е.О., Галкина О.В., Зубина И.М., Добронравов В.А. ПРОТЕИНЫ МОЧИ И ФИБРОПЛАСТИЧЕСКИЕ ИЗМЕНЕНИЯ КОМПАРТМЕНТОВ ПОЧКИ ПРИ ИММУННЫХ ГЛОМЕРУЛОПАТИЯХ. Нефрология. 2017;21(6):54-59. https://doi.org/10.24884/1561-6274-2017-21-6-54-59
For citation:
Bogdanova E.O., Galkina O.V., Zubina I.M., Dobronravov V.A. URINE PROTEINS AND FIBROTIC LESIONS OF RENAL COMPARTMENTS IN IMMUNE GLOMERULOPATHIES. Nephrology (Saint-Petersburg). 2017;21(6):54-59. (In Russ.) https://doi.org/10.24884/1561-6274-2017-21-6-54-59
JATS XML








































